Синтез и строение гидрата 2-[(6-аминопиримидин-4(3н)-он-2-ил)сульфанил]ацетата тетрафенилсурьмы
Автор: Губанова Юлия Олеговна, Шарутина Ольга Константиновна, Ким Дмитрий Гымнанович, Петрова Ксения Юрьевна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 4 т.11, 2019 года.
Бесплатный доступ
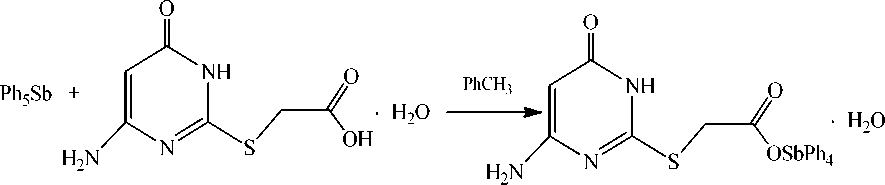
Продуктом взаимодействия пентафенилсурьмы с гидратом 2-[(6-аминопиримидин-4(3 Н )-он-2-ил)сульфанил]уксусной кислоты является 2-[(6-аминопиримидин-4(3 Н )-он- 2-ил)сульфанил]ацетат тетрафенилсурьмы, который образуется в результате замещения атома водорода на фрагмент Ph4Sb в карбоксильной группе. Соединение выделено в форме гидрата с выходом 78 % и представляет собой бесцветные кристаллы с температурой плавления 197 °С. Соединение охарактеризовано методами ИК-спектроскопии и рентгеноструктурного анализа. В ИК-спектре соединения имеются полосы поглощения карбонильных групп, находящихся в цикле и в кислотном остатке, с частотами 1629 и 1603 см-1 соответственно. По данным рентгеноструктурного анализа, проведенного на дифрактометре D8 QUEST фирмы Bruker, криталлографические параметры элементарной ячейки соединения: триклинная сингония, группа симметрии P 1 ; а = 9,551(3), b = 13,469(3), c = 14,484(5) Å, α = 86,355(11)°, β = 74,421(18)°, γ = 76,483(10) °, V = 1745,0(9) Å3, ρвыч = 1,234 г/см3. Атом сурьмы имеет искаженную тригонально-бипирамидальную координацию. Аксиальный угол OSbC составляет 179,42(10)°, сумма углов в экваториальной плоскости равна 357,0(13)°. Аксиальная связь и экваториальные связи Sb-C равны 2,175(3) Å и 2,107(3)-2,139(3) Å соответственно. Длина связи Sb-O составляет 2,253(2) Å. В молекуле одинарная и двойная связи С-О в карбоксильной группе не выровнены (1,283(3) и 1,226(4) Å соответственно). Пиримидиновый цикл является практически плоским, атомы углерода и азота отклоняются от средней плоскости не более, чем на 0,012 Å; атом серы выходит из плоскости цикла на величину, равную 0,106 Å.
Пентафенилсурьма, 2-[(6-аминопиримидин-4(3н)-он-2-ил)сульфанил]уксусная кислота, молекулярная структура, рентгеноструктурный анализ, 2-[(6-aminopyrimidine-4(3н)-one-2-yl)sulfonyl]acetic acid
Короткий адрес: https://sciup.org/147233144
IDR: 147233144 | УДК: 546.865 | DOI: 10.14529/chem190406
Текст научной статьи Синтез и строение гидрата 2-[(6-аминопиримидин-4(3н)-он-2-ил)сульфанил]ацетата тетрафенилсурьмы
Как известно, для производных пиримидина характерен широкий спектр биологической активности. В частности доказано, что производные пиримидин-4(3Н)-она проявляют антимикотическую [1], лейкопоэтическую [2], противоопухолевую [3], противовирусную активность в отношении ВИЧ-1 в микромолярных концентрациях [4]. В работах [5–7] показано, что конденсированные производные 6-амино-2-тиоурацила проявляют антибактериальную, противовирусную и противогрибковую активность. С другой стороны, некоторые арильные производные сурьмы проявляют аналогичные свойства [8-11]. Введение в соединения сурьмы(V) лиганда, содержащего пиримидиновый цикл, позволяет расширить спектр их практически важных свойств. В литературе имеются данные о сурьмаорганических производных нескольких гетероциклических кислот c такими атомами, как азот, кислород и сера [12-18], также известно об одном производном дикарбоновой гетероциклической кислоты [19]. Особенности строения соединений с гетероциклическими лигандами заключаются в возможности дополнительной координации гетероатома на центральный атом сурьмы [16, 19].
В настоящей работе изучено взаимодействие пентафенилсурьмы с гидратом 2-[(6-аминопиримидин-4(3 Н )-он-2-ил)сульфанил]уксусной кислоты, полученной по методике [20, 21], и установлено строение продукта реакции.
Экспериментальная часть
Синтез гидрата 2-[(6-аминопиримидин-4(3 Н )-он-2-ил)сульфанил]ацетата тетрафенил-сурьмы (1). Смесь из 0,2 г пентафенилсурьмы и 0,086 г гидрата 2-[(6-аминопиримидин-4(3 Н )-он-
Органическая химия
2-ил)сульфанил]уксусной кислоты в 5 мл толуола помещали в стеклянную ампулу и запаивали. Смесь нагревали на водяной бане в течение часа. После удаления растворителя выделили 0,2 г (78 %) бесцветных кристаллов соединения 1 с т. пл. 197 °С. ИК-спектр ( ν , см-1): 3439, 3327, 3192, 3057, 2361, 1629, 1603, 1558, 1456, 1433, 1346, 1223, 1064, 997, 927, 816, 731, 690, 590, 459. Для C 30 H 28 N 3 O 4 SSb вычислено, %: С 55,6; H 4,32.
ИК-спектр соединения 1 записывали на ИК-Фурье спектрометре Shimadzu IRAffinity-1S в таблетке KBr в области 4000–400 см–1.
Рентгеноструктурный анализ (РСА) кристалла соединения 1 осуществлен с использованием автоматического четырехкружного дифрактометра D8 QUEST фирмы Bruker (Mo K α -излучение, λ = 0,71073 Å, графитовый монохроматор). Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены с помощью программы SMART SAINT- Plus [22]. Определение и уточнение структуры кристаллов выполнено c помощью программ SHELX/PC [23] и OLEX2 [24]. Структура расшифрована прямым методом и уточнена методом наименьших квадратов вначале в изотропном, затем в анизотропном приближении для неводородных атомов. Атомы водорода помещены в геометрически рассчитанные положения и включены в уточнение по модели наездника .
Кристаллы соединения 1 бесцветные, призматические, триклинные, C30H28N3O4SSb, М = 648,36 г/моль; а = 9,551(3), b = 13,469(3), c = 14,484(5) Å, α = 86,355(11)°, β = 74,421(18)°, γ = 76,483(10) °, V = 1745,0(9) Å3, ρвыч = 1,234 г/см3, Z = 2, пространственная группа P 1 . Измерено всего 149453 отражений, 22154 независимых отражений, μ = 0,883 мм-1. Окончательные значения факторов расходимости: R1 0,1551 и wR2 0,2428 (по всем рефлексам), R1 0,0797 и wR2 0,2041 (по рефлексам F2> 2σ(F2)). Структуры депонированы в Кембриджской базе кристаллоструктурных данных (CCDC 1954677, .
Геометрические характеристики координационного полиэдра атома сурьмы приведены в таблице.
Основные длины связей ( d ) и валентные углы ( ω ) в структуре соединения 1
|
Связь |
d , Å |
Угол |
ω, град. |
|
Sb(1)–O(1) |
2,253(2) |
C(31)Sb(1)O(1) |
179,42(10) |
|
Sb(1)–C(31) |
2,175(3) |
C(1)Sb(1)C(21) |
121,09(13) |
|
Sb(1)–C(21) |
2,118(3) |
C(21)Sb(1)C(11) |
122,23(12) |
|
Sb(1)–C(11) |
2,139(3) |
C(1)Sb(1)C(11) |
113,68(12) |
|
Sb(1)–C(1) |
2,107(3) |
C(21)Sb(1)C(31) |
94,21(12) |
|
C(11)Sb(1)C(31) |
96,77(11) |
||
|
C(31)Sb(1)C(1) |
95,61(14) |
Обсуждение результатов
Установлено, что взаимодействие пентафенилсурьмы c гидратом 2-[(6-аминопиримидин-4(3 Н )-он-2-ил)сульфанил]уксусной кислоты в толуоле при нагревании протекает с замещением атома водорода в карбоксильной группе, другие подвижные атомы водорода в молекуле кислоты остаются инертными. Продуктом реакции является гидрат 2-[(6-аминопиримидин-4(3 Н )-он-2-ил)сульфанил]ацетата тетрафенилсурьмы ( 1 ).
В ИК-спектре соединения 1 полосы поглощения карбонильной группы в цикле и в кислотном остатке при 1629, 1603 см-1 соответственно смещены в область низкочастотных колебаний по сравнению со справочными данными для карбоновых кислот (1700–1680 см-1 [25]) и значением в спектре исходной кислоты (1707 и 1610 см-1 соответственно).
Согласно данным РСА, атом сурьмы имеет искаженную тригонально-бипирамидальную координацию (см. рисунок). В экваториальных положениях находятся атомы углерода трех фенильных лигандов, в аксиальных - атом углерода четвертого фенильного лиганда и атом кислорода кислотного остатка. Атом Sb выходит из экваториальной плоскости в сторону аксиального атома углерода на 0,213 Å. Аксиальный угол O(1)Sb(1)C(31) равен 179,42(10)°, сумма углов в экваториальной плоскости составляет 357,0(13)° (113,68(12) - 122,23(12)°). Углы C акс Sb(1)C экв изменяются в интервале 94,21(12)–96,77(11)°. Аксиальная связь Sb(1)–C(31), равная 2,175(3) Å, значительно длиннее экваториальных связей Sb(1)–C(1,11,21) (2,107(3)-2,139(3) Å). Длина связи Sb-O составляет 2,253(2) Å и сопоставима с аналогичной связью в других карбоксилатах тетрафенил-сурьмы с объемными кислотными остатками (2,289; 2,278 Å [26, 27]). Внутримолекулярное взаимодействие атома сурьмы с атомом кислорода карбонильной группы проявляется слабо: расстояние Sb(1)∙∙∙O(2) составляет 3,500(4) Å.
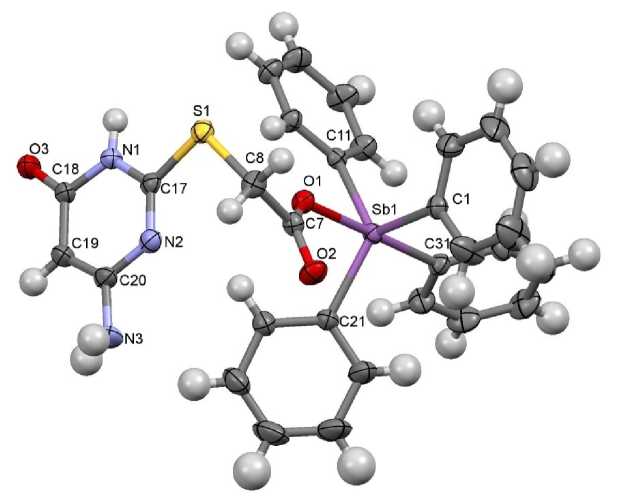
Рис. 1. Строение соединения 1 (молекула воды не показана)
В молекуле 1 одинарная С(7)-О(1) и двойная С(7)-О(2) связи в карбоксильной группе не выровнены (1,283(3) и 1,226(4) Å соответственно). Длина связи в карбонильной группе цикла С(18)-О(3) значительно длиннее карбонильной связи С(7)-О(2) и составляет 1,253(4) Å. Пиримидиновый цикл имеет плоское строение, отклонение атомов из средней плоскости не превышает 0,012 Å; атом серы выходит из плоскости цикла на 0,106 Å. В гетероцикле наблюдается чередование кратных и простых связей, о чем свидетельствуют значения расстояний N(2)-C(17), N(1)-C(17), N(2)-C(20) в цикле, равные 1,302(4), 1,355(4) и 1,391(5) Å. Связи С(19)-С(20) и С(19)-С(18) также различаются и составляют 1,376(6) и 1,413(5) Å, что подтверждает неравномерное распределение электронной плотности.
В кристалле соединения 1 имеется множество межмолекулярных водородных связей, образованных атомами водорода, углерода, азота, кислорода молекул сурьмаорганического соединения и воды.
Вывод
Таким образом, продуктом реакции пентафенилсурьмы с гидратом 2-[(6-аминопиримидин-4(3 Н )-он-2-ил)сульфанил]уксусной кислоты вне зависимости от соотношения реагентов является гидрат 2-[(6-аминопиримидин-4(3 Н )-он-2-ил)сульфанил]ацетата тетрафенилсурьмы. Атом сурь-
Органическая химия мы имеет искаженную тригонально-бипирамидальную координацию, пиридиновый цикл является практически плоским. Структурная организация кристалла обусловлена множеством межмолекулярных водородных связей.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 19-33-90061.
Выражаем благодарность проф. В.В. Шарутину за проведенные рентгеноструктурные исследования.
Список литературы Синтез и строение гидрата 2-[(6-аминопиримидин-4(3н)-он-2-ил)сульфанил]ацетата тетрафенилсурьмы
- HPLC in Biopharmaceutical Investigations of Drugs Representing Pyrimidine Derivatives (a review) / D.V. Moiseev, S.I. Marchenko, A.M. Moiseeva et al. // Pharmaceutical Chemistry Journal. - 2007. - V. 41, № 1. - P. 25-33. DOI: 10.1007/s11094-007-0007-4
- Кривоногов, В.П. Pазработка технологичных методов синтеза сераорганических и гетероциклических соединений и поиск путей их практического применения: дис. … д-ра хим. наук / В.П. Кривоногов. - Уфа, 1996. - 320 с.
- Preobrazhenskaya, M.N. Developments in the Research of New Antitumor Agents (review) / M.N. Preobrazhenskaya // Chemistry of Heterocyclic Compounds. - 1985. - V. 21, № 1. - P. 13-24. DOI: 10.1007/BF00505892
- Сим, О.Г. Синтез биологически активных новых 5-замещенных производных 2-аминопиримидин-4(3H) -она: дис. … канд. фарм. наук / О.Г. Сим. - Волгоград, 2006. - 310 с.
- Rinaldi, M. Synthesis and Biological Activity of New Heterocyclic Structures: [1,3]Thiazino[2,3-i]purine, Thiazolo[3,2-c][1,2,3]triazolo[4,5-e]Pyrimidine and [1,2,3]Triazolo[4',5':4,5]pyrimido[6,1-b][1,3]thiazine / M. Rinaldi, P. Pecorari, L. Constantino // Farmaco. - 1992. - V. 47, № 10. - P. 1315-1322.
- Pecorari, P. Synthesis and Biological Activity of Pyrimido[2,1-b][1,3]thiazine, [1,3]Thiazino[3,2-a]purine and [1,2,3]Triazolo[4,5-d][1,3]thiazino[3,2-a]pyrimidine Derivatives and Thiazole Analogues / P. Pecorari, M. Rinaldi, L. Constantino // Farmaco. - 1991. - V. 46, № 7. - P. 899-911.
- Preparation and Physicochemical Properties of Uracil Derivatives with Potential Biological Activity / P. Pecorari, G. Vampa, A. Albasini et al. // Farmaco. - 1988. - V. 43, № 4. - P. 311-318.
- Recent Advances on Antimony(III/V) Compounds with Potential Activity Against Tumor Cells / S.K. Hadjikakou, I.I. Ozturk, C.N. Banti et al. // J. Inorg. Biochem. - 2015. - V. 153. - P. 293-304.
- DOI: 10.1016/j.jinorgbio.2015.06.006
- Tiekink, E.R.T. Antimony and Bismuth Compounds in Oncology / E.R.T. Tiekink // Crit. Rev. Oncol. Hematol. - 2002. - V. 42. - P. 217-224.
- DOI: 10.1016/S1040-8428(01)00217-7
- Synthesis, Characterization and Biological Studies of New Antimony(III) Halide Complexes with ω-Thiocaprolactam / I.I. Ozturk, C.N. Banti, M.J. Manos et al. // J. Inorg. Biochem. - 2012. - V. 109. - P. 57-65.
- DOI: 10.1016/j.jinorgbio.2012.01.014
- Anti-leishmanial Activity of Heteroleptic Organometallic Sb(V) Compounds / M.I. Ali, M.K. Rauf, A. Badshah et al. // Dalton Trans. - 2013. - V. 42, № 1. - P. 16733-16741.
- DOI: 10.1039/c3dt51382c
- Синтез и строение ниацината тетрафенилсурьмы / В.В. Шарутин, А.П. Пакусина, Т.П. Платонова и др. // Журн. общ. химии. - 2004. - Т. 74, № 2. - С. 234-237.
- Domagala, M. Triorganoantimon- und Triorganobismutderivate von Carbonsauren funfgliedriger Heterocyclen Kristall- und Molekulstruktur von (C6H5)3Sb(O2C-2-C4H3S)2 und (CH3)3Sb(O2C-2-C4H3S)2 / M. Domagala, F. Huber, H. Preut // Z. Anorg. Allg. Chem. - 1989. - Bd. 574. - P. 130-142.
- DOI: 10.1002/zaac.655740114
- Синтез и строение дикарбоксилатов триарилсурьмы Ar3Sb[OC(O)R]2 (Ar = Ph, p-Tol; R =2-C4H3O, 3-C5H4N / В.В. Шарутин, О.К. Шарутина, А.П. Пакусина и др. // Коорд. химия. - 2003. - Т. 29, № 10. - С. 750-759.
- Domagala, M. Triorganoantimon- und Triorganobismutderivate von 2-Pyridincarbonsaure und 2-Pyridinlessigsaure. Kristall- und Molekulstrukturen von Ph3Sb(O2C-2-C5H4N)2 und Me3Sb(O2CCH2-2-C5H4N)2 / M. Domagala, F. Huber, H. Preut // Z. Anorg. Allg. Chem. - 1990. - Bd. 582. - P. 37-50.
- DOI: 10.1002/zaac.19905820107
- Syntheses, Characterizations and Crystal Structures of New Organoantimony(V) Complexes with Heterocyclic (S,N) Ligand / M. Chunlin, Z. Qingfu, S. Jiafeng et al. // J. Organomet. Chem. - 2006. - V. 691. - P. 2567-2574.
- DOI: 10.1016/j.jorganchem.2006.01.049
- Triorganoantimony(V) Сarboxilates: Synthesis, Characterization and Crystal Structure of Me3Sb(O2CC3H4N)2∙H2O / K.R. Chaudhari, V.K. Jain, V.S. Sagoria, E.R.T. Tieking // J. Organomet. Chem. - 2007. - V. 692. - P. 4926-4932.
- DOI: 10.1016/j.jorganchem.2007.07.033
- Preut, H. The Further Geometry of Grain Boundaries in Hexagonal Close-packed Metals / H. Preut, M. Domagala, F. Huber // Acta Crystallogr. - 1987. - B43. - P. 416-422.
- DOI: 10.1107/S0108768187097568
- Губанова, Ю.О. Синтез и строение сольвата 2,6-пиридиндикарбоксилата бис(тетрафенилсурьмы) с толуолом / Ю.О. Губанова, О.К. Шарутина // Вестник ЮУрГУ. Серия "Химия". - 2019. - Т. 11, № 3. - С. 17-23.
- DOI: 10.14529/chem190302
- Gaafar, A.M. Chemical Synthesis of Some Novel 6-Aminouracil-2-Thiones and Their Glycoside Analogues / A.M. Gaafar, E. Abdel-Rahmana Asmaa, M.M. Helmy // Egypt. J. of Chem. - 2016. - V. 59, № 5. - P. 779-797.
- DOI: 10.21608/ejchem.2016.1449
- Murray Th.F., Allan J. Carboxymethylmercapto Сompounds as Stabilizers for Photographic Emulsions / Th.F. Murray, J. Allan. Patent US, N 2819965, 1958.
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- OLEX2: a Complete Structure Solution, Refinement and Analysis Program / O.V. Dolomanov, L.J. Bourhis, R.J. Gildea et al. // J. Appl. Cryst. - 2009. - V. 42. - P. 339-341.
- DOI: 10.1107/S0021889808042726
- Тарасевич, Б.Н. ИК-спектры основных классов органических соединений: справочные материалы / Б.Н. Тарасевич. - М.: МГУ имени М.В. Ломоносова, 2012. - 55 с.
- Ma, Y. Synthesis, Characterization and Antitumor Activity of Some Arylantimony Triphenylgermanylpropionates and Crystal Structures of Ph3GeCH(Ph)CH2CO2SbPh4 and [Ph3GeCH2CH(CH3)CO2]2Sb(4-ClC6H4)3 / Y. Ma, J. Li, Z. Xuan // J. Organometal. Chem. - 2001. - V. 620, no. 2. - P. 235-242.
- DOI: 10.1016/S0022-328X(00)00799-3
- Synthesis and in Vitro Antitumor Activity of Some Tetraphenylantimony Derivatives of exo-7-oxa-bicyclo[2,2,1]heptane(ene)-3-arylamide-2-acid / J.-S. Li, Y.-Q. Ma, J.-R. Cui, R.-Q. Wang // J. Appl. Organomet. Chem. - 2001. - V. 15, no. 7. - P. 639-645.
- DOI: 10.1002/aoc.200

![Синтез и строение гидрата 2-[(6-аминопиримидин-4(3н)-он-2-ил)сульфанил]ацетата тетрафенилсурьмы Синтез и строение гидрата 2-[(6-аминопиримидин-4(3н)-он-2-ил)сульфанил]ацетата тетрафенилсурьмы](/file/cover/147233144/sintez-i-stroenie-gidrata-26-aminopirimidin-4-3non-2-il-sulfanil-acetata.png)
