Синтез и строение гидрата бис(2,4-диметилбензолсульфоната) трифенилвисмута
Автор: Шарутин В.В., Сенчурин В.С.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 1 т.16, 2024 года.
Бесплатный доступ
Взаимодействием трифенилвисмута с 2,4-диметилбензолсульфоновой кислотой в присутствии трет-бутилгидропероксида в эфире получен гидрат бис(2,4-диметилбензолсульфоната) трифенилвисмута Ph3Bi(OSO2C6H3Me2-2,4)2∙½ H2O. По данным рентгеноструктурного анализа, проведенного при 293 К на автоматическом четырехкружном дифрактометре D8 Quest Bruker (двухкоординатный CCD-детектор, МоКα-излучение, λ = 0,71073 Å, графитовый монохроматор), кристалла [C34H34O6.5S2Bi, M 819,71: сингония моноклинная, группа симметрии C2/c, параметры ячейки: a = 34,948(16), b = 9,210(5), c = 21,114(9) Å; α = γ = 90,00 град., β = 99,97(2) град.; V = 6693(6) Å3; размер кристалла 0,38 × 0,14 × 0,06 мм; интервалы индексов отражений -45 ≤ h ≤ 45, -11 ≤ k ≤ 11, -27 ≤ l ≤ 27; всего отражений 52257; независимых отражений 7691; GOOF 1,026; R1 = 0,0325, wR2 = 0,0776; остаточная электронная плотность 0,98/-0,82 e/Å3]; атом висмута имеет искаженную тригонально-бипирамидальную координацию. Аксиальный угол OBiO равен 171,58(12)°, сумма углов CBiC в экваториальной плоскости составляет 360°. Длины аксиальных связей Bi-O равны 2,274(3) Å и 2,284(3) Å; интервал изменения длин экваториальных связей Bi-C составляет 2,188(5)-2,209(4) Å. В структуре гидрата бис(2,4-диметилбензолсульфоната) трифенилвисмута присутствуют внутримолекулярные контакты между атомами висмута и кислорода сульфонатных лигандов; расстояния Bi···O=S составляют 3,178(10) и 3,261(10) Å, что меньше суммы ван-дер-ваальсовых радиусов висмута и кислорода (3,59 Å). Молекула воды связана водородной связью с атомом кислорода из сульфонатных лигандов (O-H···O=S 2,50 Å). Полные таблицы координат атомов, длин связей и валентных углов для структуры депонированы в Кембриджском банке структурных данных (№ 1919942, deposit@ccdc.cam.ac.uk, http://www.ccdc. cam.ac.uk).
Трифенилвисмут, 2, 4-диметилбензолсульфоновая кислота, бис(2, 4-диметилбензолсульфонат) трифенилвисмута гидрат, синтез, строение, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147243271
IDR: 147243271 | УДК: 546.87+547.47+548.312.5 | DOI: 10.14529/chem240103
Текст научной статьи Синтез и строение гидрата бис(2,4-диметилбензолсульфоната) трифенилвисмута
Аннотация. Взаимодействием трифенилвисмута с 2,4-диметилбензолсульфоновой кислотой в присутствии трет-бутилгидропероксида в эфире получен гидрат бис(2,4-диметил-бензолсульфоната) трифенилвисмута Ph3Bi(OSO2C6H3Me2-2,4)2∙½ H2O. По данным рентгеноструктурного анализа, проведенного при 293 К на автоматическом четырехкружном дифрактометре D8 Quest Bruker (двухкоординатный CCD-детектор, МоКα-излучение, λ = 0,71073 Å, графитовый монохроматор), кристалла [C34H34O6.5S2Bi, M 819,71: сингония моноклинная, группа симметрии C2/c, параметры ячейки: a = 34,948(16), b = 9,210(5), c = 21,114(9) Å; α = γ = 90,00 град., β = 99,97(2) град.; V = 6693(6) Å3; размер кристалла 0,38 × 0,14 × 0,06 мм; интервалы индексов отражений –45 ≤ h ≤ 45, –11 ≤ k ≤ 11, –27 ≤ l ≤ 27; всего отражений 52257; независимых отражений 7691; GOOF 1,026; R1 = 0,0325, wR2 = 0,0776; остаточная электронная плотность 0,98/– 0,82 e/Å3]; атом висмута имеет искаженную тригонально-бипирамидальную координацию. Аксиальный угол OBiO равен 171,58(12)°, сумма углов CBiC в экваториальной плоскости составляет 360°. Длины аксиальных связей Bi-O равны 2,274(3) А и 2,284(3) А; интервал изменения длин экваториальных связей Bi–C составляет 2,188(5)–2,209(4) Å. В структуре гидрата бис(2,4-диметилбензолсульфоната) трифенилвисмута присутствуют внутримолекулярные контакты между атомами висмута и кислорода сульфонатных лигандов; расстояния Bi···O=S составляют 3,178(10) и 3,261(10) Å, что меньше суммы ван-дер-ваальсовых радиусов висмута и кислорода (3,59 Å). Молекула воды связана водородной связью с атомом кислорода из сульфонатных лигандов (O–H···O=S 2,50 Å). Полные таблицы координат атомов, длин связей и валентных углов для структуры депонированы в Кембриджском банке структурных данных (№ 1919942, , .
Достижения в области арильных соединений пятивалентного висмута описаны в обзоре [1] и монографии [2], где преимущественно рассматриваются вопросы синтеза и химического поведения производных Ar4BiX и Ar3BiX2 (где Х – электроотрицательный лиганд). В меньшей степени изучены пентаарильные производные висмута, первым представителем которых является пента-фенилвисмут [3], являющийся прекурсором производных Ar 4 BiX. Действительно, именно из пентафенилвисмута и спирта или кислоты (НХ) можно получить алкокситетрафенилвисмут [4] и другие соединения Ar 4 BiX с электроотрицательным лигандом, среди которых следует выделить термоустойчивые аренсульфонаты тетрафенилвисмута [5–8]. К другим широко известным термоустойчивым производным пятивалентного висмута относят соединения Ph3BiX2 [9–19], также являющиеся прекурсорами в синтезе соединений Ph4BiX, когда последние получают по реакции перераспределения из пентафенилвисмута и Ph 3 BiX 2 .
В настоящей работе рассматривается синтез и особенности строения гидрата бис (2,4-диметилбензолсульфоната) трифенилвисмута, полученного окислением смеси трифенилвисмута и 2,4-диметилбензолсульфоновой кислоты (1:2 мольн.) трет -бутилгидропероксидом.
Экспериментальная часть
Синтез гидрата бис (2,4-диметилбензолсульфоната) трифенилвисмута (1) . Смесь 0,300 г (0,68 ммоль) трифенилвисмута, 0,303 г (1,36 ммоль) 2,4-диметилбензолсульфоновой кислоты и 0,1 мл 70 %-ного водного раствора трет бутилгидропероксида (0,68 ммоль) в 15 мл эфира выдерживали 24 ч при комнатной температуре. Образовавшийся мелкокристаллический продукт перекристаллизовывали из 20 мл смеси бензол – гептан (5 : 1 объемн.). Получили 0,38 г (68 %) неокрашенных кристаллов 1 с т. пл. 169 ° С. ИК-спектр, ( v , см - 1): 3653, 3441, 3418, 3049, 2922, 1624, 1557, 1468, 1437, 1281, 1206, 1167, 1140, 1098, 1069, 1030, 984, 939, 924, 733, 725, 677, 573, 442. Найдено, %: C 49,69; H 4,28. Для C 34 H 34 O 6,5 S 2 Bi вычислено, %: C 49,82; H 4,15.
Элементный анализ выполнен на элементном анализаторе Carlo Erba CHNS-O EA 1108. Температуры плавления измерены на синхронном термоанализаторе Netzsch 449C Jupiter.
ИК-спектр соединения 1 записывали на ИК-Фурье спектрометре Shimadzu IRAffinity-1S в таблетке KBr в области 4000 - 400 см - 1.
Рентгеноструктурный анализ ( РСА ) проводили на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Broker (Mo К а -излучение, X = 0,71073 А, графитовый монохроматор) при 293 K. Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены с помощью программ SMART и SAINT-Plus . Все расчеты по определению и уточнению структур выполнены с помощью программ SHELXL/PC и OLEX2
[20‒22]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Положение атомов водорода уточняли по модели наездника ( U изо (H) = 1,2 U экв (C)). Основные кристаллографические данные и результаты уточнения структуры 1 приведены в табл. 1, основные длины связей и валентные углы - в табл. 2.
Taблица 1
Кристаллографические данные, параметры эксперимента и уточнения структуры 1
|
Параметр |
Значение |
|
Формула |
C 34 H 34 O 6.5 S 2 Bi |
|
М |
819,71 |
|
Т, К |
293 |
|
Сингония |
Моноклинная |
|
Пр. группа |
C2/c |
|
a, Å |
34,948(16) |
|
b, Å |
9,210(5) |
|
c, Å |
21,114(9) |
|
α,º |
90,00 |
|
β,º |
99,97(2) |
|
γ,º |
90,00 |
|
V, Å3 |
6693(6) |
|
Z |
8 |
|
ρ (выч.), г/см3 |
1,627 |
|
µ , мм - 1 |
5,437 |
|
F(000) |
3240,0 |
|
Размер кристалла (мм) |
0,38 × 0,14 × 0,06 |
|
Область сбора данных по θ , град |
5,6 - 55,32 |
|
Интервалы индексов отражений |
- 45 ≤ h ≤ 45, - 11 ≤ k ≤ 11, - 27 ≤ l ≤ 27 |
|
Измерено отражений |
52257 |
|
Независимых отражений |
7691 |
|
Переменных уточнения |
400 |
|
GOOF |
1,026 |
|
R -факторы по F2> 2 σ (F2) |
R 1 = 0,0325, wR 2 = 0,0689 |
|
R -факторы по всем отражениям |
R 1 = 0,0545, wR 2 = 0,0776 |
|
Остаточная электронная плотность (min/max), e/A3 |
0,98/ - 0,82 |
Таблица 2
Основные длины связей и валентные углы в структуре 1
|
Связь |
Длина, Å |
Угол |
ω , град. |
|
Bi(1) - O(1) |
2,274(3) |
O(1)Bi(1)O(4) |
171,58(12) |
|
Bi(1) - O(4) |
2,284(3) |
C(1)Bi(1)C(11) |
115,39(17) |
|
Bi(1)∙∙∙O(3) |
3,178 |
C(1)Bi(1)C(21) |
109,99(17) |
|
Bi(1)∙∙∙O(5) |
3,261 |
C(11)Bi(1)C(21) |
134,62(17) |
|
Bi(1) - С(1) |
2,209(4) |
O(1)Bi(1)C(1) |
86,16(15) |
|
Bi(1) - С(11) |
2,192(5) |
O(1)Bi(1)C(11) |
91,97(16) |
|
Bi(1) - С(21) |
2,188(5) |
O(1)Bi(1)C(21) |
90,96(16) |
|
S(1) - С(31) |
1,762(6) |
O(4)Bi(1)C(1) |
85,43(15) |
|
O(1) - S(1) |
1,500(4) |
O(4)Bi(1)C(11) |
91,50(15) |
|
S(2) - С(41) |
1,772(4) |
O(4)Bi(1)C(21) |
92,05(16) |
|
O(4) - S(2) |
1,505(3) |
Bi(1)O(1)S(1) |
119,7(2) |
|
Bi(1)O(4)S(2) |
122,30(19 |
Полные таблицы координат атомов, длин связей и валентных углов для структуры 1 депонированы в Кембриджском банке структурных данных (№ 1919942; ; .
Обсуждение результатов
Нами изучено взаимодействие трифенилвисмута с 2,4-диметилбензолсульфоновой кислотой в присутствии трет -бутилгидропероксида, а также структурно охарактеризован целевой продукт.
Реакция протекала по обычной схеме реакции окислительного присоединения с образованием гидрата бис (2,4-диметилбензолсульфоната) трифенилвисмута (1):
-
1. Et 2 O
-
2. бензол/гептан
Ph 3 Bi + 2 HOSO 2 C 6 H 3 Me 2 -2,4∙2H 2 O + t -BuOOH
Ph 3 Bi(OSO 2 C 6 H 3 Me 2 -2,4) 2 ∙½ H 2 O + t -BuOH + 1,5H 2 O 1
По данным РСА, атом висмута в соединении 1 имеет искаженную тригонально-бипирамидальную координацию с аксиально расположенными 2,4-диметилбензолсульфонат-ными лигандами (см. рисунок). Аксиальный угол OBiO равен 171,58(12) ° . Суммы углов CBiC в экваториальной плоскости составляют 360 ° . Длины экваториальных связей Bi-C изменяются в интервале 2,188(5)–2,209(4) Å и имеют близкие значения к суммам ковалентных радиусов атомов висмута и sp2-гибридного углерода 2,21 Å [23]. В молекулах 1 присутствуют внутримолекулярные контакты Bi⋅⋅⋅O=S, которые отличаются друг от друга (3,178 и 3,261 Å) и значительно больше ковалентных связей Bi–O (2,274(3) Å и 2,284(3) Å), однако меньше суммы ван-дер-ваальсовых радиусов атомов висмута и кислорода (3,59 Å) [24]. Это приводит к увеличению одного из экваториальных углов C(11)Bi(1)C(21) со стороны контакта до 134,62(17) ° .
В ИК-спектре соединения 1 полоса поглощения при 442 см - 1 относится к валентным колебаниям связи Bi - С. Колебания v (SO2) в сульфонатных группах характеризуются частотами 1206 см-1 (антисимметричные) и 1030 см–1 (симметричные). Гидратная молекула воды проявляется в спектре полосами при 3653, 3441 и 3419 см - 1 [25].
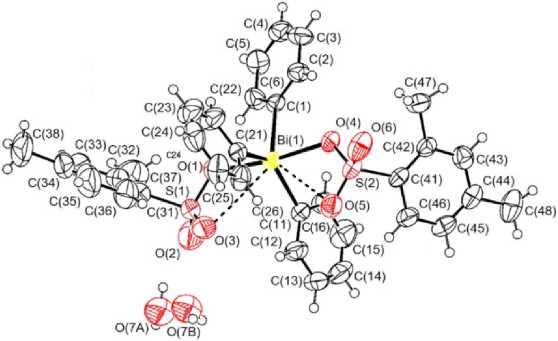
Общий вид гидрата бис(2,4-диметилбензолсульфоната) трифенилвисмута (1)
Структурная организация в кристалле обусловлена слабыми межмолекулярными водородными связями типа С–H···O=S 2,52 и 2,56 Å, что близко к сумме ван-дер-ваальсовых радиусов атомов кислорода и водорода (2,62 Å) [24]. Молекула воды связана водородной связью O(7)– H(7)···O(3)=S(1) 2,50 Å с атомом кислорода О(3) одного из сульфонатных лигандов.
Выводы
Установлено, что взаимодействие трифенилвисмута с 2,4-диметилбензолсульфоновой кислотой в присутствии трет -бутилгидропероксида приводит к образованию гидрата бис (2,4-диметилбензолсульфоната) трифенилвисмута (1). 2,4-Диметилбензолсульфонатные лиганды, имеющие атомы кислорода с неподеленными электронными парами, обусловливают дополнительные невалентные внутримолекулярные взаимодействия с атомом висмута, что сопровождается увеличением КЧ центрального атома до 7.
Список литературы Синтез и строение гидрата бис(2,4-диметилбензолсульфоната) трифенилвисмута
- Шарутин В.В., Поддельский А.И., Шарутина О.К. // Коорд. химия. 2021. Т. 47, № 12. С. 719. DOI: 10.31857/S0132344X21120021.
- Кочешков К.А. Методы элементоорганической химии / К.А. Кочешков, А.П. Сколдинов, Н.Н. Землянский // Сурьма, висмут. - М.: Наука, 1976. - 483 с.
- Wittig G., ClaußK. // Lieb. Ann. 1952. Bd. 578, № 1. P. 136. DOI: 10.1002/jlac.19525780116.
- Разуваев Г.А., Осанова Н.А., Шарутин В.В. // Докл. АН СССР. 1975. Т. 225, № 3. С. 581.
- Шарутин В.В., Егорова И.В., Иваненко Т.К. и др. // Коорд. химия. 2003. Т. 29, № 7. С. 502. EDN: OOFOYX.
- Шарутин В.В., Пакусина А.П., Егорова И.В. и др. // Коорд. химия. 2003. Т. 29, № 5. С. 336. EDN: OOFOOD.
- Шарутин В.В., Егорова И.В., Пакусина А.П. и др. // Коорд. химия. 2007. Т. 33, № 3. С. 176. EDN: IADDTV.
- Рыбакова А.В. // Вестник ЮУрГУ. Серия «Химия». 2022. Т. 14, № 1. С. 32. DOI: 10.14529/chem220104.
- Rüther R., Huber F., Preut H. // Z. anorg. allg. Chem. 1986. V. 539, no. 8. P. 110. DOI: 10.1002/zaac.19865390811.
- Goswami M., Ellern A., Pohl N.L.B. // Angew. Chem. Int. Ed. 2013. V. 52, no. 32. P. 8441. DOI: 10.1002/anie.201304099.
- Шарутин В.В., Шарутина О.К., Сенчурин В.С. // Журн. неорган. химии. 2016. Т. 61, № 3. С. 334. DOI: 10.7868/S0044457X16030211.
- Robertson A.P.M., Budford N., McDonaid R., Ferduson M.J. // Angew. Chem. Int. Ed. 2014, V. 53. P. 3480. DOI: 10.1002/anie.201310613.
- Механошина Е.С., Рыбакова А.В., Шарутин В.В. // Вестник ЮУрГУ. Серия «Химия». 2022. Т. 14, № 3. С. 51. DOI: 10.14529/chem220306.
- Ермакова В.А. // Вестник ЮУрГУ. Серия «Химия». 2017. Т. 9, № 3. С. 65. DOI: 10.14529/chem170308.
- Шарутин В.В., Егорова И.В., Циплухина Т.В. и др. // Коорд. химия. 2004. Т. 30, № 12. С. 935. EDN: OVZTIH.
- Шарутин В.В., Егорова И.В., Циплухина Т.В. // Журн. общ. химии. 2004. Т. 74, № 2. С. 343. EDN: PBCSBH.
- Шарутин В.В., Шарутина О.К., Сенчурин В.С. // Журн. структ. химии. 2020. Т. 61, № 5. С. 776. DOI: 10.26902/JSC_id55423.
- Шарутин В.В., Шарутина О.К., Сенчурин В.С. // Журн. неорган. химии. 2020. Т. 65, № 11. С. 1516. DOI: 10.31857/S0044457X20110173.
- Сенчурин В.С., Шарутин В.В., Шарутина О.К. // Журн. неорган. химии. 2020. Т. 65, № 3. С. 320. DOI: 10.31857/S0044457X20030125.
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Cryst. 2009. Vol. 42. P. 339. DOI: 10.1107/S0021889808042726.
- Cordero B., Gómez V., Platero-Prats A.E. et al. // Dalton Trans. 2008. V. 21. P. 2832. DOI: 10.1039/B801115J.
- Mantina M., Chamberlin A.C., Valero R. et al. // J. Phys. Chem. A. 2009. V. 113, №. 19. P. 5806. DOI: 10.1021/jp811155623.
- Тарасевич Б.Н. ИК-спектры основных классов органических соединений. М.: МГУ, 2012. 54 с.


