Синтез и строение Нитратов бензили (4-карбоксибутил)трифенилфосфония
Автор: Шарутин В.В., Шевченко Д.П., Хажиева К.Р.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 1 т.17, 2025 года.
Бесплатный доступ
Взаимодействием бромидов бензил- и (4-карбоксибутил)трифенилфосфония с азотной кислотой синтезированы комплексы фосфора [Ph3PCH2Ph]NO3 (1) и [Ph3P(CH2)4COOH]NO3 (2) соответственно. Полученные соединения охарактеризованы методами ИК-спектроскопии и рентгеноструктурного анализа (РСА). По данным РСА, нитрат бензилтрифенилфосфония (1) [C25H22NO3P, M = 415,41; триклинная сингония, пр. гр. P-1; параметры ячейки: a = 9,573(7) Å, b = 10,272(10) Å, c = 12,066(11) Å; a = 105,42(4)°, β = 107,06(4)°, g = 92,73(4)°, V = 1083,3(16) Å3, Z = 2; rвыч = 1,273 г/см3; m = 0,153 мм-1; F(000) = 436,0; обл. сбора по 2q: 5,68-54,32°; -12 ≤ h ≤ 12, -13 ≤ k ≤ 13, -15 ≤ l ≤ 15; всего отражений 26281; независимых отражений 4802 (Rint = 0,0345); GOOF = 1,038; R-фактор 0,0451] и нитрат (4-карбоксибутил)трифенилфосфония (2) [C23H24NO5P, M = 425,40; моноклинная сингония, пр. гр. P21/n; параметры ячейки: a = 8,937(16) Å, b = 17,86(3) Å, c = 13,71(2) Å; a = 90,00°, β = 95,04(11)°, g = 90,00°, V = 2180(6) Å3, Z = 4; rвыч = 1,296 г/см3; m = 0,160 мм-1; F(000) = 896,0; обл. сбора по 2q: 5,72-55,48°; -11 ≤ h ≤ 11, -22 ≤ k ≤ 23, -17 ≤ l ≤ 17; всего отражений 18882; независимых отражений 4732 (Rint = 0,0952); GOOF = 1,040; R-фактор 0,0729] имеют ионное строение и состоят из органилтрифенилфосфониевых катионов с несколько искаженной тетраэдрической координацией атома фосфора (углы CPC варьируются в пределах 107,10(8)-111,56(10)° для 1 и 107,62(10)-111,99(16)° для 2; расстояния P-C составляют 1,791(2)-1,803(2) Å и 1,786(4)-1,803(4) Å соответственно) и плоских тригональных нитрат-анионов (суммы углов ONO равны 359,6° и 360°). Структурная организация в кристалле 1 обусловлена только межионными водородными связями C-H∙∙∙O-NO2 (2,24-2,61 Å). Кристалл 2, кроме взаимодействий C-H∙∙∙O-NO2 (2,12-2,72 Å), также содержит контакты O-H∙∙∙O-NO2 (2,12 и 2,42 Å), C-H∙∙∙O=C (2,63 Å) и C-H∙∙∙NO3 (2,60 Å). Полные таблицы координат атомов, длин связей и валентных углов нитратов 1 и 2 депонированы в Кембриджском банке структурных данных (CCDC 2331486 (1), 2331490 (2); deposit@ccdc.cam.ac.uk; http://www.ccdc.cam.ac.uk).
Нитраты алкилтрифенилфосфония, синтез, строение, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147248063
IDR: 147248063 | УДК: 546.185+547.53.024+548.312.3 | DOI: 10.14529/chem250104
Текст научной статьи Синтез и строение Нитратов бензили (4-карбоксибутил)трифенилфосфония
Аннотация. Взаимодействием бромидов бензил- и (4-карбоксибутил)трифенилфосфония с азотной кислотой синтезированы комплексы фосфора [Ph3PCH2Ph]NO3 (1) и [Ph3P(CH2)4COOH]NO3 (2) соответственно. Полученные соединения охарактеризованы методами ИК-спектроскопии и рентгеноструктурного анализа (РСА). По данным РСА, нитрат бензилтрифенилфосфония (1) [C25H22NO3P, M = 415,41; триклинная сингония, пр. гр. P–1; параметры ячейки: a = 9,573(7) A, b = 10,272(10) A, c = 12,066(11) А; а = 105,42(4)°, в = 107,06(4)°, Y = 92,73(4)°, V = 1083,3(16) A3, Z = 2; рвыч = 1,273 г/см3; ц = 0,153 мм-1; F(000) = 436,0; обл. сбора по 20: 5,68-54,32°; -12 < h < 12, -13 < k < 13, -15 < l < 15; всего отражений 26281; независимых отражений 4802 (Rint = 0,0345); GOOF = 1,038; R-фактор 0,0451] и нитрат (4-карбоксибутил)трифенилфосфония (2) [C23H24NO5P, M = 425,40; моноклинная сингония, пр. гр. P21/n; параметры ячейки: a = 8,937(16) A, b = 17,86(3) A, c = 13,71(2) А; а = 90,00°, в = 95,04(11)°, у = 90,00°, V = 2180(6) A3, Z = 4; рвыч = 1,296 г/см3; ц = 0,160 мм-1; F(000) = 896,0; обл. сбора по 20: 5,72-55,48°; -11 < h < 11, -22 < k < 23, -17 < l < 17; всего отражений 18882; независимых отражений 4732 (Rint = 0,0952); GOOF = 1,040; R-фактор 0,0729] имеют ионное строение и состоят из органилтрифенилфосфониевых катионов с несколько искаженной тетраэдрической координацией атома фосфора (углы CPC варьируются в пределах 107,10(8)-111,56(10)° для 1 и 107,62(10)-111,99(16)° для 2; расстояния P-C составляют 1,791(2)1,803(2) Å и 1,786(4)–1,803(4) Å соответственно) и плоских тригональных нитрат-анионов (суммы углов ONO равны 359,6° и 360°). Структурная организация в кристалле 1 обусловлена только межионными водородными связями C–H∙∙∙O–NO2 (2,24–2,61 Å). Кристалл 2, кроме взаимодействий C–H∙∙∙O–NO2 (2,12–2,72 Å), также содержит контакты O–H∙∙∙O–NO2 (2,12 и 2,42 Å), C–H∙∙∙O=C (2,63 Å) и C–H∙∙∙NO3 (2,60 Å). Полные таблицы координат атомов, длин связей и валентных углов нитратов 1 и 2 депонированы в Кембриджском банке структурных данных (CCDC 2331486 (1), 2331490 (2); ; .
Известно, что фосфорорганические соединения широко используются в качестве смазочных материалов, топливных присадок, антипиренов, пластификаторов, фармацевтических препаратов, реагентов в органическом синтезе и проявляют свойства инсектицидов, гербицидов или нервнопаралитических агентов [1–3]. Одними из наиболее исследованных органических производных фосфора являются соли тетраорганилфосфония [R 4 P]X (где R – одинаковые или отличающиеся заместители), получаемые алкилированием/арилированием органофосфинов, а также по реакции пентаорганилфосфора с различными агентами [4, 5]. Важнейшей областью применения солей фосфония можно считать получение из них фосфорных илидов, используемых для синтеза алкенов заданного строения, кроме того, данные соединения широко применяются в качестве объемных катионов для стабилизации различных анионов [6–8], а также в качестве ионных жидкостей [9], межфазных катализаторов [10] и антипиренов [11]. Несмотря на значительный объем накопленных экспериментальных данных по тетраорганилфосфониевым солям, кристаллическое строение нитратных производных [R 4 P]NO 3 известны для небольшого числа примеров [12–17]. С целью продолжения данного направления нами описан синтез нитратов бензилтрифенилфосфония ( 1 ) и (4-карбоксибутил)трифенилфосфония ( 2 ), строение которых доказано методами ИК-спектроскопии и рентгеноструктурного анализа.
Экспериментальная часть
Синтез нитрата бензилтрифенилфосфония [PhCH 2 P(Ph) 3 ][NO 3 ] (1). Бромид бензилтрифенилфосфония (0,200 г, 0,46 ммоль) растворяли в 20 мл воды при нагревании, охлаждали до комнатной температуры и прибавляли 1 мл раствора концентрированной азотной кислоты (ρ = 1,382 г/мл). Выпавший осадок соединения 1 фильтровали, сушили и перекристаллизовывали из 2-пропанола. Выход 0,164 г (85 %), т. пл. 213 °С. Найдено (%): C 72,11; Н 5,44. Для C 25 H 22 NO 3 P рассчитано (%): С 72,22; Н 5,30. ИК-спектр: 3061, 3026, 2994, 2940, 2895, 2822, 1443, 1377, 1323, 995, 827 см–1.
Синтез нитрата (4-карбоксибутил)трифенилфосфония [HO(O)C(CH 2 ) 4 PPh 3 ][NO 3 ] (2). Синтезировали по аналогичной методике из бромида (4-карбоксибутил)трифенилфосфония ( 0,100 г, 0,23 ммоль) и азотной кислоты. Выход 0,078 г (81 %), т. пл. 175 °С. Найдено (%):
C 65,37; Н 5,71. Для C 23 H 24 NO 5 P рассчитано (%): С 64,92; Н 5,64. ИК-спектр: 3082, 3055, 3042, 3026, 2997, 2907, 2878, 2839, 1728, 1439, 1319, 995, 824 см–1.
ИК-спектры соединений 1 и 2 записывали на ИК-Фурье спектрометре Shimadzu IRAffinity-1S; образцы готовили таблетированием с KBr (область поглощения 4000 - 400 см - 1).
Рентгеноструктурный анализ соединений 1 и 2 проводили на автоматическом четырехкружном дифрактометре Bruker D8 QUEST (Mo K α -излучение, λ = 0,71073 Å, графитовый монохроматор). Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT-Plus [18]. Все расчеты по определению и уточнению структур выполнены по программам SHELXL/PC [19] и OLEX2 [20]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Кристаллографические данные и результаты уточнения структуры приведены в табл. 1, длины связей и валентные углы – в табл. 2.
Таблица 1
Кристаллографические данные, параметры эксперимента и уточнения структур 1 и 2
|
Параметр |
1 |
2 |
|
Формула |
C 25 H 22 NO 3 P |
C 23 H 24 NO 5 P |
|
М |
415,41 |
425,40 |
|
Сингония |
Триклинная |
Моноклинная |
|
Пространственная группа |
P –1 |
P 2 1 / n |
|
a , Å |
9,573(7) |
8,937(16) |
|
b, Å |
10,272(10) |
17,86(3) |
|
c, Å |
12,066(11) |
13,71(2) |
|
α, град. |
105,42(4) |
90,00 |
|
β, град. |
107,06(4) |
95,04(11) |
|
γ, град. |
92,73(5) |
90,00 |
|
V , Å3 |
1083,3(16) |
2180(6) |
|
Z |
2 |
4 |
|
ρ (выч.), г/см3 |
1,273 |
1,296 |
|
–1 µ , мм |
0,153 |
0,160 |
|
F (000) |
436,0 |
966,0 |
|
Форма кристалла (размер, мм) |
0,55 × 0,5 × 0,11 |
0,56 × 0,26 × 0,11 |
|
Область сбора данных по 2 θ , град. |
5,68–54,32 |
5,72–55,48 |
|
Интервалы индексов отражений |
–12 ≤ h ≤ 12, –13 ≤ k ≤ 13, –15 ≤ l ≤ 15 |
–11 ≤ h ≤ 11, –22 ≤ k ≤ 22, –17 ≤ l ≤ 17 |
|
Измерено отражений |
26281 |
18882 |
|
Независимых отражений ( R int) |
4802 (0,0345) |
4732 (0,0952) |
|
Переменных уточнения |
275 |
272 |
|
GOOF |
1,038 |
1,040 |
|
R -факторы по F 2 > 2 σ ( F 2) |
R 1 = 0,0451, wR 2 = 0,1170 |
R 1 = 0,0729, wR 2 = 0,1805 |
|
R -факторы по всем отражениям |
R 1 = 0,0569, wR 2 = 0,1262 |
R 1 = 0,1409, wR 2 = 0,2162 |
|
Остаточная электронная плотность (min/max), e /Å3 |
0,34/–0,27 |
0,28/–0,25 |
Таблица 2
Длины связей и валентные углы в структурах 1 и 2
|
Связь d , Å \ |
Угол ω, град. |
||
|
1 |
|||
|
P(1)–C(1) |
1,791(2) |
C(1)P(1)C(21) |
110,52(9) |
|
P(1)–C(21) |
1,795(2) |
C(1)P(1)C(11) |
110,87(9) |
|
P(1)–C(11) |
1,7989(19) |
C(1)P(1)C(37) |
108,27(9) |
|
P(1)–C(37) |
1,803(2) |
C(21)P(1)C(11) |
107,10(8) |
Окончание табл. 2
|
Связь d , Å |
Угол ω, град. |
||
|
O(1)–N(1) |
1,230(3) |
C(21)P(1)C(37) |
111,56(10) |
|
O(3)–N(1) |
1,219(2) |
C(11)P(1)C(37) |
108,52(9) |
|
O(2)–N(1) |
1,234(2) |
O(1)N(1)O(2) |
122,1(2) |
|
2 |
|||
|
P(1)–C(21) |
1,802(4) |
C(21)P(1)C(31) |
108,77(19) |
|
P(1)–C(1) |
1,786(4) |
C(1)P(1)C(21) |
107,62(16) |
|
P(1)–C(31) |
1,803(4) |
C(1)P(1)C(31) |
111,99(16) |
|
P(1)–C(11) |
1,795(4) |
C(1)P(1)C(11) |
109,52(18) |
|
O(5)–C(35) |
1,193(5) |
C(11)P(1)C(21) |
108,04(16) |
|
N(1)–O(1) |
1,231(4) |
C(11)P(1)C(31) |
110,78(16) |
|
N(1)–O(2) |
1,180(5) |
O(2)N(1)O(3) |
118,4(4) |
|
N(1)–O(3) |
1,229(5) |
O(1)N(1)O(2) |
122,3(4) |
Полные таблицы координат атомов, длин связей и валентных углов соединения 1 и 2 депонированы в Кембриджском банке структурных данных (№ 2331486 и 2331490; ; .
Обсуждение результатов
Известно, что реакции обмена галогенид-аниона в галогенидах органилтрифенилфосфония используются для получения комплексов платины, золота и серебра [6, 21, 22]. Интересный случай замещения галогенид-аниона на остаток более сильной кислоты описан авторами работы [23], в которой описываются реакции галогенидов органилтрифенилфосфония с аренсульфоновыми кислотами в воде, приводящие к образованию аренсульфонатов органилтрифенилфос-фония. Единственный пример замещения атома хлора на нитрогруппу приведен в работе [24], где действие азотной кислоты на хлориды цианометил- и ацетонилтрифенилфосфония приводит к образованию с хорошим выходом соответствующих нитратов.
В продолжение исследований в области реакций замещения бром-аниона в производных фосфора [Ph 3 PR]Br нами получены нитраты бензилтрифенилфосфония и (4-карбоксибутил)трифенилфосфония [Ph 3 PCH 2 Ph]NO 3 ( 1 ) и [Ph 3 P(CH 2 ) 4 C(O)OH]NO 3 ( 2 ):
[Ph 3 PR]Br + HNO 3 -^-+ [Ph 3 PR]NO 3
R = CH 2 Ph ( 1 ), (CH 2 ) 4 C(O)OH ( 2 )
Структуры соединений 1 и 2 подтверждаются данными ИК-спектров, которые содержат характерные для органилтрифенилфосфониевых солей полосы поглощения колебаний связей P-C Ph в областях 1450-1435 см–1 и 1005–995 см–1: 1439, 995 см–1 ( 1 ) и 1443, 995 см–1 ( 2 ). ИК-спектр комплекса 2 содержит интенсивную полосу поглощения валентных колебаний карбонильной группы при 1728 см–1. Кроме того, в ИК-спектрах соединений 1 и 2 присутствуют полосы поглощения при 1319 см–1 ( 1 ) и 1323, 1377 см–1 ( 2 ), относящиеся к асимметричным валентным колебаниям N–O связи в анионах NO3–. Также наблюдается слабые полосы поглощения при 824 см–1 ( 1 ) и 827 см–1 ( 2 ), характерные для деформационных колебаний О-N-O нитратных анионов. ИК-спектры обоих комплексов содержат полосы поглощения при 3061, 2994 ( 1 ), 3082, 2997 см–1 ( 2 ), и 2940, 2822 см–1 ( 1 ), 2907, 2839 см–1 ( 2 ), относящиеся к валентным колебаниям связей C-H Ar и C– H Alk соответственно [25].
Комплексы 1 и 2 состоят из нитрат-анионов и органилтрифенилфосфониевых катионов с несколько искаженной тетраэдрической координацией атома фосфора (углы CPC варьируются в пределах 107,10(8) - 111,56(10) ° для 1 (рис. 1) и 107,62(10) - 111,99(16) ° для 2 (рис. 2); расстояния P–C составляют 1,791(2)–1,803(2) Å и 1,786(4)–1,803(4) Å соответственно и не превышают суммы ковалентных радиусов атомов фосфора и sp 3-гибридизованного углерода (1,88 Å [26]).
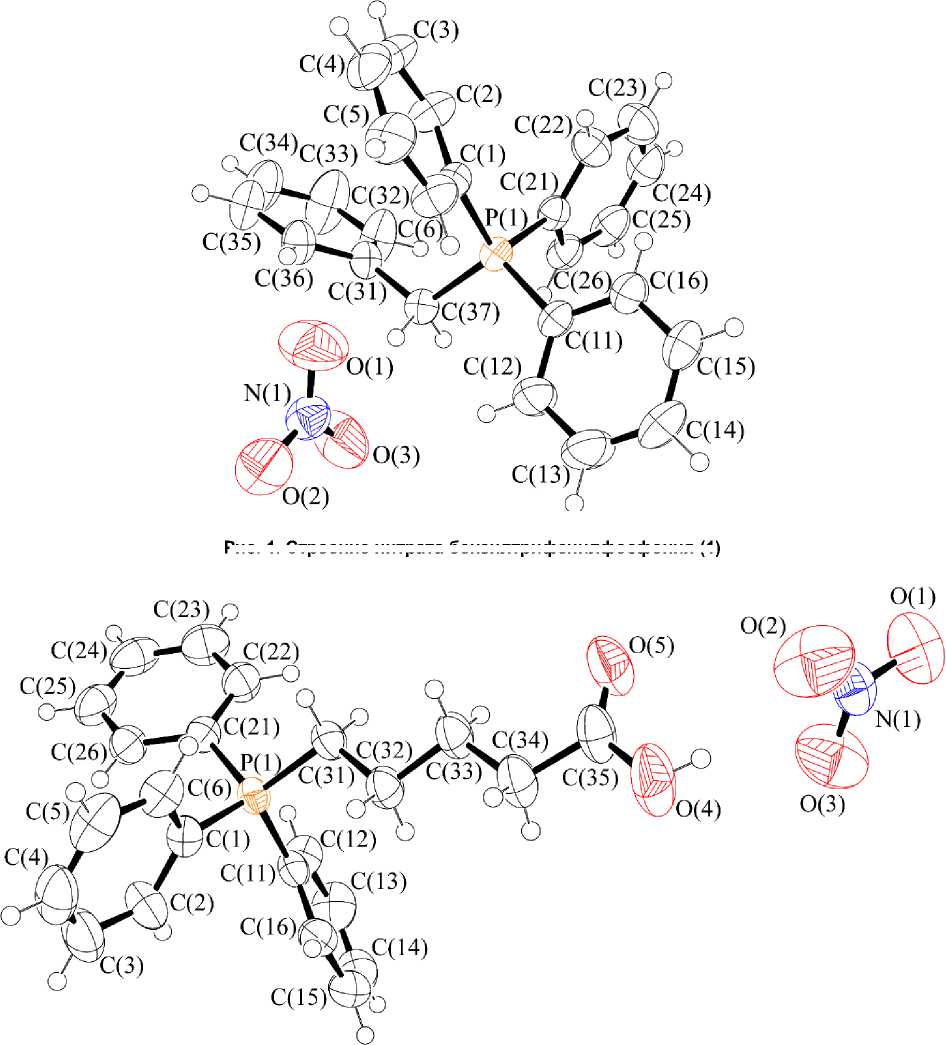
Рис. 1. Строение нитрата бензилтрифенилфосфония (1)
Рис. 2. Строение нитрата (4-карбоксибутил)трифенилфосфония (2)
В плоских тригональных нитрат-анионах суммы углов ONO равны 359,6 ° и 360 ° соответственно. Структурная организация в кристаллах 1 и 2 обусловлена межионными водородными связями C–H∙∙∙O–NO 2 (2,24–2,61 Å и 2,12–2,72 Å соответственно), причем наиболее короткий контакт наблюдается в 2 между атомом водорода метиленовой группы при атоме фосфора и атомом азота нитрогруппы.
Кристаллическая организация нитратов 1 и 2 (рис. 3, 4), в основном, обусловлена водородными связями C–H∙∙∙O–NO2, длины которых варьируют в интервале 2,25–2,61 Å, что не превышает суммы ван-дер-ваальсовых радиусов атомов водорода и кислорода (H∙∙∙O 2,62 Å [27]). Кристалл 2 имеет более сложную организацию, и, кроме контактов C–H∙∙∙O–NO 2 (2,39–2,64 Å), также содержит водородные связи O–H∙∙∙O–NO 2 (2,12 и 2,42 Å), C–H∙∙∙O=C (2,63 Å) и C–H∙∙∙NO 3 (2,60 Å), длины которых меньше сумм ван-дер-ваальсовых радиусов соответствующих атомов или близки к таковым (H∙∙∙N 2,65 Å [27]).
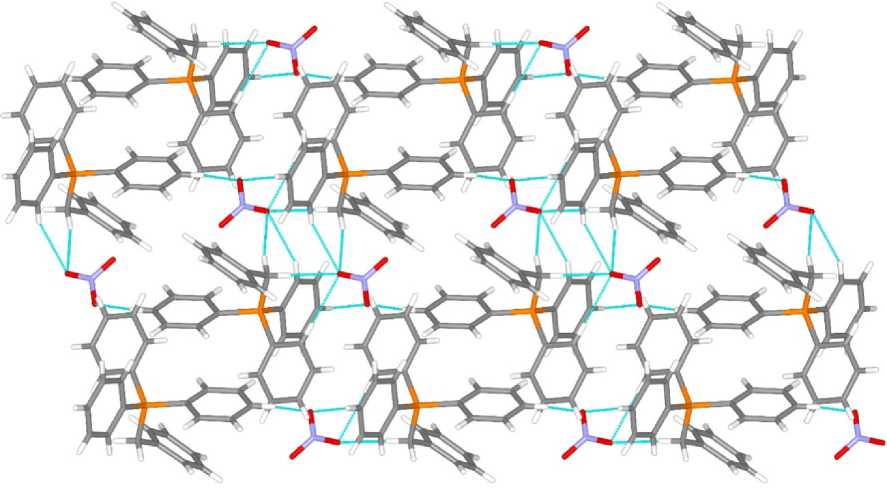
Рис. 3. Пространственная организация кристалла 1
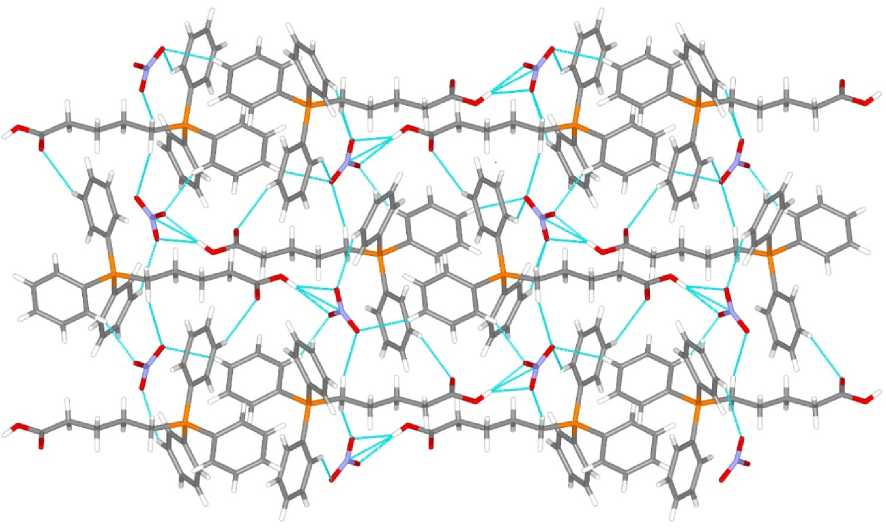
Рис. 4. Пространственная организация кристалла 2 (проекция вдоль оси a )
Выводы
Таким образом, нами впервые получены нитраты бензилтрифенилфосфония ( 1 ) и (4-карбоксибутил)трифенилфосфония ( 2 ), которые состоят из слабо искаженных тетраэдрических алкилтрифенилфосфониевых катионов и плоских тригональных нитрат-анионов. Межионные взаимодействия в кристалле 1 представлены только водородными связями C–H∙∙∙O–NO2, в то время как пространственная организация кристалла 2 включает также контакты O–H∙∙∙O–NO 2 , C– H∙∙∙O=C и C–H∙∙∙NO 3 .


