Синтез и строение органосульфонатов органилтрифенилфосфония [Ph3PR][OSO2R’], R = Ph, R’ = C6H3Cl2-2,5; R = C6H11-cyclo, R’ = C6H3Cl2-2,5; R = CH2OMe, R’ = C6H3(NO2)2-2,4; R = CH2OMe, R’ = C6H4(COOH-2)
Автор: Шарутин Владимир Викторович, Шарутина Ольга Константиновна, Механошина Евгения Сергеевна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 2 т.14, 2022 года.
Бесплатный доступ
Взаимодействием эквимолярных количеств хлорида тетраорганилфосфония с 2,5-дихлорбензолсульфоновой, 2,4-динитробензолсульфоновой и 2-карбоксибензолсульфоновой кислотами в воде синтезированы органосульфонаты тетраорганилфосфония [Ph3PR][OSO2R’], R = Ph, R’ = C6H3Cl2-2,5 (1); R = C6H11-cyclo, R’ = C6H3Cl2-2,5 (2); R = CH2OMe, R’ = C6H3(NO2)2-2,4 (3); R = CH2OMe, R’ = C6H4(COOH-2) (4). По данным рентгеноструктурного анализа, проведенного при 293 К на автоматическом четырехкружном дифрактометре D8 Quest Bruker (двухкоординатный CCD-детектор, Мо Кα-излучение, λ = 0,71073 Å, графитовый монохроматор), кристаллов 1 [C30H27Cl2O5PS, M 601,45; сингония триклинная, группа симметрии P-1; параметры ячейки: a = 10,998(5), b = 11,358(6), c = 12,923(10) Å; a = 85,54(3), β = 67,47(2), g = 76,81(2) град., V = 1451,5(15) Å3, Z = 2; rвыч = 1,376 г/см3; m = 0,389 мм-1; F(000) = 624,0; Rint = 0,0393, GOOF = 1,034], 2 [C30H29Cl2O3PS, M 571,46; сингония моноклинная, группа симметрии Cc; параметры ячейки: a = 9,089(4), b = 17,082(7), c = 17,647(7) Å; a = 90,00, β = 97,22(2), g = 90,00 град., V = 2718,0(19) Å3, Z = 4; rвыч = 1,397 г/см3; m = 0,406 мм-1; F(000) = 1192,0; Rint = 0,0241, GOOF = 1,037], 3 [C26H23N2O8PS, M 554,49; сингония триклинная, группа симметрии P-1; параметры ячейки: a = 9,437(6), b = 11,424(10), c = 13,685(12) Å; a = 65,34(3), β = 84,66(3), g = 72,68(3) град., V = 1279,3(17) Å3, Z = 2; rвыч = 1,439 г/см3; m = 0,243 мм-1; F(000) = 576,0; Rint = 0,0395, GOOF = 1,033], 4 [C27H25O6PS, M 508,50; сингония триклинная, группа симметрии P-1; параметры ячейки: a = 8,263(11), b = 12,085(17), c = 12,987(14) Å; a = 84,17(5), β = 86,78(4), g = 83,51(6) град., V = 1281(3) Å3, Z = 2; rвыч = 1,319 г/см3; m = 0,229 мм-1; F(000) = 532,0; Rint = 0,0423, GOOF = 1,024], атомы фосфора в катионах характеризуются тетраэдрической координацией, органосульфонатные анионы имеют обычную геометрию с тетраэдрическим атомом серы. Длины связей P-C составляют 1,7665(18)-1,836(2) Å, что меньше суммы ковалентных радиусов атомов-партнеров (1,88 Å). Валентные углы СРС изменяются в интервалах 103,81(6)°-113,43(7)°. Структурная организация кристаллов 1-4 формируется за счёт множества слабых водородных связей между катионами и анионами, например, S=O···H-CAr, N=O···H-CAr, C=O···H-CAr и др. Аренсульфонатные анионы в комплексе 1 посредством молекул кристаллизационной воды структурированы в димеры. Полные таблицы координат атомов, длин связей и валентных углов для структур депонированы в Кембриджском банке структурных данных (№ 2142598 (1), № 2144330 (2), № 2144708 (3), № 2145604 (4); deposit@ccdc.cam.ac.uk; http://www.ccdc. cam.ac.uk).
Органосульфонат тетраорганилфосфония, синтез, строение, рентгеноструктурные исследования
Короткий адрес: https://sciup.org/147237512
IDR: 147237512 | УДК: 546.87+547.29+548.312.5
Текст научной статьи Синтез и строение органосульфонатов органилтрифенилфосфония [Ph3PR][OSO2R’], R = Ph, R’ = C6H3Cl2-2,5; R = C6H11-cyclo, R’ = C6H3Cl2-2,5; R = CH2OMe, R’ = C6H3(NO2)2-2,4; R = CH2OMe, R’ = C6H4(COOH-2)
Взаимодействием эквимолярных количеств хлорида тетраорганилфосфония с 2,5дихлорбензолсульфоновой, 2,4-динитробензолсульфоновой и 2-карбоксибензолсульфоновой кислотами в воде синтезированы органосульфонаты тетраорганилфосфония [Ph3PR][OSO2R’], R = Ph, R’ = C6H3Cl2-2,5 (1); R = C6H11-cyclo, R’ = C6H3Cl2-2,5 (2); R = CH2OMe, R’ = C6H3(NO2)2-2,4 (3); R = CH2OMe, R’ = C6H4(COOH-2) (4). По данным рентгеноструктурного анализа, проведенного при 293 К на автоматическом четырехкружном дифрактометре D8 Quest Bruker (двухкоординатный CCD-детектор, Мо Кα-излучение, λ = 0,71073 Å, графитовый монохроматор), кристаллов 1 [C30H27Cl2O5PS, M 601,45; сингония триклинная, группа симметрии P-1; параметры ячейки: a = 10,998(5), b = 11,358(6), c = 12,923(10) А; a = 85,54(3), в = 67,47(2), Y = 76,81(2) град., V = 1451,5(15) А3, Z = 2; рвыч = 1,376 г/см3; ц = 0,389 мм-1; F(000) = 624,0; Rmt = 0,0393, GOOF = 1,034], 2 [C30H29Cl2O3PS, M 571,46; сингония моноклинная, группа симметрии Cc; параметры ячейки: а = 9,089(4), b = 17,082(7), c = 17,647(7) А; a = 90,00, в = 97,22(2), Y = 90,00 град., V = 2718,0(19) А3, Z = 4; рвыч = 1,397 г/см3; ц = 0,406 мм-1; F(000) = 1192,0; Rn = 0,0241, GOOF = 1,037], 3 [C26H23N2O8PS, M 554,49; сингония триклинная, группа симметрии P-1; параметры ячейки: а = 9,437(6), b = 11,424(10), c = 13,685(12) А; a = 65,34(3), в = 84,66(3), Y = 72,68(3) град., V = 1279,3(17) А3, Z = 2; рвыч = 1,439 г/см3; ц = 0,243 мм-1; F(000) = 576,0; Rint = 0,0395, GOOF = 1,033], 4 [C27H25O6PS, M 508,50; сингония триклинная, группа симметрии P-1; параметры ячейки: a = 8,263(11), b = 12,085(17), c = 12,987(14) Å; a = 84,17(5), в = 86,78(4), Y = 83,51(6) град., V = 1281(3) А3, Z = 2; рвыч = 1,319 г/см3; ц = 0,229 мм-1; F(000) = 532,0; Rint = 0,0423, GOOF = 1,024], атомы фосфора в катионах характеризуются тетраэдрической координацией, органосульфонатные анионы имеют обычную геометрию с тетраэдрическим атомом серы. Длины связей P-C составляют 1,7665(18)-1,836(2) А, что меньше суммы ковалентных радиусов атомов-партнеров (1,88 А). Валентные углы СРС изменяются в интервалах 103,81(6)°-113,43(7)°. Структурная организация кристаллов 1-4 формируется за счёт множества слабых водородных связей между катионами и анионами, например, S=O---H-CAr, N=O---H-CAr, C=O^H-CAr и др. Аренсульфонатные анионы в комплексе 1 посредством молекул кристаллизационной воды структурированы в димеры. Полные таблицы координат атомов, длин связей и валентных углов для структур депонированы в Кембриджском банке структурных данных (№ 2142598 (1), № 2144330 (2), № 2144708 (3), № 2145604 (4); ; .
Интерес к органическим соединениям фосфора во многом определяется потенциалом их применения в самых разнообразных областях практической деятельности: в качестве инсектицидов, фунгицидов, дефолиантов, гербицидов, пластификаторов, ионитов, присадок к бензинам и смазочным маслам [1]. Органические соединения фосфора нашли также применение в синтетической органической химии, например, при получении олефинов по Виттигу [2] или синтезе элементоорганических соединений [3]. Сообщалось также о перспективах практического применения некоторых фосфорорганических соединений в качестве катализаторов гидрофункционализации непредельных субстратов [4], реагентов для транс-металлирования [5] и метатезиса σ-связей [6]. Из всех производных пятивалентного фосфора наиболее изучены соли тетрафенилфосфония, которые обычно получают по реакции окислительного присоединения из трифенилфосфина и галогенарена в присутствии хлористого алюминия [1] либо по реакции пентафенилфосфора с кислотами [7-10]. В работах [11-17] описан синтез других структурно охарактеризованных органо-сульфонатов тетрафенилфосфония, однако в литературе неизвестны примеры получения арен-сульфонатов органилтрифенилфосфония.
Нами впервые синтезированы и структурно охарактеризованы аренсульфонаты органилтрифе-нилфосфония [Ph 3 PR][OSO 2 R’], R = Ph, R’ = C 6 H 3 Cl 2 -2,5 ( 1 ); R = C 6 H 11 - cyclo , R’ = C 6 H 3 Cl 2 -2,5 ( 2 ); R = CH 2 OMe, R’ = C 6 H 3 (NO 2 ) 2 -2,4 ( 3 ); R = CH 2 OMe, R’ = C 6 H 4 (COOH-2) ( 4 ).
Экспериментальная часть
В работе использовали хлориды органилтрифенилфосфония и аренсульфоновые кислоты (Alfa Aesar).
Гидрат 2,5-дихлорбензолсульфоната тетрафенилфосфония
[Ph 4 P][OSO 2 C 6 H 3 Cl 2 -2,5] ∙ 2H 2 O (1)
получали из эквимолярных количеств хлорида тетрафенилфосфония и 2,5дихлорбензолсульфоновой кислоты в воде. После перекристаллизации целевого продукта из воды получили бесцветные кристаллы с t пл = 168 °С (94 %). ИК-спектр ( ν , см-1): 3549, 3483, 3063, 1782, 1651, 1585, 1483, 1439, 1375, 1317, 1217, 1165, 1148, 1107, 1065, 1016, 995, 893, 827, 814, 768, 723, 692, 621, 528, 434. Найдено, %: С 58,77; Н 4,56. C 30 H 27 Cl 2 O 5 PS. Вычислено, %: С 59,01; Н 4,52.
2,5-Дихлорбензолсульфонат циклогексилтрифенилфосфония [Ph3PC6H11-цикло][OSO2C6H3Cl2-2,5] (2), бесцветные кристаллы с tпл = 195 °С (95 %). ИК-спектр (ν, см-1): 3078, 3042, 2930, 2884, 2853, 1585, 1485, 1441, 1371, 1346, 1327, 1238, 1219, 1165, 1146, 1107, 1090, 1061, 1015, 997, 901, 885, 853, 829, 804, 743, 721, 692, 621, 528, 513, 471, 417. Найдено, %: С 62,86; Н 5,14. C30H29Cl2O3PS. Вычислено, %: С 63,05; Н 5,11.
2,4-Динитробензолсульфонат метоксиметилтрифенилфосфония[Ph3PCH2OMe] [OSO2C6H3(NO2)2-2,4] (3), бесцветные кристаллы с tпл = 145 °С (97 %).ИК-спектр (ν, см-1): 3088, 3019, 2893, 2833, 1600, 1587, 1545, 1528, 1485, 1437, 1352, 1236, 1165, 1130, 1115, 1097, 1063, 1028, 997, 943, 903, 851, 833, 797, 746, 727, 691, 635, 557, 532, 507, 494, 467, 447. Найдено, %: С 56,17; Н 4,36. C26H23N2O8PS. Вычислено, %: С 56,32; Н 4,18.
2-Карбоксибензолсульфонат метоксиметилтрифенилфосфония[Ph3PCH2OMe] [OSO2C6H4(COOH-2)] (4), бесцветные кристаллы с tпл = 134 °С (97 %). ИК-спектр (ν, см-1): 3460, 3065, 3024, 2934, 2833, 1715, 1589, 1566, 1487, 1439, 1292, 1248, 1171, 1140, 1115, 1094, 1020, 997, 872, 798, 760, 719, 691, 619, 569, 528, 503, 446. Найдено, %: С 63,63; Н 4,99. C27H25O6PS. Вычислено, %: С 63,77; Н 4,95.
ИК-спектры соединений записывали на ИК-Фурье спектрометре Shimadzu в таблетках KBr. Температуры плавления измерены на синхронном термоанализаторе Netzsch 449C Jupiter. Элементный анализ проводили на анализаторе Euro EA3028-НТ, РСА - на дифрактометре D8 QUEST фирмы Bruker при 293 К. Сбор данных, определение и уточнение структур проведено по программам [18 - 20].
Кристаллографические данные и результаты уточнения структур приведены в табл. 1, длины связей и валентные углы – в табл. 2.
Таблица 1
Кристаллографические данные, параметры эксперимента и уточнения структур 1 ‒ 4
|
Параметр |
1 |
2 |
3 |
4 |
|
Формула |
C 30 H 27 Cl 2 O 5 PS |
C 30 H 29 Cl 2 O 3 PS |
C 26 H 23 N 2 O 8 PS |
C 27 H 25 O 6 PS |
|
М |
601,45 |
571,46 |
554,49 |
508,50 |
|
Сингония |
Триклинная |
Моноклинная |
Триклинная |
Триклинная |
|
Пр. группа |
P -1 |
Cc |
P -1 |
P -1 |
|
a , Å |
10,998(5) |
9,089(4) |
9,437(6) |
8,263(11) |
|
b, Å |
11,358(6) |
17,082(7) |
11,424(10) |
12,085(17) |
|
c, Å |
12,923(10) |
17,647(7) |
13,685(12) |
12,987(14) |
|
α, град. |
85,54(3) |
90,00 |
65,34(3) |
84,17(5) |
Окончание табл. 1
|
Параметр |
1 |
2 |
3 |
4 |
|
β, град. |
67,47(2) |
97,22(2) |
84,66(3) |
86,78(4) |
|
γ, град. |
76,81(2) |
90,00 |
72,68(3) |
83,51(6) |
|
V , Å3 |
1451,5(15) |
2718,0(19) |
1279,3(17) |
1281(3) |
|
Z |
2 |
4 |
2 |
2 |
|
р(выч.), г/см 3 |
1,376 |
1,397 |
1,439 |
1,319 |
|
–1 ц, мм |
0,389 |
0,406 |
0,243 |
0,229 |
|
F (000) |
624,0 |
1192,0 |
576,0 |
532,0 |
|
Размер кристалла, мм |
0,4 × 0,25 × 0,12 |
0,5 × 0,3 × 0,19 |
0,32 × 0,23 × 0,17 |
0,43 × 0,35 × 0,17 |
|
Область сбора данных по 9, град. |
6,14–56,7 |
5,84‒66,34 |
6,14–72,92 |
6–57 |
|
Интервалы индексов отражений |
–14 ≤ h ≤ 14, –15 ≤ k ≤ 15, –17 ≤ l ≤ 17 |
–13 ≤ h ≤ 13, –26 ≤ k ≤ 26, –27 ≤ l ≤ 26 |
–15 ≤ h ≤ 15, –18 ≤ k ≤ 18, –22 ≤ l ≤ 22 |
–11 ≤ h ≤ 11, –16 ≤ k ≤ 16, –17 ≤ l ≤ 17 |
|
Измерено отражений |
49272 |
49456 |
76725 |
52567 |
|
Независимых отражений |
7189 |
10159 |
11319 |
6475 |
|
R int |
0,0393 |
0,0241 |
0,0395 |
0,0423 |
|
Переменных уточнения |
358 |
334 |
344 |
339 |
|
GOOF |
1,034 |
1,037 |
1,033 |
1,024 |
|
R -факторы по F > 2ст( F ) |
R 1 = 0,0409, wR 2 = 0,1015 |
R 1 = 0,0317, wR 2 = 0,0773 |
R 1 = 0,0521, wR 2 = 0,1302 |
R 1 = 0,0414, wR 2 = 0,0999 |
|
R -факторы по всем отражениям |
R 1 = 0,0592, wR 2 = 0,1116 |
R 1 = 0,0413, wR 2 = 0,0814 |
R 1 = 0,0856, wR 2 = 0,1455 |
R 1 = 0,0623, wR 2 = 0,1104 |
|
Остаточная электронная плотность (min/max), e/A3 |
0,47/–0,65 |
0,22/–0,27 |
0,37/–0,62 |
0,27/–0,30 |
Таблица 2
|
Связь d , Å |
Угол ю, ° |
||
|
1 |
|||
|
S(1)–O(1) |
1,4498(18) |
O(1)S(1)O(2) |
112,92(12) |
|
S(1)–O(2) |
1,4499(18) |
O(1)S(1)O(3) |
113,78(11) |
|
S(1)–O(3) |
1,4535(18) |
O(2)S(1)O(3) |
112,83(12) |
|
S(1)– C(41) |
1,7852(19) |
O(1)S(1)C(41) |
106,54(9) |
|
P(1)–C(1) |
1,8036(19) |
C(1)P(1)C(11) |
107,44(9) |
|
P(1)–C(11) |
1,7981(19) |
C(11)P(1)C(21) |
108,72(8) |
|
P(1)–C(21) |
1,7984(19) |
C(21)P(1)C(31) |
107,53(9) |
|
P(1)–C(31) |
1,7999(19) |
C(1)P(1)C(31) |
110,24(8) |
|
Cl(1)‒C(42) |
1,735(2) |
Cl(1)C(42)C(43) |
117,98(14) |
|
Cl(2)‒C(45) |
1,738(2) |
Cl(2)C(45)C(46) |
118,59(16) |
|
2 |
|||
|
S(1)–O(1) |
1,4497(14) |
O(1)S(1)O(2) |
113,32(9) |
|
S(1)–O(2) |
1,4502(15) |
O(1)S(1)O(3) |
113,43(10) |
|
S(1)–O(3) |
1,4365(13) |
O(2)S(1)O(3) |
114,84(10) |
|
S(1)– C(41) |
1,8063(16) |
O(1)S(1)C(41) |
104,53(7) |
|
P(1)–C(1) |
1,7897(13) |
C(1)P(1)C(11) |
110,56(5) |
|
P(1)–C(11) |
1,7972(13) |
C(11)P(1)C(21) |
104,95(5) |
|
P(1)–C(21) |
1,7984(13) |
C(21)P(1)C(31) |
111,14(6) |
|
P(1)–C(31) |
1,8173(13) |
C(1)P(1)C(31) |
109,81(6) |
|
Cl(1)‒C(42) |
1,7386(15) |
Cl(1)C(42)C(43) |
116,31(12) |
|
Cl(2)‒C(45) |
1,7391(14) |
Cl(2)C(45)C(46) |
118,81(12) |
|
3 |
|||
|
S(1)–O(2) |
1,4620(16) |
O(2)S(1)O(3) |
111,67(10) |
|
S(1)–O(3) |
1,3968(18) |
O(2)S(1)O(4) |
115,86(10) |
|
S(1)–O(4) |
1,4146(17) |
O(3)S(1)O(4) |
113,03(11) |
Окончание табл. 2
|
Связь d , Å |
Угол ю, ° |
||
|
S(1)– C(31) |
1,8422(18) |
O(2)S(1)C(31) |
107,06(9) |
|
P(1)–C(1) |
1,8085(17) |
C(1)P(1)C(7) |
111,80(8) |
|
P(1)–C(7) |
1,8081(18) |
C(7)P(1)C(11) |
103,81(6) |
|
P(1)–C(11) |
1,7875(16) |
C(11)P(1)C(21) |
111,47(7) |
|
P(1)–C(21) |
1,7665(18) |
C(1)P(1)C(21) |
105,91(8) |
|
N(1)–O(5) |
1,252(3) |
O(5)N(1)O(6) |
128,42(19) |
|
N(1)–O(6) |
1,224(2) |
O(7)N(2)O(8) |
123,3(2) |
|
N(2)–O(7) |
1,202(3) |
C(7)O(1)C(8) |
108,73(13) |
|
N(2)–O(8) |
1,211(4) |
P(1)C(7)O(1) |
104,14(9) |
|
O(1)–C(7) |
1,3975(18) |
||
|
4 |
|||
|
S(1)–O(2) |
1,465(2) |
O(2)S(1)O(3) |
111,65(12) |
|
S(1)–O(3) |
1,440(2) |
O(2)S(1)O(4) |
112,50(12) |
|
S(1)–O(4) |
1,464(2) |
O(3)S(1)O(4) |
114,63(11) |
|
S(1)– C(31) |
1,791(2) |
O(2)S(1)C(31) |
104,47(11) |
|
P(1)–C(1) |
1,793(2) |
C(1)P(1)C(7) |
107,96(11) |
|
P(1)–C(7) |
1,836(2) |
C(7)P(1)C(11) |
112,08(11) |
|
P(1)–C(11) |
1,807(3) |
C(11)P(1)C(21) |
108,91(12) |
|
P(1)–C(21) |
1,799(2) |
C(1)P(1)C(21) |
112,67(11) |
|
O(1)‒C(7) |
1,409(2) |
C(7)O(1)C(8) |
114,92(18) |
|
O(5A)‒C(37) |
1,184(9) |
O(5A)C(37)O(6A) |
115,4(6) |
|
O(5B)–C(37) |
1,190(6) |
O(5B)C(37)O(6B) |
121,2(3) |
|
O(6A)‒C(37) |
1,371(5) |
C(32)C(37)O(5A) |
124,1(5) |
|
O(6B)–C(37) |
1,347(4) |
C(32)C(37)O(6A) |
118,6(3) |
Полные таблицы координат атомов, длин связей и валентных углов для структур депонированы в Кембриджском банке структурных данных (№ 2142598 (1), 2144330 (2), 2144708 (3), 2145604 (4); ; .
Обсуждение результатов
Комплексы 1 - 4 получены при смешивании водных растворов хлоридов органилтрифенил-фосфония и соответствующей аренсульфоновой кислоты. При медленном испарении воды имело место образование устойчивых на воздухе прозрачных кристаллов, хорошо растворимых в хлороформе, аренах и дихлорметане, плохо - в воде и ацетонитриле при комнатной температуре.
[Ph a PRJCl + HOSO 2 R’ ^ [Ph 3 PR][OSO 2 R’] + HCl
R = Ph, R’ = C 6 H 3 Cl 2 -2,5 ( 1 ); R = C 6 H 11 - cyclo , R’ = C 6 H 3 Cl 2 -2,5 ( 2 );
R = CH 2 OMe, R’ = C 6 H 3 (NO 2 ) 2 -2,4 ( 3 ); R = CH 2 OMe, R’ = C 6 H 4 (COOH-2) ( 4 ).
Отметим, что комплекс 1 был синтезирован также из пентафенилфосфора и 2,5дихлорбензолсульфоновой кислоты в бензоле и выделен после перекристаллизации из воды в виде гидрата с выходом 93 %:
Ph 5 P + HOSO 2 C 6 H 3 Cl 2 -2,5 ^ [РЫР]^О 2 С б Н з С1 2 —2,5] + PhH
Полосы валентных колебаний углеродного скелета ароматических фрагментов в ИК-спектрах соединений 1 - 4 проявляются в области 1600-1483 см-1. Также наблюдаются полосы поглощения средней интенсивности валентных и деформационных колебаний связей CAr–H при 3088‒3019 см–1 и 1165‒1130 см–1, внеплоскостные деформационные колебания характеризуются полосами при 872‒797 см–1. Полосы поглощения при 1248-1217 см-1 и 1116-1090 см-1 относятся к асимметричным и симметричным валентным колебаниям сульфонатной группы SO3. Интенсивные полосы поглощения при 692‒691 см–1 и 532‒528 см‒1 можно отнести к валентным колебаниям связей S‒O и C–S. Валентные и деформационные колебания связей C Ar –P характеризуются полосами поглощения в областях 1441‒1437 см–1 и 1028‒995 см–1 соответственно [21].
Колебаниям связей C Ar –Cl в спектрах структур 1 , 2 отвечают полосы высокой интенсивности при 723 и 721 см–1. В ИК-спектрах комплекса 3 ассиметричным и симметричным колебаниям
NO 2 -группы соответствуют интенсивные полосы поглощения при 1545, 1528 и 1352 см–1. ИК-спектры соединений 3 , 4 содержат при 2833 см–1 полосы поглощения, относящиеся к валентным колебаниям связей O‒CH3. Наличие молекул воды в кристалле гидрата 2,5-дихлорбензол-сульфоната тетрафенилфосфония подтверждается присутствием в его ИК-спектре полос при 3549 и 3483 см–1. В ИК-спектре комплекса 4 проявляется интенсивная полоса валентных колебаний карбонильной группы (при 1715 см–1) и широкая полоса валентных колебаний гидроксильной группы (3460 см–1) [22], что свидетельствует о наличии свободной карбоксильной группы.
По данным РСА, кристалл 1 состоит из катионов тетрафенилфосфония (P - C 1,7981(19) - 1,8036(19) A, CPC 107,44(9) °- 112,23(9) ° ), 2,5-дихлорбензолсульфонатных анионов (S - O 1,4498(18) - 1,4535(18) A, OSO 112,83(12) °- 113,78(11) ° ) и молекул воды (рис. 1).
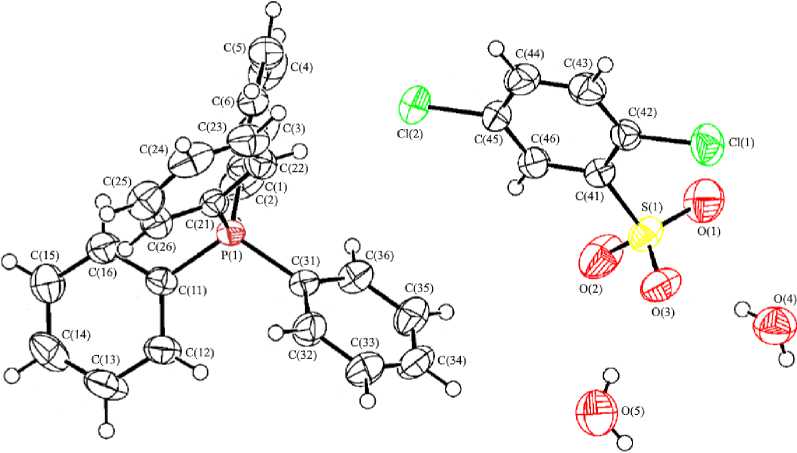
Рис. 1. Общий вид соединения 1
Молекулы воды связывают водородными связями два 2,5-дихлорбензолсульфонатных аниона в димер (Н-Ю 2,07 - 2,17 A), кроме того, имеют место внутримолекулярные контакты между орто -атомом хлора и одним из атомов кислорода сульфонатной группы (Cl∙∙∙O 3,193(5) Å) (рис. 2).
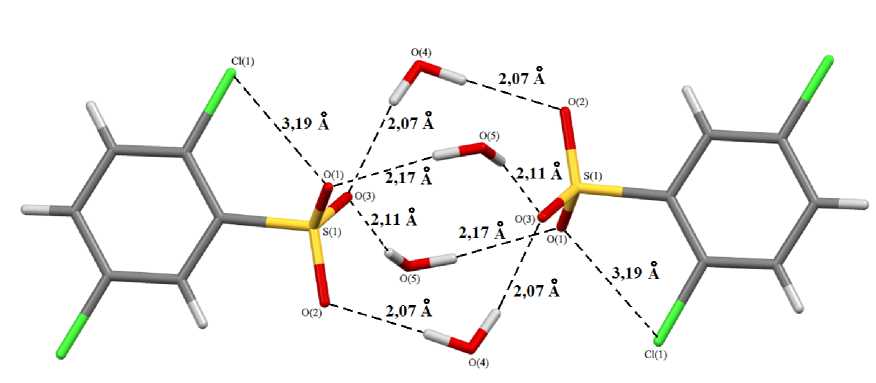
Рис. 2. Димерная организация аренсульфонатных анионов в кристалле соединения 1
О подобном структурировании аренсульфонатных анионов посредством молекул воды сообщалось в работах [23, 24].
Из данных рентгеноструктурного анализа соединений 2 - 4 следует, что их кристаллы включают катионы алкилтрифенилфосфония и аренсульфонатные анионы (рис. 3 - 5).
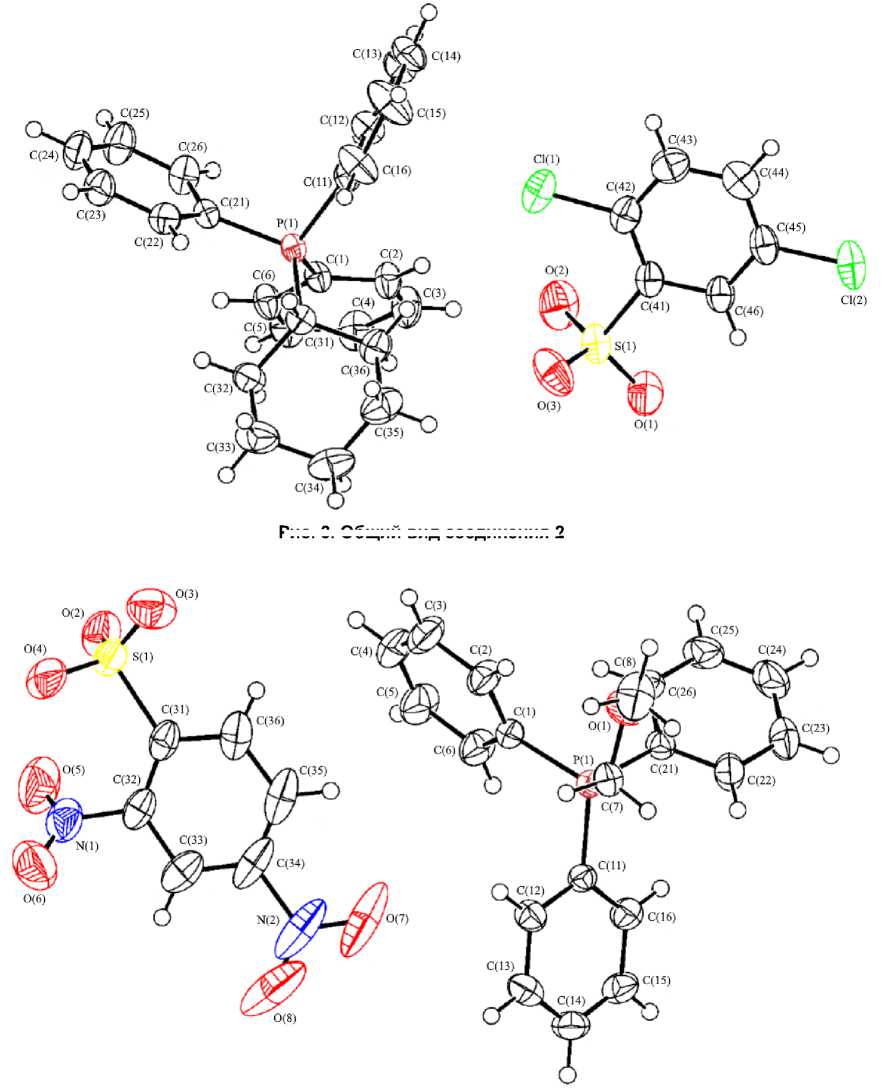
Рис. 3. Общий вид соединения 2
Рис. 4. Общий вид соединения 3
Атомы фосфора в катионах 2 , 3 , 4 имеют тетраэдрическую координацию [углы CРС варьируют в интервале 104,95(5) °- 111,14(6) ° для 2 , 103,81(6) - 113,43(7) ° для 3 , 105,90(12) - 112,67(11) ° для 4 ]. Длины связей P - C составляют 1,7897(13) - 1,8173(13), 1,7665(18) - 1,8085(17), 1,793(2) - 1,836(2) А соответственно, что несколько меньше суммы их ковалентных радиусов (1,88 А [25]). Расстояния S - O в аренсульфонатных анионах незначительно отличаются [1,4365(13) - 1,4502(15), 1,3968(18) - 1,4620(16), 1,440(2) - 1,465(2) А], однако в первом приближении можно говорить о равномерном распределении электронной плотности в группах SO3. Длины связей S - C составляют 1,8063(16), 1,8422(18), 1,791(2) А, что сопоставимо с аналогичным значением в соединении 1 [1,791(2) Å].
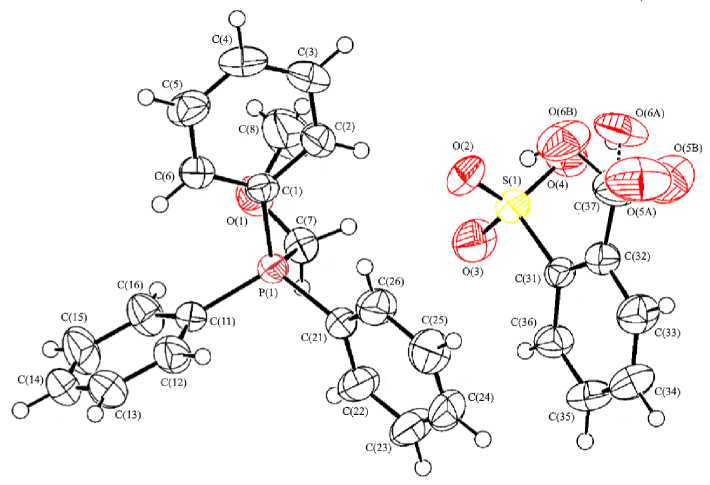
Рис. 5. Общий вид соединения 4
Структурная организация кристаллов 1 - 4 формируется за счёт множества слабых водородных связей между катионами и анионами, например, S=O···H - CAr, N=O···H - CAr, C=O···H - CAr и др.
Выводы
Установлено, что реакции замещения доступных хлоридов органилтрифенилфосфония с аренсульфоновыми кислотами в воде являются эффективным способом синтеза аренсульфона-тов органилтрифенилфосфония, который может рассматриваться как альтернативный способу их получения из пентаорганилфосфора и сульфоновых кислот.
Список литературы Синтез и строение органосульфонатов органилтрифенилфосфония [Ph3PR][OSO2R’], R = Ph, R’ = C6H3Cl2-2,5; R = C6H11-cyclo, R’ = C6H3Cl2-2,5; R = CH2OMe, R’ = C6H3(NO2)2-2,4; R = CH2OMe, R’ = C6H4(COOH-2)
- Пурдела, Д. Химия органических соединений фосфора / Д. Пурдела, Р. Вылчану. - М.: Химия, 1972. - 752 с.
- Бартон, Д. Общая органическая химия. Том 5. Соединения фосфора и серы / Д. Бартон, У.Д. Оллис. - М.: Химия, 1983. - 720 с.
- Alkyloxy- and Silyloxy-Derivatives of P(V) and Sb(V) / G.A. Razuvaev, N.A. Osanova, T.G. Brilki-na et al. // J. Organomet. Chem. - 1975. - V. 99, № 1. - P. 93-106. DOI: 10.1016/S0022-328X(00)86365-2
- Wang, D. The Golden Age of Transfer Hydrogénation / D. Wang, D. Astruc // Chem. Rev. -2015. - V. 115. - P. 6621-6686. DOI: 10.1021/acs.chemrev.5b00203.
- The Stille Reaction, 38 Years Later / C. Cordovilla, C. Bartolome, J.M. Martinez-Ilarduya et al. // ACS Catal. - 2015. - V. 5. - P. 3040-3053. DOI: 10.1021/acscatal.5b00448
- Chong, C.C. Metal-Free c-Bond Metathesis in 1,3,2-Diazaphospholene-Catalyzed Hydroboration of Carbonyl Compounds / C.C. Chong, H. Hirao, R. Kinjo // Angew. Chem. Int. Ed. - 2015. - V. 127. -P. 192-196. DOI: 10.1002/ange.201408760
- Карбоксилаты и сульфонаты тетрафенилфосфора. Синтез и строение / В.В. Шарутин, В.С. Сенчурин, О.К. Шарутина и др. // Журн. общей химии. - 2009. - Т. 79. - С. 80-89. DOI: 10.1134/S1070363209010125
- Синтез и строение карбоксилатов тетрафенилфосфония / В.В. Шарутин, О.К. Шарутина, A.В. Рыбакова и др. // Журн. общей химии. - 2018. - Т. 88, № 8. - С. 1308-1313. DOI: 10.1134/S0044460X18080139
- Шарутин, В.В. Синтез и строение 2,4-динитробензолсульфоната тетрафенилфосфония / B.В. Шарутин, Н. Мукушева, А.В. Уржумова // Вестник ЮУрГУ. Серия «Химия». - 2018. - Т. 10, № 2. - С. 48-54. DOI: 10.14529/chem180206
- Шарутин, В.В. Синтез и строение аренсульфонатов тетрафенилфосфония / В.В. Шарутин, О.К. Шарутина, Ю.О. Губанова // Изв. вузов. Химия и хим. технология. - 2019. - Т. 62, № 2. - C. 4-10. DOI: 10.6060/ivkkt.20196202.5823
- New Organic Free Radical Anions TEMPO-A-CO-(o-; m-; ^-^HlSOb" (A = NH; NCH3; O) and their TTF and/or BEDT-TTF Salts / H. Akutsu, K. Masaki, K. Mori et al. // Polyhedron. - 2005. -V. 24. - P. 2126-2132. DOI: 10.1016/j.poly.2005.03.023
- Tunable GUMBOS-Based Sensor Array for Label-Free Detection and Discrimination of Proteins / W.I.S. Galpothdeniya, F.R. Fronczek, M. Cong et al. // J. Mater. Chem. B. - 2016. - V. 4, № 8. -P. 1414-1422. DOI: 10.1039/C5TB02038G
- A New Anionic Acceptor, 2-Sulfo-3,5,6-trichloro-1,4-benzoquinone and its Charge-Transfer Salts / H. Akutsu, J. Yamada, S. Nakatsuji et al. // CrystEngComm. - 2009. - V. 11, № 12. -P. 2588-2592. DOI: 10.1039/b909519e
- Dinuclear Calcium Complex with Weakly NH—O Hydrogen-Bonded Sulfonate Ligands / A. Onoda, Y. Yamada, M. Doi et al. // Inorg. Chem. - 2001. - V. 40, № 3. - P. 516-521. DOI: 10.1021/ic0003067
- Anion Polarity-Induced Self-Doping in a Purely Organic Paramagnetic Conductor, a-a'-(BEDT-TTF)2(PO-CONH-m-C6H4SO3-H2O where BEDT-TTF is £7s(ethylenedithio)tetrathiafulvalene and PO is the Radical 2,2,5,5-Tetramethyl-3-pyrrolin-1-oxyl / H. Akutsu, K. Ishihara, S. Ito et al. // Polyhedron. - 2017. - V. 136. - P. 23-29. DOI: 10.1016/j.poly.2017.02.001
- Correlation between Metal-Insulator Transition and Hydrogen-Bonding Network in the Organic Metal á-(BEDT-TTF)4[2,6-Anthracene-te(sulfonate)HH2O)4 / F. Camerel, G. Le Helloco, T. Gui-zouarn et al. // Cryst. Growth Des. - 2013. - V. 13, № 11. - P. 5135-5145. DOI: 10.1021/cg401416h
- Ferrer, E.G. On a Novel Synthesis of 2-Sulfonatobenzoic Acid by Oxidation of Thiosalicylic Acid Catalyzed by Copper(II): a Structural Study / E.G. Ferrer, P.A.M. Williams, E.E. Castellano // Z. Anorg. Allg. Chem. - 2002. - V. 628. - P. 1979-1984. DOI: 10.1002/1521-3749(200209)628:9/10<1979::AID-ZAAC1979-3.0.CO;2-V
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- OLEX2: a Complete Structure Solution, Refinement and Analysis Program / O.V. Dolomanov, L.J. Bourhis, R.J. Gildea et al. // J. Appl. Cryst. - 2009. - V. 42. - P. 339-341. DOI: 10.1107/S0021889808042726
- Тарасевич, Б.Н. ИК-спектры основных классов органических соединений / Б.Н. Тарасевич. - М.: МГУ, 2012. - 54 с.
- Инфракрасная спектроскопия органических и природных соединений: учебное пособие / А.В. Васильев, Е.В. Гриненко, А.О. Щукин и др. - СПб.: СПбГЛТА, 2007. - 54 с.
- Ruther, R. Synthesis of Tetraphenylstibonium Alkyl- and Aryl-Sulphonates. Crystal Structure of Tetraphenylstibonium Benzenesulphonate Hydrate / R. Ruther, F. Huber, H. Preut // J. Organomet. Chem. - 1985. - V. 295, № 1. - P. 21-28. DOI: 10.1016/0022-328X(85)88068-2
- Синтез и кристаллическая структура гидрата бензолсульфоната и 3,4-диметилбензол-сульфоната тетрафенилвисмута / В.В. Шарутин, И.В. Егорова, Т.К. Иваненко и др. // Коорд. химия. - 2003. - Т. 29, № 7. - С. 502-507. DOI: 10.1023/A:1024722812183.
- Covalent Radii Revisited / B. Cordero, V. Gómez, A.E. Platero-Prats et al. // Dalton Trans. -2008. - Iss. 21. - P. 2832-2838. DOI: 10.1039/B801115J.

![Синтез и строение органосульфонатов органилтрифенилфосфония [Ph3PR][OSO2R’], R = Ph, R’ = C6H3Cl2-2,5; R = C6H11-cyclo, R’ = C6H3Cl2-2,5; R = CH2OMe, R’ = C6H3(NO2)2-2,4; R = CH2OMe, R’ = C6H4(COOH-2) Синтез и строение органосульфонатов органилтрифенилфосфония [Ph3PR][OSO2R’], R = Ph, R’ = C6H3Cl2-2,5; R = C6H11-cyclo, R’ = C6H3Cl2-2,5; R = CH2OMe, R’ = C6H3(NO2)2-2,4; R = CH2OMe, R’ = C6H4(COOH-2)](/file/cover/147237512/sintez-i-stroenie-organosulfonatov-organiltrifenilfosfonija-ph3pr-oso2r-r.png)
