Синтез и строение органосульфонатов тетраорганилфосфония [R4P][OSO2R’], R= Me, R’ = C6H3Cl2-2,5; R= Bu, R’ = C10H5(OH-1)(NO2)2-2,4; [Ph3PR][OSO2R’], R= CH2CH=CHCH2PPh3, R’ = C9H4N(OH-8)(I-7); R= C6H11-cyclo, R’ = C6H3(NO2)2-2,4; R=CH2CHCHMe,R’ = C6H3Cl2-2,5
Автор: Механошина Евгения Сергеевна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 1 т.15, 2023 года.
Бесплатный доступ
Взаимодействием эквимолярных количеств галогенидов тетраорганилфосфония с 2,5-дихлорбензолсульфоновой, 2,4-динитробензолсульфоновой, 1-окси-2,4-динитро- 7-нафталинсульфоновой и 8-окси-7-йод-5-хинолинсульфоновой кислотами в воде синтезированы ионные органосульфонаты тетраорганилфосфония [R4P][OSO2R’], R = Me, R’ = C6H3Cl2-2,5 (1); R = Bu, R’ = C10H5(OH-1)(NO2)2-2,4 (2); [Ph3PR][OSO2R’], R = CH2CH=CHCH2PPh3, R’ = C9H4N(OH-8)(I-7) (3); R = C6H11- cyclo , R’ = C6H3(NO2)2-2,4 (4); R = CH2CH=CHMe, R’ = C6H3Cl2-2,5 (5). Рентгеноструктурный анализ кристаллов 1-4 проведен при 293 К на автоматическом четырехкружном дифрактометре D8 Quest Bruker (двухкоординатный CCD-детектор, Мо К α-излучение, λ = 0,71073 Å, графитовый монохроматор). Кристалл 1 [C16H22O8PS2Cl4, M 579,23; сингония моноклинная, группа симметрии С 2/ с ; параметры ячейки: a = 35,69(4), b = 7,454(9), c = 23,67(2) Å; a = 90,00, β = 129,16(3), g = 90,00 град., V = 4883(9) Å3, Z = 8; rвыч = 1,576 г/см3], 2 [C42H77N2O8P2S, M 832,06; сингония ромбическая, группа симметрии Pbca ; параметры ячейки: a = 14,712(9), b = 22,825(16), c = 29,475(16) Å; a = 90,00, β = 90,00, g = 90,00 град., V = 9898(11) Å3, Z = 8; rвыч = 1,117 г/см3], 3 [C29H27O6PSIN, M 675,45; сингония триклинная, группа симметрии P- 1; параметры ячейки: a = 9,506(8), b = 11,323(12), c = 13,662(10) Å; a = 82,21(4), β = 89,26(2), g = 72,60(4) град., V = 1390(2) Å3, Z = 2; rвыч = 1,614 г/см3], 4 [C30H29N2O7PS, M 592,58; сингония триклинная, группа симметрии P- 1; параметры ячейки: a = 9,793(5), b = 11,214(5), c = 14,341(7) Å; a = 109,495(17), β = 99,55(3), g = 94,58(2) град., V = 1448,5(12) Å3, Z = 2; rвыч = 1,359 г/см3]. В катионах 1-4 атомы фосфора имеют искаженную тетраэдрическую координацию, органосульфонатные анионы имеют обычную геометрию с тетраэдрическим атомом серы. Длины связей Р-С принимают значения 1,746(7)-1,841(19) Å, что меньше суммы ковалентных радиусов атомов-партнеров (1,83 Å); расстояния S-C: 1,759(5)-1,815(3) Å. Валентные углы СРС изменяются в интервалах 85,2(8)°-114,0(5)°. Структурная организация в кристаллах 1-4 в основном обусловлена слабыми межмолекулярными контактами типа O···Н 1,60-2,72 Å (сумма ван-дер-ваальсовых атомов-партнеров 2,62 Å). Полные таблицы координат атомов, длин связей и валентных углов для структур депонированы в Кембриджском банке структурных данных (№ 2153156 (1), № 2157531 (2), № 2160476 (3), № 2157713 (4), deposit@ccdc.cam.ac.uk; http://www.ccdc. cam.ac.uk).
2, 5-дихлорбензолсульфоновая, 2, 4-динитробензолсульфоновая, 1-окси-2, 4-динитро-7-нафталинсульфоновая, 8-окси-7-йод-5-хинолинсульфоновая, кислота, органосульфонат тетраорганилфосфония, синтез, строение, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147239554
IDR: 147239554 | УДК: 546.87+547.29+548.312.5 | DOI: 10.14529/chem230103
Текст научной статьи Синтез и строение органосульфонатов тетраорганилфосфония [R4P][OSO2R’], R= Me, R’ = C6H3Cl2-2,5; R= Bu, R’ = C10H5(OH-1)(NO2)2-2,4; [Ph3PR][OSO2R’], R= CH2CH=CHCH2PPh3, R’ = C9H4N(OH-8)(I-7); R= C6H11-cyclo, R’ = C6H3(NO2)2-2,4; R=CH2CHCHMe,R’ = C6H3Cl2-2,5
Взаимодействием эквимолярных количеств галогенидов тетраорганилфосфония с 2,5-дихлорбензолсульфоновой, 2,4-динитробензолсульфоновой, 1-окси-2,4-динитро-7-нафталинсульфоновой и 8-окси-7-йод-5-хинолинсульфоновой кислотами в воде синтезированы ионные органосульфонаты тетраорганилфосфония [R4P][OSO2R’], R = Me, R’ = C6H3Cl2-2,5 (1); R = Bu, R’ = C10H5(OH-1)(NO2)2-2,4 (2); [Ph3PR][OSO2R’], R = CH2CH=CHCH2PPh3, R’ = C9H4N(OH-8)(I-7) (3); R = C6H11-cyclo, R’ = C6H3(NO2)2-2,4 (4); R = CH2CH=CHMe, R’ = C6H3Cl2-2,5 (5). Рентгеноструктурный анализ кристаллов 1–4 проведен при 293 К на автоматическом четырехкружном дифрактометре D8 Quest Bruker (двухкоординатный CCD-детектор, Мо Кα-излучение, λ = 0,71073 Å, графитовый монохроматор). Кристалл 1 [C16H22O8PS2Cl4, M 579,23; сингония моноклинная, группа симметрии С2/с; параметры ячейки: a = 35,69(4), b = 7,454(9), c = 23,67(2) Å; α = 90,00, β = 129,16(3), γ = 90,00 град., V = 4883(9) Å3, Z = 8; ρвыч = 1,576 г/см3], 2 [C42H77N2O8P2S, M 832,06; сингония ромбическая, группа симметрии Pbca; параметры ячейки: a = 14,712(9), b = 22,825(16), c = 29,475(16) Å; α = 90,00, β = 90,00, γ = 90,00 град., V = 9898(11) Å3, Z = 8; ρвыч = 1,117 г/см3], 3 [C29H27O6PSIN, M 675,45; сингония триклинная, группа симметрии P–1; параметры ячейки: a = 9,506(8), b = 11,323(12), c = 13,662(10) Å; α = 82,21(4), β = 89,26(2), γ = 72,60(4) град., V = 1390(2) Å3, Z = 2; ρвыч = 1,614 г/см3], 4 [C30H29N2O7PS, M 592,58; сингония триклинная, группа симметрии P–1; параметры ячейки: a = 9,793(5), b = 11,214(5), c = 14,341(7) Å; α = 109,495(17), β = 99,55(3), γ = 94,58(2) град., V = 1448,5(12) Å3, Z = 2; ρвыч = 1,359 г/см3]. В катионах 1‒4 атомы фосфора имеют искаженную тетраэдрическую координацию, органосульфонатные анионы имеют обычную геометрию с тетраэдрическим атомом серы. Длины связей Р-С принимают значения 1,746(7)-1,841(19) Å, что меньше суммы ковалентных радиусов атомов-партнеров (1,83 Å); расстояния S-C: 1,759(5)-1,815(3) Å. Валентные углы СРС изменяются в интервалах 85,2(8)°-114,0(5)°. Структурная организация в кристаллах 1‒4 в основном обусловлена слабыми межмолекулярными контактами типа O···Н 1,60–2,72 Å (сумма ван-дер-ваальсовых атомов-партнеров 2,62 Å). Полные таблицы координат атомов, длин связей и валентных углов для структур депонированы в Кембриджском банке структурных данных (№ 2153156 (1), № 2157531 (2), № 2160476 (3), № 2157713 (4), ; .
Органические соединения фосфора обладают уникальными свойствами и находят применение в самых разнообразных областях практической деятельности: в качестве инсектицидов, фунгицидов, дефолиантов, гербицидов, пластификаторов, ионитов, антипиренов, присадок к бензинам и смазочным маслам [1]. Фосфорорганические соединения также используются в синтетической органической химии, например, при получении олефинов по Виттигу [2] или синтезе элементоорганических соединений [3]. Сообщалось также о перспективах практического применения некоторых органических соединений фосфора в качестве катализаторов гидрофункционализации непредельных субстратов [4], реагентов для транс -металлирования [5] и метатезиса
σ-связей [6]. Кроме того, соли фосфония используются в современных методах разделения редкоземельных элементов [7]. Фосфонио-содержащие ионные жидкости (PILs) на основе тетраарилфосфониевых катионов обладают низкой вязкостью и высокой термической, химической и электрохимической стабильностью, что дает им преимущество над аналогичными солями на основе имидазолиевых, четвертичных аммониевых или тетраалкилфосфониевых катионов [8]. Четвертичные фосфониевые соли также обладают высокой биологической активностью и находят широкое применение в качестве противоопухолевых и антимикробных соединений [9]. Бромсодержащие комплексы платины с органилтрифенилфосфониевыми катионами являются весьма интересными объектами для изучения различных каталитических превращений [10]. Цианидные галогенсодержащие комплексы золота с органилтрифенилфосфониевыми катионами могут проявлять различные практически полезные свойства [11]. Разработка методов получения новых фосфониевых солей, содержащих различные функциональные группы, а также их производных является на сегодняшний день одним из перспективных направлений в органической химии. Из всех производных пятивалентного фосфора наиболее изучены соли тетраорганилфосфония, которые обычно получают по реакции окислительного присоединения из трифенилфосфина и галогенарена в присутствии хлористого алюминия [1] либо по реакции пентафенилфосфора с кислотами [12 - 15]. В работах [16 - 22] описан синтез некоторых структурно охарактеризованных органосульфонатов тетрафенилфосфония. Кристаллы комплексов получали при выдерживании смеси галогенидов тетрафенилфосфония и аренсульфоновой кислоты в различных растворителях (метаноле, ацетонитриле, ацетоне, бензоле, диэтиловом эфире, ДМФА, ТГФ). Большинство реакций проводили при нагревании, выходы комплексов при этом не превышали 78 %. Однако в литературе не известны примеры получения аренсульфонатов тетраорганилфосфония.
Ранее сообщалось о взаимодействии галогенидов органилтрифенилфосфония с аренсульфоновыми кислотами в воде, при котором происходит замещение галогенид-аниона на аренсульфонатный анион. Данным способом были получены органосульфонаты органилтрифенилфосфония [Ph 3 PR][OSO 2 R’], R = Ph, R’ = C 6 H 3 Cl 2 -2,5; R = C 6 H 11 - cyclo , R’ = C 6 H 3 Cl 2 -2,5; R = CH 2 OMe, R’ = C6H3(NO2)2-2,4; R = CH2OMe, R’ = C6H 4 (COOH-2) [23].
Продолжая исследования в данном направлении, были синтезированы и структурно охарактеризованы аренсульфонаты тетраорганилфосфония [R 4 P][OSO2R’], R = Me, R’ = C6H3Cl2-2,5 ( 1 ); R = Bu, R’ = C10H5(oH-1)(NO2)2-2,4 ( 2 ); и [Ph3PR][OSO2R’], R = CH2CH=CHCH2PPh3, R’ = C 9 H 4 N(OH-8)(I-7) ( 3 ); R = C6Hn- cyclo , R’ = C6H3(NO2)2-2,4 ( 4 ); R = CH2CH=CHMe, R’ = C6H3Cl2-2,5 ( 5 ).
Экспериментальная часть
-
2,5- Дихлорбензолсульфонат тетраметилфосфония (1). Раствор галогенида (хлорида) тетраметилфосфония (0,063 г, 0,500 ммоль) в 8 мл воды смешивали с 8 мл водного раствора 2,5-дихлорбензолсульфоновой кислоты (0,132 г, 0,500 ммоль). При медленном испарении растворителя выделялись бесцветные кристаллы, которые сушили на воздухе. Выход 0,169 г (96 %), Т пл = 105 ° С. ИК-спектр ( v , см - 1): 3090, 2970, 1734, 1717, 1558, 1506, 1452, 1375, 1317, 1290, 1236, 1198, 1149, 1098, 1065, 989, 885, 806, 773, 752, 708, 685, 615, 534, 519,511, 436. Найдено, %: 32,97; Н 3,91. C 16 H 22 O 8 PS 2 Cl 4 . Вычислено, %: С 33,18; Н 3,83.
Соединения 2 - 5 синтезировали аналогично.
1-Окси-2,4-динитро-7-нафталинсульфонат тетрабутилфосфония (2). Светло-коричневые кристаллы. Выход 0,269 г (94 %), Т пл = 107 ° С. ИК-спектр ( v , см - 1): 3208, 3019, 2931, 2912, 1826, 1568, 1520, 1506, 1448, 1398, 1325, 1298, 1223, 1128, 1098, 1032, 1009, 968, 922, 893, 806, 794, 746, 711, 692, 658, 621, 596, 522, 478,419. Найдено, %: С 60,52; Н 9,41. C 42 H 77 N 2 O 8 P 2 S. Вычислено, %: С 60,63; Н 9,33.
Бис (8-окси-7-йод-5-хинолинсульфонат) 2-бутен-1,4- бис (трифенилфосфония) (3). Оранжевые кристаллы. Выход 0,297 г (93 %), Тпл = 147 ° С. ИК-спектр ( v , см - 1): 3205, 3061, 2985, 2930, 1830, 1658, 1607, 1585, 1558, 1489, 1437, 1398, 1373, 1314, 1220, 1194, 1142, 1113, 1038, 1009, 997, 950, 906, 841, 816, 793, 745, 714, 688, 658, 600, 544, 492, 419. Найдено, %: С 51,23; Н 4,15. C 29 H 27 O 6 PSIN. Вычислено, %: С 51,57; Н 4,03.
-
2,4- Динитробензолсульфонат трифенил(циклогексил)фосфония (4). Жёлто-коричневые кристаллы. Выход 0,298 г (95 %), Т пл = 168 ° С. ИК-спектр ( v , см - 1): 3069, 3022, 2936, 2897, 2860,
1825, 1749, 1599, 1541, 1526, 1485, 1452, 1437, 1350, 1250, 1228, 1167, 1109, 1063, 1026, 995, 918, 889, 849, 833, 746, 719, 696, 664, 636, 544, 519, 469, 419. Найдено, %: 60,59; Н 4,80. C 30 H 29 N 2 O 7 PS. Вычислено, %: С 60,80; Н 4,93.
-
2,5- Дихлорбензолсульфонат (2-бутенил)трифенилфосфония (5). Бесцветные кристаллы. Выход 0,278 г (96 %), Т = 167 ° С. ИК-спектр ( v , см - 1): 3084, 3061, 2984, 1830, 1773, 1636, 1609, 1585, 1558, 1506, 1489, 1441, 1373, 1340, 1311, 1233, 1217, 1165, 1144, 1113, 1063, 1015, 999, 897, 837, 814, 762, 723, 692, 614, 590, 538, 515, 444. Найдено, %: С 61,79; Н 4,69. C 28 H 25 O 3 PSCl 2 . Вычислено, %: С 61,88; Н 4,64.
Элементный анализ выполнен на элементном анализаторе Carlo Erba CHNS-O EA 1108. Температуры плавления измерены на синхронном термоанализаторе Netzsch 449C Jupiter.
ИК-спектр соединений 1-5 записывали на ИК-Фурье спектрометре Shimadzu IR Affinity- 1S в таблетке KBr в области 4000 - 400 см - 1.
Рентгеноструктурный анализ ( РСА ) проводили на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Bruker (Mo K „ -излучение, X = 0,71073 А, графитовый монохроматор) при 293 K. Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены с помощью программ SMART и SAINT-Plus . Все расчеты по определению и уточнению структур выполнены с помощью программ SHELXL/PC и OLEX2 [24‒26]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Положение атомов водорода уточняли по модели наездника ( U изо (H) = 1,2 U экв (C)). Кристаллографические данные и результаты уточнения структур приведены в табл. 1, длины связей и валентные углы – в табл. 2.
Таблица 1
Кристаллографические данные, параметры эксперимента и уточнения структур 1 ‒ 4
|
Параметр |
(1) |
(2) |
(3) |
(4) |
|
Формула |
C 16 H 22 O 8 PS 2 Cl 4 |
C 42 H 77 N 2 O 8 P 2 S |
C 29 H 27 O 6 PSIN |
C 30 H 29 N 2 O 7 PS |
|
М |
579,23 |
832,06 |
675,45 |
592,58 |
|
Сингония |
Моноклинная |
Ромбическая |
Триклинная |
Триклинная |
|
Пр. группа |
С 2/ с |
Pbca |
P-1 |
P-1 |
|
a , Å |
35,69(4) |
14,712(9) |
9,506(8) |
9,793(5) |
|
b, Å |
7,454(9) |
22,825(16) |
11,323(12) |
11,214(5) |
|
c, Å |
23,67(2) |
29,475(16) |
13,662(10) |
14,341(7) |
|
α, град. |
90,00 |
90,00 |
82,21(4) |
109,495(17) |
|
β, град. |
129,16(3) |
90,00 |
89,26(2) |
99,55(3) |
|
γ, град. |
90,00 |
90,00 |
72,60(4) |
94,58(2) |
|
V , Å3 |
4883(9) |
9898(11) |
1390(2) |
1448,5(12) |
|
Z |
8 |
8 |
2 |
2 |
|
р (выч.), г/см3 |
1,576 |
1,117 |
1,614 |
1,359 |
|
ц , мм-1 |
0,761 |
0,176 |
1,329 |
0,217 |
|
F (000) |
2376,0 |
3624,0 |
680,0 |
620,0 |
|
Размер кристалла, мм |
0,28×0,12×0,1 |
0,45×0,24×0,09 |
0,3×0,1×0,09 |
0,45×0,25×0,16 |
|
Область сбора данных по 9 , град. |
6,42–57,24 |
5,82‒56,6 |
6,7–56,64 |
5,74–74,24 |
|
Интервалы индексов отражений |
–48 ≤ h ≤ 48, –10 ≤ k ≤ 10, –31 ≤ l ≤ 31 |
–19 ≤ h ≤ 16, –30 ≤ k ≤ 30, –39 ≤ l ≤ 39 |
–12 ≤ h ≤ 12, –14 ≤ k ≤ 15, –17 ≤ l ≤ 18 |
–16 ≤ h ≤ 16, –19 ≤ k ≤ 19, –24 ≤ l ≤ 24 |
|
Измерено отражений |
75563 |
150723 |
36412 |
99393 |
|
Независимых отражений |
6236 |
12219 |
6858 |
14804 |
|
R int |
0,2499 |
0,2773 |
0,0692 |
0,0504 |
|
Переменных уточнения |
290 |
545 |
362 |
370 |
|
GOOF |
1,068 |
0,997 |
1,015 |
1,331 |
|
R -факторы по F 2 > 2 с ( F 2) |
R 1 = 0,0942, wR 2 = 0,1770 |
R 1 = 0,0986, wR 2 = 0,2196 |
R 1 = 0,0421, wR 2 = 0,0843 |
R 1 = 0,1120, wR 2 = 0,3416 |
Окончание табл. 1
Длины связей и валентные углы в структурах 1 ‒ 4
|
Параметр |
(1) |
(2) |
(3) |
(4) |
|
R -факторы по всем отражениям |
R 1 = 0,1858, wR 2 = 0,2117 |
R 1 = 0,2954, wR 2 = 0,3110 |
R 1 = 0,0789, wR 2 = 0,0963 |
R 1 = 0,1693, wR 2 = 0,3790 |
|
Остаточная электронная плотность (min/max), e/A3 |
0,43/–0,64 |
0,41/–0,21 |
1,54/–0,69 |
4,59/–1,54 |
Таблица 2
|
Связь d , Å |
Угол ю, ° |
||
|
1 |
|||
|
S(1)–O(1) |
1,425(4) |
O(1)S(1)O(2) |
113,0(3) |
|
S(1)–O(2) |
1,435(4) |
O(1)S(1)O(3) |
112,1(3) |
|
S(1)–O(3) |
1,428(4) |
O(2)S(1)O(3) |
113,1(3) |
|
S(1)– C(1) |
1,766(5) |
O(1)S(1)C(1) |
106,4(3) |
|
S(2)–O(4) |
1,447(5) |
O(4)S(2)O(5) |
111,3(3) |
|
S(2)–O(5) |
1,417(4) |
O(4)S(2)O(6) |
113,4(3) |
|
S(2)–O(6) |
1,414(5) |
O(5)S(2)O(6) |
113,5(3) |
|
S(2)–C(11) |
1,759(5) |
O(4)S(2)C(11) |
103,0(3) |
|
P(1)–C(7) |
1,765(6) |
C(7)P(1)C(8) |
111,4(3) |
|
P(1)–C(8) |
1,758(6) |
C(8)P(1)C(9) |
108,6(3) |
|
P(1)–C(9) |
1,751(6) |
C(9)P(1)C(10) |
110,4(3) |
|
P(1)–C(10) |
1,763(6) |
C(7)P(1)C(10) |
110,5(3) |
|
Cl(1)‒C(2) |
1,723(6) |
Cl(1)C(2)C(1) |
122,1(4) |
|
2 |
|||
|
S(1)–O(1) |
1,428(4) |
O(1)S(1)O(2) |
112,2(3) |
|
S(1)–O(2) |
1,442(4) |
O(1)S(1)O(3) |
114,9(3) |
|
S(1)–O(3) |
1,436(4) |
O(2)S(1)O(3) |
112,3(3) |
|
S(1)– C(48) |
1,788(5) |
O(1)S(1)C(48) |
105,7(3) |
|
P(1)–C(1A) |
1,839(11) |
C(1A)P(1)C(5) |
114,0(5) |
|
P(1)–C(1B) |
1,748(12) |
C(1B)P(1)C(5) |
113,3(6) |
|
P(1)–C(5) |
1,747(7) |
C(5)P(1)C(13) |
110,2(3) |
|
P(1)–C(9A) |
1,814(12) |
C(9A)P(1)C(13) |
110,7(6) |
|
P(1)–C(9B) |
1,841(19) |
C(9B)P(1)C(13) |
85,2(8) |
|
P(1)–C(13) |
1,746(7) |
C(17)P(2)C(21) |
113,2(3) |
|
P(2)–C(17) |
1,813(6) |
C(21)P(2)C(25) |
112,3(3) |
|
P(2)–C(21) |
1,763(5) |
C(25)P(2)C(29) |
112,4(3) |
|
N(1)–O(5) |
1,193(5) |
O(5)N(1)O(6) |
120,0(5) |
|
N(1)–O(6) |
1,217(5) |
O(7)N(2)O(8) |
122,2(5) |
|
O(4)–C(41) |
1,241(5) |
O(5)N(1)C(42) |
121,0(5) |
|
3 |
|||
|
S(1)–O(1) |
1,447(3) |
O(1)S(1)O(2) |
111,79(19) |
|
S(1)–O(2) |
1,443(3) |
O(1)S(1)O(3) |
113,20(18) |
|
S(1)–O(3) |
1,457(3) |
O(2)S(1)O(3) |
113,07(18) |
|
S(1)– C(31) |
1,779(3) |
O(1)S(1)C(31) |
105,90(16) |
|
P(1)–C(1) |
1,786(4) |
C(1)P(1)C(7) |
110,04(16) |
|
P(1)–C(7) |
1,815(4) |
C(7)P(1)C(11) |
104,33(15) |
|
P(1)–C(11) |
1,801(3) |
C(11)P(1)C(21) |
109,60(15) |
|
P(1)–C(21) |
1,791(3) |
C(1)P(1)C(21) |
109,25(16) |
|
N(1)–C(35) |
1,360(5) |
C(35)N(1)C(39) |
117,4(3) |
|
I(1)–C(33) |
2,097(4) |
I(1)C(33)C(32) |
119,0(3) |
|
O(4)–C(34) |
1,353(4) |
O(4)C(34)C(33) |
120,4(3) |
|
C(8)‒C(8)1 |
1,323(6) |
C(7)C(8)C(8)1 |
122,6(4) |
Окончание табл. 2
|
Связь d , Å |
Угол ю, ° |
||
|
4 |
|||
|
S(1)–O(1) |
1,418(3) |
O(1)S(1)O(2) |
108,21(19) |
|
S(1)–O(2) |
1,472(3) |
O(1)S(1)O(3) |
119,27(19) |
|
S(1)–O(3) |
1,384(3) |
O(2)S(1)O(3) |
112,0(2) |
|
S(1)– C(41) |
1,815(3) |
O(1)S(1)C(41) |
104,81(14) |
|
P(1)–C(1) |
1,781(2) |
C(1)P(1)C(11) |
109,89(10) |
|
P(1)–C(11) |
1,798(2) |
C(11)P(1)C(21) |
108,62(11) |
|
P(1)–C(21) |
1,803(2) |
C(21)P(1)C(31) |
109,51(10) |
|
P(1)–C(31) |
1,829(2) |
C(1)P(1)C(31) |
111,44(10) |
|
N(1)–O(4) |
1,219(5) |
O(4)N(1)O(5) |
125,2(3) |
|
N(1)–O(5) |
1,184(5) |
O(6)N(2)O(7) |
124,2(4) |
|
N(2)–O(6) |
1,242(5) |
O(4)N(1)C(42) |
118,0(3) |
Преобразования симметрии: 12‒x, 1‒y, 1‒z.
Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 2153156 (1), № 2157531 (2), № 2160476 (3), № 2157713 (4), ; .
Обсуждение результатов
Комплексы 1 - 5 получены при смешивании водных растворов галогенидов тетраорганилфос-фония и соответствующей аренсульфоновой кислоты. При медленном испарении воды имело место образование устойчивых на воздухе прозрачных кристаллов, хорошо растворимых в аренах, хлороформе, тетрагидрофуране, этаноле, ацетонитриле, четыреххлористом углероде и плохо - в воде при комнатной температуре.
[R 4 P]Hal + HOSO 2 R’ ⎯⎯⎯⎯ [R 4 P][OSO 2 R’] R = Me; R’= C 6 H 3 C a l 2 -2,5 ( 1 );
ОН
R = Bu; R’ = ( 2 )
no2
[Ph PR]Hal + HOSO R’ ⎯⎯⎯⎯ [Ph PR][OSO R’] -HHal
R = CH 2 CH=CHCH 2 PPh 3 , R’ = ( 3 );
он
R = C 6 H 11 - cyclo , R’ = C 6 H 3 (NO 2 ) 2 -2,4 ( 4 );
R = CH 2 CH=CHMe, R’ = C 6 H 3 Cl 2 -2,5 ( 5 )
ИК-спектры соединений 1-5 содержат характерные полосы валентных колебаний углеродного скелета ароматических фрагментов в области 1599‒1485 см–1. Валентным колебаниям связей CAr–H соответствуют полосы поглощения средней интенсивности при 3090‒3019 см–1; плоскостным деформационным колебаниям этих же связей – полосы при 1149‒1098 см–1, внеплоскостным деформационным колебаниям – при 897‒806 см–1. Также присутствуют характерные полосы поглощения сильной интенсивности при 1250-1217 см-1 и средней интенсивности при 1065-1026 см-1, которые отвечают асимметричным и симметричным валентным колебаниям сульфонатной группы SO3. Полосы поглощения сильной интенсивности валентных колебаний связи S‒O распо- ложены при 696‒685 см–1. Интенсивные полосы поглощения в области 544‒511 см‒1 и 752‒708 см–1 соответствуют валентным колебаниям связей CAr–S и CAr–P соответственно [27]. Валентным колебаниям связей CAr–Cl в спектрах структур 1, 5 отвечают полосы сильной интенсивности при 773 и 762 см–1. Интенсивная полоса при 600 см‒1 в спектре соединения 3 относится к валентным колебаниям связи CAr–I. Деформационным колебаниям метильных групп P‒CH3 в спектре комплекса 1 соответствуют полосы поглощения при 1375‒1317 см–1. Спектры соединений 3, 5 содержат полосы валентных колебаний связей C=C алкеновых фрагментов в области 1658‒1607 см–1. В структурах комплексов 2, 3 присутствуют гидроксильные группы, валентным колебаниям которых отвечают широкие полосы при 3208 и 3205 см–1. В спектрах соединений 2, 4 асимметричным колебаниям NO2-группы соответствуют интенсивные полосы поглощения при 1520 и 1526 см–1, симметричным колебаниям – 1325 и 1350 см–1 [28].
По данным РСА, кристаллы комплексов 1 ‒ 4 образованы катионами тетраорганилфосфония и аренсульфонат-анионами (рис. 1 - 4).
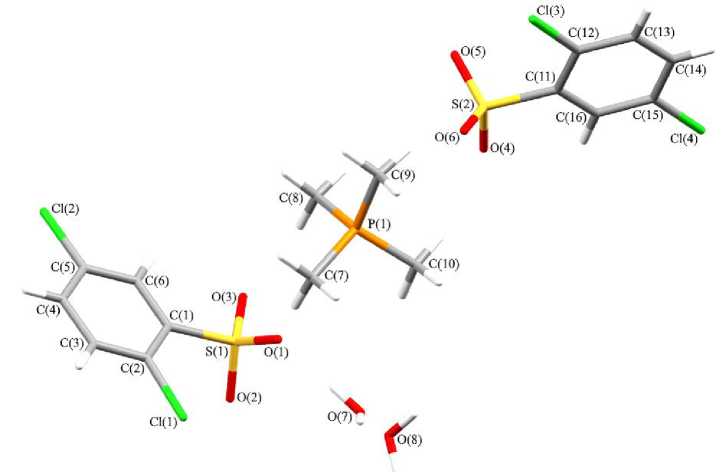
Рис. 1. Общий вид 2,5-дихлорбензолсульфоната тетраметилфосфония
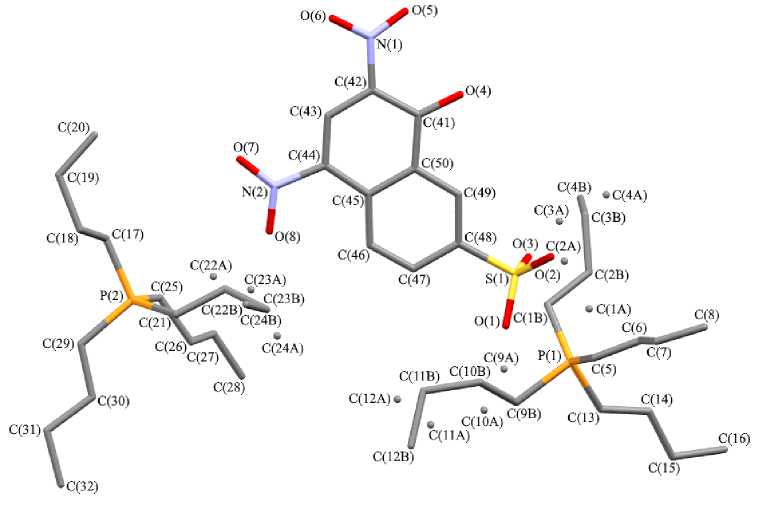
Рис. 2. Общий вид 1-окси-2,4-динитро-7-нафталинсульфоната тетрабутилфосфония (атомы водорода не показаны; для разупорядоченных атомов показаны два положения: C(A) и С(B))
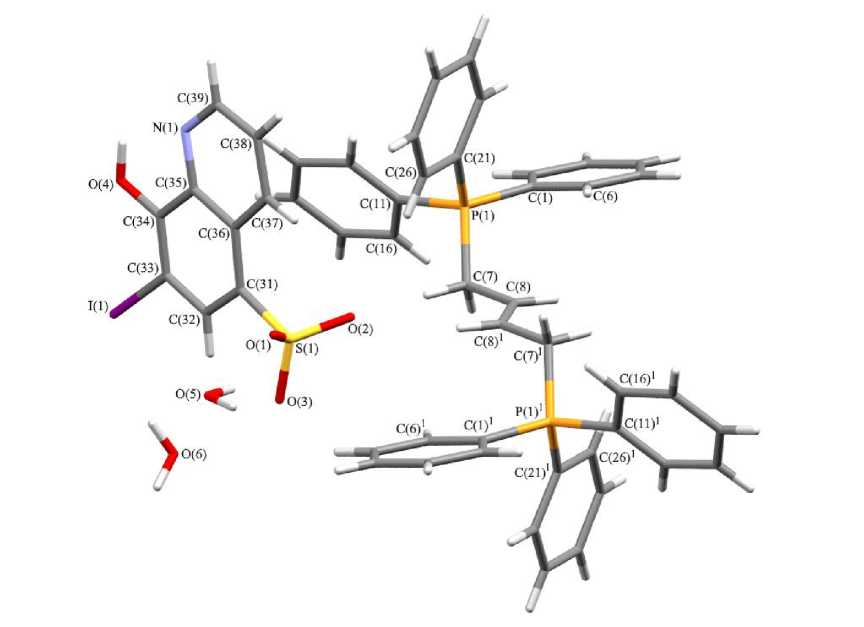
Рис. 3. Общий вид бис (8-окси-7-йод-5-хинолинсульфоната) 2-бутен-1,4- бис (трифенилфосфония)
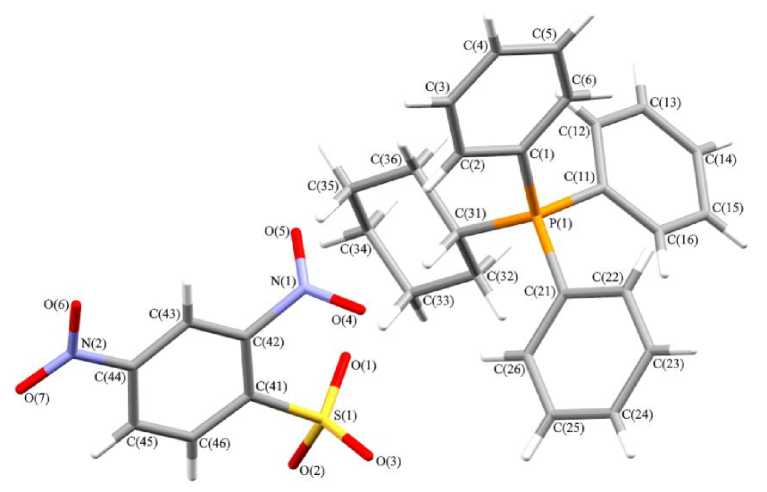
Рис. 4. Общий вид 2,4-динитробензолсульфоната трифенил(циклогексил)фосфония
Соединения 1 и 3 кристаллизуются в виде гидратов состава [Me 4 P][OSO 2 C 6 H 3 Cl 2 -2,5] ∙ 2H 2 O и [Ph 3 PCH 2 CH=CHCH 2 PPh 3 ][OSO 2 C 9 H 4 N(OH-8)(I-7)] 2 ∙ 4H 2 O. В кристалле комплекса 1 присутствуют два типа кристаллографически независимых анионов; в кристалле соединения 2 ‒ два типа кристаллографически независимых катионов.
В соединении 2 некоторые атомы бутильных групп [C(1)‒C(4), C(9)‒C(12), C(22)‒C(24)] разупорядочены по двум положениям (см. рис. 2). Катион органил- бис (трифенилфосфония) комплекса 3 содержит зеркально-поворотную ось второго порядка, которая проходит через центр двойной связи C(8)=C(8)1 (точечная группа C 2h ).
Катионы тетраорганилфосфония в структурах 1 ‒ 4 имеют незначительно искаженную тетраэдрическую конфигурацию. Длины связей Р-С принимают значения 1,746(7)-1,841(19) Å [1,751(6)-1,765(6) Å ( 1 ); 1,746(7)–1,841(19) Å ( 2 ); 1,786(4)–1,815(4) Å ( 3 ); 1,781(2)–1,829(2) Å ( 4 )], что меньше суммы ковалентных радиусов атомов-партнеров (1,83 Å) [29]. Валентные углы СРС изменяются в интервалах 85,2(8)°-114,0(5)°: 108,6(3)°-111,4(3)°; 85,2(8)°-114,0(5)°; 104,33(15)°-111,97(15)°; 108,62(11)°-111,44(10)° в 1 , 2 , 3 , 4 соответственно.
В аренсульфонатных анионах комплексов 1 - 4 расстояния S-C близки между собой и принимают значения 1,759(5)-1,815(3) Å. Связи S–О практически выровнены, что свидетельствует о равномерном распределении электронной плотности в SO3-группах. Расстояния S‒O изменяются в пределах 1,384(3)‒1,472(3) Å: 1,414(5)‒1,447(5) Å ( 1 ), 1,428(4)‒1,442(4) Å ( 2 ), 1,443(3)‒1,457(3) Å ( 3 ), 1,384(3)‒1,472(3) Å ( 4 ).
Валентные углы OSC в сульфонатных группах (103,0(3)°-106,4(3)°) меньше, чем углы OSO (108,21(19)°-119,27(19)°), что полностью согласуется с теорией отталкивания электронных пар валентных оболочек (ОПВЭО) [30].
В сульфонат-анионе структуры 4 плоскость пара -нитрогруппы незначительно отклоняется от средней плоскости ароматического кольца (соответствующий двугранный угол равен 7,49°), нитрогруппа в орто -положении развернута относительно плоскости кольца на угол 67,83°. Расстояния N-O (1,184(5), 1,219(5) А) в орто- группе более короткие, чем в пара -нитрогруппе (1,231(5), 1,242(5) Å), что связано с возможным сопряжением при малом отклонении нитрогруппы от плоскости аренового цикла. В аренсульфонатном анионе комплекса 2 плоскость (NO 2 -4)-группы практически совпадает с плоскостью нафталинового цикла (2,50°).
В структуре 1 две молекулы кристаллизационной воды, два типа кристаллографически независимых аренсульфонат-анионов и катион тетраорганилфосфония образуют циклы посредством водородных связей типа S=O∙∙∙Н(C) [2,31‒2,68 Å] и S=O∙∙∙Н(O) [1,69 Å, 1,77 Å] (рис. 5).
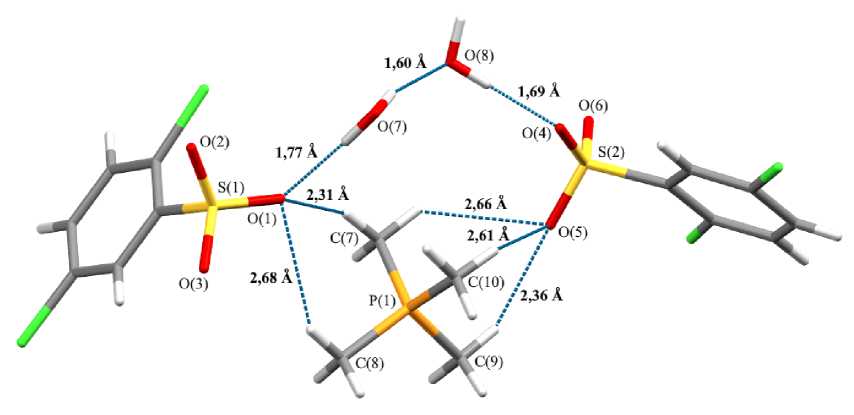
Рис. 5. Водородные связи в кристалле 1
Катионы и анионы в комплексах 1‒4 связаны слабыми водородными связями типа S=O∙∙∙Н(C) (2,30–2,72 Å). В структурах 2 , 4 представлены множественные водородные связи типа N=O∙∙∙H [2,14‒2,86 Å ( 2 ), 2,45‒2,68 Å ( 4 )]. В молекулах 2 , 3 имеют место водородные связи между атомом кислорода гидроксильной группы в анионах и атомами водорода в катионах (Ar)O∙∙∙H(С) [2,47‒2,52 Å ( 2 ), 2,57 Å ( 3 )]. В комплексе 1 также присутствуют короткие контакты типа С‒H∙∙∙Cl(Ph) и S=O∙∙∙Cl(Ph) [2,825 Å, 3,254 Å], в структуре 3 ‒ короткие контакты типа S=O∙∙∙I(Ar) (3,302 Å).
Структурная организация в кристаллах 1 ‒ 4 в основном обусловлена слабыми межмолекулярными контактами типа O···Н 1,60–2,68 Å ( 1 ), 2,45–2,72 Å ( 2 ), 2,31–2,70 Å ( 3 ), 2,35–2,72 Å ( 4 ) (сумма ван-дер-ваальсовых атомов-партнеров – 2,62 Å [31]). Данные взаимодействия структурируют молекулы кристалла 3 в слои, перпендикулярные кристаллографической оси c (рис. 6).
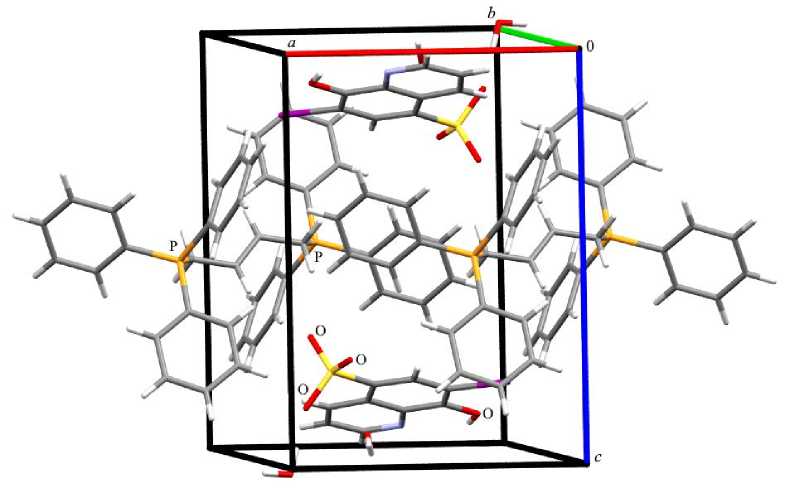
Рис. 6. Упаковка ионов комплекса 3 в кристалле (показан один слой)
Выводы
Установлено, что взаимодействие галогенидов тетраорганилфосфония с аренсульфоновыми кислотами в воде приводит к образованию ионных аренсульфонатов тетраорганилфосфония с тетраэдрическими катионами тетраорганилфосфония и аренсульфонатными анионами с тетраэдрическим атомом серы.
Выражаю признательность профессору В.В. Шарутину за рентгеноструктурный анализ кристаллов соединений 1‒4 и помощь при работе над статьей.
Список литературы Синтез и строение органосульфонатов тетраорганилфосфония [R4P][OSO2R’], R= Me, R’ = C6H3Cl2-2,5; R= Bu, R’ = C10H5(OH-1)(NO2)2-2,4; [Ph3PR][OSO2R’], R= CH2CH=CHCH2PPh3, R’ = C9H4N(OH-8)(I-7); R= C6H11-cyclo, R’ = C6H3(NO2)2-2,4; R=CH2CHCHMe,R’ = C6H3Cl2-2,5
- Пурдела Д., Вылчану Р. Химия органических соединений фосфора. М.: Химия, 1972. 752 с.
- Бартон Д., Оллис У.Д. Общая органическая химия. Том 5. Соединения фосфора и серы. М.: Химия, 1983. - 720 с.
- Alkyloxy- and silyloxy-derivatives of P(V) and Sb(V) / G.A. Razuvaev, N.A. Osanova, T.G. Brilkina et al. // J. Organomet. Chem. 1975. Vol. 99, no. 1. P. 93-106. DOI: 10.1016/S0022-328X(00)86365-2.
- Wang D., Astruc D. The golden age of transfer hydrogenation // Chem. Rev. 2015. Vol. 115. P. 6621-6686. DOI: 10.1021/acs.chemrev.5b00203.
- The stille reaction, 38 years later / C. Cordovilla, C. Bartolome, J.M. Martinez-Ilarduya et al. // ACS Catal. 2015. Vol. 5. P. 3040-3053. DOI: 10.1021/acscatal.5b00448.
- Chong C.C., Hirao H., Kinjo R. Metal-free c-bond metathesis in 1,3,2-diazaphospholene-catalyzed hydroboration of carbonyl compounds // Angew. Chem. Int. Ed. 2015. Vol. 127. P. 192-196. DOI: 10.1002/ange.201408760.
- Separation of rare earth elements by synergistic solvent extraction with phosphonium-based ionic liquids using a P-diketone extractant and a neutral ligand / M. Matsumiya, D. Nomizu, Y. Tsuchida et al. // Solvent Extraction and Ion Exchange. 2021. Vol. 39. P. 764-784. DOI: 10.1080/07366299.2021.1889761.
- Ionic liquids of superior thermal stability / C.G. Cassity, A. Mirjafari, N. Mobarrez et al. // Chem. Commun. 2013. Vol. 49, no. 69. P. 7590-7592. DOI: 10.1039/c3cc44118k.
- Synthesis, spectral and solid state characterization of a new bioactive hydrazine bridged cyclic diphosphonium compound / M. Milenkovic, B. Warzajtis, U. Rychlewska et al. // Molecules. 2012. Vol. 17, no. 3. P. 2567-2578. DOI: 10.3390/molecules17032567.
- Зыкова А.Р., Шарутин В.В., Шарутина О.К. Новые гексабромоплатинаты органилтрифе-нилфосфония [Ph3PR]2[PtBR6], R = CH3, CH=CH2, CH2CH=CH2 // Журн. общей химии. 2021. Т. 66, № 1. С. 63-68. DOI: 10.31857/S0044457X21010141.
- Синтез и строение дицианодигалогенауратов (4-фторбензил)трифенилфосфония [Ph3PCH2C6H4F-4][Au(CN)2Hlg2] / В.В. Шарутин, О.К. Шарутина, Н.М. Тарасова и др. // Журн. общей химии. 2021. Т. 91, № 11. С. 1716-1722. DOI: 10.31857/S0044460X21110081.
- Карбоксилаты и сульфонаты тетрафенилфосфора. Синтез и строение / В.В. Шарутин, В.С. Сенчурин, О.К. Шарутина и др. // Журн. общей химии. 2009. Т. 79. С. 80-89. DOI: 10.1134/S1070363209010125.
- Синтез и строение карбоксилатов тетрафенилфосфония / В.В. Шарутин, О.К. Шарутина, А.В. Рыбакова и др. // Журн. общей химии. 2018. Т. 88, № 8. С. 1308-1313. DOI: 10.1134/S0044460X18080139.
- Шарутин В.В., Мукушева Н., Уржумова А.В. Синтез и строение 2,4-динитробензолсульфоната тетрафенилфосфония // Вестник ЮУрГУ. Серия «Химия». 2018. Т. 10, № 2. С. 48-54. DOI: 10.14529/chem180206.
- Шарутин В.В., Шарутина О.К., Губанова Ю.О. Синтез и строение аренсульфонатов тетрафенилфосфония // Изв. вузов. Химия и хим. технология. 2019. Т. 62, № 2. С. 4-10. DOI: 10.6060/ivkkt.20196202.5823.
- New organic free radical anions TEMPO-A-CO-(o-; m-; ^-)C6H4SO3- (A = NH; NCH3; O) and their TTF and/or BEDT-TTF salts / H. Akutsu, K. Masaki, K. Mori et al. // Polyhedron. 2005. Vol. 24. P. 2126-2132. DOI: 10.1016/j.poly.2005.03.023.
- Tunable GUMBOS-based sensor array for label-free detection and discrimination of proteins / W.I.S. Galpothdeniya, F.R. Fronczek, M. Cong et al. // J. Mater. Chem. B. 2016. Vol. 4, no. 8. P. 1414-1422. DOI: 10.1039/C5TB02038G.
- A new anionic acceptor, 2-sulfo-3,5,6-trichloro-1,4-benzoquinone and its charge-transfer salts / H. Akutsu, J. Yamada, S. Nakatsuji et al. // CrystEngComm. 2009. Vol. 11, no. 12. P. 2588-2592. DOI: 10.1039/b909519e.
- Dinuclear calcium complex with weakly NH-0 hydrogen-bonded sulfonate ligands / A. Onoda, Y. Yamada, M. Doi et al. // Inorg. Chem. 2001. Vol. 40, no. 3. P. 516-521. DOI: 10.1021/ic0003067.
- Anion polarity-induced self-doping in a purely organic paramagnetic conductor, a-a'-(BEDT-TTF)2(PO-CONH-m-C6H4SO3-H2O where BEDT-TTF is te(ethylenedithio)tetrathiafulvalene and PO is the radical 2,2,5,5-tetramethyl-3-pyrrolin-1-oxyl / H. Akutsu, K. Ishihara, S. Ito et al. // Polyhedron. 2017. Vol. 136. P. 23-29. DOI: 10.1016/j.poly.2017.02.001.
- Correlation between metal-insulator transition and hydrogen-bonding network in the organic metal ¿-(BEDT-TTF)4[2,6-anthracene-67s(sulfonate)](H2O)4 / F. Camerel, G. Le Helloco, T. Guizouarn et al. // Cryst. Growth Des. 2013. Vol. 13, no. 11. P. 5135-5145. DOI: 10.1021/cg401416h.
- Ferrer E.G., Williams P.A.M., Castellano E.E. On a novel synthesis of 2-sulfonatobenzoic acid by oxidation of thiosalicylic acid catalyzed by copper(II): a structural study // Z. Anorg. Allg. Chem. 2002. Vol. 628. P. 1979-1984. DOI: 10.1002/1521-3749(200209)628:9/10<1979::AID-ZAAC1979-3.0.CO;2-V.
- Шарутин В.В., Шарутина О.К., Механошина Е.С. Синтез и строение органосульфонатов органилтрифенилфосфония [Ph3PR][OSO2R'], R = Ph, R' = C6H3Cb-2,5; R = CHu-cyclo, R' = C6H3Cl2-2,5; R = C^OMe, R' = C6H3(NO2)2-2,4; R = C^OMe, R' = C6H4(COOH-2) // Вестник ЮУрГУ. Серия «Химия». 2022. Т. 14, № 2. С. 1-51. DOI: 10.14529/chem220205.
- Bruker. SMART and SAINT-Plus. Versions 5.0. data collection and processing software for the smart system. Bruker axs Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An integrated system for solving, refining and displaying crystal structures from diffraction data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- OLEX2: a complete structure solution, refinement and analysis program / O.V. Dolomanov, L.J. Bourhis, R.J. Gildea et al. // J. Appl. Cryst. 2009. Vol. 42. P. 339-341. DOI: 10.1107/S0021889808042726.
- Тарасевич Б.Н. ИК-спектры основных классов органических соединений. М.: МГУ, 2012. 54 с.
- Инфракрасная спектроскопия органических и природных соединений: учебное пособие / А.В. Васильев, Е.В. Гриненко, А.О. Щукин и др. СПб.: СПбГЛТА, 2007. 54 с.
- Covalent radii revisited / B. Cordero, V. Gómez, A.E. Platero-Prats et al. // Dalton Trans. 2008. Iss. 21. P. 2832-2838. DOI: 10.1039/B801115J.
- Гиллеспи Р., Харгиттаи И. Модель отталкивания электронных пар валентной оболочки и строение молекул, М.: Мир, 1992. 75 с.
- Consistent van der waals radii for the whole main group / M. Mantina, A.C. Chamberlin, R. Valero et al. // J. Phys. Chem. A. 2009. Vol. 113, iss. 19. P. 5806-5812. DOI: 10.1021/jp8111556.

![Синтез и строение органосульфонатов тетраорганилфосфония [R4P][OSO2R’], R= Me, R’ = C6H3Cl2-2,5; R= Bu, R’ = C10H5(OH-1)(NO2)2-2,4; [Ph3PR][OSO2R’], R= CH2CH=CHCH2PPh3, R’ = C9H4N(OH-8)(I-7); R= C6H11-cyclo, R’ = C6H3(NO2)2-2,4; R=CH2CHCHMe,R’ = C6H3Cl2-2,5 Синтез и строение органосульфонатов тетраорганилфосфония [R4P][OSO2R’], R= Me, R’ = C6H3Cl2-2,5; R= Bu, R’ = C10H5(OH-1)(NO2)2-2,4; [Ph3PR][OSO2R’], R= CH2CH=CHCH2PPh3, R’ = C9H4N(OH-8)(I-7); R= C6H11-cyclo, R’ = C6H3(NO2)2-2,4; R=CH2CHCHMe,R’ = C6H3Cl2-2,5](/file/cover/147239554/sintez-i-stroenie-organosulfonatov-tetraorganilfosfonija-r4p-oso2r-r-me.png)
