Синтез и строение пентафторпропионата тетрафенилсурьмы Ph4SbOC(O)CF2CF3
Автор: Ефремов Андрей Николаевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 3 т.12, 2020 года.
Бесплатный доступ
По реакциям замещения между пентафенилсурьмой и пентафторпропионой кислотой и по перераспределению лигандов между пентафенилсурьмой и бис (пентафторпропионатом) трифенилсурьмы получен с выходом до 96 % пентафторпропионат тетрафенилсурьмы. Соединение идентифицировано методом ИК-спектроскопии и рентгеноструктурного анализа (РСА). По данным РСА, атом сурьмы имеет искаженную тригонально-бипирамидальную координацию с атомом кислорода карбоксилатного и атомом углерода фенильного лигандов в апикальных положениях. Все атомы фтора и углерод группы CF3 разупорядочены по двум положениям (соотношение вкладов положений в разупорядоченный фрагмент составляет 0,58/0,42). Аксиальный угол СSbO составляет 178,19(1)º, сумма экваториальных углов CSbC равна 355,78(14)º. Атом сурьмы выходит из экваториальной плоскости [C3] в сторону аксиального атома углерода на 0,254 Å. Плоскости фенильных колец повернуты вокруг связей Sb-Cэкв таким образом, чтобы минимизировать внутри- и межмолекулярные взаимодействия. Среднее значение длин связей Sb-Сэкв составляет 2,129(4) Å, при этом длина связи Sb-Сакс сопоставима с экваториальными и имеет значение 2,124(3) Å. Расстояние Sb-O составляет 2,325(3) Å, что больше суммы ковалентных радиусов сурьмы и кислорода (2,07 Å). Характерной особенностью всех карбоксилатов тетраарилсурьмы является наличие внутримолекулярного контакта атома сурьмы с карбонильным атомом кислорода. Данное расстояние Sb×××O=C составляет 3.492(5) Å, что меньше суммы ван-дер-ваальсовых радиусов сурьмы и кислорода (3,70 Å). Это взаимодействие приводит к увеличению одного из экваториальных углов, расположенного со стороны внутримолекулярного контакта, до 122,67(14)°. Организация молекул в кристалле обусловлена водородными связями с участием карбонильного атома кислорода. Данные контакты структурируют молекулы в слои, расположенные перпендикулярно кристаллографической оси b . Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 1850118; deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/data_request/cif).
Пентафенилсурьма, пентафторпропионовая кислота, карбоксилат тетрафенилсурьмы, реакция перераспределения лигандов, реакция замещения, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147234235
IDR: 147234235 | УДК: 549.242+547.53.024+548.312.2+548.312.5 | DOI: 10.14529/chem200302
Текст научной статьи Синтез и строение пентафторпропионата тетрафенилсурьмы Ph4SbOC(O)CF2CF3
По реакциям замещения между пентафенилсурьмой и пентафторпропионой кислотой и по перераспределению лигандов между пентафенилсурьмой и бис(пентафторпропионатом) трифенилсурьмы получен с выходом до 96 % пентафторпропионат тетрафенилсурьмы. Соединение идентифицировано методом ИК-спектроскопии и рентгеноструктурного анализа (РСА). По данным РСА, атом сурьмы имеет искаженную тригонально-бипирамидальную координацию с атомом кислорода карбоксилатного и атомом углерода фенильного лигандов в апикальных положениях. Все атомы фтора и углерод группы CF3 разупорядочены по двум положениям (соотношение вкладов положений в разупорядочен-ный фрагмент составляет 0,58/0,42). Аксиальный угол СSbO составляет 178,19(1)º, сумма экваториальных углов CSbC равна 355,78(14)º. Атом сурьмы выходит из экваториальной плоскости [C3] в сторону аксиального атома углерода на 0,254 Å. Плоскости фенильных колец повернуты вокруг связей Sb–Cэкв таким образом, чтобы минимизировать внутри- и межмолекулярные взаимодействия. Среднее значение длин связей Sb–Сэкв составляет 2,129(4) Å, при этом длина связи Sb–Сакс сопоставима с экваториальными и имеет значение 2,124(3) Å. Расстояние Sb–O составляет 2,325(3) Å, что больше суммы ковалентных радиусов сурьмы и кислорода (2,07 Å). Характерной особенностью всех карбоксилатов тетраарилсурьмы является наличие внутримолекулярного контакта атома сурьмы с карбонильным атомом кислорода. Данное расстояние Sb⋅⋅⋅O=C составляет 3.492(5) Å, что меньше суммы ван-дер-ваальсовых радиусов сурьмы и кислорода (3,70 Å). Это взаимодействие приводит к увеличению одного из экваториальных углов, расположенного со стороны внутримолекулярного контакта, до 122,67(14)°. Организация молекул в кристалле обусловлена водородными связями с участием карбонильного атома кислорода. Данные контакты структурируют молекулы в слои, расположенные перпендикулярно кристаллографической оси b. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 1850118; или .
Достаточно хорошо структурно охарактеризованы соединения пятивалентной сурьмы общей формулы Ar 4 SbX (где X – лиганд, связанный с атомом сурьмы через гетероатом) [1–21]. Наиболее изученными из таких производных сурьмы(V) являются карбоксилаты тетрафенилсурьмы [22–39]. Синтез таких соединений осуществляют по реакциям замещения между кислотами и пентафенилсурьмой [22–24] или галогенидом тетрафенилсурьмы в присутствии акцептора гало-геноводорода [25–30], галогенидом тетрафенилсурьмы и солями карбоновых кислот [31]. Также известен менее распространенный способ синтеза по реакции перераспределения лигандов между Ph 5 Sb и производными симметричного строения Ph 3 SbX 2 [32–39].
В настоящей работе впервые по реакциям замещения и перераспределения лигандов синтезирован пентафторпропионат тетрафенилсурьмы и определены его структурные особенности методом рентгеноструктурного анализа.
Экспериментальная часть
Исходный реагент - пентафенилсурьму получали по методике, описанной в монографии [40]. В работе использовали пентафторпропионовую кислоту производства фирмы «Alfa Aesar».
Синтез пентафторпропионата тетрафенилсурьмы Ph4SbOС(O)CF2CF3 (1)
-
1. Смесь 200 мг (0,394 ммоль) пентафенилсурьмы и 65 мг (0,394 ммоль) пентафторпропионовой кислоты в 30 мл смеси растворителей бензол-изооктан (2:1 объемн.) оставляли до полного удаления растворителей. После перекристаллизации твердого остатка из смеси этанол–изооктан получили 224 мг (96 %) бледно-желтых кристаллов соединения 1 с т. пл. 135 °С.
-
2. Смесь 200 мг (0,394 ммоль) пентафенилсурьмы и 268 мг (0,394 ммоль) бис (пентафторпропионата) трифенилсурьмы в 3 мл бензола нагревали в запаянной ампуле на водяной бане при 80 °С в течение часа. После охлаждения к смеси прибавляли 0,5 мл октана и концентрировали раствор до объема 0,5 мл. Выпавшие бледно-желтые кристаллы отфильтровывали и сушили на воздухе. Получили 430 мг (92 %) соединения 1 с т. пл. 135 °С.
ИК-спектр, ν , см - 1: 3105, 3061, 1697, 1577, 1479, 1436, 1377, 1317, 1271, 1211, 1168, 1143, 1070, 1058, 1026, 997, 912, 860, 813, 773, 750, 738, 729, 698, 690, 657, 617, 584, 540, 466, 455, 447, 408.
Найдено, %: С 54,64; Н 3,55. C 27 H 20 O 2 F 5 Sb. Вычислено, %: С 54,66; Н 3,41.
ИК-спектр соединения 1 записывали на ИК-спектрометре Shimadzu IR Affinity-1S в таблетках KBr в области 4000–400 см–1.
Элементный анализ на С, Н проведен на Carlo-Erba 1106.
Рентгеноструктурный анализ (РСА) кристалла соединения 1 проведен на дифрактометре D8 QUEST фирмы Bruker (MoKα-излучение, λ = 0,71073 Å, графитовый монохроматор) при 296(2) К. Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT-Plus [41]. Все расчеты по определению и уточнению структуры выполнены по программам SHELXL/PC [42], OLEX2 [43]. Структура определена прямым методом и уточнена методом наименьших квадратов в анизотропном приближении для неводородных атомов. Кристаллографические данные и результаты уточнения структуры приведены в табл. 1. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№1850118; или .
Таблица 1
Кристаллографические данные, параметры эксперимента и уточнения структуры 1
|
Параметр |
1 |
|
М |
593,18 |
|
Сингония |
Моноклинная |
|
Пр. группа |
P2 1 /c |
|
a , Å |
10,188(3) |
|
b , Å |
27,219(9) |
|
c , Å |
10,364(3) |
|
α, град. |
90 |
|
β, град. |
118,283(10) |
|
γ, град. |
90 |
|
V , Å3 |
2530,8(13) |
|
Z |
4 |
|
ρ (выч.), г/см3 |
1,557 |
|
µ, мм–1 |
1,148 |
|
F (000) |
1176,0 |
|
Размер кристалла, мм |
0,36 × 0,30 × 0,13 |
|
Область сбора данных по 2θ, град. |
6,332–56,998 |
|
Интервалы индексов отражений |
–13 ≤ h ≤ 13, –36 ≤ k ≤ 36,–13 ≤ l ≤ 13 |
|
Измерено отражений |
47885 |
|
Независимых отражений |
6399 ( R int = 0,0316) |
|
Переменных уточнения |
336 |
|
GOOF |
1,178 |
|
R -факторы по F2>2σ(F2) |
R 1 = 0,0460, wR 2 = 0,1024 |
|
R -факторы по все отражениям |
R 1 = 0,0542, wR 2 = 0,1055 |
|
Остаточная электронная плотность (max/min), e/Å3 |
0,86/–1,28 |
Обсуждение результатов
Известно, что наиболее эффективными методами синтеза карбоксилатов тетраарилсурьмы являются методы, в основе которых лежат реакции замещения и перераспределения лигандов. В первом случае исходными соединениями являются пентаарилсурьма и карбоновая кислота [22– 24], во втором – пентаарилсурьма и дикарбоксилат триарилсурьмы [32–39]. Данные методы синтеза одностадийные, характеризуются мягкими условиями протекания реакций, высоким выходом и чистотой целевого продукта.
Синтез пентафторпропионата тетрафенилсурмы осуществлен по вышеуказанным методам. Реакцию замещения между пентафенилсурьмой и пентафторпропионовой кислотой проводили в смеси растворителей бензол–изооктан (2:1 объемн.) при комнатной температуре с последующей перекристаллизацией твердого остатка из смеси этанол–изооктан (2:1 объемн.) для получения кристаллов, пригодных для РСА. Взаимодействие пентафенилсурьмы и бис (пентафторпропионата) трифенилсурьмы осуществляли в бензоле в запаянной ампуле при нагревании на водяной бане с последующим добавлением октана:
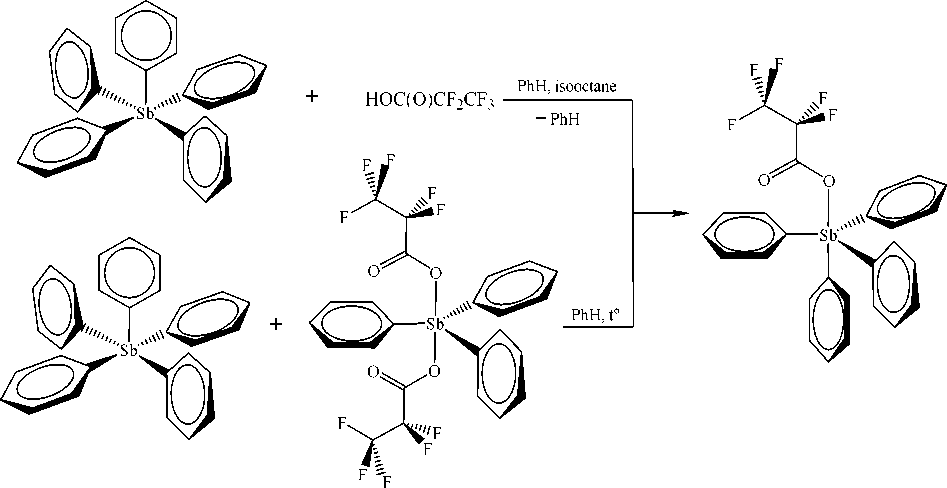
Соединение 1 представляет собой кристаллы бледно-желтого цвета с четкой температурой плавления, хорошо растворимые в ароматических углеводородах и полярных растворителях. Строение пентафторпропионата тетрафенилсурьмы подтверждено методами ИК-спектроскопии и рентгеноструктурного анализа.
В ИК-спектре соединения 1 наблюдается интенсивная полоса поглощения валентных колебаний связей Sb–C при 455 см–1. Полоса поглощения высокой интенсивности при 1697 см–1 характеризует валентные колебания карбонильной группы, а полосе при 1211 см–1 отвечают колебания ν(С–О). ИК-спектр также содержит характерные полосы валентных колебаний углеродного скелета фенильных лигандов: 1577, 1479, 1436 см–1. Валентным колебаниям связей CAr–H отвечает полоса поглощения средней интенсивности при 3061см–1, а внеплоскостным деформационным колебаниям этих же связей – полосы при 738 и 690 см–1. Ряд интенсивных полос при 1377, 1317, 1168 и 1143 см–1 принадлежит валентным колебаниям фрагмента CF 2 CF 3 [44, 45].
По данным РСА, атом сурьмы в соединении 1 имеет искаженную тригонально-бипирамидальную координацию с атомом кислорода карбоксилатного и атомом углерода фенильного лигандов в аксиальных позициях (рис. 1). Все атомы фтора и углерод группы CF 3 разу-порядочены по двум положениям. Уточненное соотношение вкладов положений в разупорядо-ченный фрагмент составляет 0,58/0,42.
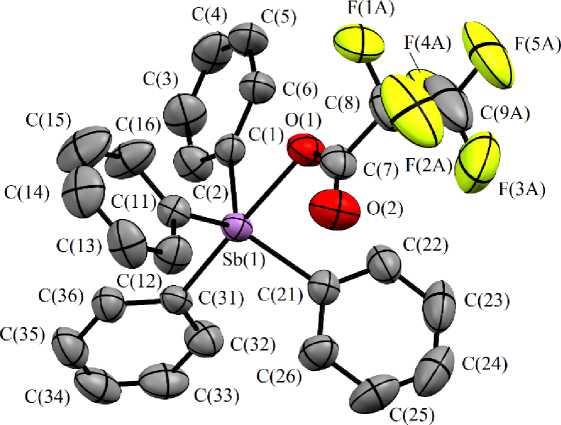
Рис. 1. Строение пентафторпропионата тетрафенилсурьмы (1) (атомы водорода не указаны)
Аксиальный угол СSbO составляет 178,19(1)º, сумма экваториальных углов CSbC равна 355,78(14)°. Значения углов Оа^ЬСэЮ меньше 90 ° (82,34(13)°, 85,32(13)°, 84,80(13)°), а Са^ЬСэЮ больше 90 ° (95, 8 9( 14 ) °, 98, 21( 14 ) ° , 96,54(14)°). Атом сурьмы выходит из экваториальной плоскости [C(1)C(11)C(21 ) ] в с т орон у а к с и а льного а тома у гле род а н а 0, 254Å. Плоскости фенильных колец повернуты вокруг связей S b –C экв таким образом, чтобы минимизировать внутри- и межмолекул я рн ы е в за и м оде й с тв ия. Д в угранные углы между экваториальной плоскос тью и плоскостями коле ц п ри э том с ос та в ля ю т 6, 43º [С(11)–С(16)], 39,32º [С(21)–С(26)], 86,93º [С(1)–С(6)]. Отметим, что плоскость кольца С(11)– С( 16) компланарна экваториальной плоскости, п ри э том у гол ме жд у э кват ори альн ой п лоск ост ью и п лоск ос т ью к ольц а С ( 1)–С(6) приближается к 90º.
Длины связей Sb–С экв в с ое д и н е н и и 1 составляют 2,123(4), 2,164(4), 2,100(4) Å, при этом длина связи Sb–С акс соп ос та в и м а с экваториальными и имеет значение 2,124 ( 3) Å. Расстояние Sb– O составляет 2,325(3) Å, ч т о больше суммы ковалентных радиусов сурьмы и кислорода (2,07 Å).
Ха р а к те рной ос обе н н ос т ью к а р б оксилатов тетраарилсурьмы является наличие внутримолекул я рн ого кон та к та ат о ма су рьмы с карбонильным атомом кислорода [ 20–39]. Расстояние Sb—O=C в с трук ту ре с оед и н е н и я 1 составляет 3,492(5) А, что меньше суммы ван-дер-ваальсовых р а д и у с ов с у рьмы и к и с ло род а (3,70 Å) [46]. Данное взаимодействие приводит к увеличению одн ого из э к в а тори а л ьн ых у глов C(11)Sb(1)C(21) (122,67(14)°), расположенного со стороны внутримолекулярного контакта.
Ин
те
рес
н
о с
ра
в
н
и
ть в
ли
я
н
ие схожих фторсодержащих карбоксилатны
х ли
г
а
н
д
ов
н
а
ос
новн
ы
е
п
а
ра
ме
тр
ы к
оор
д
и
н
ац
и
он
ного полиэдра атома сурьмы в карбоксилатах те
трафе
н
илс
у
рьмы
. Р
анее на
ми были
с
и
н
те
з
и
ров
а
н
ы ге
п
тафторб
у
ти
ра
т
[
3
3] и
3,
3,3
-трифторпропионат тетрафенил-сурь
м
ы [
34
]
. В
ыб
о
р
и
мен
н
о
э
тих соединений обусловлен увеличением э
ле
к
трон
о
а
к
ц
е
п
торных св
ойств
к
арб
о
к
с
и
л
а
тн
ых ли
га
н
д
ов в ряд
у OС(O)CH
2
CF
3
Проанализировав
да
н
н
ые
т
аб
л
. 2, можно сделать вывод о том, что с увеличением электроноакцеп
торны
х с
в
ой
с
тв
ли
га
н
д
ов
в
ряд
у OС(O)CH
2
CF
3
Таблица 2
Основные геометрические параметры карбоксилатов тетрафенилсурьмы
|
OC(O)R |
Выход атома Sb из плоскости [С3], Å |
max ∠ С э SbC э , град. |
∠ OSbC а , град. |
d (Sb–O), Å |
d (Sb–C), Å |
d (Sb∙∙∙O), Å |
|
CH 2 CF 3 |
0,209 |
1 21, 5 0(8 ) |
173,29(7) |
2,255(2) |
2,167(2) (акс) 2,109(2) (экв) 2,111(2) (экв) 2,117(2) (экв) |
3,414(3) |
|
CF 2 CF 3 |
0,254 |
1 22, 6 7(1 4) |
178,19(1) |
2,325(3) |
2,124(3) (акс) 2,100(4) (экв) 2,123(4) (экв) 2,164(4) (экв) |
3,492(5) |
|
CF 2 CF 2 CF 3 |
0,263 |
1 24, 4 7(1 0) |
178,87(8) |
2,340(2) |
2,154(3) (акс) 2,101(2) (экв) 2,110(3) (экв) 2,120(2) (экв) |
3,517(6) |
Организация молекул в кристалле соединений 1 обусловлена водородными связями с участием карбонильного атома кислорода. Расстояния Н∙∙∙O=C составляют 2,52 и 2,55 Å. Данные контакты структурируют молекулы в кристалле в слои, расположенные перпендикулярно кристаллографической оси b (рис. 2).
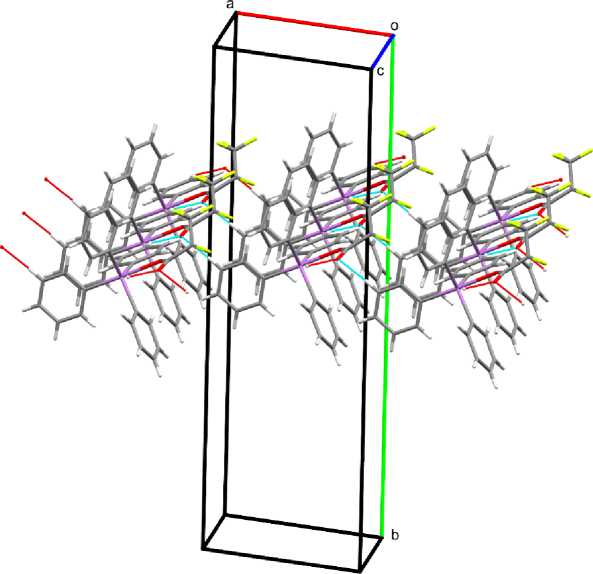
Рис. 2. Упаковка молекул в кристалле соединения 1 (показан только один слой)
Выводы
Таким образом, в настоящей работе по реакциям замещения и перераспределения лигандов получен с высоким выходом и структурно охарактеризован пентафторпропионат тетрафенилсурьмы. Координационный полиэдр атома сурьмы представляет собой искаженную тригональную бипирамиду с аксиально расположенным карбоксилатным лигандом. Формирование пространственной структуры кристаллов обусловлено образованием водородных связей с участием карбонильных атомов кислорода, при этом молекулы в кристалле образуют слои.
Выражаю благодарность профессору В.В. Шарутину за проведенные рентгеноструктурные исследования.
Список литературы Синтез и строение пентафторпропионата тетрафенилсурьмы Ph4SbOC(O)CF2CF3
- Cambridge CrystallograficDatebase. Release 2020. Cambridge.
- Synthesis, Crystal Structures and in vitro Antitumor Activities of Some Arylantimony Derivatives of Analogues of Demethylcantharimide / G.-C. Wang, J. Xiao, L. Yu et al. // J. Organomet. Chem. - 2004. - V. 689, № 9. - P. 1631-1638. DOI: 10.1016/j.jorganchem.2004.02.015.
- Синтез и строение цианамида тетрафенилсурьмы / И.В. Егорова, В.В. Жидков, И.П. Гри-нишак и др. // Журн. общей химии. - 2014. - Т. 84, № 7. - С. 1176-1178.
- Synthesis, Crystal Structures and in vitro Antitumor Activities of Some Organoantimony Aryl-hydroxamates / G.-C. Wang, Y.-N. Lu, J. Xiao et al. // J. Organomet. Chem. - 2005. - V. 690, № 1. -P. 151-156. DOI: 10.1016/j.jorganchem.2004.09.002.
- Spectroscopic and Crystal Structure Data of the Alkali-, Thallium (I) and Onic-salts of Dimethyl-N-trichloracetylamidophosphate / V.A. Trush, K.E. Gubina, V.M. Amirkhanov et al. // Polyhedron. -2005. - V. 24, № 9. - P. 1007-1014. DOI: 10.1016/j.poly.2005.01.023.
- Structure and Dynamic Behavior of Neutral Hexacoordinate Antimony Compounds with Intramolecular Coordination / H. Yamamichi, S. Matsukawa, S. Kojima et al. // Heteroat. Chem. - 2011. -V. 22, № 3-4. - P. 553-561. DOI: 10.1002/hc.20721.
- Synthesis, Characterization and Structure of Some Arylantimony Ferrocenylacrylates / J.-S. Li, R.-C. Liu, X.-B. Chi et al. // Inorg. Chim. Acta. - 2004. - V. 357, № 7. - P. 2176-2180. DOI: 10.1016/j.ica.2003.12.012.
- Синтез, структурное и MAS ЯМР (13С, 15N) спектральное исследование комплексов тетрафенилсурьмы с ^^диалкилдитиокарбаматными лигандами: проявление канформационной изомерии / А.В. Иванов, А.П. Пакусина, М.А. Иванов и др. // Докл. акад. наук СССР. - 2005. -Т. 401, № 5. - С. 643-647.
- Establishing the Coordination Chemistry of Antimony(V) Cations: Systematic Assessment of Ph4Sb(OTf) and Ph3Sb(OTfh as Lewis Acceptors / A.P.M. Robertson, S.S. Chitnis, H.A. Jenkins et al. // Chem. - Eur. J. - 2015. - V. 21, № 21. - P. 7902-7913. DOI: 10.1002/chem.201406469.
- Influence of the Catalyst Structure in the Cycloaddition of Isocyanates to Oxiranes Promoted by Tetraarylstibonium Cations / M. Yang, N. Pati, G. Belanger-Chabot et al. // Dalton Trans. - 2018. -V. 47. - P. 11843-11850. DOI: 10.1039/C8DT00702K.
- Tetraphenylantimony(V) 2-Isonitroso-2-(4-methylthiazolyl-2)acetamide: Synthesis, Crystal Structure, and Molecular Structure / K.V. Domasevich, V.V. Skopenko, R. Kempe et al. // Russ. J. Inorg. Chem. - 1998. - V. 43, № 2. - P. 192-195.
- Шарутин, В.В. Синтез и строение сольвата 1,2-дифенилэтандиондиоксимата бис(тетрафенилсурьмы) с толуолом Ph4SbONC(Ph)С(Ph)ONSbPh4 • 2PhCH3 и 1,2-дифенил(2-окси)этаноноксимата тетрафенилсурьмы Ph4SbONC(Ph)CH(Ph)OH / В.В. Шарутин, О.В. Молокова, О.К. Шарутина // Журн. неорг. химии. - 2013. - Т. 58, № 4. - С. 460-467. DOI: 10.7868/S0044457X13040181.
- Syntheses, Characterizations and Crystal Structures of New Organoantimony(V) Complexes with Heterocyclic (S, N) Ligand / C. Ma, Q. Zhang, J. Sun et al. // J. Organomet. Chem. - 2006. -V. 691, № 11. - P. 2567-2574. DOI: 10.1016/j.jorganchem.2006.01.049.
- Synthesis of Two Tetraphenylantimony Complexes of Pyridine-N-oxides; Crystal Structure of Tetraphenylantimony (2-Mercaptopyridine-N-oxide) / G.M. Arvanitis, M.E. Berardini, T.B. Acton et al. // Phosphorus, Sulfur Silicon, Relat. Elem. - 1993. - V. 82, № 1-4. - P. 127-135. DOI: 10.1080/10426509308047416.
- Ortho-metallation of a Phenyl Ring with Antimony(V) / N. Dinsdale, J.C. Jeffrey, R.J. Kilby et al. // Inorg. Chim. Acta. - 2007. - V. 360, № 1. - P. 418-420. DOI: 10.1016/j.ica.2006.07.091.
- Perrin, C.L. Symmetry of Metal Chelates / C.L. Perrin, Y.-J. Kim // Inorg. Chem. - 2000. -V. 39, № 17. - P. 3902-3910. DOI: 10.1021/ic000382+.
- Pan, B. [Sb(C6F5)4][B(C6F5)4]: An Air Stable, Lewis Acidic Stibonium Salt That Activates Strong Element-Fluorine Bonds / B. Pan, F.P. Gabbai // J. Am. Chem. Soc. - 2014. - V. 136, № 27. -P. 9564-9567. DOI: 10.1021/ja505214m.
- Шарутин, В.В. Синтез и строение пропиолатов три- и тетрафенилсурьмы / В.В. Шарутин, О.К. Шарутина, В.С. Сенчурин // Коорд. химия. - 2014. - Т. 40, № 2. - С. 108-112. DOI: 10.7868/S0132344X14020108.
- Domasevitch, K.V. Organoantimony(V) Cyanoximates: Synthesis, Spectra and Crystal Structures / K.V. Domasevitch, N.N. Gerasimchuk, A. Mokhir // Inorg. Chem. - 2000. - V. 39, № 6. -P. 1227-1237. DOI: 10.1021/ic9906048.
- Шарутин, В.В. Синтез и строение ароксидов тетрафенисурьмы Ph4SbOAr (Ar = C6H4C6H7, C6H2(Br2-2,6)(mpem-Bu-4), C6H3(NO2b-2,4, C6H2(Br2-2,6)(NO2-4)) / В.В. Шарутин, О.К. Шарутина, В.С. Сенчурин // Журн. неорг. химии. - 2017. - Т. 62, № 3. - С. 290-295. DOI: 10.7868/S0044457X17030151.
- Шарутин, В.В. Новый способ получения ароксидов хлоротрифенилсурьмы Ph3SbCl(OAr) / В.В. Шарутин, О.К. Шарутина, В.С. Сенчурин // Коорд. химия. - 2016. - Т. 42, № 1. - С. 34-38. DOI: 10.7868/S0132344X15120075.
- Dihydroxybenzoic Acids as Polydentate Ligands in Phenylantimony (V) Complexes / V.V. Sharutin, O.K. Sharutina, Y.O. Gubanova et al. // Inorg. Chim. Acta. - 2019. - V. 494. - P. 211215. DOI: 10.1016/j.ica.2019.05.029
- Bone, S.P. The Crystal Structures of Tetraphenylantimony Acetate and Its / S.P. Bone, D.B. Sowerby // Phosphorus, Sulfur Silicon, Relat. Elem. - 1989. - V. 45, № 1-2. - P. 23-29. DOI: 10.1080/10426508908046072
- Синтез и строение ниацината тетрафенилсурьмы / В.В. Шарутин, А.П. Пакусина, Т.П. Платонова и др. // Журн. общ. химии. - 2004. - Т. 74, №. 2. - С. 234-237.
- Synthesis, Characterizations and Crystal Structures of New Organoantimony(V) Complexes with Various Isomers of Fluoromethylbenzoate Ligands / H.-D. Yin, L.-Y. Wen, J.-C. Cui et al. // Polyhedron. - 2009. - V. 28, № 14. - P. 2919-2926. DOI: 10.1016/j.poly.2009.06.065.
- Synthesis, Characterization and Crystal Structures of Tri- and Tetraphenylantimony(V) Compounds Containing Arylcarbonyloxy Moiety / L. Quan, H.-D. Yin, J.-C. Cui et all. // J. Organomet. Chem. - 2009. - V. 694, № 23. - P. 3708-3717. DOI: 10.1016/j.jorganchem.2009.07.040.
- New Organoantimony Complexes with the Isomers of Chlorophenylacetic Acid: Syntheses, Characterizations and Crystal Structures of 1D Polymeric Chain, 2D Network Structure and 3D Framework / L.-Y. Wen, H.-D. Yin, W.-K. Li et al. // Inorg. Chim. Acta. - 2010. - V. 363, № 4. - P. 676-684. DOI: 10.1016/j.ica.2009.11.022.
- Synthesis, Characterization and in vitro Antitumor Activity of Some Arylantimony Ferrocene-carboxylates and Crystal Structures of C5H5FeC5H4CO2SbPh4 and (C5H5FeC5H4CO2)2Sb(4-CH3C6H4)3 / R.-C. Liu, Y.-Q. Ma, L. Yu et al. // Appl. Organomet. Chem. - 2003. - V. 17, № 9. - P. 662-668. DOI: 10.1002/aoc.491.
- Synthesis and in vitro Antitumor Activity of Some Tetraphenylantimony Derivatives of exo-7-Oxa-bicyclo[2,2,1]heptane(ene)-3-arylamide-2-acid / J.-S. Li, Y.-Q. Ma, J.-R. Cui et al. // Appl. Organomet. Chem. - 2001. - V. 15, № 7. - P. 639-645. DOI: 10.1002/aoc.200.
- Synthesis and Crystal Structure of Dinuclear Tetraphenylantimony Carboxylate Derivatives Based on Different Coordination Modes / L. Quan, H. Yin, J. Cui, et al. // J. Organomet. Chem. -2009. - V. 694, № 23. - P. 3683-3687. DOI: 10.1016/j.jorganchem.2009.07.041.
- Millington, P.M. Phenylantimony(V) Oxalates: Isolation and Crystal Structures of [SbPh4][SbPh2(ox)2], [SbPh3(OMe)]2ox and (SbPh4)2ox / P.M. Millington, D.B. Sowerby // J. Chem. Soc., Dalton Trans. - 1992. - V. 7. - P. 1199-1204. DOI: 10.1039/DT9920001199.
- Термохимические свойства Ph4Sb(OC(O)Ci0H15) и Ph3Sb(OC(O)Ci0H15)2 / Д.В. Лякаев, А.В. Маркина, Е В. Хабарова и др. // Журн. физ. химии. - 2018. - Т. 92, № 9. - С. 1384-1389. DOI 10.1134/S0044453718090170.
- Синтез и строение 3,3,3-трифторпропанатов три- и тетрафенилсурьмы / В.В. Шарутин, О.К. Шарутина, А.Н. Ефремов и др. // Журн. неорг. химии. - 2019. - Т. 64, № 10. - С. 1051-1056. DOI: 10.1134/S0044457X19100131.
- Фторсодержащие карбоксилаты тетраарилсурьмы. Синтез и строение / В.В. Шарутин, О.К. Шарутина, А.Н. Ефремов и др. // Журн. неорг. химии. - 2020. - Т. 65, № 4. - С. 482-486. DOI: 10.31857/S0044457X20040170.
- Синтез фторбензоатов тетра- и триарилсурьмы / В.В. Шарутин, О.К. Шарутина, Е.А. Бондарь и др. // Журн. общ. химии. - 2002. - Т. 72, №. 3. - С. 419-420.
- Синтез и строение пентафторбензоата тетрафенилсурьмы и нитрата тетра-и-толилсурьмы / В.В. Шарутин, О.К. Шарутина, Е.А. Бондарь и др. // Коорд. химия. - 2001. - Т. 27, № 6.- С. 423-427.
- Синтез и строение фторбензоатов тетра- и триарилсурьмы / В.В. Шарутин, О.К. Шарутина, Е.А. Бондарь, А.П. Пакусина и др. // Коорд. химия. - 2002. - Т. 28, № 5. - С. 356363.
- Синтез и строение феноксиацетата и этилмалоната тетрафенилсурьмы Ph4SbOC(O)R [R = CH2OPh, CH2C(O)OC2H5] / В.В. Шарутин, А.П. Пакусина, О.П. Задачина и др. // Коорд. химия. -2004. - Т. 30, № 6. - С. 426-431.
- Синтез и строение 1-адамантанкарбоксилата тетрафенилсурьмы и бис(1- адамантанкар-боксилата) трифенилсурьмы / В.В. Шарутин, В.С. Сенчурин, О.К. Шарутина и др. // Журн. общ. химии. - 2009. - Т. 79, №. 10. - С. 1636-1643.
- Кочешков, К.А. Методы элементоорганической химии. Сурьма, висмут / К.А. Кочешков, А.П. Сколдинов, Н.Н. Землянский. - М.: Наука, 1976. - 483 с.
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures From Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- OLEX2: Complete Structure Solution, Refinement and Analysis Program / O.V. Dolomanov, L.J. Bourhis, R.J. Gildea et al. // J. Appl. Cryst. - 2009. - V. 42. - P. 339-341. DOI: 10.1107/S0021889808042726.
- Тарасевич, Б.Н. ИК-спектры основных классов органических соединений / Б.Н. Тарасевич. - М.: МГУ, 2012. - 54 с.
- Инфракрасная спектроскопия органических и природных соединений: учебное пособие / А.В. Васильев, Е В. Гриненко, А О. Щукин и др. - СПб.: СПбГЛТА, 2007. - 54 с.
- Бацанов, С.С. Атомные радиусы элементов / С.С. Бацанов // Журн. неорган. химии. -1991. - Т. 36, № 12. - С. 3015-3037.


