Синтез и строение продукта реакции пента-пара-толилсурьмы с гептафторпропил(t-бутил)дикетоном-1,3 p-Tol4Sb[t-BuC(O)СHС(О)С3F7]
Автор: Сопшина Дарья Михайловна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 1 т.14, 2022 года.
Бесплатный доступ
Пента( пара -толил)сурьма реагирует с гептафторпропил( t -бутил)дикетоном-1,3 с отщеплением толуола и образованием продукта замещения p -Tol4Sb[ t -BuC(O)СHС(О)С3F7] (1) с выходом 82 %. Соединение идентифицировано методами ИК-спектроскопии и рентгеноструктурного анализа (РСА). РСА проводили на автоматическом четырехкружном дифрактометре D8 Quest Bruker (Мо Кα -излучение, λ = 0,71073 Å, графитовый монохроматор) при 293 К. Размер кристалла 1 0,59 × 0,48 × 0,13 мм, P- 1, a = 10,47(2), b = 10,94(2), c = 17,04(3) Å, a = 73,12(6), β = 88,94(8), g = 89,94(8) град., V = 1867(7) Å3, Z = 2, ρ = 1,39 г/cм3, F (000) = 792,0; 2q 3,89-56,999 град., R 1 = 0,2213, wR 2 = 0,5429. По данным РСА, соединение 1 представляет собой молекулярный комплекс, в котором атомы сурьмы имеют октаэдрическую координацию с двумя атомами кислорода и двумя атомами углерода в экваториальной плоскости; аксиальные положения занимают два оставшихся толильных лиганда. Аксиальный угол CSbC сильно искажен и равен 159,6(8)°. Диагональные углы CSbO в экваториальной плоскости составляют 167,1(7), 166,9(7)°, длины связей Sb-C составляют 2,11(2) и 2,19(3) Å. Формирование цепочечной пространственной структуры кристаллов обусловлено образованием связей между молекулами с участием атомов фтора (H∙∙∙F 2,6-2,8 Å) и углерода (С∙∙∙F 3,005 Å). Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 2067768 (1); deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/data_request/cif).
Пента(пара-толил)сурьма, b-дикетон, реакция замещения, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147236624
IDR: 147236624 | УДК: 549.242+547.53.024+548.312.5 | DOI: 10.14529/chem220106
Текст научной статьи Синтез и строение продукта реакции пента-пара-толилсурьмы с гептафторпропил(t-бутил)дикетоном-1,3 p-Tol4Sb[t-BuC(O)СHС(О)С3F7]
Сурьмаорганические производные общей формулы Ar4SbX (где X – лиганд, связанный с атомом сурьмы через гетероатом) достаточно хорошо изучены методом рентгеноструктурного анализа [1–25]. Синтез таких производных осуществляют по реакциям деарилирования пента-арилсурьмы соединениями, содержащими подвижный атом водорода или перераспределения лигандов между пентаарилсурьмой и производным симметричного строения Ar3SbX2. Получение производных пятивалентной сурьмы общей формулы Ar 4 SbX более предпочтительно осуществлять непосредственно из пентаарилсурьмы и кислоты НХ, так как в этом случае получение продукта происходит в одну стадию, его выделение не является трудоемким, а выход достаточно высок [26]. Поскольку β -дикетоны являются сравнительно сильными С-Н-кислотами, рК α которых соизмеримо со значениями рК α некоторых фенолов (например, рК α ацетилацетона составляет 8,95, а фенола – 9,95 [27]), была изучена возможность их взаимодействия с пентафенилсурь-мой [28–30], однако аналогичные реакции пента( пара -толил)сурьмы практически не были исследованы [31].
В настоящей работе впервые по реакции замещения из пента( пара -толил)сурьмы и β -дикетона t -BuC(O)СH 2 С(О)С 3 F 7 синтезирован новый β -дикетонат тетра( пара -толил)сурьмы и определены его структурные особенности методом рентгеноструктурного анализа.
Экспериментальная часть
Исходный реагент - пента- пара -толилсурьму – получали по методике, описанной в монографии [32].
Синтез p-Tol4Sb[OC(C3F7)CHC(t-Bu)O] (1)
Раствор 0,2 г (0,4 ммоль) пента( пара -толил)сурьмы и 0,105 г (0,4 ммоль) 98%-ного 6,6,7,7,8,8,8-гептафтор-2,2-диметил-3,5-октандиона в 20 мл бензола нагревали до полного растворения пента( пара -толил)сурьмы. При медленном охлаждении до комнатной температуры наблюдали появление кристаллов. Растворитель медленно удаляли, твердый остаток перекристаллизовали из смеси ацетонитрила и изопропилового спирта (3:1). Получили 0,159 г (59 %) желтых кристаллов 1 с т. пл. 167,6 °С.
ИК-спектр (ῡ, см–1): 1614, 1582, 1537, 1479, 1445, 1366, 1278, 1231, 1188, 1119, 1098, 1067, 1015, 908, 831, 797, 741, 689, 575, 532, 488.
Найдено, %: С 58,24; Н 4,89. C 38 H 38 F 7 O 2 Sb. Вычислено, %: С 58,39; Н 4,86.
ИК-спектр соединения 1 записывали на ИК-спектрометре Shimadzu IR Affinity-1S в таблетках KBr в области 4000–400 см–1.
Рентгеноструктурный анализ (РСА) кристаллов соединения 1 проведен на дифрактометре D8 QUEST фирмы Bruker (MoKα-излучение, λ = 0,71073 Å, графитовый монохроматор) при 296(2) К. Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT-Plus [33]. Все расчеты по определению и уточнению структур выполнены по программам SHELXL/PC [34], OLEX2 [35]. Структура определена прямым методом и уточнена методом наименьших квадратов в анизотропном приближении для неводородных атомов. Кристаллографические данные и результаты уточнения структуры приведены в таблице. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 2067768 для 1; или .
Кристаллографические данные, параметры эксперимента и уточнения структуры 1
|
Параметр |
1 |
|
М |
781,43 |
|
Сингония |
Триклинная |
|
Пр. группа |
P– 1 |
|
a , Å |
10,47(2) |
|
b , Å |
10,94(2) |
|
c , Å |
17,04(3) |
|
α, град. |
73,12(6) |
|
β, град. |
88,36(14) |
|
γ, град. |
89,94(8) |
|
V , Å3 |
1867(7) |
|
Z |
2 |
|
ρ (выч.), г/см3 |
1,390 |
|
–1 µ, мм– |
0,804 |
|
F (000) |
792,0 |
|
Размер кристалла, мм |
0,59 × 0,48 × 0,13 |
|
Область сбора данных по 2θ, град. |
3,89 - 56,998 |
|
Интервалы индексов отражений |
–14 ≤ h ≤ 14, –14 ≤ k ≤ 14, –22 ≤ l ≤ 22 |
|
Измерено отражений |
20314 |
|
Независимых отражений |
8853 ( R int = 0,0915) |
|
Переменных уточнения |
456 |
|
GOOF |
2,244 |
|
R -факторы по F 2>2σ( F 2) |
R 1 = 0,2213, wR 2 = 0,5429 |
|
R -факторы по всем отражениям |
R 1 = 0,2761, wR 2 = 0,5669 |
|
Остаточная электронная плотность (max/min), e/Å3 |
4,45/–4,58 |
Обсуждение результатов
Известно, что наиболее эффективным способом синтеза производных тетраарилсурьмы Ar 4 SbX является метод, в основе которого лежит реакция пентаарилсурьмы с кислотой HX [26]. Данный метод хорошо изучен для фенильных производных сурьмы и характеризуется мягкими условиями протекания реакций, высоким выходом и чистотой целевого продукта, однако реакции пента(пара-толил) сурьмы с β -дикетонами ранее не изучались.
Мы нашли, что взаимодействие эквимолярных количеств пента- пара -толилсурьмы с гептаф-торпропил( t -бутил)дикетоном-1,3 в бензоле приводит к образованию β -дикетоната тетра( пара -толил)сурьмы ( 1 ). Для завершения реакций требовалось нагревание реакционной смеси в течение 1 ч. При медленном охлаждении раствора исходных реагентов в бензоле наблюдалось образование кристаллов. Пригодные для РСА кристаллы были получены перекристаллизацией целевого продукта из смеси ацетонитрил-изопропанол (3:1).
Соединение 1 представляет собой бесцветные кристаллы, хорошо растворимые в ароматических углеводородах и полярных растворителях. Строение комплекса 1 подтверждено методами ИК-спектроскопии и рентгеноструктурного анализа.
В ИК-спектре соединения 1 наблюдается интенсивная полоса поглощения валентных колебаний связей Sb–C при 488 см–1. Полосу поглощения высокой интенсивности при 1614 см–1 можно отнести к валентным колебаниям карбонильных групп, а полосы поглощения средней интенсивности при 2968–2868 см–1 - к валентным асимметричным и симметричным колебаниям связей С–H метильных групп соответственно. ИК-спектр соединения также содержит характерные полосы валентных колебаний углеродного скелета ароматических фрагментов: 1537, 1495, 1452 см–1 [31, 32].
Анализ геометрических характеристик полученных ранее β -дикетонатов тетрафенилсурьмы позволил выявить некоторые зависимости прочности связывания лиганда, распределения электронной плотности в хелатном цикле и искажения октаэдрического полиэдра центрального атома от природы заместителей при атоме сурьмы и γ -заместителя ацетилацетона [36].
Нами впервые синтезированы β -дикетонаты тетра( пара -толил)сурьмы с различными заместителями в α -положениях дикетона, поэтому интересно было установить их строение и выявить особенности координации лиганда на атом сурьмы.
Показано, что октаэдрическая координация атома сурьмы с двумя атомами кислорода и двумя атомами углерода в экваториальной плоскости сильно искажена; аксиальные положения занимают два атома углерода оставшихся толильных лигандов (см. рисунок).
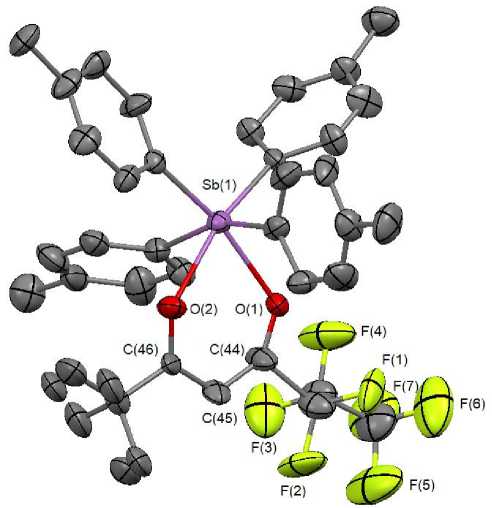
Структура соединения 1
Аксиальный угол CSbC сильно искажен и равен 159,6(8)°. Диагональные углы CSbO в экваториальной плоскости составляют 167,1(7), 166,9(7)°. Длины четырех связей Sb–С изменяются в интервалах 2,11(2)–2,19(3) Å. Связи Sb - O(1,2) равны 2,312(16) и 2,357(16) Å, что свидетельствует о несимметричном связывании β -дикетонатного лиганда с атомом металла. Расстояния О(1)– С(44) и О(2)–С(46) в циклах различаются: 1,23(3), 1,32(3) Å, но связи С–С имеют одинаковое значение 1,36(4) Å.
Выводы
Таким образом, по реакции замещения из пента( пара -толил)сурьмы и гептафторпропил( t -бутил)дикетона-1,3 получен с выходом 59 % неизвестный ранее β -дикетонат тетрапара-толилсурьмы p -Tol4Sb[ t -BuC(O)СHС(О)С3F7], в котором атом сурьмы имеет искаженную октаэдрическую координацию с хелатным циклом в экваториальном положении. Формирование цепочечной пространственной структуры кристаллов обусловлено образованием связей между молекулами с участием атомов фтора (H∙∙∙F 2,6 - 2,8 Å) и углерода (С∙∙∙F 3,005 Å).
Выражаю благодарность профессору В.В. Шарутину за проведенные рентгеноструктурные исследования.
Список литературы Синтез и строение продукта реакции пента-пара-толилсурьмы с гептафторпропил(t-бутил)дикетоном-1,3 p-Tol4Sb[t-BuC(O)СHС(О)С3F7]
- Cambridge Crystallografic Datebase. Release 2020. Cambridge.
- Шарутин, В.В. Синтез, реакции и строение арильных соединений пятивалентной сурьмы / В.В. Шарутин, А.И. Поддельский, О.К. Шарутина // Журн. коорд. химии. – 2020. – Т. 46, № 10. – С. 579–648. DOI: 10.31857/S0132344X20100011.
- Синтез и строение цианамида тетрафенилсурьмы / И.В. Егорова, В.В. Жидков, И.П. Гри-нишак, А.А. Раханский // Журн. общей химии. – 2014. – Т. 84, № 7. – С. 1176–1178.
- Establishing the Coordination Chemistry of Antimony(V) Cations: Systematic Assessment of Ph4Sb(OTf) and Ph3Sb(OTf)2 as Lewis Acceptors / A.P.M. Robertson, S.S. Chitnis, H.A. Jenkins et al. // Chem. Eur. J. – 2015. – V. 21, № 21. – P. 7902–7913. DOI: 10.1002/chem.201406469.
- Pan, B. [Sb(C6F5)4][B(C6F5)4]: An Air Stable, Lewis Acidic Stibonium Salt that Activates Strong Element-Fluorine Bonds / B. Pan, F.P. Gabbai // J. Am. Chem. Soc. – 2014. – V. 136, № 27. – P. 9564–9567. DOI: 10.1021/ja505214m.
- Ortho-metallation of a Phenyl Ring with Antimony(V) / N. Dinsdale, J.C. Jeffrey, R.J. Kilby et al. // Inorg. Chim. Acta. – 2007. – V. 360, № 1. – P. 418–420. DOI: 10.1016/j.ica.2006.07.091.
- Influence of the Catalyst Structure in the Cycloaddition of Isocyanates to Oxiranes Promoted by Tetraarylstibonium Cations / M. Yang, N. Pati, G. Belanger-Chabot et al. // Dalton Trans. – 2018. – V. 47. – P. 11843–11850. DOI: 10.1039/C8DT00702K.
- Синтез, структурное и MAS ЯМР (13С, 15N) спектральное исследование комплексов тетра-фенилсурьмы с N,N-диалкилдитиокарбаматными лигандами: проявление конформационной изо-мерии / А.В. Иванов, А.П. Пакусина, М.А. Иванов и др. // Докл. акад. наук СССР. – 2005. – Т. 401, № 5. – С. 643–647.
- Structure and Dynamic Behavior of Neutral Hexacoordinate Antimony Compounds with Intra-molecular Coordination / H. Yamamichi, S. Matsukawa, S. Kojima et al. // Heteroat. Chem. – 2011. – V. 22, № 3–4. – P. 553–561. DOI: 10.1002/hc.20721.
- Synthesis, Crystal Structures and in vitro Antitumor Activities of Some Organoantimony Aryl-hydroxamates / G.-C. Wang, Y.-N. Lu, J. Xiao J. et al. // J. Organomet. Chem. – 2005. – V. 690, № 1. – P. 151–156. DOI: 10.1016/j.jorganchem.2004.09.002.
- Synthesis, Crystal Structures and in vitro Antitumor Activities of Some Arylantimony Deriva-tives of Analogues of Demethylcantharimide / G.-C. Wang, J. Xiao, L. Yu. et al. // J. Organomet. Chem. – 2004. – V. 689, № 9. – P. 1631–1638. DOI: 10.1016/j.jorganchem.2004.02.015
- Domasevitch, K.V. Organoantimony(V) Cyanoximates: Synthesis, Spectra and Crystal Struc-tures / K.V. Domasevitch, N.N. Gerasimchuk, A. Mokhir // Inorg. Chem. – 2000. – V. 39, № 6. – P. 1227–1237. DOI: 10.1021/ic9906048.
- Syntheses, Characterizations and Crystal Structures of New Organoantimony(V) Complexes with Heterocyclic (S, N) Ligand / C. Ma, Q. Zhang, J. Sun et al. // J. Organomet. Chem. – 2006. – V. 691, № 11. – P. 2567–2574. DOI: 10.1016/j.jorganchem.2006.01.049.
- Synthesis, Characterization and Structure of Some Arylantimony Ferrocenylacrylates / J.-S. Li, R.-C. Liu, X.-B. Chi et al. // Inorg. Chim. Acta – 2004. – V. 357. – P. 2176–2180. DOI: 10.1016/j.ica.2003.12.012.
- Фторсодержащие карбоксилаты тетраарилсурьмы. Синтез и строение / В.В. Шарутин, О.К. Шарутина, А.Н. Ефремов и др. // Журн. неорг. химии. – 2020. – Т. 65, № 4. – С. 482–486. DOI: 10.31857/S0044457X20040170.
- Особенности взаимодействия пентафенилсурьмы с бифункциональными кислотами. строение глутарата бис(тетрафенилсурьмы), сольвата 1,4-циклогександикарбоксилата бис(тетрафенилсурьмы) с бензолом, сольвата 3-гидроксибензоата тетрафенилсурьмы с диокса-ном и аддукта 3-гидроксибензоата тетрафенилсурьмы с 3-тетрафенилстибоксибензоатом тетра-фенилсурьмы и толуолом / В.В. Шарутин, О.К. Шарутина, Ю.О. Губанова и др. // Журн. неорг. химии. – 2019. – Т. 64, № 9. – С. 957–964. DOI: 10.1134/S0044457X19090198.
- Шарутин, В.В. Синтез и строение сольвата 1,2-дифенилэтандиондиоксимата бис(тетрафенилсурьмы) с толуолом Ph4SbONC(Ph)С(Ph)ONSbPh4 · 2PhCH3 и 1,2-дифенил(2-окси)этаноноксимата тетрафенилсурьмы Ph4SbONC(Ph)CH(Ph)OH / В.В. Шарутин, О.В. Молокова, О.К. Шарутина // Журн. неорг. химии. – 2013. – Т. 58, № 4. – С. 460–467. DOI: 10.7868/S0044457X13040181.
- Шарутин, В.В. Синтез и строение пропиолатов три- и тетрафенилсурьмы / В.В. Шарутин, О.К. Шарутина, В.С. Сенчурин // Коорд. химия. – 2014. – Т. 40, № 2. – С. 108–112. DOI: 10.7868/S0132344X14020108.
- Dihydroxybenzoic Acids as Polydentate Ligands in Phenylantimony (V) Complexes / V.V. Sharutin, O.K. Sharutina, Y.O. Gubanova et al. // Inorg. Chim. Acta. – 2019. – V. 494. – P. 211–215. DOI: 10.1016/j.ica.2019.05.029
- Термохимические свойства Ph4Sb(OC(O)C10H15) и Ph3Sb(OC(O)C10H15)2 / Д.В. Лякаев, А.В. Маркина, Е.В. Хабарова и др. // Журн. физ. химии. – 2018. – Т. 92, № 9. – С. 1384–1389. DOI 10.1134/S0044453718090170.
- Шарутин, В.В. Синтез и строение ароксидов тетрафенисурьмы Ph4SbOAr (Ar = C6H4C6H7, C6H2(Br2-2,6)(трет-Bu-4), C6H3(NO2)2-2,4, C6H2(Br2-2,6)(NO2-4)) / В.В. Шарутин, О.К. Шарутина, В.С. Сенчурин // Журн. неорг. химии. – 2017. – Т. 62, № 3. – С. 290–295. DOI: 10.7868/S0044457X17030151.
- Шарутин, В.В. Новый способ получения ароксидов хлоротрифенилсурьмы Ph3SbCl(OAr) / В.В. Шарутин, О.К. Шарутина, В.С. Сенчурин // Коорд. химия. – 2016. – Т. 42, № 1. – С. 34–38. DOI: 10.7868/S0132344X15120075.
- Новые методы синтеза арокситетраарильных производных сурьмы / В.В. Шарутин, О.К. Шарутина, П.Е. Осипов и др. // Журн. общ. химии. – 2001. – Т. 71, № 6. – С. 1045–1046.
- Синтез и строение 2,4,6-трихлорфеноксидов тетра- и трифенилсурьмы / В.В. Шарутин, О.К. Шарутина, В.С. Сенчурин и др. // Журн. общ. химии. – 2016. – Т. 86, № 1. – С. 92–99.
- Синтез и строение пентафтор- и пентахлорфеноксидов тетра- и триарилсурьмы / В.В. Шарутин, О.К. Шарутина, А.Н. Ефремов и др. // Журн. неорг. химии. – 2017. – Т. 62, № 10. – С. 1330–1336. DOI: 10.7868/S0044457X17100075.
- Арильные соединения пятивалентной сурьмы: синтез, реакции и строение / В.В. Шарутин, А.И. Поддельский, О.К. Шарутина // Коорд. химия. – 2020. – V. 46, № 10. – P. 579–648. DOI: 10.1134/S1070328420100012.
- Темникова Т.И. Курс теоретических основ органической химии / Т.И. Темникова. – Л.: Госхимиздат, 1962. – 948 с.
- Синтез и строение γ-фенилацетилацетоната тетрафенилсурьмы / В.В. Шарутин, А.П. Пакусина, О.К. Шарутина и др. // Химия и комп. модел. Бутлеровские сообщ. – 2003. – Т. 4, № 1. – С. 34–35.
- Синтез и строение γ-хлорацетилацетоната тетрафенилсурьмы / В.В. Шарутин, О.К. Шарутина, О.П. Задачина и др. // Журн. орг. химии. – 2000. – Т. 70, № 10. – С. 1672–1674.
- Синтез и строение γ-алкилацетилацетонатов тетрафенилсурьмы / В.В. Шарутин, О.К. Шарутина, О.П. Задачина и др. // Коорд. химии. – 2003. – Т. 29, № 1. – С. 8–12.
- Синтез -дикетонатов тетраарилсурьмы из пентаарилсурьмы и -дикетонов / В.В. Шару-тин, О.К. Шарутина, О.П. Задачина и др. // Журн. орг. химии. – 2000. – Т. 70, № 5. – С. 746–747.
- Кочешков, К.А. Методы элементоорганической химии. Сурьма, висмут / К.А. Кочешков, А.П. Сколдинов, Н.Н. Землянский. – М.: Наука, 1976. – 483 с.
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Display-ing Crystal Structures from Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- OLEX2: Complete Structure Solution, Refinement and Analysis Program / O.V. Dolomanov, L.J. Bourhis, R.J. Gildea et al. // J. Appl. Cryst. – 2009. – V. 42. – P. 339–341. DOI: 10.1107/S0021889808042726.
- Шарутина, О.К. Молекулярные структуры органических соединений сурьмы(V): моно-графия / О.К. Шарутина, В.В. Шарутин. – Челябинск: Издательский центр ЮУрГУ, 2012. – 395 с.

![Синтез и строение продукта реакции пента-пара-толилсурьмы с гептафторпропил(t-бутил)дикетоном-1,3 p-Tol4Sb[t-BuC(O)СHС(О)С3F7] Синтез и строение продукта реакции пента-пара-толилсурьмы с гептафторпропил(t-бутил)дикетоном-1,3 p-Tol4Sb[t-BuC(O)СHС(О)С3F7]](/file/cover/147236624/sintez-i-stroenie-produkta-reakcii-penta-para-tolilsurmy-s-geptaftorpropil.png)
