Синтез и строение Производного три-пара-толилсурьмы с гликолевой кислотой
Автор: Гущин А.В., Вахитов В.Р., Воробьев И.И., Сомов Н.В.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 1 т.17, 2025 года.
Бесплатный доступ
Взаимодействием три- пара -толилсурьмы с трет -бутилгидропероксидом и гликолевой кислотой (1:1:2) получен 2,2,2-три- пара -толил-1,3-диокса-2λ5-стиболан-4-он с выходом 75 %. Была проведена оценка его строения методами ЯМР и РСА. В отличие от описанной ранее аналогичной реакции трифенилсурьмы с пероксидом водорода и молочной кислотой, в ходе данной реакции образуется именно циклометаллическое соединение, а не соответствующий дикарбоксилат, что становится очевидным из спектральной картины, в которой отсутствует сигнал гидроксильной группы. Кристаллы C23H23O3Sb описываются ромбической группой симметрии Pbca с параметрами элементарной ячейки a = 15,01871(11), b = 15,37651(11), c = 17,04701(12) Å, Z = 8. Используя структурный параметр τ, был сделан вывод о том, что координация атома сурьмы в данном МОС близка к тригонально-бипирамидальной (по данным РСА τ = 0,77). Результаты РСА, включающие координаты атомов, длины связей и валентные углы депонированы в Кембриджский банк структурных данных (CCDC 2370604).
Три-пара-толилсурьма, гликолевая кислота, 2, 2, 2-три-пара-толил-1, 3-диокса-2λ5-стиболан-4-он, синтез, строение, ямр-спектроскопия, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147248064
IDR: 147248064 | УДК: 547.1’13+547.47 | DOI: 10.14529/chem250105
Текст научной статьи Синтез и строение Производного три-пара-толилсурьмы с гликолевой кислотой
Исследование металлоорганических соединений сурьмы(V) является активно развивающейся областью современной металлоорганической химии ввиду их широкого применения в различных сферах научной деятельности [1]. Дикарбоксилаты триарилсурьмы используются в реакциях кросс-сочетания, катализируемых палладием, для образования связей C–C [2–8], C–B [9] и C-P [10]. Также дикарбоксилаты триарилсурьмы имеют медицинское применение: они обладают антилейшманиальной [11], а некоторые салицилатные производные – противоопухолевой активностью [12, 13]. Наличие в карбоксилатном фрагменте кратных связей, способных к полимеризации, открывает новые перспективы для использования их в фотолитографии в качестве высокочувствительных УФ-резистов [14] и для получения металлосодержащих полимерных материалов [15].
Особый интерес вызывают циклометаллические производные Sb(V) с α-гидроксикислотами. Известен ряд соединений подобного строения и выявлена следующая закономерность: взаимодействие Ph 3 Sb со стерически затрудненными в α-положении оксикислотами приводит к образованию соответствующего дикарбоксилата, например, с бензиловой кислотой – Ph 3 Sb(O 2 CC(OH)Ph 2 ) 2 , в противном случае возможна циклизация [16]. Несмотря на эту закономерность, было получено и охарактеризовано дикарбоксилатное производное трифенилсурьмы с молочной кислотой – Ph 3 Sb(O 2 CCH(OH)CH 3 ) 2 [17]. Взаимодействием диалкоголятов триоргано-сурьмы с гликолевой и тиогликолевой кислотами также могут быть получены соединения строения R 3 Sb(XCH 2 C(O)O), в том числе устойчивые алкоксиды, где X = O [18], и термически нестабильные тиолаты, где X = S [19]. Циклометаллаты триарилсурьмы с гликолевой и миндальной кислотами также исследованы на предмет проявления ими антилейшманиальной активности [20], а производные хиральных гидроксикислот являются эффективными катализаторами в реакциях асимметрического гидрирования бензоксазинов и хинолинов [21].
В настоящей работе рассматривается синтез и особенности строения p -Tol 3 Sb(OCH 2 C(O)O) [2,2,2-три- пара -толил-1,3-диокса-2λ5-стиболан-4-она, или моногликолата три- пара -толилсурьмы], полученного окислением смеси три- пара -толилсурьмы и гликолевой кислоты трет -бутилгидропероксидом.
Экспериментальная часть t-BuOOH (т. кип. 133 °С) получали из коммерческого 70%-ного водного раствора: сушили над безводным MgSO4 с дальнейшей перегонкой в ловушку, охлаждаемую жидким азотом. Концентрация трет-бутилгидропероксида составила 99 %.
Синтез 2,2,2-три-пара-толил-1,3-диокса-2λ5-стиболан-4-она (1) . К раствору 0,395 г p -Tol3Sb (1 ммоль) в 5 мл диэтилового эфира добавляли 0,152 г гликолевой кислоты (2 ммоль) и 0,09 г трет -бутилгидропероксида (1 ммоль). Колбу с реакционной смесью перемешивали в течение 20 мин и оставляли в холодильнике на 24 ч. Выпавшие бесцветные кристаллы отделяли фильтрованием, промывали 2 раза петролейным эфиром, перекристаллизовывали из смеси хлороформа и петролейного эфира (1/8). Выход 75 %, т. пл. 140–146 °C. ИК-спектр (ν, см-1, таблетка KBr): 3013, 2911, 1699, 1601, 1558, 1493, 1441, 1393, 1321, 1312, 1211, 1186, 1111, 1069, 1016, 930, 799, 737,
-
704, 579, 536, 482. Спектр ЯМР 1Н (400 MHz, CDCl 3 ), δ, м. д.: 2,39 (s, 9H, C 6 H 4 -Me), 4,22 (s, 2H, CH 2 ), 7,28 (d, J = 7,8 Hz, 6H, m -C 6 H 4 ), 7.61 (d, J = 8,1 Hz, 6H, o -C 6 H 4 ). ЯМР 13C (101 MHz, CDCl 3 ), δ, м. д.: 21,67 (Me), 62,00 (CH 2 ), 130,31 ( m -C 6 H 4 ), 131,55 (Sb-C), 135,50 ( o -C 6 H 4 ), 142,42 ( p -C 6 H 4 ), 174,67 (C=O).
Спектры ЯМР 1 H и 13 C регистрировали в CDCl 3 на ЯМР-спектрометре Agilent DD2 400.
ИК-спектр соединения 1 регистрировали на приборе IR Prestige-21 (Shimadzu, Япония) в диапазоне 4000–400 см-1 в таблетке KBr, приготовленной с помощью ручного гидравлического пресса «ПГР-400».
Рентгеноструктурный анализ (РСА) проводили на автоматическом дифрактометре Rigaku XtaLab MM003 P200K (Mo K α -излучение, λ = 0,71073 Å, монохроматор MicroMax-003) при 100 К. Первичный фрагмент структуры 1 найден методом двойного пространства в программных комплексах SHELX [22] и ShelXle [23]. Параметры остальных атомов, включая атомы водорода, определены по разностному синтезу электронной плотности и уточнены по |F|2 методом наименьших квадратов. Положения водородных атомов уточнялись в основном цикле метода наименьших квадратов в изотропном приближении.
Обсуждение результатов
При взаимодействии три- пара -толилсурьмы с двумя эквивалентами гликолевой (гидроксиук-сусной) кислоты в присутствии ГПТБ был впервые синтезирован 2,2,2-три- пара -толил-1,3-диокса-2λ5-стиболан-4-он ( 1 ), вместо ожидаемого дигликолата три- пара -толилсурьмы (схема 1). Гидроксиуксусная кислота присоединяется к атому металла не только по карбоксильной, но и по гидрокси-группе, а второй эквивалент кислоты остается непрореагировавшим, что было доказано методом 1H ЯМР-спектроскопии.
Х^> /)-То1з8Ь(О2ССН2ОН)2 + /-BuOH + H2O
/i-Tol3Sb + HO2CCH2OH + r-BuOOH
24h, RT
/-BuOH + H2O
Схема 1
Ранее были опубликованы результаты реакции трифенилсурьмы с пероксидом водорода и молочной кислотой (1:1:2), в результате которой получился дилактат трифенилсурьмы [17]. Вероятно, изменение направления реакции связано с различием окислителя и растворителя (дилактат получался в смешанном растворителе эфир/изопропиловый спирт, пероксид водорода содержал 58,7% воды, молочная кислота содержала 13 % воды).
В 1H ЯМР-спектре соединения 1 в области слабого поля (7,28–7,61 м. д.) находятся дублетные сигналы протонов ароматических колец (C 6 H 4 ) и два сигнала протонов, выходящих синглетами на 4,22 и 2,39 м. д., соответствующих метиленовому фрагменту в карбоксилатном заместителе и метильной группе у ароматического кольца в пара -положении к атому сурьмы, соответственно. В спектре отсутствует сигнал гидроксильной группы, что свидетельствует о невозможности протекании реакции по первому пути с образованием дикарбоксилата (схема 1).
В 13C ЯМР-спектре исследуемого соединения число сигналов совпадает с числом различных видов углеродных атомов, порядок уменьшения химических сдвигов атомов углерода в пара -толильных группах при атоме Sb o -C 6 H 4 > m -C 6 H 4 согласуется с протонным спектром. Малоинтенсивный сигнал атома углерода при атоме сурьмы выходит синглетом на 131,55 м. д., остальные сигналы углеродных атомов можно интерпретировать однозначно. Подробное описание 1H и 13C ЯМР-спектров приведено в экспериментальной части работы.
Для соединения 1 были выращены бесцветные монокристаллы размером 0,700×0,600×0,270 мм и был проведен их рентгеноструктурный анализ (рис. 1). По данным РСА, валентный угол φ(O2SbC3) имеет значение 168°, что близко к 180° и характерно для тригональной бипирамиды. Также характерной чертой тригонально-бипирамидальной конфигурации является тот факт, что сумма углов C17SbC10, O1SbC10 и O1SbC17 в экваториальной плоскости близка к 360° (см. таблицу).
Основные межатомные расстояния (Å) и валентные углы (град) в соединении 1
|
Межатомные расстояния |
Валентные углы |
||||
|
Связь |
d, Å |
Угол |
φ, град |
Угол |
φ, град |
|
Sb–C3 |
2,1295(15) |
O2SbC3 |
168,32(5) |
O1SbC3 |
89,44(5) |
|
Sb–C10 |
2,1078(15) |
C17SbC10 |
114,87(6) |
C3SbC10 |
99,90(6) |
|
Sb–C17 |
2,1027(15) |
O1SbC10 |
122,05(6) |
C3SbC17 |
99,05(6) |
|
Sb–O1 |
1,9671(11) |
O1SbC17 |
119,81(6) |
O2SbC10 |
86,34(5) |
|
Sb–O2 |
2,1397(11) |
O1SbO2 |
78,88(5) |
O2SbC17 |
87,07(5) |
Данное металлоорганическо е соединение описывается координационным числом, равным 5, следовательно, о способе коорди нации атома металла можно судить, проана лизировав структу рный параметр τ [24 ], который определяется как ( α – β)/60, где α и β – величины двух наибольших углов между заместителями при атоме Sb ( α > β). Для идеальной тетрагональной пирамиды τ = 0 (α = β), а в случае идеальной тригональной бипирамиды τ = 1 (аксиальный угол α = 180°, экваториальный β = 120°). Для сое динения 1 параметр τ = 0,77. В соответствии с этим, координацион ное окружение атома сурьмы в данном соединении ближе к тригонально -бипирамидальному, чем к тетрагонально- пирамидальному (рис. 2). Остальные углы, расположенные не в экваториальной плоскости бипирамиды, имеют значения, близкие к 90°.
Тригонально- бипирамидальн ую координацию атома сурьмы также подтв ерждает расчет ст е пени подобия координационного полиэдра тригональной бипирамиде Ф Δ = 0,45691(18) и тетрагональной пирамиде Ф □ = 0,23407(17) [ 25]. Степень искажения распределения электронной плотно сти координационного окружен ия атома сурьмы, рассчитанная для тригона льной бипирамиды, составила η Δ [ρ(x)]= 0,578( 1), это свидетельствует, что примерно на 76 % распределения элек тронной плотности соответствует и деализированной тригонально-бипирамидальной конфигурации [26].
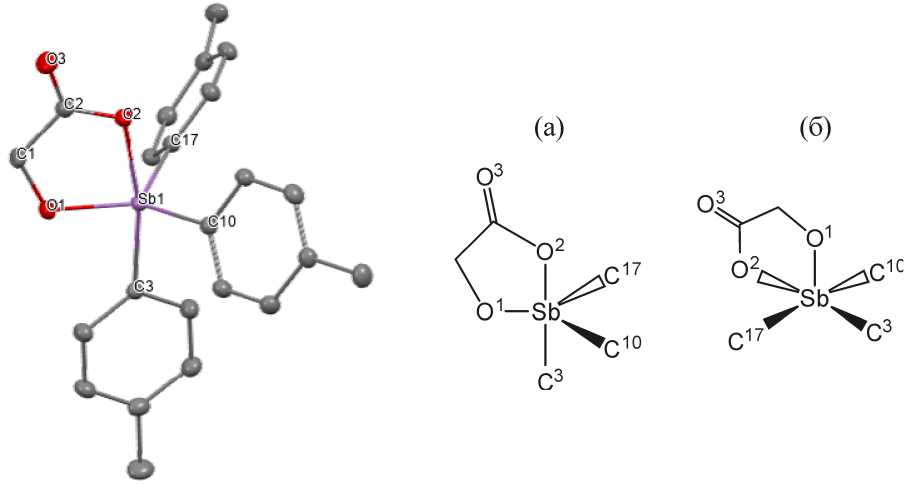
Рис. 1. Кристаллическая структура соединения 1 Рис. 2. Фрагмент структуры соединения 1
с конфигурацией тригональной бипирамиды (а) и тетрагональной пирамиды (б)
Заключение
Установлено, что взаимодействие три - пара -толилсурьмы с гликолевой кислотой в присутствии трет - бутилгидропероксида приводит к образованию 2,2,2 -три- пара -толил-1,3-диокса-2λ5-стиболан-4-она ( 1), а не к дигли колату, в отличие от известной реакции с ис пользованием H 2 O 2 . По данным РСА координация ат ома сурьмы в исследуемом соединении бли же к структуре тр и гональной бипирамиды, чем к тетрагональной пирамиде.


