Синтез и строение сольвата бис[3,5-динитробензоата] трис(2-метокси)(5-бром)фенилсурьмы [C6H3(2-OMe)(5-Br)]3Sb[OC(O)C6H3(NO2)2-3,5]2 • PhH • 1/2 C8H18
Автор: Тарасова Н.М.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 1 т.16, 2024 года.
Бесплатный доступ
Бис[3,5-динитробензоат] трис(2-метокси)(5-бром)фенилсурьмы (1) получен методом окислительного присоединения из 3,5-динитробензойной кислоты и триарилсурьмы в присутствии гидропероксида третичного бутила в эфире и выделен после перекристаллизации из смеси бензол-октан в виде кристаллосольвата с молекулами бензола и октана в кристаллической решетке. Строение сольвата 1 установлено с применением ИК-спектроскопии и метода рентгеноструктурного анализа (РСА). В ИК-спектре комплекса 1, кроме полос поглощения, относящихся к валентным колебаниям Sb-C, СAr-О-Ме и карбонильных групп, присутствуют полосы, соответствующие валентным колебаниям связей С-Br (524 и 555 см-1). Из данных РСА следует, что атомы сурьмы в комплексе 1 имеют координацию искаженной тригональной бипирамиды с карбоксилатными лигандами в аксиальном положении. Атом сурьмы и два атома кислорода не лежат на одной прямой и располагаются таким образом, что угол OSbO составляет 170,79°. Расстояния O…Sb (2,134(4) и 2,110(5) Å) близки к сумме ковалентных радиусов сурьмы и кислорода. Кроме того, согласно результатам РСА соединение 1 кристаллизуется в моноклинной сингонии, пространственная группа P21/n. Структурная организация в кристалле формируется за счет коротких контактов атомов кислорода в составе нитрогрупп карбоксилатных лигандов с атомами углерода и брома арильных лигандов соседних молекул, а также водородных O…H (2,524-2,715 Å) связей. Кроме того, определенный вклад в формирование кристаллической структуры вносит p-p стекинг между ароматическими кольцами кристаллизационного бензола и метокси-бром-фенильными лигандами. Ароматические кольца смещены относительно друг друга, и расстояние между ними составляет 3,367 Å. Согласно данным термоанализа сольвата 1 его температура плавления составляет 172,6 °С. Однако дальнейшее повышение температуры сопровождается разложением соединения 1, в связи с чем на ДСК кривой наблюдается экзотермический пик при 255,7 °С, соответствующий потере массы 31 % по данным ТГА. Полные таблицы координат атомов, длин связей и валентных углов соединения 1 депонированы в Кембриджском банке структурных данных (CCDC 2060562; deposit@ccdc.cam.ac.uk; http://www.ccdc.cam.ac.uk).
Синтез, дикарбоксилат трис(2-метокси-5-бромфенил)сурьмы, дта, особенности строения, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147243270
IDR: 147243270 | УДК: 546.865+547.53.024+548.312.5 | DOI: 10.14529/chem240102
Текст научной статьи Синтез и строение сольвата бис[3,5-динитробензоата] трис(2-метокси)(5-бром)фенилсурьмы [C6H3(2-OMe)(5-Br)]3Sb[OC(O)C6H3(NO2)2-3,5]2 • PhH • 1/2 C8H18
Аннотация. Бис[3,5-динитробензоат] трис(2-метокси)(5-бром)фенилсурьмы (1) получен методом окислительного присоединения из 3,5-динитробензойной кислоты и триарилсурьмы в присутствии гидропероксида третичного бутила в эфире и выделен после перекристаллизации из смеси бензол-октан в виде кристаллосольвата с молекулами бензола и октана в кристаллической решетке. Строение сольвата 1 установлено с применением ИК-спектроскопии и метода рентгеноструктурного анализа (РСА). В ИК-спектре комплекса 1, кроме полос поглощения, относящихся к валентным колебаниям Sb-C, СAr–О–Ме и карбонильных групп, присутствуют полосы, соответствующие валентным колебаниям связей С–Br (524 и 555 см–1). Из данных РСА следует, что атомы сурьмы в комплексе 1 имеют координацию искаженной тригональной бипирамиды с карбоксилатными лигандами в аксиальном положении. Атом сурьмы и два атома кислорода не лежат на одной прямой и располагаются таким образом, что угол OSbO составляет 170,79°. Расстояния O…Sb (2,134(4) и 2,110(5) Å) близки к сумме ковалентных радиусов сурьмы и кислорода. Кроме того, согласно результатам РСА соединение 1 кристаллизуется в моноклинной сингонии, пространственная группа P21/n. Структурная организация в кристалле формируется за счет коротких контактов атомов кислорода в составе нитрогрупп карбоксилатных лигандов с атомами углерода и брома арильных лигандов соседних молекул, а также водородных O…H (2,524–2,715 Å) связей. Кроме того, определенный вклад в формирование кристаллической структуры вносит л-л сте-кинг между ароматическими кольцами кристаллизационного бензола и метокси-бром-фенильными лигандами. Ароматические кольца смещены относительно друг друга, и расстояние между ними составляет 3,367 Å. Согласно данным термоанализа сольвата 1 его температура плавления составляет 172,6 °С. Однако дальнейшее повышение температуры сопровождается разложением соединения 1, в связи с чем на ДСК кривой наблюдается экзотермический пик при 255,7 °С, соответствующий потере массы 31 % по данным ТГА. Полные таблицы координат атомов, длин связей и валентных углов соединения 1 депонированы в Кембриджском банке структурных данных (CCDC 2060562; ; .
Abstract. Tris(2-methoxy)(5-bromo)phenylantimony bis[3,5-dinitrobenzoate] (1) was obtained from 3,5-dinitrobenzoic acid by oxidative addition to triarylantimony in the presence of tertiary butyl hydroperoxide in ether, and was isolated by recrystallization from a benzene-octane mixture in the form of a crystal solvate with benzene and octane molecules in its crystal lattice. The structure of solvate 1 was established by the IR spectroscopy and X-ray diffraction analysis (XRD). In the IR spectrum of complex 1, in addition to the absorption bands related to the stretching vibrations of the Sb–C, СAr–О– Ме, and carbonyl groups, there are bands corresponding to the stretching vibrations of the C–Br bonds (524 and 555 cm–1). The X-ray diffraction data show that the antimony atoms in complex 1 have a distorted trigonal bipyramid coordination with carboxylate ligands in the axial position. The antimony atom and two oxygen atoms do not lie on the same straight line and are located in such a way that the OSbO angle is 170.79°. The distances (2.134(4) and 2.110(5) A) are close to the sum of the covalent radii of antimony and oxygen. In addition, according to the X-ray diffraction data, compound 1 crystallizes in the monoclinic crystal system, space group P21/n. The structural organization in the crystal is formed due to short contacts of oxygen atoms in the nitro groups of the carboxylate ligands with carbon and bromine atoms of the aryl ligands of neighboring molecules, as well as hydrogen O...H (2.524– 2.715 Å) bonds. In addition, a certain contribution to the formation of the crystal structure is made by the π-π stacking between the aromatic rings of crystallization benzene and the methoxy-bromo-phenyl ligands. The aromatic rings are displaced in relation to each other and the distance between them is 3.367 Å. Melting point of solvate 1 is 172.6 °C, according to the thermal analysis data. However, further increase in temperature is accompanied by decomposition of compound 1, and therefore an exothermic peak is observed on the DSC curve at 255.7 °C, corresponding to a mass loss of 31 % according to the TGA data. Complete tables of atom coordinates, bond lengths, and valence angles are deposited at the Cambridge Crystallographic Data Center (No. 2060562, or
Интерес к синтезу новых соединений сурьмы во многом определяется расширяющимся потенциалом различных областей применения в практической деятельности: в фармацевтической промышленности, в качестве биоцидов, фунгицидов, а также реагентов в тонком органическом синтезе и компонентов каталитических систем при полимеризации, антиоксидантов и др. [1].
Известно, что взаимодействие три- пара -толилсурьмы с трифторуксусной, трихлоруксусной, йодуксусной, толуолсульфоновой кислотами (НХ) в растворе толуола в присутствии или отсутствии кислорода воздуха приводит к образованию дикарбоксилатов триарилсурьмы по двум конкурирующим между собой направлениям с образованием производных пятивалентной сурьмы общей формулы p-Tol 3 SbХ 2 (Х – остаток карбоновой кислоты) [2].
p-TolgSb + 2HX P-T0I3SDX2
p-Tol3Sb + 2HX + 1/2O2----► p-Tol3SbX2
-H20
В основе другого эффективного способа синтеза соединений пятивалентной сурьмы лежит другая реакция окислительного присоединения, когда из триарильных соединений сурьмы, кислоты НХ и пероксида получают арильные производные пятивалентной сурьмы Ar 3 SbX 2 . Указанная реакция впервые была осуществлена на примере синтеза диацетата трифенилсурьмы из трифенилсурьмы, уксусной кислоты и пероксида водорода [3]. Именно по этой схеме были синтезированы бис- (1-адамантанкарбоксилат) трифенилсурьмы [4], бис- (бромацетат) трис (2-метокси-5-бромфенил)сурьмы [5], бис- (2-нитробензоат) трифенилсурьмы [6], бис-(1-адамантанкарбоксилат) три- м -толилсурьмы [7], бис (циклопропанкарбоксилат) трис (5-бром-2-метоксифенил)сурьмы [8], дибензоат трис (4-N,N-диметиламинофенил)сурьмы [9], бис- (2-метилбензоат) трис (4-N,N-диметиламинофенил)сурьмы [10], бис- (4-метилбензоат) трис- (4-N,N-диметиламинофенил)сурьмы [11], бис- (2-нитробензоат) трис -(5-бром-2-метоксифенил)сурьмы [12], бис- (хлорацетат) трис- (5-бром-2-метоксифенил)сурьмы, бис- (бромацетат) трис- (5-бром-2-метоксифенил)сурьмы и бис- (иодацетат) трис- (5-бром-2-метоксифенил)сурьмы [13], бис- (4-нитрофенилацетат) трис- (5-бром-2-метоксифенил)сурьмы, бис- (2-метоксибензоат) трис- (5-бром-2-метоксифенил)сурьмы и бис- (фенилпропиолат) трис- (5-бром-2-метоксифенил)сурьмы [14], бис- (4-оксибензолсульфонат) трифенилсурьмы [15]. Серия α -гидроксикарбоксилатных комплексов трифенилсурьмы синтезирована по реакции окислительного присоединения из трифе-нилсурьмы, карбоновой кислоты и гидроперекиси третичного бутила [16].
n RR'C(OH)-COOH
Ph3Sb + 2 t-BuOOH----► Ph3Sb(OH)2 -------*- Ph3Sb(RR'C(OH)-COO)n
-2t-BuOH -nH2O r = r1 = h, n = 1
R = Ph, R' = H, n = 1
R = Ph, R' = H, n = 2
R = R' = Ph, n = 2
Отметим, что, несмотря на наличие двух карбоксильных групп в орто- фталевой кислоте, ее взаимодействие с трифенилсурьмой в присутствии пероксида водорода протекает по классической схеме реакции окислительного присоединения [17]. Особенностью молекулярной структуры дифталата трифенилсурьмы является отсутствие внутримолекулярной водородной связи, характерной для орто- фталевой кислоты.
По аналогичной схеме образуются бис- (4-оксибензоат) трифенилсурьмы [18], бис- (пропиолат) трифенилсурьмы [19], бис- (иодацетат) трис- (4-фторфенил)сурьмы и бис- (пентафторбензоат) трис- (4-фторфенил)сурьмы [20], бис- (1-адамантанкарбоксилат) трис- (4-фторфенил)сурьмы и бис- (циклопропанкарбоксилат) трис- (4-фторфенил)сурьмы [21], бис- (хлорацетат) трис (4-фторфенил)сурьмы, бис- (4-нитрофенилацетат) трис- (4-фторфенил)сурьмы и дибензоат трис- (4-фторфенил)сурьмы [22], дикарбоксилаты трис- (3-фторфенил)сурьмы [23, 24], диакрилаты трифенилсурьмы [25, 26], дибензоат три( мета -толил)сурьмы [27], бис (2-нитробензоат) три(3-фторфенил)сурьмы [28], бис (фенилпропиолат) трифенилсурьмы [29], бис (4-оксибензоат) трифенилсурьмы [30], бис (3-фторфенилацетат), бис (пентафторбензоат) и бис (2,3-дифторбензоат) трис- (3-фторфенил)сурьмы [31].
При взаимодействии эквимолярных количеств триарилсурьмы, кислоты НХ и пероксида водорода в эфире образуются соединения сурьмы мостикового типа (Ar 3 SbX) 2 O, что, например, наблюдается в реакциях трифенилсурьмы с салициловой кислотой, когда с выходом 40 % образуется мостиковое соединение сурьмы, обладающее противоопухолевой активностью [32]. В аналогичных условиях из трифенилсурьмы и пропиоловой кислоты в присутствии пероксида водорода образуется μ 2 -оксо- бис [(пропиолато)трифенилсурьма] [Ph 3 SbOC(O)C≡СН] 2 O.
Взаимодействием трифенилсурьмы с 6,6,6-трифтор-2,2-диметилгександионом-3,5 в присутствии пероксида водорода в эфире синтезирован комплекс (6,6,6-трифтор-3-гексанон-5,5-диолато)трифенилсурьма [33].
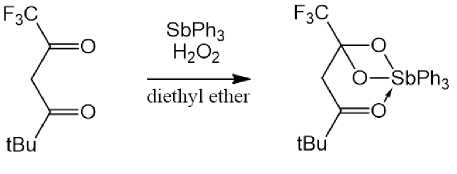
Дикарбоксилаты триарилсурьмы, содержащие в арильных лигандах при атоме сурьмы различные функциональные группы [8, 14, 34 - 41], изучены в гораздо меньшей степени, чем соответствующие фенильные производные, однако именно некоторые их представители проявляют ан-тилейшманиозные свойства [41], поэтому исследование синтеза и свойств подобных соединений представляется важной задачей.
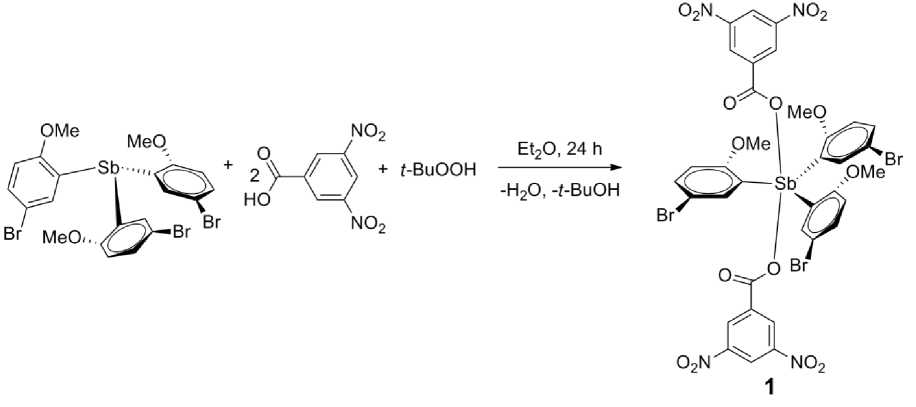
В настоящей работе изучены синтез и особенности строения сольвата бис (3,5-динитробензоата) трис [(2-метокси)(5-бром)фенил]сурьмы с бензолом и октаном [C 6 H 3 (2-OMe)(5-Br)] 3 Sb[OC(O)C 6 H 3 (NO 2 ) 2 -3,5] 2 ∙ PhH ∙ ½ C 8 H 18 ( 1 ).
Экспериментальная часть
Соединение 1 синтезировали по методике, описанной в [1], из триарилсурьмы и 3,5-динитробензойной кислоты в присутствии трет -бутилгидропероксида в растворе эфира (мольное соотношение исходных реагентов 1:2:1). После удаления растворителя и перекристаллизации целевого продукта из смеси бензол-октан (1:2 объем.) получали с выходом 86 % бесцветные кристаллы 1 (т. пл. 172,6 °С), которые анализировали методами элементного анализа, РСА и ИК-спектроскопии. ИК-спектр, ν , см–1: 3098, 1678, 1543, 1474, 1439, 1342, 1284, 1254, 1049, 1014, 810, 725, 555, 524, 443. Найдено, %: С 40,24; Н 2,15. C 45 H 39 Br 3 N 4 O 15 Sb. Вычислено, %: С 38,11; Н 2,28.
ИК-спектр соединения записывали на ИК-Фурье спектрометре Shimadzu IRAffinity-1S, образец готовили таблетированием с KBr (область поглощения 4000 - 400 см - 1).
Температура плавления измерена на синхронном термоанализаторе Netzsch 449C Jupiter. Элементный анализ проводился на анализаторе Euro EA3028-НТ
Рентгеноструктурный анализ проводили на автоматическом четырехкружном дифрактометре Bruker D8 QUEST (Mo K α -излучение, λ = 0,71073 Å, графитовый монохроматор). Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT-Plus [42]. Все расчеты по определению и уточнению структуры выполнены по программам SHELXL/PC [43] и OLEX2 [44]. Структура определена прямым методом и уточнена методом наименьших квадратов в анизотропном приближении для неводородных атомов. Кристаллографические данные и результаты уточнения структуры приведены в таблице.
Таблица
Кристаллографические данные, параметры эксперимента и уточнения структуры 1
|
Параметр |
1 |
|
Формула |
C 45 H 39 Br 3 N 4 O 15 Sb |
|
М |
1237,28 |
|
Сингония |
Моноклинная |
|
Пр. группа |
P2 1 /n |
|
a , Å |
12,444(10) |
|
b, Å |
31,104(19) |
|
c, Å |
14,028(8) |
|
α, град. |
90 |
|
β, град. |
114,23(3) |
|
γ, град. |
90 |
|
V , Å3 |
4951(6) |
|
Z |
4 |
|
ρ (выч.), г/см3 |
1,660 |
|
µ , мм–1 |
3,048 |
|
F (000) |
2452,0 |
|
Размер кристалла, мм |
0,38 × 0,21 × 0,14 |
Окончание таблицы
|
П а ра м е тр |
1 |
|
О б л асть с бора да н ных по 2 9 , град. |
6,268–47,864 |
|
И нт ерв ал ы и ндекс ов отражений |
–14 ≤ h ≤ 14, –35 ≤ k ≤ 35, –15 ≤ l ≤ 15 |
|
И з м е ре но отра ж е ни й |
74018 |
|
Независимых о т раж ени й |
7606 |
|
П е ре м е нных у точ не н ия |
618 |
|
GOOF |
1,182 |
|
R -факторы по F 2 > 2 о ( F 2) |
R 1 = 0,0528, wR 2 = 0,1085 |
|
R -ф а к торы по в с е м отра ж е н иям |
R 1 = 0,0630, wR 2 = 0,1124 |
|
Остаточная э л е ктрон на я плотн ос ть ( m in /m a x ), e /Å3 |
0,75/–1,11 |
Полные таблицы координат атомов, длин связей и валентных углов соединения 1 депонированы в Кембриджском банке структурных данных (CCDC 2060562; ; .
Обсуждение результатов
Соединение 1 был о п олу че н о ок и с ли т е льн ым п рис ое д и н е н ие м 3, 5-динитробензойной кислоты к трис (5-бром)-3-мет ок с и фенил)сурьме в присутствии гидропероксида тре ти чн ого б у ти ла (2:1 :1 мол ьн . ) и к ри с талл и з ов а л ос ь и з с мес и б е н зо л -октан в виде сольвата с бензолом и октаном.
В ИК- с п е к тра х к омп л е к са 1 наблюдаются характерные для данного типа соединений полосы [45, 46]. Так, при 443 см–1 р а с полагается полоса средней интенсивности, отн ос ящ а яс я к к олеб аниям связи Sb-C. В а ле н тн ым колебаниям карбонильных групп соответствуе т интенсивная полоса при 1678 см–1 . В ы с окой интенс ивностью обладают полосы, соответствующи е с ке ле тн ым к ол е бан и ям а рома ти че ск и х колец п ри 725, 810, 1439 , 147 4 с м–1 и связей С Ar –Н при 3098 см–1. Колебаниям v (СAr-О-Ме) в ИК-сп е к тре 1 соответствуют интенсивные полосы при 1014, 1049, 1254 и 1284 см–1. П о ло с ы средн ей интен сивн о ст и пр и 5 24 и 55 5 см–1 можно отнести к валентным колебаниям связей С–Br. Индивидуаль но й о собен нос т ью ИК-спектров соединения 1 является налич ие о чень интенсивн ых пол ос по гл ощения , свя з анн ых с кол е бания ми NO 2 -групп при 1342 и 1543 см–1.
Молекула бис (3,5-д и н итробе н з оата) трис [(2-метокси)(5-бром)фенил]сурьмы имеет координ аци ю и с ка ж е н н ой три г он а льн ой б и п и р а ми д ы (рис. 1). Аксиальный угол OSbO составляет 170,79 ° . Расстояния O...Sb в 2, 134( 4) и 2, 110( 5 ) А незначительно превышают сумму соответств у ю щих к ов а ле н тн ых рад и у с ов ( 2, 05 Å). Арильные лиганды находятся в пропеллерной конформаци и , ра зв ора чи в а яс ь о тн ос ительно экваториальной плоскости в силу стерических причин. С у ммы у глов C S bC в эк в а тори а л ьной п лоск ос т и моле к у л сос та в ляют 359,87 ° . Длины связей C(11)–Sb(1) и C(21)– S b ( 1) отли ча ютс я не значи т ель н о 2, 107(6) и 2, 121(6) Å.
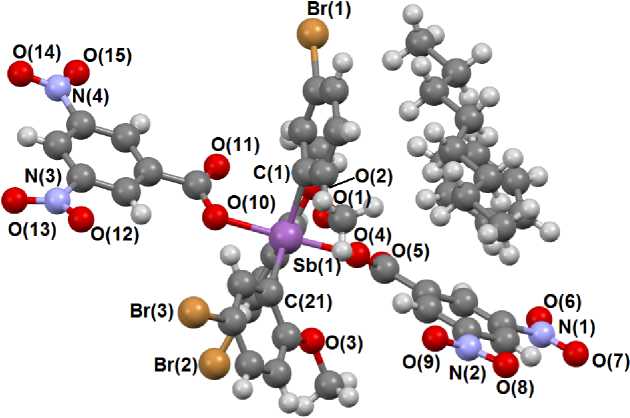
Рис. 1. Строение сольвата [C 6 H 3 (2-OMe)(5-Br)] 3 Sb[OC(O)C 6 H 3 (NO 2 ) 2 -3,5] 2 ∙ PhH ∙ ½ C 8 H 18 (1)
С тру к ту рн а я орга н и за ц и я в кристалле формируется за счет коротких ко н т ак тов O(8)…Br(1) (3,009 A), O(12)…C(1 4) (3, 189 Å) , O(12)…C(32) (3,103 Å) и водородных O…H (2,524–2,715 Å) связей ( ри с . 2) . Т а кже след у е т у к а за ть н а у ча с ти е п - п -стекинга между ароматическими кольцами сольв а тн ог о ра с тв ори т е л я и ме ток с и-бром-фенильного лиганда в образовании кристаллической струк ту ры, пл ос к ос ти а р ома ти ческих колец в которой несколько смещены д ру г отн ос и те льн о дру га п ри расс тояни и межд у н и ми [ С ( 46 ) –С(56)] в 3,367 Å (рис. 3).
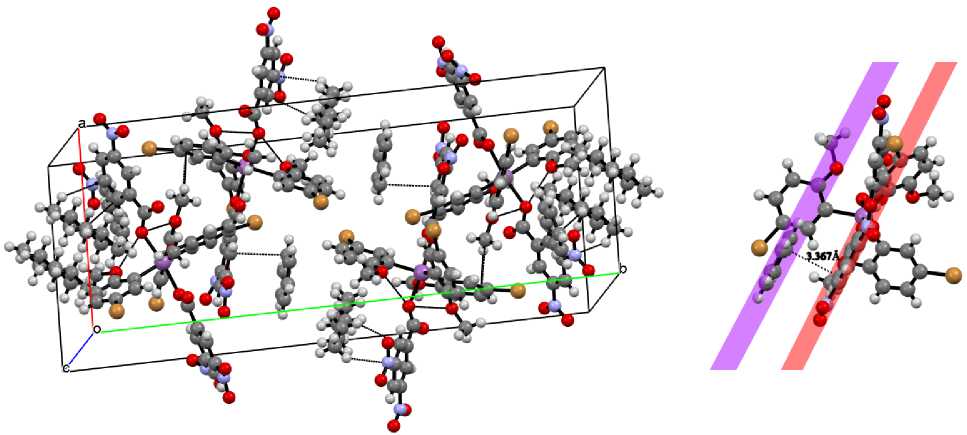
Рис. 2. Вид кристаллической ячейки сольвата 1 вдоль оси с
Рис. 3. Формирование π - π -стекинговых взаимодействий в кристалле сольвата 1
Да н н ые те рми чес к о го а н а ли за показывают наличие эндотермического пика на кривой ДСК при температуре 172,6 °С, отв е чающего температуре плавления комплекс а ( ри с . 4). Отметим так ж е э н д отерми че ск и й п и к п ри 2 24, 2 °С и соответствующий разложению комплекса 1 экзотермический пик при 255,7 ° С.
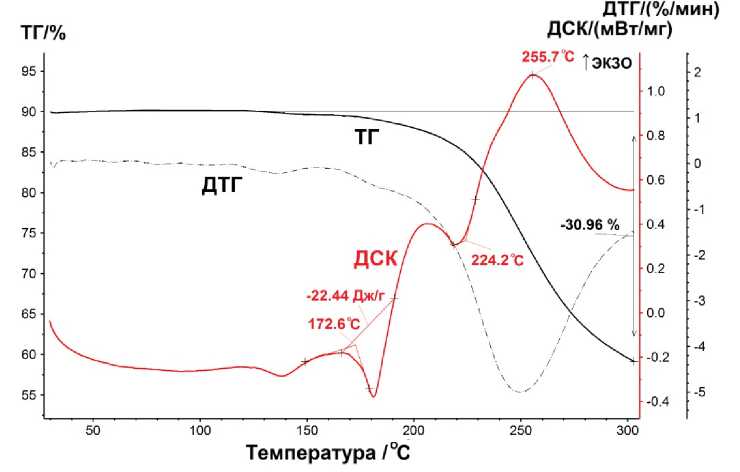
Рис. 4. Кривые ТГ-ДТГ-ДСК сольвата [C 6 H 3 (2-OMe)(5-Br)] 3 Sb[OC(O)C 6 H 3 (NO 2 ) 2 -3,5] 2 ∙ PhH ∙ ½ C 8 H 18 1
Заключение
Таким образом, по реакции окислительного присоединения из трис [(2-метокси)(5-бром)фенил]сурьмы, 3,5-динитробензойной кислоты и трет -бутилгидропероксида при мольном соотношении 1:2:1 в эфире получен бис (3,5-динитробензоат) трис [(2-метокси)(5-бром)фенил]сурьмы, строение которого после перекристаллизации из смеси бензол-октан доказано методами ИК-спектроскопии и рентгеноструктурного анализа. Атомы сурьмы в молекулах 1 имеют искаженную тригонально-бипирамидальную конфигурацию с атомами кислорода в аксиальных положениях.
Список литературы Синтез и строение сольвата бис[3,5-динитробензоата] трис(2-метокси)(5-бром)фенилсурьмы [C6H3(2-OMe)(5-Br)]3Sb[OC(O)C6H3(NO2)2-3,5]2 • PhH • 1/2 C8H18
- Шарутин В.В., Поддельский А.И., Шарутина О.К. // Коорд. химия. 2020. Т. 46, № 10. С. 579. DOI: 10.31857/S0132344X20100011
- Sharutin V.V., Senchurin V.S., Sharutina O.K., KazakovM.V. // Russ. J. Gen. Chem. 2012. V. 82, No 1. P. 95. DOI: 10.1134/S1070363212010161.
- Thepe T.C., Garascia R.J., Selvoski M.A., Patel A.N. // Ohio J. Sci. 1977. V. 77. P. 134. http://hdl.handle.net/1811/22448.
- Sharutin V.V., Sharutina O.K., Pakusina A.P. et al. // Russ. J. Inorg. Chem. 2008. V. 53, No 8. P. 1242. DOI: 10.1134/S0036023608080160.
- Artem'eva E.V., Sharutin V.V., Sharutina O.K., Bulanova A.V. // Russ. J. Inorg. Chem. 2020. V. 65, No 1. P. 22. DOI: 10.1134/S00360236200100.
- Шарутин В.В., Сенчурин В.С., Шарутина О.К. // Бутлеровские сообщения. 2010. Т. 22, № 12. C. 7. EDN: NCYMUX.
- Sharutin V.V., Sharutina O.K., Senchurin V.S. et al. // Russ. J. Inorg. Chem. 2011. V. 56, No 7. P. 1060. DOI: 10.1134/S0036023611070242.
- Sharutin V.V., Sharutina O.K., Senchurin V.S. Chagarova O.V. // Russ. J. Gen. Chem. 2012. V. 82, No 10. P. 1665. DOI: 10.1134/S1070363212100064.
- Sharutin V.V., Senchurin V.S., Sharutina O.K. et al.// Russ. J. Gen. Chem. 2008. V. 78, No 12. P. 2344. DOI: 10.1134/S1070363208120098.
- Sharutin V.V., Senchurin V.S., Sharutina O.K., Chagarova O.V. // Russ. J. Inorg. Chem. 2011. V. 56, No 7. P. DOI: 1064 10.1134/S0036023611070254.
- Sharutin V.V., Senchurin V.S., Sharutina O.K., Chagarova O.V. // Russ. J. Gen. Chem. 2011. V. 81, No 11. P. 2242 DOI: 10.1134/S1070363211110053.
- Sharutin V.V., Senchurin V.S., Sharutina O.K., et al. // Russ. J. Coord. Chem. 2011. V. 37, No 10. P. 781. DOI: 10.1134/S1070328411090089.
- Sharutin V.V.,Sharutina O.K., Tolstoguzov D.S. // Russ. J. Gen. Chem. 2014. V. 84, No 9. P. 1754. DOI: 10.1134/S1070363214090199.
- Sharutin V.V.,Sharutina O.K., Senchurin V.S. // Russ. J. Inorg. Chem. 2014. V. 59. No 4. P. 326. DOI: 10.1134/S0036023614040202.
- Sharutin V.V.,Egorova I.V., Pakusina A.P. et al. // Russ. J. Coord. Chem. 2007. V. 33, No 3. P. 168. DOI: 10.1134/S1070328407030037.
- Duffin R.N., Blair V.L., Kedzierski L., Andrews P.C. // Dalton Trans. 2018. V. 47. P. 971. DOI: 10.1039/C7DT04171C.
- Sharutin V.V., Sharutina O.K., Senchurin V.S. // Russ. J. Inorg. Chem. 2014. V. 59, No 9. P. 947. DOI: 10.1134/S0036023614090162.
- H. Barucki, S.J. Coles, J.F. Costello et al. // J. Chem. Soc., Dalton Trans., 2000. P. 2319. DOI: 10.1039/B002337J.
- Sharutin V.V., Sharutina O.K., Senchurin V.S. // Russ. J. Coord. Chem. 2014. V. 40, No 2. P. 109. DOI: 10.1134/S1070328414020109.
- Sharutin V.V., Sharutina O.K. // Russ. Chem. Bull. 2017. V. 66, No 4. P. 707. DOI: 10.1007/s11172-017-1796-6.
- Sharutin V.V., Sharutina O.K., Efremov A.N. // Russ. J. Inorg. Chem. 2016. V. 61, No 1. P. 43. DOI: 10.1134/S003602361601023X.
- Sharutin V.V., Sharutina O.K. // Russ. J. Gen. Chem. 2016. V. 86, No 8. P. 1902. DOI: 10.1134/S107036321608020X
- Sharutin V.V., Sharutina O.K., Efremov A.N. et al. // Russ. J. Coord. Chem. 2018. V. 44, No 10. P. 635. DOI: 10.1134/S107032841810010X.
- Sharutin V.V., Sharutina O.K., Reshetnikova R.V. et al. // Russ. J. Inorg. Chem. 2017. V. 62, No 11. P. 1450. DOI: 10.1134/S003602361711016X.
- Гущин А.В., Прыткова Л.К., Шашкин Д.В. и др. // Вестник Нижегородского университета им. Н.И. Лобачевского. 2010. № 1. С. 95.
- Fukin G.K., Samsonov M.A., Arapova A.V. et al. // J. Solid State Chem. 2017. V. 254. P. 32. DOI: 10.1016/j.jssc.2017.06.030.
- Sharutin V.V., Sharutina O.K., Kazakov M.V. // Russ. J. Inorg. Chem. 2014. V. 59, No 10. P. 1115. DOI: 10.1134/S0036023614100167.
- Шарутин В.В., Шарутина О.К., Ефремов А.Н. и др. // Журн. неорган. химии. 2018. Т. 63, № 2. С. 164. DOI: 10.7868/S0044457X1802006X.
- Шарутин В.В., Шарутина О.К., Котляров А.Р. // Журн. неорган. химии. 2015. Т. 60, № 4. С. 525. DOI: 10.7868/S0044457X15040236.
- Шарутин В.В., Шарутина О.К., Сенчурин В.С. // Журн. неорган. химии. 2014. Т. 59, № 9. С. 1182. DOI: 0.7868/S0044457X14090189.
- Шарутин В.В., Шарутина О.К., Жеребцов Д.А. и др. // Коорд. химия. 2022. Т. 48, № 4. С. 223. DOI: 10.31857/S0132344X2204003X.
- Polychronis N.M., Banti C.N., Raptopoulou C.P. et al. // Inorg. Chim. Acta. 2019. V. 489. P. 39. DOI: 10.1016/j.ica.2019.02.004.
- Sharutin V.V., Pakusina A.P., Sharutina O.K., Pochekutova T.S. // Russ. J. Inorg. Chem. 2008. V. 53, No 11. P. 1737. DOI: 10.1134/S0036023608110119.
- Шарутин В.В., Шарутина О.К. // Журн. неорган. химии. 2021. Т. 66, № 3. С. 358. DOI: 10.31857/S0044457X21030156.
- Sharutina O.K., Sharutin V.V., Artem'eva E.V. et al. // J. Fluor. Chem. 2019. V. 228. P. 109393. DOI: 10.1016/j.jfluchem.2019.109393.
- Шарутин В.В., Шарутина О.К., Хайбуллина O.A. // Журн. общ. химии. 2021. Т. 91, № 9. С. 1446. DOI: 10.31857/S0044460X2109016X.
- Артемьеваa Е.В., Шарутина О.К., Шарутинa В.В. и др. // Журн. неорган. химии 2020. Т. 65, № 1. С. 25. DOI: 10.31857/S0044457X20010031.
- Sharutin V.V., Senchurin V.S., Sharutina O.K. et al. // Russ. J. Coord. Chem. 2011. V. 37, No 10. С. 781. DOI: 10.1134/S1070328411090089
- Артемьева Е.В., Шарутин В.В., Шарутина О.К. // Журн. неорган. химии. 2019. Т. 64, № 11. С. 1184. DOI: 10.1134/S0044457X19110035.
- Шарутин В.В., Шарутина О.К., Толстогузов Д.С. // Журн. общ. химии. 2014. Т. 84, № 9. С. 1516. EDN: SKCTUP.
- Artem'eva E.V., Efremov A.N., Sharutina O.K. et al. // Polyhedron. 2022. V. 213. P. 115627. DOI: 10.1016/j.poly.2021.115627.
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and processing software for the SMART system. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An integrated system for solving, refining and displaying crystal structures from diffraction data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Cryst. 2009. Vol. 42. P. 339. DOI: 10.1107/S0021889808042726.
- Ефремов А.Н., Шарутин В.В. // Вестник ЮУрГУ. Серия «Химия». 2021. Т. 13, № 4. С. 120. DOI: 10.14529/chem210410.
- Шарутин В.В., Шарутина О.К., Ефремов А.Н. // Журн. общ. химии. 2022. Т. 92, № 2. С. 304. DOI: 10.31857/S0044460X22020172.

![Синтез и строение сольвата бис[3,5-динитробензоата] трис(2-метокси)(5-бром)фенилсурьмы [C6H3(2-OMe)(5-Br)]3Sb[OC(O)C6H3(NO2)2-3,5]2 • PhH • 1/2 C8H18 Синтез и строение сольвата бис[3,5-динитробензоата] трис(2-метокси)(5-бром)фенилсурьмы [C6H3(2-OMe)(5-Br)]3Sb[OC(O)C6H3(NO2)2-3,5]2 • PhH • 1/2 C8H18](/file/cover/147243270/sintez-i-stroenie-solvata-bis-35-dinitrobenzoata-tris-2-metoksi-5-brom.png)
