Синтез метиловых эфиров 3,4-дигидрокси-6-оксо-2,4-алкадиеновых кислот
Автор: Тарасова Виктория Алексеевна, Муковоз Петр Петрович, Козьминых Владислав Олегович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 3 т.6, 2014 года.
Бесплатный доступ
Конденсацией метилацетата с диметилоксалатом и алкилметилкетонами получены метиловые эфиры 3,4-дигидрокси-6-оксо-2,4-алкадиеновых кислот. Обсуждаются особенности строения синтезированных соединений на основании данных ИК и ЯМР 1Н спектроскопии. Установлено, что эти соединения в твердом состоянии и в растворах неполярных растворителей существуют в форме диенольных бис-OH-хелатных таутомеров.
Тетракарбонильные соединения, двухстадийная конденсация, 6-тетракетоны, кетипинаты, трикетоэфиры, метиловые эфиры 3, 4- дигидрокси-6-оксо-2, 4-алкадиеновых кислот
Короткий адрес: https://sciup.org/147160289
IDR: 147160289 | УДК: 547.341+547.725
Текст научной статьи Синтез метиловых эфиров 3,4-дигидрокси-6-оксо-2,4-алкадиеновых кислот
1,3,4,6-Тетракарбонильные соединения (ТКС) являются доступными, устойчивыми и реакционноспособными оксосистемами, которые успешно применяются в органическом синтезе для получения различных биологически активных соединений. Наличие нескольких реакционных центров в молекуле ТКС определяет их синтетические возможности, которые проявляются в реакциях с нуклеофильными реагентами, приводящих к линейным и кольчатым оксо- и азопроизводным [1–7]. Эфиры 6-арил-3,4,6-триоксогексановых кислот ( 1 , схема 1), представляющие переходное звено от 1,3,4,6-тетракетонов ( 2 ) [8–11] к эфирам 3,4-диоксо-1,6-гександиовой кислоты ( 3 ) [12–15], известны по единичным примерам, а способы их получения довольно трудоёмки [16, 17].
OO OO OO
Ar Alk AlkO
Ar OAlk Alk OAlk
Ar = Ph, 4-MeOPh, Alk = Me, Et, Pr и др.
Схема 1. Структуры известных 1,3,4,6-тетракарбонильных соединений (1-3)
Нами впервые разработан способ получения эфиров 3,4-дигидрокси-6-оксо-2,4-алкадиеновых кислот ( 4 ) по реакции сложноэфирной конденсации.
Основная часть
В результате конденсации метилацетата с диметилоксалатом и различными алкилметилкето-нами нами выделены метил-3,4-дигидрокси-6-оксогепта-2,4-диеноат ( 4a ), метил-3,4-дигидрокси-6-оксоокта-2,4-диеноат ( 4b ) и метил-3,4-дигидрокси-6-оксонона-2,4-диеноат ( 4c , схема 2). Реакцию метилацетата с диметилоксалатом и метилатом натрия проводили в соотношении 1:1:1 в среде тетрагидрофурана без выделения промежуточно образующихся соединений, далее в реакционную систему добавляли эквимольное количество метилата натрия и соответствующего ме-тилалкилкетона. Соединения ( 4a–c ) выделяли последующим подкислением реакционной массы.
MeO

CH3 MeO +
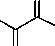
1)+ MeONa OMe (1 : 1 : 1)
OO
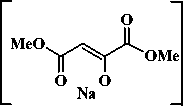
2) + MeONa, MeCOAlk
(1 : 1 : 1)
+ 2H+,
- 2Na+
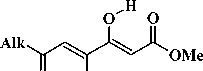
O O
H
4a-c
Alk = Me (4a), Et (4b), Pr (4c)
Схема 2. Синтез метиловых эфиров 3,4-дигидрокси-6-оксо-2,4-алкадиеновых кислот (4a–c)
К недостаткам предложенного нами способа можно отнести незначительные выходы соединений ( 4a–c ), что объясняется протеканием конкурирующих реакций в процессе синтеза. На первой стадии, кроме промежуточно образующегося щавелевоуксусного эфира, в реакционной системе образуется также метиловый эфир 3,4-диоксо-1,6-гександиовой кислоты ( 3 ), а на второй стадии кроме соединений ( 4a–c ) образуются симметричные тетракетоны ( 2 ), что значительно затрудняет выделение целевых продуктов. Для более эффективного разделения смеси продуктов предполагается использовать препаративные хроматографические методы, однако принципиально изменить направление сравнимых по скорости конкурирующих реакций, протекающих в одной реакционной системе, на данный момент не представляется возможным. Присутствие в продуктах реакции соединений ( 2 , 3 ) подтверждается данными ТСХ и ХМС.
Соединения ( 4a–c ) представляют собой бесцветные кристаллические вещества, не растворимые в воде и хорошо растворимые в большинстве органических растворителей. Строение синте-
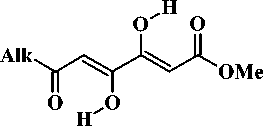
4A
зированных соединений установлено методами ИК и ЯМР 1Н спектроскопии, согласно которым соединения (4a–c) как в твердом состоянии, так и в растворах неполярных растворителей (CDCl3) существуют в бис-хелатной диенольной форме 4А (схема 3), также как и их структурные аналоги – кетипинаты (3) и 1,3,4,6- тетракетоны (2) [9, 10, 12, 13].
Alk = Me (4a), Et (4b), Pr (4c) Так, в ИК-спектрах соединений (4a–c), записанных в пасте вазелинового масла, имеется слабая, сравни-Схема 3. Строение метиловых эфиров тельно низкочастотная полоса валентных колебаний 3,4-дигидрокси-6-оксо-2,4-алкадиеновых гидроксильных групп при 3230–3287 см–1, а также ин-кислот (4a–c)
тенсивные уширенные сигналы поглощения при 15731580 см–1, соответствующие характеристическим валентным колебаниям карбонильных групп, сопряженных с двойными связями в бис-ОН-хелате. Для сравнения отметим, что соответствующие полосы поглощения 1,6-диалкилзамещенных 1,3,4,6-тетраонов (2) находятся в достаточно близкой области – при 3200–3253 см–1 (ОН) и 1556–1607 см–1 (С=О) [8, 9], а поглощение диме-тилкетипината (3, OAlk = OMe) – при 3297 см–1 (ОН) и 1650 см–1 (С=О) соответственно [12, 13].
Спектры ЯМР 1Н, снятые в растворе дейтерохлороформа, характеризуются одинаковым значением химического сдвига метоксигруппы сложноэфирного фрагмента (δ 3,80 м.д.) у всех трех соединений (4а–с), вне зависимости от характера алкильного заместителя. Данные сигналы находятся в области слабого поля и достаточно близки значению сигнала метоксигруппы сложно-эфирного аналога (3, δ 3,55 м.д.). [12, 14, 15]. Химические сдвиги сигналов двух С(2,5)Н метиновых протонов соединений (4а–с) находятся в слабом поле (при δ 5,95–6,34 м.д.), что подтверждает 3Z,5Z-конфигурацию молекулы. В то же время эти протоны не являются попарно эквивалентными (С(2)Н δ 5,95–6,25 м.д. и C(5)H δ 6,25–6,34 м.д.), что обусловлено различным магнитным окружением и свидетельствует об ассимметричном строении молекулы. Отметим, что сигналы С(2,5)Н метиновых протонов 1,3,4,6-тетракетонов (2, Alk = Me, Et, Pr, δ 6,34–6,34 м.д.) и диме-тилкетипината (3, δ 5,87 м.д.) являются попарно эквивалентными и наблюдаются в ЯМР 1H спектрах в виде синглетов, подтверждая центральносимметричное строение молекул [8, 11, 12]. Аналогичным образом сказывается различие в магнитном окружении и на положении сигналов двух енольных гидроксильных групп, разделенных значительным интервалом химического сдвига (С(3)ОН при δ 11,62–11,63 м.д. и С(4)ОН при δ 14,65–14,77 м.д.), что также подтверждает асси-метричное строение молекул соединений (4а–с) [8, 11, 12].
Заключение
Разработанный нами способ синтеза соединений ( 4 ) открывает широкие возможности для получения новых производных 3,4-дигидрокси-6-оксо-2,4-алкадиеновых кислот, а также их (ок-со)азо-аналогов. Соединения ( 4 ) сочетают в себе особенности строения соединений ( 2 , 3 ) и вероятно будут обладать свойствами, не характерными для соединений ( 2 , 3 ) по отдельности, что может приводить к новым типам потенциально полезных структур (в том числе и биологически активных), определяя актуальность развития данного направления.
Экспериментальная химическая часть
ИК спектры соединений (4) записаны на спектрофотометре Spectrum Two Perkin Elmer в пасте твёрдого вещества в вазелиновом масле. Спектры ЯМР 1H (CDCl3) соединений (4) получены на приборе MERCURYplus-300 (300,05 МГц) в СDCl3, внутренний стандарт – ТМС. Индивидуальность полученных веществ подтверждена методом ТСХ на пластинках Silufol UV-254 в системе гексан – ацетон 3:1, проявление парами иода.
Методика синтеза соединений 4. В круглодонную колбу на 250 мл добавляют 50 мл предварительно перегнанного над натрием метанола, прибавляют порциями 1,15 г (50 ммоль) натрия, метанол отгоняют. К сухому остатку образовавшегося метилата натрия при охлаждении и перемешивании добавляют смесь 50 мл тетрагидрофурана, 4,0 мл (50 ммоль) метилацетата, 5,9 г (50 ммоль) диметилоксалата и кипятят 30–40 минут. В другую круглодонную колбу на 250 мл добавляют 50 мл метанола, прибавляют порциями 1,15 г (50 ммоль) натрия, метанол отгоняют и к сухому остатку метилата натрия добавляют 50 мл тетрагидрофурана. Затем при охлаждении и перемешивании прибавляют реакционную массу, образовавшуюся в первой колбе, и 3,7 мл (50 ммоль) ацетона (для синтеза соединения 4a ), или 4,5 мл (50 ммоль) 2-бутанона (для синтеза соединения 4b ), или 5,3 мл (50 ммоль) 2-пентанона (для синтеза соединения 4с ) и далее кипятят 1 час. Растворитель выпаривают, к остатку при перемешивании добавляют 100 мл охлажденной 15 % соляной кислоты, выпавший осадок соединений ( 4 ) промывают холодной водой, отфильтровывают, сушат и кристаллизуют из этанола или этилацетата.
Метил (2 Z ,4 Z )-3,4-дигидрокси-6-оксогепта-2,4-диеноат ( 4a ). Выход 0,25 г (11 %), т. пл. 98– 100°С. ИК-спектр: 3287 (ОH хелат ), 3123 (CH), 2923 ν as (CH 3 ), 2853 ν s (CH 3 ), 2742 ν s (CH 2 ), 1573 шир. (С(1,6)=O хелат ), 1454 δ as (CH 3 ), 1362 δ s (CH 3 ), 1193, 1089 ν (= С–О Н), 1022, 986, 943, 920, 848, 819 ν скелетные (C–C). Спектр ЯМР 1Н (CDCl 3 ): 2,24 c (3H, CH 3 CO), 3,80 c (O CH 3 ), 6,25 c (C(4)H), 6,34 c (C(5)H), 11,62 c (C(3)OH), 14,73 уш.с (С(4)OH).
Метил (2 Z ,4 Z )-3,4-дигидрокси-6-оксоокта-2,4-диеноат ( 4b ). Выход 0,29 г (13 %), т. пл. 76– 78°С. ИК-спектр: 3264 (ОH хелат ), 3120 (CH), 2925 ν as (CH 3 ), 2854 ν s (CH 3 ), 2743 ν s (CH 2 ), 1578 шир. (С(1,6)=O хелат ), 1453 δ as (CH 3 ), 1376 δ крутильные (CH 2 ), 1359 δ s (CH 3 ), 1285 δ веерные (CH 2 ), 1076 ν (= С– О Н), 1040, 980, 954, 911, 863, 813 ν скелетные (C–C). Спектр ЯМР 1Н (CDCl 3 ): 1,16 т (3Н, СН 3 CH 2 СО, J 7,8 Гц), 2,52 кв (2Н, СН 2 , J 7,8 Гц), 3,80 с (О СН 3 ), 5,95 с (С(4)Н), 6,26 с (С(5)Н), 11,63 с (С(3)ОН), 14,65 уш.с (С(4)ОН).
Метил (2 Z ,4 Z )-3,4-дигидрокси-6-оксонона-2,4-диеноат ( 4c ). Выход 0,16 г (7 %), т. пл. 67– 68°С. ИК-спектр: 3230 (ОH хелат ), 3112 (CH), 2923 ν as (CH 3 ), 2853 ν s (CH 3 ), 2726 ν s (CH 2 ), 1580 шир. (С(1,6)=O хелат ), 1454 δ as (CH 3 ), 1378 δ крутильные (CH 2 ), 1364 δ s (CH 3 ), 1290 δ веерные (CH 2 ), 1145, 1082 ν (= С–О Н), 1039, 1021, 942, 906, 879, 840, 817 ν скелетные (C–C). Спектр ЯМР 1Н (CDCl 3 ): 0,92 т (3Н, СН 3 CH 2 CH 2 СО, J 7,8 Гц), 1,68 м (2Н, СН 2 ), 2,45 т (2Н, СН 2 , J 7,5 Гц), 3,80 (3Н, O СН 3 ), 5,95 с (С(4)Н), 6,25 с (С(5)Н), 11,63 с (С(3)ОН), 14,77 уш.с (С(4)ОН).
Список литературы Синтез метиловых эфиров 3,4-дигидрокси-6-оксо-2,4-алкадиеновых кислот
- 1,3,4,6-Тетракарбонильные соединения. 3. Синтез, особенности строения и противомикробная активность 1,6-диаpил-3,4-дигидpокси-2,4-гексадиен-1,6-дионов/Н.М. Игидов, Е.Н. Козьминых, О.А. Софьина и др.//Химия гетероциклических соединений. -1999. -№ 11. -С. 1466-1475.
- Козьминых, Е.Н. 1,3,4,6-Тетракарбонильные системы. Сообщение 8. Синтез и противомикробная активность 2(5)-галогенпроизводных 1,3,4,6-тетракарбонильных соединений/Е.Н. Козьминых, В.И. Гончаров, В.О. Козьминых//Химико-фармацевтический журнал. -2008. -Т. 42, № 9. -С. 18-24.
- Синтез 2,2'-(2-оксоимидазолидин-4,5-диилиден)диацетатов/П.П. Муковоз, В.О. Козьминых, И.Н. Ноздрин, Е.Н. Козьминых//Химия гетероциклических соединений. -2010. -№ 8 (518). -С. 1262-1264.
- Муковоз, П.П. Новый простой метод получения 2,2′-(2H-1,4-бензоксазин-2,3-диилиден)диацетатов/П.П. Муковоз, В.О. Козьминых, О.Н. Дворская//Башкирский химический журнал. -2010. -Т. 17, № 3. -С. 23-24.
- Простой однореакторный синтез 2,2-хиноксалин-2,3-диилдиацетатов/П.П. Муковоз, О.Г. Карманова, Е.Н. Козьминых, В.О. Козьминых//Башкирский химический журнал. -2012. -Т. 19, № 2. -С. 12-15.
- Синтез и строение 2,3-бис-(2-оксоалкилиден)-1,2,3,4-тетрагидрохиноксалинов/О.Г. Карманова, П.П. Муковоз, В.О. Козьминых, Е.Н. Козьминых//Известия высших учебных заведений. Серия: Химия и химическая технология. -2013. -Т. 56, № 3. -С. 3-7.
- 1,3,4,6-Тетракарбонильные соединения IV.* Взаимодействие 3,4-дигидpокси-2,4-гексадиен-1,6-дионов с гидразином и арилгидразинами/Т.М. Широнина, Н.М. Игидов, Е.Н. Козьминых и др.//Журнал органической химии. -2001. -Т. 37, № 10. -С. 1555-1563.
- Синтез и структурное разнообразие 1,6-диалкил-3,4-дигидрокси-2,4-гексадиен-1,6-дионов/О.Г. Карманова, П.П. Муковоз, Е.Н. Козьминых, В.О. Козьминых//Известия высших учебных заведений. Химия и химическая технология. -2013. -Т. 56, № 1. -С. 13-16.
- Современные достижения в области синтеза и изучения строения 1,3,4,6-тетракарбонильных систем и их ближайших аналогов/О.Г. Карманова, В.О. Козьминых, П.П. Муковоз, Е.Н. Козьминых//Башкирский химический журнал. -2012. -Т. 19, № 3. -С. 109-114.
- Structural diversity of 1,3,4,6-tetracarbonyl compounds, their analogues and nitrogen containing derivatives (review)/O.G. Karmanova, V.O. Kozminykh, P.P. Mukovoz, E.N. Kozminykh//Вестник Южно-Уральского государственного университета. Серия «Химия». -2012. -Вып. 9. -№ 24. -С. 39-45.
- Синтез, особенности строения и таутомерия 1,6-дизамещённых 3,4-дигидрокси-2,4-гексадиен-1,6-дионов/Е.А. Кириллова, П.П. Муковоз, А.Н. Виноградов и др.//Известия высших учебных заведений. Серия: Химия и химическая технология. -2011. -Т. 54, № 4. -С. 18-22.
- Муковоз, П.П. Синтез и особенности строения эфиров 3,4-дигидрокси-1,6-гександиовой кислоты/П.П. Муковоз, О.Н. Дворская, В.О. Козьминых//Известия высших учебных заведений. Серия: Химия и химическая технология. -2011. -Т. 54, № 5. -С. 96-100.
- Козьминых, В.О. 1,3,4,6-Тетракарбонильные системы. Сообщение 9. Диэтилкетипинат: синтез, особенности строения и взаимодействие с 1,2-диаминобензолом/В.О. Козьминых, П.П. Муковоз, Е.А. Кириллова//Вестник Оренбургского государственного университета. -2009. -№ 5. -С. 155-166.
- Stachel, H.-D. Die Struktur der Ketipinsäure und ihrer Derivate/H.-D. Stachel//Liebigs Annalen der Chemie. -1965. -Bd 689. -S. 118-126. -Chemical Abstracts. -1966. -Vol. 64. -№ 5.
- Stachel, H.-D. Über γ-Alkylidentetronsäuren. 2. Mitt./H.-D. Stachel//Archiv der Pharmazie. -1965. -Bd 298. -№ 7. -S. 447-453.
- Пятичленные 2,3-диоксогетероциклы XXXV. Взаимодействие 5-арил-2,3-дигидро-2,3-фурандионов с ацеталями кетена. Синтез, строение и реакции гетероциклизации алкилор.эфиров 5-арил-2-гидрокси-3-оксо-2,3-дигидрофуран-2-илуксусных кислот/С.Н. Шуров, Л.И. Ливанцева, Е.Ю. Павлова и др.//Журнал органической химии. -1993. -Т. 29, № 11. -С. 2275-2289.
- Синтез и биологическая активность 2-замещённых 5-арил-2,3-дигидро-3-фуранонов/В.О. Козьминых, Н.М. Игидов, Е.Н. Козьминых и др.//Химико-фармацевтический журнал. -1992. -Т. 26, № 2. -С. 35-38.


