Синтез новых 6-(арен)хромтрикарбонильных комплексов с 1,3-бензодиоксольными и 1,4-бензодиоксановыми лигандами
Автор: Артмов Александр Николаевич, Колесова Анна Сергеевна, Сазонова Елена Васильевна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 2 т.14, 2022 года.
Бесплатный доступ
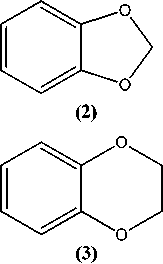
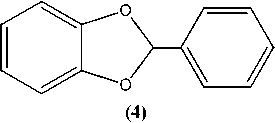
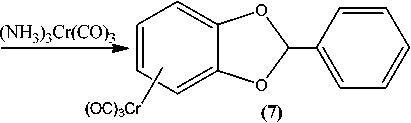
Особый интерес к изучению строения и особенностей химического поведения гетероциклических соединений, содержащих два атома кислорода в своем составе, связан с широким распространением их в природе, а также с их высокой биологической активностью. Нами впервые представлены данные о возможности получения и исследования ряда физико-химических свойств и спектральных характеристик некоторых η6-(арен)хромтрикарбонильных комплексов циклических эфиров пирокатехина. На первом этапе нашего исследования взаимодействием пирокатехина (1) с дихлорметаном, 1,2-дихлорэтаном и бензальдегидом нами синтезированы соответствующие циклические эфиры: 1,3-бензодиоксол (2), 1,4-бензодиоксан (3) и 2-фенил-1,3-бензодиоксол (4). Далее π-комплексы были получены двумя независимыми методами: реакцией соединений (2), (3) и (4) с гексакарбонилом хрома (метод А) и триамминхромтрикарбонилом (метод В). Реакции по методу А осуществлялись путем взаимодействия указанных выше соединений 2-4 с гексакарбонилом хрома в кипящем дибутиловом эфире или в смеси диглим/октан (1:1). Реакции, вероятно, проходят с частичным разложением полученных π-комплексов. Более высокие выходы наблюдаются при проведении реакций по методу В, в котором используются производные гексакарбонила хрома - триамминхромтрикарбонил в растворе диоксана. Показано, что последний метод не только дает более высокие выходы, но и позволяет синтезировать более широкий круг гетероциклических π-комплексов хрома. Состав и строение полученных соединений были установлены с помощью различных физико-химических методов анализа, таких как ВЭЖХ, УФ-, ИК-, 1Н ЯМР-спектрометрии и масс-спектрометрии.
Гетероциклические соединения, η6-(арен)хромтрикарбонильные комплексы гетероциклических соединений, 1, 3-бензодиоксолы, 1, 4-бензодиоксаны, защитное алкилирование, реакция координации
Короткий адрес: https://sciup.org/147237511
IDR: 147237511 | УДК: 547
Текст научной статьи Синтез новых 6-(арен)хромтрикарбонильных комплексов с 1,3-бензодиоксольными и 1,4-бензодиоксановыми лигандами
Среди веществ, обладающих фармакологическими и биологически активными свойствами, особое место занимают гетероциклические 1,3- и 1,4-производные, содержащие пяти- и шестичленные циклы [1–6].
(R = H, Ph)
Известно, что введение в эти соединения металлорганических фрагментов значительно меняет многие свойства этих соединений, что делает их перспективными веществами для дальнейшего использования [7–11]. Большой интерес представляет введение в эти соединения Cr(CO) 3 -групп. Однако до сих пор в научной литературе отсутствуют работы по получению и исследованию свойств η6–(арен)хромтрикарбонильных комплексов с гетероциклическими кислородсодержащими лигандами.
По-видимому, отсутствие в литературе подробных сведений об этих соединениях связано с малой доступностью исходных веществ, например, η6-(пирокатехин)хромтрикарбонила. Так как исходный пирокатехин имеет в своем составе два рядом расположенных атома кислорода – элемента, имеющего нуклеофильные электронные пары, синтез его π-комплекса прямой реакцией с гексакарбонилом хрома Cr(CO) 6 или его производными типа L 3 Cr(CO) 3 (L= NH 3 или MeCN) невозможен.
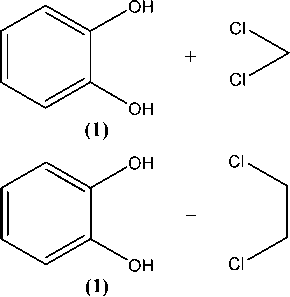
Однако мы предположили, что образование η6-(арен)хромтрикарбонильных комплексов все же можно осуществить, если защитить свободные электронные пары атомов кислорода подходящими блокирующими группами [12–13]. Одним из вариантов такой защиты является реакция алкилирования пирокатехина с образованием его циклических эфиров. Эту реакцию можно осуществить путем использования дигалоидных органических соединений или с помощью циклоприсоединения альдегидов [14–16]. Пути прохождения реакций могут быть представлены следующей схемой:
Cl2(CH2)n
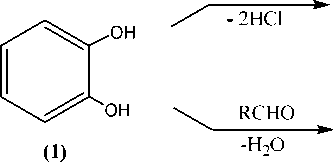
n l.2; R = Ph
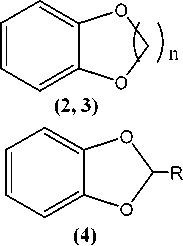
Далее, проводя реакцию с полученными лигандами, можно синтезировать желаемые η6-(арен)хромтрикарбонильные комплексы.
Обсуждение результатов
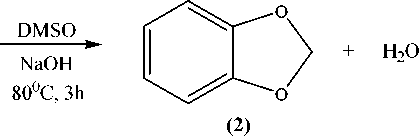
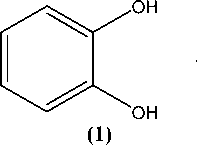
Путем взаимодействия пирокатехина (1) с дихлорметаном и 1,2-дихлорэтаном нами были получены 1,3-бензодиоксол (2) и 1,4-бензодиоксан (3) соответственно [16]:
DMSO , NaOH 80°C, 3h
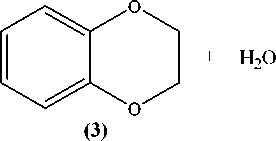
Реакции проводились в растворе диметилсульфоксида (DMSO) при температуре 80–85 °С в течение 3 часов. Полученную смесь гидролизовали и перегоняли с паром.
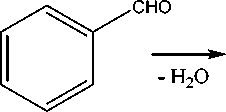
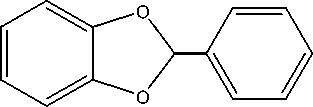
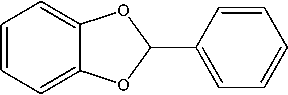
Синтез 2-фенилзамещенного производного 1,3-бензодиоксола (4) осуществлялся с помощью реакции конденсации пирокатехина (1) с бензальдегидом в среде кипящего п -ксилола в условиях азеотропной отгонки воды [15, 17]:
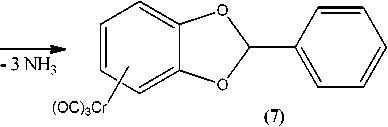
Описанная выше эфирная защита гидроксильных групп пирокатехина позволила получить η6-(арен)хромтрикарбонильные комплексы 1,3-бензодиоксола и 1,4-бензодиоксана (5–7) :
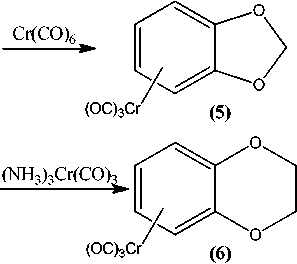
Учитывая индивидуальные особенности полученных соединений, а также их низкую термическую стабильность, введение Cr(CO)3-группы в эти соединения проводилось двумя известными методами, первый из которых состоял в прямом взаимодействии с гексакарбонилом хрома [18– 20]. Так, реакции соединений 2 и 3 с Cr(CO) 6 в кипящем дибутиловом эфире или в смеси диг-лим/октан, видимо, проходят с частичным разложением, что заметно по потемнению раствора и образованию темно-коричневой реакционной смеси, из которой путем фильтрования, упаривания растворителя и перекристаллизации остатков были получены ожидаемые желтые кристаллы. Показано, что оптимальные выходы η6-комплексов наблюдаются при проведении реакции в интервале температур бани 140–150 °С; ниже 140 °С реакция протекает слишком медленно, а при температуре выше 150 °С происходит существенное разложение комплексных продуктов.
Более высокие выходы наблюдаются при проведении реакции координации с триаммин-хромтрикарбонилом в кипящем диоксане [21–22]. В этом случае заметное разложение происходит только в конце реакции, что отчетливо видно по изменению цвета реакционного раствора. Анализ продуктов реакции рядом физико-химических методов подтвердил идентичность состава и строения веществ, полученных разными методами в различных экспериментальных условиях.
С помощью этих двух методик из полученных ранее лигандов 2 – 4 были синтезированы их π-комплексы, которые представляли собой желтые кристаллические вещества, а их индивидуальность и строение были подтверждены ВЭЖХ, УФ-, ИК-, 1Н ЯМР-спектроскопией и масс-спектрометрией. Некоторые характеристики синтезированных веществ приведены в таблице.
Характеристики циклических эфиров пирокатехина и их π -комплексов
|
Соединение |
Выход (%) |
Т пл , °С |
ИК-спектр ν (СO), см–1 |
Масс-спектр m/z (I отн. (%)) |
|
|
2 |
38,0 |
Жидк. |
– |
122 [М]+(66) |
|
|
3 |
48,0 |
Жидк. |
– |
136 [М]+(100) |
|
|
4 |
35,0 |
105 |
– |
198 [М]+(78) |
|
|
Метод А |
Метод Б |
||||
|
5 |
23,7 |
36,5 |
125 |
1955, 1859 |
258 [М]+(3) |
|
6 |
31,2 |
41,5 |
59–60 |
1955, 1872, 1841 |
272 [М]+(32) |
|
7 |
30,1 |
37,0 |
85–93 |
1961, 1886, 1853 |
334 [М]+(20) |
На ВЭЖХ-хроматограмме каждого из соединений 4–6 присутствовал 1 пик. В их ИК-спектрах наблюдались интенсивные полосы валентных колебаний связей СО хромтрикарбониль-ных фрагментов в районе 1841–1961 см–1, в масс-спектре присутствовали ожидаемые молекулярные и осколочные ионы (см. экспериментальную часть). ЯМР Н1-спектр также подтверждает строение полученных веществ: в нем обнаружены сигналы протонов как гетероциклического, так и координированного ароматического колец.
В отличие от соединений 5 и 6 соединение 7 имеет два фенильных фрагмента. Известно, что в этом случае возможно образование двух изомерных η6-(арен)хромтрикарбонильных комплексов, обычно выделяемых в виде их смесей, причем наиболее легко Cr(CO) 3 -группа вступает в то кольцо, которое имеет повышенную электронную плотность. Такой группой в соединении 7 является фениленовое кольцо. Действительно, 2-фенил-1,3-бензодиоксол, имеющий в своем составе два ароматических кольца, с эквивалентным количеством триамминхромтрикарбонила в среде диоксана дает в качестве главного продукта соединение 7 , в котором фенилхромтрикарбонильная группа находится у фениленового кольца, тогда как его изомер с Cr(CO) 3 -группой у фенильного кольца присутствует в конечном продукте в виде небольшой примеси:
+ (NH3)3Cr(CO)3
С помощью колоночной хроматографии основной продукт реакции был выделен в чистом виде и охарактеризован с помощью физико-химических методов анализа.
Диаграмма ВЭЖХ (1 пик, τ = 8,35 мин) и УФ (λ = 218, 315 нм) находятся в соответствии с предполагаемой структурой. Его ИК-спектр содержит 3 полосы поглощения при 1961, 1886, 1853 см–1, характерных для валентных колебаний CO-группы в хромтрикарбонильном фрагменте. В масс-спектре наблюдаются сигналы, соответствующие молекулярному иону 334 [M]+ (20), 278 [M-CO]+ (9), 250 [M-3CO]+ (100), 273 [M-3CO-Ph]+ (62), 52 [Cr].
Строение соединения (7) также подтверждает и его Н 1 -ЯМР-спектр (см. рисунок).
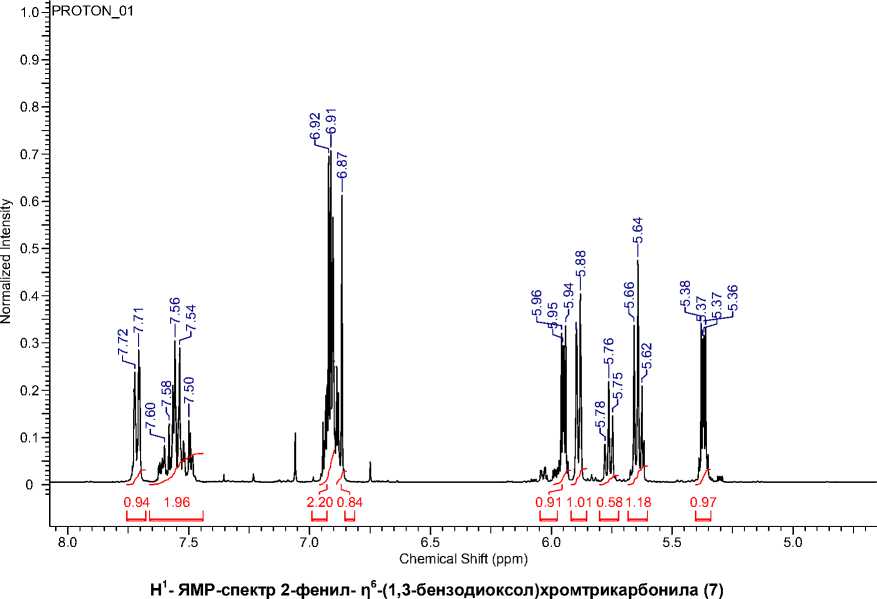
В нем присутствуют сигналы протонов двух ароматических фрагментов: фенильного и η6-(фенилен)хромтрикорбонильного, наблюдаемых в области 7,8–6,7 и 6,2–5,3 м. д. соответственно. Интегрирование этих сигналов ясно указывает на то, что в этом соединении соотношение протонов координировнного и некоординированного колец составляет 5:4, что соответствует структуре соединения 7 .
Экспериментальная частьПодготовка исходных веществ
Перед использованием в синтезах все растворители: гексан (T кип = 68,7 °С), диэтиловый эфир (T кип = 34,6 °С), диоксан (Т кип = 101 °С), этилацетат (T кип = 77 °С) сушили и перегоняли при атмосферном давлении. Диметилсульфоксид (ДМСО, T кип = 189 °С) сушили над гидроксидом натрия, затем перегоняли при пониженном давлении (T кип = 51 °С/ 5 мм рт. ст.). Дихлорметан (T кип = 40 °С) сушили над едким натром и перегоняли при атмосферном давлении. Дихлорэтан (Tкип = 83,5 °С) очищали выдерживанием в присутствии безводного хлористого алюминия с последующей отгонкой. Бензальдегид перегоняли в вакууме. Этилацетат (T кип = 77 °С) сушили над хлористым кальцием и перегоняли. Пирокатехин очищали возгонкой при пониженном давлении. Гексакарбонил хрома очищали возгонкой в сублиматоре при температуре 60 °С/1 мм рт. ст. [23]. Триамминхромтрикарбонил получали по известной методике [24].
Методика анализа
Высокоэффективную жидкостную хроматографию (ВЭЖХ) проводили на хроматографе Knauer Smartline 5000 с РДА-детектором S 2600, колонка Диасфер 110-С16Т, 5 мкм, 4,6*250 мм, элюент – ацетонитрил : вода (84:16). УФ-спектры элюентов расшифровывали в диапазоне 200– 500 нм. ИК-спектры регистрировались на спектрометре «Инфралюм ФТ – 801» в диапазоне 480– 4600 см–1 в таблетках KBr. Спектры 1Н ЯМР регистрировали на спектрометре Bruker DPX 200 и Bruker Avance DPX 400 (рабочие частоты 200 и 400 МГц соответственно), растворитель – аце-тон-d6. Масс-спектрометрическое исследование проводили на приборе Trance GC Metra/PS Q 11 в режиме регистрации положительных ионов, ионизация методом электронного удара (70 эВ), диапазон m/z 28–500, капельная колонка TR5MS 60000*0,25 мм, скорость потока гелия – 1 мл/мин, программирование температуры от 60–300 °С при скорости нагрева 15 град./мин. Синтез и выделение соединений (5–7) проводили в атмосфере аргона.
Синтез соединений (2) и (3). Общая методика[16]
В 3-горлую колбу с обратным холодильником и двумя вводами для твердых веществ поместили 0,74 моль диметилсульфоксида и 0.6 моль дихлоралкана. Смесь нагревали до 80 °С, затем порциями с интервалом 7 минут при перемешивании добавили 0,18 моль пирокатехина (mпорции = 0,9 г) и 0,67 моль гидроксида натрия (m порции = 1,2 г), поддерживая температуру среды 80–85 °С. После завершения добавления пирокатехина и щелочи реакционную смесь перемешивали в течение 3 часов. На следующий день к полученной смеси при перемешивании добавили 36,4 мл воды, затем реакционную смесь перегнали с паром. С помощью делительной воронки отделили нижний слой, который затем перегнали в вакууме. В результате перегонки получили соединения (2) и (3) в виде прозрачных жидкостей.
-
1,3- Бензодиоксол (2). Выход 38 %. n D 20 = 1,539 [Лит. [25] n D 20=1,539]. ВЭЖХ – 1 пик, τ = 6,75 мин. УФ-спектр (MeCN, H 2 O), λ/нм: 281. Масс-спектр (ЭУ, 70 эВ, m/z (I отн (%)): для С 7 O 2 H 6 рассчитано [М]+ 122: найдено 122 [М]+(66), 121 [М-Н]+(100), 92 [М-CH 2 О]+(2). 1H-ЯМР, м. д. (acetone – d6): 4,25 (с., 2H,CH 2 ); 6,75–6,85 (м., 4H, Ph).
-
1,4- Бензодиоксан (3). Выход 48 %. n D 20 = 1,553 [Лит. [26] n D 20=1,553]. Масс-спектр (ЭУ, 70 эВ, m/z (I отн. (%)): для С 8 O 2 H 8 рассчитано [М]+ 136: найдено 136 [М]+(100), 135 [М-Н]+(25), 121 [М-CH 3 ]+ (16).
Синтез 2-фенил-1,3-бензодиоксола (4) [15, 17]
В 2-горлую колбу, снабженную ловушкой Дина–Старка, поместили 11 г (0,1 моль) свеже-возогнанного пирокатехина, 10,18 мл (0,096 моль) бензальдегида, 80 мл толуола и 30 мг толуолсульфокислоты. Реакционная смесь кипятилась в течение 10 часов, при этом выделилось 1,3 мл воды (72 %). После охлаждения реакционную смесь обработали 10%-ным раствором гидроксида натрия (2*15 мл), органический слой промывали водой (15 мл) и высушивали над безводным Na 2 SO 4 . Растворитель (толуол) отгоняли в вакууме, образовавшийся черно-коричневый остаток возгоняли в вакууме. В результате возгонки было получено белое твердое вещество с Тпл.= 59– 60 °С. Выход 35 %. ВЭЖХ: 1 пик, τ = 9,23 мин. УФ-спектр (MeCN, H 2 O), λ/нм: 215, 281. ИК-спектр (KBr), ν/см–1: 3066(ν (С ar -H)); 2896(ν (С-H)); 1101 (ν (С-O)); 939, 910, 738 (ω (С ar -H)). Масс-спектр (ЭУ, 70 эВ, m/z (I отн. (%)): для C 13 O 2 H 10 рассчитано [М]+ 198: найдено 198 [М]+(78), 197 [М-Н]+(100), 121 [М-Ph]+(22).
Синтез соединений (5–7) [18–22]
Метод А. В 2-горлую колбу с обратным холодильником в атмосфере аргона поместили 0,014 моль Cr(CO)6, гетероциклический лиганд 0,014 моль и 30 мл смеси диглим/октан (1:1). Фракционную смесь нагревали 8 часов при температуре бани 140–150 °С до полного выделения СО (940 мл). Затем реакционную смесь охлаждали до комнатной температуры, фильтровали через слой Al2O3 и отгоняли в вакууме растворитель. В колбе остался темно-коричневый продукт. Перекристаллизация этого остатка из смеси гексан : этилацетат (1:1) дает желтые кристаллы.
Метод В. В 2-горлую колбу с припаянным обратным холодильником, снабженную газовой бюреткой, заполненной диметилфталатом, помещали 0,033 моль гетероциклического лиганда и 0,033 моль триамминхромтрикарбонила и 34 мл диоксана. Реакционную смесь нагревали 3,5 часа на масляной бане (Т = 120 °С) до полного выделения аммиака, затем колбу охлаждали и заполняли аргоном. Полученную смесь отфильтровали через фильтр Шотта с использованием Al2O3. Диоксан отогнали в вакууме. Получили твердое вещество желтого цвета. Перекристаллизацией полученного вещества из гексана и этилацетата (3:1), получили желтые кристаллы.
η6-(1,3-бензодиоксол)хромтрикарбонил (5). Выход составил 3,1 г (36,5 %). Т пл =105 °С. ВЭЖХ – 1 пик, τ = 5,9 мин. ИК-спектр (KBr), ν/см–1: 3099(ν (С ar -H)); 2943, 2923(ν (С-H)); 1955, 1859 (ν (С≡O)); 1101 (ν (С-O)); 887, 827, 630 (ω (С ar -H)). Масс-спектр (ЭУ, 70эВ, m/z (I отн. (%)): для С 10 O 5 H 6 Cr рассчитано [М]+ 258: найдено 258 [М]+(3), 173 [М-3CO]+(23), 52 [Cr]+(100). 1H-ЯМР, м.д. (acetone – d6): 5,3–5,35 (м., 2H, Ph*); 5,75 (с., 1H, CH 2 ); 5,88–5,96 (м., 2H, Ph*); 6,2 (с., 1H, CH 2 ).
η6-(1,4-бензодиоксан)хромтрикарбонил (6). Выход составил 3,5 г (41,5 %). Т пл. = 125 °С. ВЭЖХ – 1 пик, τ = 5,47 мин. ИК-спектр (KBr), ν/см–1: 3120 (ν (С ar -H)); 2921, 2850(ν (С-H)); 1955, 1872, 1841 (ν (С≡O)); 1143 (ν (С-O)); 669, 630 (ω (С ar -H)). Масс-спектр (ЭУ, 70 эВ, m/z (I отн. (%)): для С 11 O 5 H 8 Cr рассчитано [М]+ 272: найдено 272 [М]+(32), 216 [М-2CO]+(17), 188 [М-3CО]+(100), 136 [М-Cr(CO) 3 ]+(14). 1H-ЯМР, м.д. (acetone – d6): 4,27–4,33 (м., 2H, CH 2 ); 4,35-4,41 (м., 2H, CH 2 ); 5,31–5,35 (м., 2H, Ph*); 5,67–5,71 (м., 2H, Ph*).
η6-(2-фенил-1,3-бензодиоксол)хромтрикарбонил (7). Выход составил 0,7 г (37 %). Т пл = 90– 93 °С. ВЭЖХ – 1 пик, τ = 8,35 мин. УФ-спектр (MeCN, H 2 O, λ/нм: 218, 315. ИК-спектр (KBr), ν/см–1: 3089(ν (С ar -H)); 2921, 2850((ν С-H)); 1961, 1886, 1853 (ν (С≡O)); 1143 (ν (С-O)); 902, 798, 759, 661, 626, 530, 478(ω (С ar -H)). Масс-спектр (ЭУ, 70эВ, m/z (I отн. (%)): для С 16 O 5 H 10 Cr рассчитано [М]+ 334: найдено 334 [М]+(20), 278 [М-2CO]+(8), 250 [М-3CO]+(100), 198 [М-Cr(CO) 3 ]+(12), 173 [М-Ph-Cr(CO) 3 ]+(64). 1H-ЯМР, м.д. (acetone – d6): 5,35–5,39 (м., H,BzCr); 5,62–5,67 (м., H, BzCr); 5,88– 5,90 (м., H, BzCr); 5,94–5,97 (м., H, BzCr); 6,86–6,98(1H, CH); 6,91–6,95 (м., 2H, Ph); 7,48–7,58 (м., 2H, Ph); 7,70–7,73 (м., 1H, Ph).
Выводы
В заключение следует отметить, что в результате проведенного исследования были впервые синтезированы и охарактеризованы с помощью различных физико-химических методов анализа η6-(арен)хромтрикарбонильные комплексы с 1,3-бензодиоксольными и 1,4-бензодиоксановыми лигандами, которые получались двумя независимыми методами: реакцией предварительно полученных свободных от металла гетероциклов 2 – 4 , с гексакарбонилом хрома в кипящей смеси ок-тан-диглим (1:1) (метод А) и координацией этих лигандов с триамминхромтрикарбонилом (метод В). Показано, что последний метод дает более высокие выходы и позволяет синтезировать более широкий круг гетероциклических π-комплексов хрома.
Авторы статьи выражают благодарность сотрудникам химического факультета Нижегородского государственного университета им. Н.И. Лобачевского: ведущему инженеру В.И. Фаерма-ну за регистрацию масс-спектров и к.х.н. Ю.Б. Малышевой за регистрацию ЯМР 1Н-спектров.
Работа выполнена при финансовой поддержке Министерства наука и высшего образования Российской федерации, проект № 0729-0039 в рамках базовой части государственного задания.
Список литературы Синтез новых 6-(арен)хромтрикарбонильных комплексов с 1,3-бензодиоксольными и 1,4-бензодиоксановыми лигандами
- Goodman, L. Goodman & Gilman's Pharmacological Basis of Therapeutics / L. Goodman // New York: McGraw-Hill, 2011. - P. 2084.
- Касьян, Л. Оксаазагетероциклы на основе аминоспиртов, эпоксидов и азиридинов: монография / Л.И. Касьян, В.А. Пальчиков, А.В. Токарь. - Днепропетровск: Изд-во ДНУ, 2012. - 644 c.
- Jaouen, G. Bioorganometallics: Biomolecules, Labeling, Medicine / G. Jaouen. - Weinheim: Wi-ley-VCH, 2006. - 444 p.
- Ahmed, B. Chemistry and Pharmacology of Benzodioxanes / B. Ahmed, H. Habibullah, S. Khan // Org. Chem. - 2008. - № 4. - P. 65-77. DOI: 10.1002/CHIN.200936265.
- Pilkington, L. Synthesis and Biology of 1,4-benzodioxane Lignan Natural Products / L. Pilking-ton, D. Barker // Royal Soc. Chem. - 2015. - № 32. - P. 1369-1388. DOI: 10.1039/c5np00048c.
- Даукшас, В.К. 3-Фенил- или а-фенилзамещенные 2-алкил-аминометилбензо-диоксаны-1,4 / B.К. Даукшас, А.П. Ластаускас // ЖОрХ, сб. Биологически активные соединения. - 1968. - C.286-290.
- Butler, P.A. Biological Organometallic Chemistry of B12 / P.A. Butler, B. Krautler // Bioorga-nometallic Chemistry. - 2006. - № 17. - P. 1-55. DOI: 10.1007/3418_004.
- Jaouen, G. Chirality in Organometallic Anticancer Complexes / G. Jaouen, M. Salmain // Bioor-ganometallic Chemistry. - 2015. - P. 85-115. DOI: 10.1002/9783527673438.ch03.
- Moriuchi, T. Ferrocene-Peptide Bioconjugates / T. Moriuchi, T. Hirao // Top. Organomet. Chem. - 2006. - № 17. - P. 143-175.
- Allardyce, C.S. Medicinal Properties of Organometallic Compounds / C.S. Allardyce, P. Dyson // Top Organomet Chem. - 2006. - P. 177-210. DOI: 10.1007/3418_001.
- Severin, K. Organometallic Receptors for Biologically Interesting Molecules / K. Severin // Top Organomet Chem. - 2006. - P. 123-142. DOI: 10.1007/B97910.
- Green, T.W. Protective Groups in Organic Synthesis / T.W. Green, P.G. Wuts. - T.W. John Wiley & Sons, 2007. - 545 p.
- МакОми, Дж. Защитные группы в органической химии / Дж. МакОми. - М.: Мир, 1976. -P. 142-153.
- Пат. 87268 ЧССР. Preparing Cycle Simple and Substituted Alkylene Ether from Pyrocatechol or it's Derivatives and Alkylene Dihalides // С.А. - 1960. - V. 54. - 8862.
- Cole, E.R. An Improved Method for the Synthesis of 2,2-disubstituted and 2-monosubstituted 1,3-benzodioxoles / E.R. Cole, G. Crank, H. Minh // Austr. J. Chem. - 1980. - V. 33. - P. 675-680. DOI: 10.1071/CH9800675.
- Пат. WO 2017/158404. An Improved Method for the Preparation of Alkylenedioxybenzene Compounds. Заявл. 05.05.2016. Опубл. 21.09.2017.
- Gupta, S.D. Eco-sustainable Synthesis and Biological Evaluation of 2-phenyl 1, 3-benzodioxole Derivatives as Anticancer, DNA Binding and Antibacterial Agents / S.D. Gupta, G.B. Rao, M.K. Bom-maka // Arabian J. Chem. - 2016. - V. 9. - P. 1875-1883. DOI: 10.1016/j.arabjc.2014.08.004.
- Nicholls, B. The Organic Chemistry of the Transition Elements. Part I. Tricarbonylchromium Derivatives of Aromatic Compounds / B.Nicholls, M. Whiting // J. Chem. Soc. - 1959. - P. 551-556. DOI: 10.1039/JR9590000551.
- Silverthorn, W.E. Arene Transition Metal Chemistry / W.E. Silverthorn // Adv. Organomet. Chem. - 1975. - V. 13. - P. 69-86.
- Кальдераццо, Ф. Карбонилы металлов, их получение, структура и свойства // Органические синтезы через карбонилы металлов: пер. с англ. / под ред. А.Н. Несмеянова. - М.: Мир, 1970. - С. 11-211.
- Organometallic п-Complexes: XX. The Preparation of Styrenetricarbonylchromium / M.D.Rausch, G.A. Moser, E.J. Zaiko, A.L. Lipman // J. Organomet. №em. - 1970. - V. 23. - P. 185192. DOI: 10.1016/S0022-328X(00)92813-4.
- Реакция фенилсодержащих N-замещенных 1,3-оксазолидинов и 1,3-оксазинанов с триам-минхромтрикарбонилом / А.Н. Артемов, Е.В. Сазонова, Н.А. Аксенова и др. // Изв. АН. Сер. хим. -2019.- С. 1548-1554.
- Вайсбергер, А. Органические растворители / А. Вайсбергер, Э. Проскауэр, Дж. Риддик и др. - М.: И. Л., 1958. - 520 с.
- Post, H.W. The Reaction of Certain Orthoesters with Aldehides / H.W. Post // J. Org. Chem. -1940. - V. 5. - P. 244-249.
- Bonthrone, W. The Methylenation of Catechols / W. Bonthrone, J.W. Cornforth // J. Chem. Soc. - 1969. - P. 1202-1204. DOI: 10.1039/j39690001202.
- Агрономов, А.Е. Лабораторные работы в органическом практикуме / А.Е. Агрономов, Ю.С. Шабаров. - М.: Химия, 1974. - С. 63-64.


