Синтез новых ацетанилидных производных нуклеиновых оснований
Автор: Мережкина Д.В., Козлов С.Ю., Плужникова А.Р., Тужикова М.О., Новиков М.С., Озеров А.А.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Статья в выпуске: 1 (69), 2021 года.
Бесплатный доступ
Резюме: N-Алкилирование нуклеиновых оснований и 5-(фениламино)урацила 3,5-диметилхлорацетанилидом легко протекает в среде безводного ДМФА в присутствии карбоната калия при комнатной температуре. В отличие от других использованных субстратов, 5-(фениламино)урацил дает преимущественно N1,N3-дизамещенный продукт алкилирования.
Урацил, тимин, цитозин, аденин, 5-(фениламино)урацил, хлорацетанилид
Короткий адрес: https://sciup.org/142229370
IDR: 142229370 | УДК: 547.856.1
Текст научной статьи Синтез новых ацетанилидных производных нуклеиновых оснований
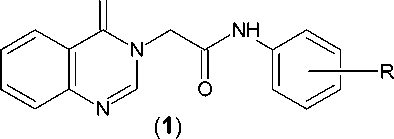
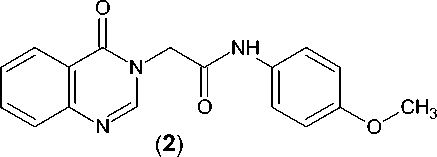
Разнообразные производные (1) хиназо-лин-4(3Н)-она – конденсированной пиримидиновой гетероциклической системы, имеющие фрагменты ацетанилида в качестве заместителя при атоме азота N3, проявляют, в зависимости от природы последнего, выраженную анти-депрессантную, анксиолитическую [2], ноотропную и противогипоксическую активность [3]. При этом N-(4-метоксифенил)-2-(2-оксохиназолин-3(4Н)-ил)ацетамид (хиназофен) (2) оказывает также мощное церебропротективное действие при нарушениях мозгового кровообращения [1]. Для этого соединения и разработанной на его основе лекарственной формы недавно в полном объеме были завершены доклинические исследования [5].
В связи с этим представляет значительный интерес получение и исследование ацетанилидных производных других пиримидиновых соединений, в частности, нуклеиновых оснований и их аналогов, также содержащих пиримидиновые циклы в своей структуре.
O
ЦЕЛЬ РАБОТЫ
Синтез новых ацетанилидных производных нуклеиновых оснований как потенциальных фармакологически активных веществ.
МЕТОДИКА ИССЛЕДОВАНИЯ
Спектры ЯМР 1Н и 13С регистрировали на спектрометре «Bruker Avance 400» (400 МГц для 1H и 100 МГц для 13С) в ДМСО-D6, внутренний стандарт тетраметилсилан. Интерпретацию спектров осуществляли с помощью лицензионной программы ACD/HNMR Predictor Pro 3.0 фирмы Advanced Chemistry Development (Канада). Температуры плавления измерены в стеклянных капиллярах на приборе Mel-Temp 3.0 (Laboratory Devices Inc., США).
3,5-Диметилхлорацетанилид (3). К раствору 20,0 мл (0,160 моль) 3,5-диметиланилина и 15,0 мл (0,186 моль) безводного пиридина в 200 мл 1,2-дихлорэтана добавляют в течение 15 мин при интенсивном перемешивании при температуре 0–5 оС 13,0 мл (0,163 моль) хлора-цетилхлорида.
Перемешивают 1 ч при комнатной температуре, реакционную массу промывают водой, 5%-м раствором хлористоводородной кислоты, водой, сушат сульфатом магния, фильтруют, фильтрат упаривают в вакууме, твердый остаток кристаллизуют из изопропилового спирта и получают 24,8 г (78 %) соединения ( 3 ) в виде светложелтого игольчатого кристаллического вещества, Т. пл. – 142–145 оС.
Спектр ЯМР 1Н, δ, м. д.: 2,24 с (6Н, СН 3 ); 4,22 с (2Н, СН 2 ); 6,72 с (1Н, арил); 7,22 с (2Н, арил); 10,11 с (1Н, NH).
Спектр ЯМР 13С, δ, м. д.: 20,99; 43,56; 117,13; 125,33; 137,79; 139,28; 164,42.
Общая методика синтеза ацетанилидных производных нуклеиновых оснований ( 4 – 8 ). Суспензию 0,025 моль соответствующего нуклеинового основания и 7,0 г (0,051 моль) тонкоизмельченного карбоната калия в 100 мл безводного ДМФА перемешивают при температуре 80–90 оС в течение 1 ч, охлаждают, добавляют в один прием 5,0 г (0,025 моль) 3,5-диметилхлорацетанилида ( 3 ) и перемешивают при комнатной температуре в течение 2 суток. Фильтруют, фильтрат упаривают в вакууме, остаток растирают с 50 мл воды, фильтруют, осадок промывают водой, сушат на воздухе и дважды кристаллизуют из смеси этиловый спирт – ДМФА (2 : 1).
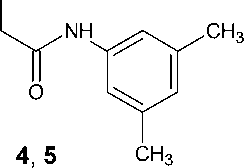
N-(3,5-Диметилфенил)-2-(2,4-диоксо-3,4-ди-гидропиримидин-1(2 Н )-ил)ацетамид ( 4 ).
Выход – 2,32 г (34 %), Т. пл. – 266–269 оС.
Спектр ЯМР 1Н, δ, м. д.: 2,23 с (6Н, СН 3 ); 4,62 с (2Н, СН 2 ); 5,50 д (1Н, 8 Гц, Н5); 6,71 с (1Н, арил); 7,20 с (2Н, арил); 7,60 д (1Н, 8 Гц, Н6); 10,10 с (1Н, NH); 11,31 с (1Н, NH).
Спектр ЯМР 13С, δ, м. д.: 21,01; 50,10; 100,48; 116,84; 125,01; 137,72; 137,79; 146,64; 151,10; 163,86, 165,45.
N-(3,5-Диметилфенил)-2-(5-метил-2,4-дио-ксо-3,4-дигидропиримидин-1(2 Н )-ил)ацетамид ( 5 ). Выход – 2,73 г (38 %). Т. пл. – 241–244 оС.
Спектр ЯМР 1Н, δ, м. д.: 1,79 с (3Н, СН 3 ); 2,23 с (6Н, СН 3 ); 4,48 с (2Н, СН 2 ); 6,71 с (1Н, арил); 7,19 с (2Н, арил); 7,45 с (1Н, Н6); 9,94 с (1Н, NH); 11,13 с (1Н, NH).
Спектр ЯМР 13С, δ, м. д.: 11,68; 20,93; 49,93; 108,04; 117,11, 125,02; 137,74; 138,39; 142,26: 151,08; 164,33; 165,53.
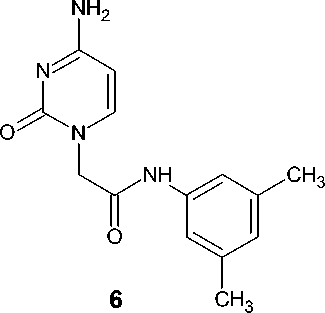
N-(3,5-Диметилфенил)-2-(4-амино-2-оксо-3,4- пиримидин-1(2 Н )-ил)ацетамид ( 6 ).
Выход – 2,93 г (43 %), Т. пл. – 301–304 оС.
Спектр ЯМР 1Н, δ, м. д.: 2,21 с (6Н, СН 3 ); 4,49 с (2Н, СН 2 ); 5,71 д (1Н, 7 Гц, Н5); 6,68 с (1Н, арил); 7,21 с (2Н, арил); 7,53 д (1Н, 7 Гц, Н6); 10,08 с (1Н, NH).
Спектр ЯМР 13С, δ, м. д.: 21,03; 51,52; 93,11; 116,79; 124,79; 137,69; 138,65; 147,09; 156,06; 166,28; 166,35.
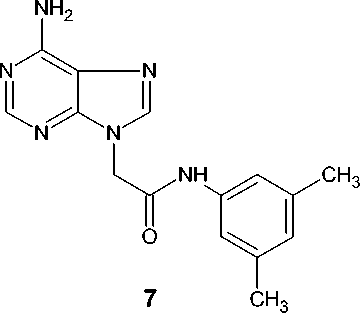
N-(3,5-Диметилфенил)-2-(6-амино-9 Н -пури-н-9-ил)ацетамид ( 7 ). Выход – 2,30 г (31 %), Т. пл. – 279–282 оС.
Спектр ЯМР 1Н, δ, м. д.: 2,23 с (6Н, СН 3 ); 5,05 с (2Н, СН 2 ); 6,72 с (1Н, арил); 7,20 с (2Н, арил); 7,81 с (1Н, Н8); 8,12 с (1Н, Н2); 10,17 с (1Н, NH).
Спектр ЯМР 13С, δ, м. д.: 20,94; 51,11; 117,16; 125,16; 137,83; 141,84; 144,95; 149,95; 151,82; 154,90; 155,91; 164,34.
N,N’-Ди(3,5-диметилфенил)-2,2’-[2,4-диоксо-5-(фениламино)пиримидин-1,3(2 Н ,4 Н )-диил]ди-ацетамид (8) . Выход – 3,68 г (56 %, считая на взятый 3,5-диметилхлорацетанилид), Т. пл. – 276–280 оС.
Спектр ЯМР 1Н, δ, м. д.: 2,22 с (6Н, СН 3 ); 2,23 с (6Н, СН 3 ); 4,68 с (4Н, СН 2 ); 6,67–6,73 м (3Н, фенил); 6,86 с (1Н, арил); 6,88 с (1Н, арил); 7,13–7,19 м (2Н, фенил); 7,20 с (2Н, арил); 7,24 с (2Н, арил); 7,82 с (1Н, Н6); 10,14 с (1Н, NH); 10,19 с (1Н, NH).
Спектр ЯМР 13С, δ, м. д.: 21,12; 51,15; 114,48; 115,24; 116,83; 116,88; 118,26; 124,92; 125,11; 128,95; 136,12; 137,81; 137,91; 138,51; 138,65; 146,01; 150,23; 161,00; 162,23; 164,93; 165,49.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
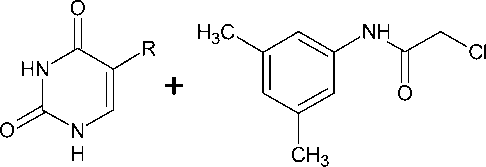
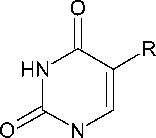
Известно, что N-алкилирование пиримидиновых оснований – урацила и тимина алкилирующими агентами со средней реакционной способностью в среде безводного ДМФА в присутствии карбоната калия или иного акцептора галогеноводорода не является региоселективным процессом и приводит к смесям N1-моно- и N1,N3-дизамещенных продуктов с преобладанием первых [4]. Нами обнаружено, что при использовании в качестве алкилирующего агента 3,5-диметил- хлорацетанилида (3) наблюдаются те же закономерности: реакция приводит к аналогичной смеси с общим выходом 60–70 %, при этом двукратная перекристаллизация продукта-сырца обеспечивает приемлемый (34–36 %) выход целевых N1-монозамещенных производных (4 и 5):
K2CO3
ДМФА
В тех же условиях цитозин и аденин селективно алкилируются, соответственно, в положения N1 и N9, приводя к монозамещенным продуктам ( 6 ) и ( 7 ) с выходом 43 и 31 % после двукратной перекристаллизации:
Иначе протекает алкилирование 5-(фени-ламино)урацила, в случае которого в указанных условиях реакции был получен N1,N3-диза-мещенный 5-(фениламино)урацил ( 8 ) в качестве единственного продукта:
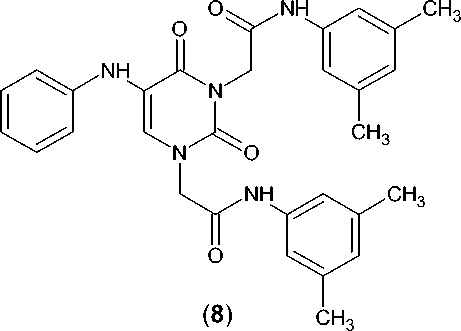
Очевидно, подобное течение реакции обусловлено очень низкой растворимостью исходного гетероцикла, имеющего липофильный ароматический фрагмент, в используемом высокопо- лярном апротонном растворителе, и образующийся первоначально N1-монозамещенный продукт, хорошо растворимый в ДМФА, легко подвергается дальнейшему алкилированию уже в положение N3. Все синтезированные нами ацетанилидные производные нуклеиновых оснований представляют собой белые или светло-желтые высокоплавкие кристаллические вещества, практически не растворимые в воде, мало растворимые в 95%-м этиловом спирте, растворимые в ДМФА и ДМСО. Их химическое строение доказано методом ЯМР 1Н и 13С спектроскопии. Вопрос о целесообразности расширения полученного ряда веществ в направлении диверсификации заместителей в ацетанилидном фрагменте будет решен после первичного фармакологического скрининга.
ЗАКЛЮЧЕНИЕ
На примере N-алкилирования нуклеиновых оснований показана возможность использования хлорацетанилидов в качестве алкилирующих агентов в одном из «классических» вариантов получения N-замещенных производных пиримидинового и пуринового ряда. Синтезированные соединения представляют интерес в качестве фармакологически активных веществ, обладающих психотропным и, возможно, противовирусным действием.
Список литературы Синтез новых ацетанилидных производных нуклеиновых оснований
- Патент № 2507199 Российская Федерация (2014). - Опубл. 20.02.2014, Бюлл. № 5. - Текст: непосредственный.
- Тюренков И. Н., Озеров А. А., Солодунова Е. А. [и др.] // Хим.-фарм. журн. - 2013. - Т. 47, № 5. -С. 7 - 10. - Текст: непосредственный.
- Тюренков И. Н., Озеров А. А., Шматова Е. Н. [и др.] // Хим.-фарм. журн. - 2015. - Т. 49, № 2. -С. 18 - 20. - Текст: непосредственный.
- Boncel S., Gondela A., Maczka M. [et al.] // Synthesis. - 2011. - Vol. 2011. - P. 603 - 610. - Direct text.
- Mishchenko E. S., Lazaryan J. S. // Annali d'ltalia. -2020. - Vol. 1. - № 5. - P. 23 - 26. - Direct text.


