Синтез новых цвиттерионных бензоил(5-(галогенметил)-5-метил-5,6-дигидротиазоло[2,3-b][1,3,4]тиадиазол-4-ий-2-ил) амидов
Автор: Тарасова Наталья Михайловна, Ким Дмитрий Гымнанович, Шарутин Владимир Викторович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 3 т.14, 2022 года.
Бесплатный доступ
Синтез 5-(бензоиламино)-2-(металлилсульфанил)-1,3,4-тиадиазола (2) осуществлен при взаимодействии 5-амино-1,3,4-тиадиазол-2-тиона с металлилхлоридом в этаноле в присутствии этилата натрия и последующим ацилированием аминогруппы бензоилхлоридом. Впервые показано, что электрофильная циклизация тиадиазола (2) под действием иода и брома в дихлорметане протекает с образованием соответствующих производных 2-бензоиламино-5-галогенметил-5-метил-5,6-дигидротиазоло[2,3- b ][1,3,4]тиадиазолия. При дальнейшем выделении продуктов реакции из ацетоновых растворов происходит дегидрогалогенирование с образованием бензоил(5-(галогенметил)-5-метил-5,6-дигидротиазоло[2,3- b ][1,3,4]тиадиазол-4-ий-2-ил)амидов, имеющих цвиттерионную природу. Строение полученных соединений исследовано методами ГХ-МС, ЯМР 1Н и 13С. Кроме того, кристаллическая структура соединения 5а также охарактеризована методом рентгеноструктурного анализа. Из данных РСА, проведенного при 293 К на автоматическом четырехкружном дифрактометре D8 Quest Bruker (двухкоординатный CCD - детектор, Мо К α-излучение, λ = 0,71073 Å, графитовый монохроматор), следует, что соединение 5а кристаллизуется в моноклинной кристаллической решетке. Элементарная ячейка состоит из четырех формульных единиц состава C13H12N3IS2O. Параметры ячейки цвиттериона 5а: a = 9,768(5), b = 10,984(5), c = 14,299(6) Å; β = 101,54(2) град.; V = 1503,2(12) Å3. Кристаллическая структура соединения 5а сформирована за счет внутри- и межмолекулярных коротких контактов S1···O1 (2,44 Å), O1···C4 (2,44 Å), а также большого количества слабых водородных связей N···Н-C, S···Н-C, О···Н-C 2,35-2,97 Å. Атом иода иодметиленового заместителя располагается над конденсированной гетероциклической системой, образуя единственный слабый внутримолекулярный контакт I1···C1 (3,66 Å) с мостиковым атомом углерода тиазоло-тиадиазолиевой системы. Полные таблицы координат атомов, длин связей и валентных углов для структуры 5а депонированы в Кембриджском банке структурных данных (№ 2168623; deposit@ccdc.cam.ac.uk; https://www.ccdc.cam.ac.uk).
5-(бензоиламино)-2-(металлилсульфанил)-1, 3, 4-тиадиазол, 5, 6-дигидротиазоло[2, 3-b][1, 3, 4]тиадиазолий, бензоил(5-(галогенметил)-5-метил-5, 6-дигидротиазоло[23-b][1, , 3, 4]тиадиазол-4-ий-2-ил)амид, синтез, строение, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147238624
IDR: 147238624 | УДК: 547.794.3 | DOI: 10.14529/chem220309
Текст научной статьи Синтез новых цвиттерионных бензоил(5-(галогенметил)-5-метил-5,6-дигидротиазоло[2,3-b][1,3,4]тиадиазол-4-ий-2-ил) амидов
дигидротиазоло[2,3-b][1,3,4]тиадиазол-4-ий-2-ил)амидов, имеющих цвиттерионную природу. Строение полученных соединений исследовано методами ГХ-МС, ЯМР 1Н и 13С. Кроме того, кристаллическая структура соединения 5а также охарактеризована методом рентгеноструктурного анализа. Из данных РСА, проведенного при 293 К на автоматическом четырехкружном дифрактометре D8 Quest Bruker (двухкоординатный CCD – детектор, МоКα-излучение, λ = 0,71073 Å, графитовый монохроматор), следует, что соединение 5а кристаллизуется в моноклинной кристаллической решетке. Элементарная ячейка состоит из четырех формульных единиц состава C13H12N3IS2O. Параметры ячейки цвиттериона 5а: a = 9,768(5), b = 10,984(5), c = 14,299(6) А; в = 101,54(2) град.; V = 1503,2(12) А3. Кристаллическая структура соединения 5а сформирована за счет внутри- и межмолекулярных коротких контактов S1···O1 (2,44 Å), O1···C4 (2,44 Å), а также большого количества слабых водородных связей N···Н–C, S···Н–C, О···Н–C 2,35–2,97 Å. Атом иода иодмети-ленового заместителя располагается над конденсированной гетероциклической системой, образуя единственный слабый внутримолекулярный контакт I1···C1 (3,66 Å) с мостиковым атомом углерода тиазоло-тиадиазолиевой системы. Полные таблицы координат атомов, длин связей и валентных углов для структуры 5а депонированы в Кембриджском банке структурных данных (№ 2168623; ; .
Перспективы применения соединений ряда 1,3,4-тиазола сложно переоценить. Электрон-дефицитный 1,3,4-тиадиазоловый цикл на сегодняшний день показан перспективным электро-накцептором для создания люминесцентных материалов [1]. Кроме того, известна и постоянно пополняется достаточно обширная подборка фармакологически активных структур, содержащих 1,3,4-тиадиазоловый фрагмент [2–6]. Следует отметить, что среди соединений 1,3,4-тиадиазолов бензоиламинопроизводные показали значительные результаты в противодействии развитию раковых клеток [3, 7] и антидепрессивную активность [8]. Отдельно стоит выделить конденсированные гетероциклические системы 1,3,4-тиадиазола, среди которых присутствуют тиазоло[3,2-а]пиримидины и имидазо[2,1-b] [1,3,4]тиадиазолы, обладающие противоопухолевым действием [9, 10], а также 1,2,4-триазоло[3,4-b]-1,3,4-тиадиазолы с выраженной противораковой и противо-микробной активностями [11, 12]. Авторы исследования [13] указывают на то, что внедрение цвиттерионных [1,3,4]тиадиазоло[3,2-а]пиримидиния-2-тиолатов в нанопокрытия ядро-оболочка повышает степень защиты поверхностей медицинских инструментов от развития биопленок грибов рода Candida.
Данных о получении конденсированных систем 5,6-дигидротиазоло[2,3- b ][1,3,4]тиадиазолия не так много в литературе, ранее галогенциклизацией соответствующих сульфанилалкенов были получены лишь некоторые производные данной системы [14]. Примечательно, что метод гало-генциклизации является весьма удобным и перспективным в плане синтеза конденсированных гетроциклических систем [15–22].
Экспериментальная частьСинтез 5-амино-2-(металлилсульфанил)-1,3,4-тиадиазола (2)
Растворяют 0,46 г Na (20 mmol) в 20 мл EtOH, прибавляют 2,00 г (15 ммоль) 5-амино-1,3,4-тиадиазол-2-тиона ( 1 ) и 1,44 мл (15 ммоль) металлилхлорида. Раствор перемешивают в течение 14 ч, отфильтровывают от осадка, осадок промывают 10 мл EtOH. Растворитель отгоняют под вакуумом. Остаток растворяют в 2 мл HCl (36 %). Нейтрализуют концентрированным раствором щелочи до pH ~ 7, экстрагируют дихлорметаном (три порции по 20 мл). Объединенный экстракт промывают 10 мл раствора HCl (10 %), 10 мл воды и сушат над CaCl 2 . Растворитель отгоняют. Соединение 2 выделяют в виде желтого прозрачного масла массой 1,52 г (54 %). Спектр ЯМР 1 H (500 МГц, CDCl 3 , м. д., J /Гц): 4,94–4,92 (м, 1Н, =СН 2 ); 4,90–4,88 (м, 1Н, =СН 2 ); 3,70 (с, 2Н, SCH 2 ); 1,86 (с, 3Н, CH 3 ). Спектр ЯМР 13C (126 МГц, ДМСО-d6, м. д.): 170,0; 149,4; 140,3; 114,8; 41,9; 20,5. MS EI: m/z ( I , %): 187 [M]+• (99,5), 174 (9), 173 [M–CН 2 ]+• (8), 172 [M–CH 3 ]+ (100), 154 [M– SH]+ (9), 112 (42), 87 (5), 86 (6), 78 (9), 74 (8), 72 [SC 3 Н 5 ]+• (10), 70 (9), 69 (18), 68 (11), 60 (17), 59 [С 2 Н 3 S]+ (3), 56 [SC 2 ]+• (2), 55 (24), 53 (15), 45 (9), 43 (28), 42 (19), 41 (11), 39 (25). Найдено: C 38,45; H 4,80. C 6 H 9 N 3 S 2 . Вычислено: C 38,48; H 4,84.
Синтез 5-бензиоламино-2-(металлилсульфанил)-1,3,4-тиадиазол (3)
Смесь соединения 2 (0,7 г, 4 ммоль) эквимолярного количества бензоилхлорида 0,44 мл (4 mmol) и 1,21 мл (4 ммоль) триэтиламина в 20 мл безводного диоксана перемешивают в течение 12 ч, отфильтровывают, промывают 5 мл диоксана. Растворитель отгоняют под вакуумом, остаток промывают 5 мл воды от примеси триэтиламмоний хлорида, просушивают и перекри-сталлизовавают из i -PrOH. Получают 0,83 г (77 %) соединения 3 в виде длинных белых игл с т. пл. 138-140 ° C. Спектр ЯМР 1 H (500 МГц, ДМСО-d6, м. д., J /Гц): 13,13 (уш. с., 1Н, NH); 8,158,08 (м, 2H, H аром. ); 7,67 (t, 3J = 7,4 Гц, H аром. ); 7,57 (т, 2H, 3J = 7,7 Гц, H аром. ); 4,98–5,00 (м, 1H,
=CH2); 4,91–4,92 (м, 1H, =CH 2 ); 3,89 (с, 2H, SCH 2 ); 1,83 (с, 3H, CH 3 ). Спектр ЯМР 13C (126 МГц, ДМСО-d6, м. д.): 165,1; 159,9; 158,4; 139,96; 133,0; 131,2; 130,3; 128,6; 128,5; 128,4; 115,2; 40,95; 20,6. Найдено: C, 53,54; H, 4,48. C 13 H 13 N 3 OS 2 . Вычислено: C, 53,58; H, 4,50.
Синтез бензоил(5-(иодметил)-5-метил-5,6-дигидротиазоло[2,3-Ь] [1,3,4]тиадиазол-4-ий-2-ил)амида (5а)
К раствору 0,25 г (0,9 ммоль) соединения 3 в 1 мл CH 2 C1 2 прибавляют при перемешивании 0,46 г (1,8 ммоль) иода в виде 8,3 мл насыщенного раствора в CH 2 Cl 2 (55,34 мг/мл). Выдерживают реакционную смесь при комнатной температуре в течение 48 ч, растворитель испаряют, оставшееся черное масло растворяют в 15 мл ацетона, прибавляют избыток NaI и 5 мл Et 2 O по каплям. Через 24 часа при –17 °C отфильтровывают образовавшийся осадок и перекристаллизовывают из EtOH. Получают 0,28 г (72 %) соединения 5а в виде прозрачных желтых кристаллов с т. пл. 182 ° C. ИК-спектр, ( v , см - 1): 1533 (С=О), 1499, 1485, 1454, 1381, 1373, 1303, 1082, 882, 725, 705, 691. Спектр ЯМР 1H (500 МГц, ДМСО-d6, м. д., J /Гц): 8,14 (д, 2Н, 3J = 7,8 Гц, H аром. ); 7,73 (т, 1Н, 3J = 7,3 Гц, H аром. ); 7,61 (т, 2Н, 3J = 7,7 Гц, H аром. ); 4,09 (c, 2H, CH 2 I); 3,95 (д, 2H, 2J = 11,3 Гц, 6-CH 2 ); 3,79 (д, 2H, 2J = 11,3 Гц, 6-CH 2 ); 1,90 (с, 3H, CH 3 ). Спектр ЯМР 13C (126 МГц, ДМСО-d6, м. д.): 178,2; 172,1; 162,9; 136,7; 131,2; 128,3 (2С); 128,1 (2С); 71,6; 44,9; 23,8; 13,5. Найдено: C, 37,44; H, 2,85. C 13 H 12 IN 3 OS 2 . Вычислено: C, 37,42; H, 2,90.
Синтез бензоил(5-(бромметил)-5-метил-5,6-дигидротиазоло[2,3- b ][1,3,4]тиадиазол-4-ий-2-ил)амида (5b)
К раствору 0,25 г (0,9 ммоль) соединения 3 в 10 мл CH2C12 по каплям при перемешивании и охлаждении до 0 °С прибавляют раствор 0,072 мл Br2 в 3 мл CH2C12. Реакционную смесь выдерживают 48 ч при комнатной температуре, растворитель испаряют, маслообразный остаток рас- творяют в ацетоне. Выпавший бесцветный осадок отфильтровывают и просушивают. Получают 0,27 г (79 %) соединения 5b с т. пл. 240 °C. ИК-спектр, (у, см-1): 2679, 1651 (С=О), 1548, 1499, 1454, 1451, 1425, 1371, 1323, 1003, 1271, 1227, 1086, 1074, 901, 716, 694, 685. Спектр ЯМР 1H (500 МГц, ДМСО-d6, м. д., J/Гц): 8,14 (д, 2Н, 3J = 7,0 Гц, Hаром.); 7,73 (т, 1Н, 3J = 7,4 Гц, Hаром.); 7,61 (т, 2Н, 3J = 7,7 Гц, Hаром.); 4,20 (д.д, 2H, 2J = 21,8 Гц, 4J = 11,9 Гц, CH2I); 4,07 (д. д, 2H, 4J = 11,9 Гц, 4J = 10,0 Гц, 6-CH2); 1,87 (с, 3H, CH3). Спектр ЯМР 13C (126 МГц, ДМСО-d6, м. д.): 172,3; 167,5; 164,3; 133,8; 130,4; 128,8 (2С); 128,7 (2С); 72,9; 44,4; 38,6; 23,6. Найдено: C, 42,02; H, 3,19. C13H12BrN3OS2. Вычислено: C, 42,17; H, 3,27.
ИК-спектр соединений 5a,b записывали на ИК-Фурье спектрометре Shimadzu IR Affinity-1S в таблетке KBr в области 4000 - 400 см - 1.
Масс-спектры (ЭУ, 70 эВ) сняты на хромато-масс-спектрометре фирмы SHIMADZU GCMS QP-2010 Ultra (пики с интенсивностью менее 5 % не учитывались).
Спектры 1H ЯМР и 13C ЯМР записаны на приборе Bruker Avance-500 (внутренний стандарт – TMS).
Элементный анализ на C и H выполнен на элементном анализаторе Carlo Erba CHNS-O EA 1108.
Рентгеноструктурный анализ ( РСА ) кристалла 5a проведен на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Bruker (Mo К а -излучение, X = 0,71073 А, графитовый монохроматор). Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены с помощью программ SMART и SAINT-Plus [23]. Все расчеты по определению и уточнению структур выполнены с помощью программ SHELXL/PC [24] OLEX2 [25]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Положение атомов водорода уточняли по модели наездника ( U изо (H) = 1,2 U экв (C)) . Кристаллографические данные и результаты уточнения структур приведены в табл. 1, геометрические характеристики соединения 5а – в табл. 2.
Таблица 1
Кристаллографические данные, параметры эксперимента и уточнения структуры 5а
|
Параметр |
Соединение 5а |
|
Формула |
C 13 H 12 N 3 IS 2 O |
|
М |
417,28 |
|
Т , К |
293,15 |
|
Сингония |
Моноклинная |
|
Пр. группа |
P21/c |
|
a , Å |
9,768(5) |
|
b, Å |
10,984(5) |
|
c, Å |
14,299(6) |
|
а ,° |
90,00 |
|
β,º |
101,54(2) |
|
Y ,° |
90,00 |
|
V , Å3 |
1503,2(12) |
|
Z |
4 |
|
р (выч.), г/см3 |
1,844 |
|
ц , мм-1 |
2,406 |
|
F (000) |
816,0 |
|
Размер кристалла, мм |
0,5 × 0,48 × 0,08 |
|
Область сбора данных по 2 9 , град. |
5,94 до 68,78 |
|
Интервалы индексов отражений |
–15 ≤ h ≤ 15, –17 ≤ k ≤ 17, –22 ≤ l ≤ 21 |
|
Измерено отражений |
38748 |
|
Независимых отражений |
6316 [ R int = 0,0256, R sigma = 0,0187] |
|
R int |
0,0256 |
|
Переменных уточнения |
182 |
Окончание табл. 1
|
Параметр |
Соединение 5а |
|
GOOF |
1,035 |
|
R -факторы по F 2 > 2 о ( F 2) |
R 1 = 0,0378, wR 2 = 0,0896 |
|
R -факторы по всем oтражениям |
R 1 = 0,0562, wR 2 = 0,0984 |
|
Остаточная электронная плотность (min/max), e/A3 |
1,32/-2,00 |
Таблица 2
Длины связей и валентные углы в соединении 5a
|
Связь |
d , A |
Угол |
co, град. |
|
I(1) - C(6) |
2,141(3) |
C(3)C(6)I(1) |
116,08(16) |
|
N(1) - C(3) |
1,481(3) |
N(1)C(3)C(6) |
109,17(18) |
|
O(1) - C(7) |
1,253(3) |
O(1)C(7)N(3) |
124,34(19) |
|
N(3) - C(7) |
1,347(3) |
N(3)C(7)C(11) |
116,30(18) |
|
N(3)-C(2) |
1,331(2) |
N(3)C(2)S(1) |
128,85(14) |
|
N(2) - N(1) |
1,361(2) |
N(2)N(1)C(3) |
121,85(17) |
|
S(1) - C(2) |
1,810(2) |
C(1)S(1)C(2) |
87,14(10) |
|
S(1) - C(1) |
1,713(2) |
S(1)C(1)S(2) |
132,84(13) |
|
S(2) - C(1) |
1,715(2) |
N(1)C(1)S(2) |
115,70(15) |
|
S(2) - C(4) |
1,828(2) |
C(1)S(2)C(4) |
90,33(11) |
Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 2168623; ; .
Обсуждение результатов
Ранние исследования электрофильной циклизации алкенилсульфанилпроизводных различных тиазоловых систем показывают аннелирование пяти - или шестичленных циклов в зависимости от строения алкенильного радикала и природы тиазолового гетероцикла [14, 20, 26]. Было продемонстрировано, что S-аллилпроизводные 1,3,4-тиадиазолов реагируют с иодом и бромом неселективно с образованием смеси солей 5,6-дигидротиазоло[2,3- b ][1,3,4]тиадиазолия и 6,7-дигидро-5 Н -[1,3,4]тиадиазоло[2,3- b ][1,3]тиазиния [14]. Также показано, что наличие аминогруппы в 5-амино-2-аллилсульфанил-1,3,4-тиадиазоле препятствует протеканию циклизации под действием иода и брома, существенно снижая выход смеси продуктов реакции. Замена аминогруппы на бензоиламиногруппу, способствует повышению выхода продуктов галогенциклизации [27]. В настоящей работе 5-(бензоиламино)-2-(металлилсульфанил)-1,3,4-тиадиазол ( 3 ) был получен последовательными алкилированием и ацилированием 5-амино-1,3,4-тиадиазол-2-тиона ( 1 ).
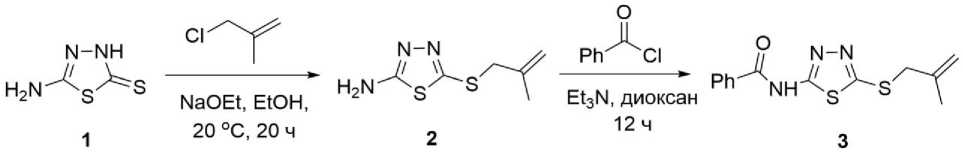
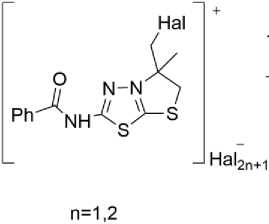
Металлилсульфанил-1,3,4-тиадиазол ( 3 ) был исследован в реакциях циклизации под действием иода и брома. В данном случае, в от отличие галогенциклизации аллилсульфанилпроизвод-ного, реакция протекает с преимущественным аннелированием тиазолового цикла и образованием иодида или бромида 2-бензоиламино-5-галогенметил-5-метил-5,6-дигидротиазоло[2,3- b ][1,3,4]тиадиазолия ( 4a,b ).
l2, СН2С12
20 °C,48ч 3 -------------------*
или Br2, СН2С12, О °C - 20 min
20 °C - 24 ч
4а Hal -1
4b Hal - Вг
4b: ацетон, перекр. EtOH
-НВг, -Br2
4а: ацетон, Et2O, Nai, -17 °C, 24 ч, перекр. EtOH
-Hl3
5а Hal -1
5b Hal - Br
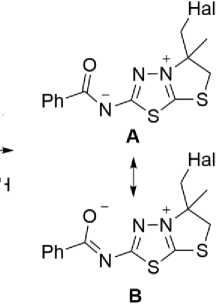
Примечательным является также, что реакция не останавливается на стадии получения солей 4a,b . В результате дальнейшего отщепления HBr и HI3 образуются цвитерионные бензоил(5-(галогенметил)-5-метил-5,6-дигидротиазоло[2,3- b ][1,3,4]тиадиазол-4-ий-2-ил)амиды ( 5a,b ). В ИК-спектрах соединений 5а,b наблюдаются характерные для вторичных амидов интенсивные полосы при 1304, 1533 см-1 и при 1303, 1548, 1651 см-1 соответственно [28].
Исследование соединения 5a методом РСА показывает, что структура имеет практически плоское строение, из плоскости значительно выступают только метильная группа (торсионный угол С5–C3–C4–N1 составляет117.5(2) Å) и иодметиленовый фрагмент (торсионный угол С6– C3–N1–С4 составляет 122.5(2) Å), амидная группировка за счет наличия короткого контакта S1···O1 (2.44 Å) лежит в плоскости тиадиазолового цикла, бензольное кольцо слегка развернуто относительно плоскости конденсированных циклов и амидной группировки, торсионный угол N3-C7-C11-C12 составляет всего 14.7(3) ° (рис. 1).
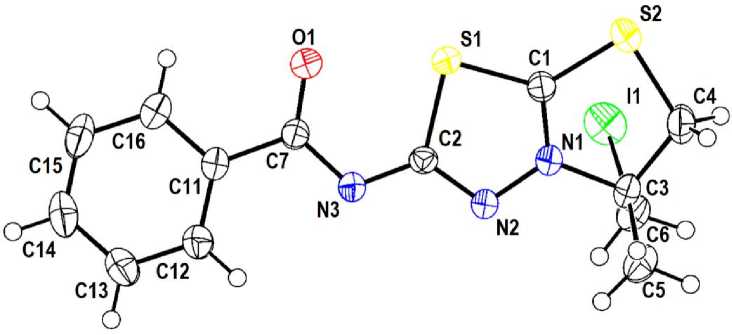
Рис. 1. Строение соединения 5a
Соединение 5а кристаллизуется в моноклинной кристаллической решетке, характеризующейся большим разнообразием внутри- и межмолекулярных коротких контактов S1···O1 (2,44 Å), O1···C4 (2,44 Å) и слабых водородных связей N···Н–C, S···Н–C, О···Н–C, величины которых варьируются в пределах 2,35–2,97 Å (рис. 2). Плотность кристаллической решетки 1,844 г/см3, что существенно меньше, чем у похожих структур, кристаллизующихся в форме трииодидов [14, 20]. Следует отметить координацию атома иода иодметиленового заместителя над тиазолотиадиазоловой системой за счет короткого контакта I1···C1 (3,66 Å), чего не наблюдается для похожих структур, в случае наличия трииодид-аниона и отсутствия возможности для формирования цвиттерионной структуры [14]. Таким образом, атом иода, очевидно, оказывается недоступен для образования коротких контактов и галогенных связей с противоионом, что способствует отрыву молекулы HI3 и образованию цвиттерионного соединения 5а .
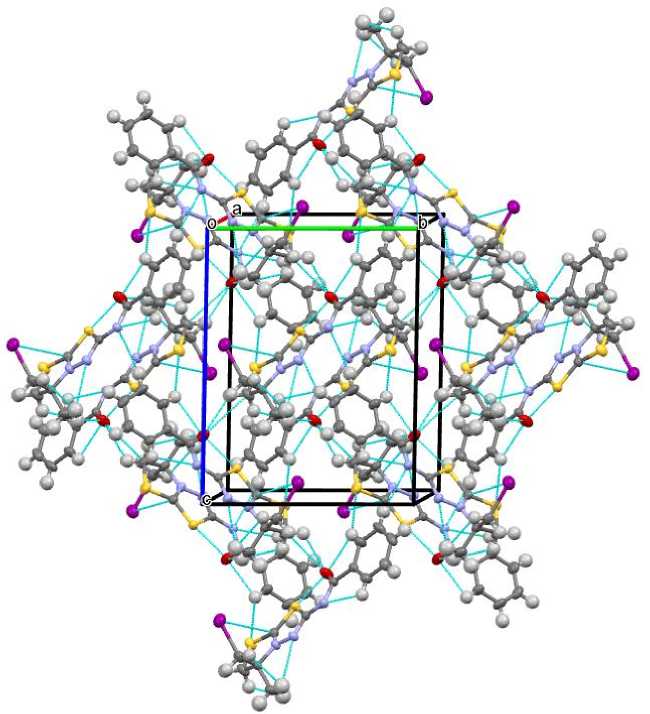
Рис. 2. Вид кристаллической решетки цвиттериона 5a вдоль оси а
Выводы
Впервые получены цвиттерионные бензоил(5-(галогенметил)-5-метил-5,6-дигидро-тиазоло[2,3- b ][1,3,4]тиадиазол-4-ий-2-ил)амиды при взаимодействии 5-(бензоиламино)-2-(металлилсульфанил)-1,3,4-тиадиазола с иодом и бромом. Молекула бензоил(5-(иодметил)-5-метил-5,6-дигидротиазоло[2,3- b ][1,3,4]тиадиазол-4-ий-2-ил)амида имеет практически плоское строение за исключением выступающих из плоскости иодметиленового и метильного заместителей и кристаллизуется в моноклинной кристаллической решетке, формируемой внутри- и межмолекулярными контактами S1···O1, O1···C4 и водородными связями N···Н–C, S···Н–C, О···Н–C.
Работа выполнена при поддержке Министерства науки и высшего образования Российской Федерации, FENU-2020-0019
Список литературы Синтез новых цвиттерионных бензоил(5-(галогенметил)-5-метил-5,6-дигидротиазоло[2,3-b][1,3,4]тиадиазол-4-ий-2-ил) амидов
- Synthesis of New, Highly Luminescent Bis(2,2'-bithiophen-5-yl) Substituted 1,3,4-Oxadiazole, 1,3,4-Thiadiazole and 1,2,4-Triazole / A.S. Kostyuchenko, V. L. Yurpalov, A. Kurowska et al. // Beilstein J. Org. Chem. 2014. No. 10. P. 1596-1602. DOI: 10.3762/bjoc.10.165.
- Biological Activities of Imidazo[2,1-6][1,3,4]thiadiazole Derivatives: a Review / B.A. Bhongade, S. Talath, R.A. Gadad et al. // J. Saudi Chem. Soc. 2016. Vol. 20. P. S463-S475. DOI: 10.1016/j .jscs.2013.01.010.
- Synthesis, Characterization and Evaluation of Anticancer Activity of Some New Schiff Bases of 1,3,4-Thiadiazole Derivatives / A. Naskar, T. Singha, T. Guria et al. // Int. J. Pharm. Pharm. Sci. 2015. Vol. 7, I3. P. 397-402.
- Kalantarian S.J., Kefayati H., Montazeri N. Synthesis and Antimicrobial Evaluation of Novel tris-Thiadiazole Derivatives // J. Heterocycl. Chem. 2022. P. 1-7 DOI: 10.1002/jhet.4466.
- Kaur P. 1,3,4-Thiadiazole and its Derivatives: a Review on Biological Activities // Int. J. Univers. Pharm. Bio Sci. 2017. Vol. 3(6). P. 246-280.
- 1,3,4-Thiadiazole: A Biologically Active Scaffold / H. Khalilullah, M.M. Khan, D. Mahmood et al. // Int. J. Pharm. Pharm. Sci. 2014. Vol. 6. P. 8-15.
- Janowska S., Paneth A., Wujec M. Cytotoxic Properties of 1,3,4-Thiadiazole Derivatives -A Review, Molecules. 2020. Vol. 25. P. 4309-4349. DOI: 10.3390/molecules25184309.
- Synthesis of 2-Amino-5-sulfanyl-1,3,4-thiadiazole Derivatives and Evaluation of Their Antidepressant and Anxiolytic Activity / F. Clerici, D. Pocar, M. Guido et al. // J. Med. Chem. 2001. Vol. 44. P. 931-936. DOI: 10.1021/jm001027w.
- Synthesis and Antitumor Activity of New Sulfonamide Derivatives of Thiadiazolo[3,2-a]pyrimidines / N.S. El-Sayed, E.R. El-Bendary, S.M. El-Ashry et al. // Eur. J. Med. Chem. 2011. Vol. 46. P. 3714-3720. DOI:10.1016/j.ejmech.2011.05.037.
- Imidazo[2,1-6][1,3,4]thiadiazoles with Antiproliferative Activity Against Primary and Gemcita-bine-resistant Pancreatic Cancer Cells / S. Cascioferro, G.L. Petri, B. Parrino et al. // Eur. J. Med. Chem. 2020. Vol. 189. P. 112088. DOI: 10.1016/j.ejmech.2020.112088.
- Synthesis and Biological Activities of 3,6-Disubstituted-1,2,4-triazolo-1,3,4- thiadiazole Derivatives / L. Lin, H. Liu, D. Wang et al. // Bull. Chem. Soc. Ethiop. 2018. Vol. 31. P. 481-489. DOI: 10.4314/bcse.v31i3.12.
- Synthesis and Anticancer Activity of Novel 3,6-Disubstituted 1,2,4-Triazolo-[3,4-6]-1,3,4-thiadiazole Derivatives / G. Charitos, D.T. Trafalis, P. Dalezis, et al. // Arabian J. Chem. 2019. Vol. 12. P. 4784-4794. DOI: 10.1016/j.arabjc.2016.09.015.
- Anti-biofilm Fe3O4@C18-[1,3,4]thiadiazolo[3,2-a]pyrimidin-4-ium-2-thiolate Derivative Core-shell Nanocoatings / R. Olar, M. Badea, C. Maxim et al. // Materials. 2020. Vol. 13. P. 4640-4654. DOI: 10.3390/ma13204640.
- Tarasova N.M., Kim D.G., Slepukhin P.A. Halocyclization of S- and N-alkenyl Derivatives of 5-Methyl-1,3,4-thiadiazole-2-thione // Chem. Heterocycl. Compd. 2015. Vol. 51. P. 923-928. DOI: 10.1007/s10593-015-1797-z.
- Aggarwal T., Kumar S., Verma A.K. Iodine-mediated Synthesis of Heterocycles via Electro-philic Cyclization of Alkynes / Org. Biomol. Chem. 2016. Vol. 14. P. 7639-7653. DOI: 10.1039/C6OB01054G.
- Ynamides Enabled 6-, 7-, and 8-Endo-dig Iodocyclization of Ethoxyethyl Ethers: Rapid Construction of Medium-sized Oxacycles at Room Temperature / T. Okitsu, A. Namura, S. Kondo et al. // Org. Chem. Front. 2020. Vol. 7. P. 879-884. DOI: 10.1039/D0QO00153H.
- Halogen-Induced Controllable Cyclizations as Diverse Heterocycle Synthetic Strategy / H. China, R. Kumar, K. Kikushima et al. // Molecules. 2020. Vol. 25. P. 6007-6039. DOI: 10.3390/molecules25246007.
- Halonium-Induced Polyene Cyclizations / A.C.A. D'Hollander, L. Peilleron, T.D. Grayfer et al. // Synthesis (Germany). 2019. Vol. 51. P. 1753-1769. DOI: 10.1055/s-0037-1612254.
- Batchu H., Bhattacharyya S., Batra S. Iodine-Mediated Intramolecular Electrophilic Aromatic Cyclization in Allylamines: A General Route to Synthesis of Quinolines, Pyrazolo[4,3-6]pyridines, and Thieno[3,2-6]pyridines // Org. Lett. 2012. Vol. 14. P. 6330-6333. DOI: 10.1021/ol303109m.
- Kim D.G., Sudolova N.M., Slepuhin P.A. Investigation of the Halocyclization of S- and N-allyl Derivatives of 2-Benzothiazolethione / Chem. Heterocycl. Comd. 2011. Vol. 47. P. 631-635. DOI: 10.1007/s10593-011-0808-y.
- Kut M.M., Onysko M.Yu. Synthesis of Functionalized Azolo(azino)quinazolines by Electro-philic Cyclization (Microreview) / Chem. Heterocycl. Compd. 2021. Vol. 57. P. 528-530. DOI: 10.1007/s10593-021-02937-z.
- Halocyclization of Olefinic 1,3-Dicarbonyls and Olefinic Amides in Aqueous Media Open in Air at Room Temperature / T.-T. Cao, W.-K. Zhang, F.-H. Qin et al. // ACS Sustainable Chemistry & Engineering. 2020. Vol. 8. P. 16946-16951. DOI: 10.1021/acssuschemeng.0c06586.
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- OLEX2: Complete Structure Solution, Refinement and Analysis Program / O.V. Dolomanov, L.J. Bourhis, R.J. Gildea et al. // J. Appl. Cryst. 2009. Vol. 42. P. 339-341. DOI: 10.1107/S0021889808042726.
- Noncovalent Bonds, Spectral and Thermal Properties of Substituted Thiazolo[2,3-6][1,3]thiazinium Triiodides / I. Yushina, N. Tarasova, D. Kim et al. // Crystals. 2019. Vol. 9. P. 506519. DOI: 10.3390/cryst9100506.
- Тарасова Н.М., Ким Д.Г., Шарутин В.В. Взаимодействие 5-замещенных 2-(аллилсульфанил)-1,3,4-тиадиазолов с галогенами / Вестник ЮУрГУ. Серия «Химия». 2016. Т. 8, № 4. С. 5-10. DOI: 10.14529/chem160401.
- Преч Э. Определение строения органических соединений / Э. Преч, Ф. Бюльманн, К. Аф-фольтер. М.: Мир, 2006. 440 с.

![Синтез новых цвиттерионных бензоил(5-(галогенметил)-5-метил-5,6-дигидротиазоло[2,3-b][1,3,4]тиадиазол-4-ий-2-ил) амидов Синтез новых цвиттерионных бензоил(5-(галогенметил)-5-метил-5,6-дигидротиазоло[2,3-b][1,3,4]тиадиазол-4-ий-2-ил) амидов](/file/cover/147238624/sintez-novyh-cvitterionnyh-benzoil-5galogenmetil5-metil-56-digidrotiazolo.png)
