Синтез новых s-производных 2-меркаптобензотиазола
Автор: Судолова Наталья Михайловна, Ким Дмитрий Гымнанович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 12 (229), 2011 года.
Бесплатный доступ
Осуществлен синтез S-производных 2-меркаптобензотиазола с использованием различных оснований и растворителей. Методами ЯМР 1Н и хромато-масс-спектрометрии исследовано строение полученных соединений.
2-меркаптобензотиазол, 2-аллштиобензотиазол, 2-(2-метил-2-пропенил)тиобензотиазол, 2-(3-метил-2-бутенил)тиобензотиазол, 2-(3-бутенил)тиобензотиазол, 2-(2-пропинил)тиобензотиазол, (2-бензотиазолил)тиоуксусная кислота, этил(2-бензотиазолил)тиоацетат, 2-(2-циклогексенил)тиобензотиазол, 2-бис(2-бензотиазолил)тиоэтан
Короткий адрес: https://sciup.org/147160184
IDR: 147160184 | УДК: 547.789.6
Текст научной статьи Синтез новых s-производных 2-меркаптобензотиазола
Производные 2-меркаптобензотиазола (2-бензотиазолилтион, каптакс) являются антиоксидантами [1], обладают противогрибковой, фунгицидной активностью [2, 3], а также широким спектром других полезных свойств, поэтому данные соединения активно исследуются.
Алкилирование 2-меркаптобензотиазола (1) различными алкилгалогенидами (2) осуществляют в присутствии основания (КОН, К2СОз, NaOMe, пиридин) в таких растворителях, как вода, этанол, ацетон [1-8].
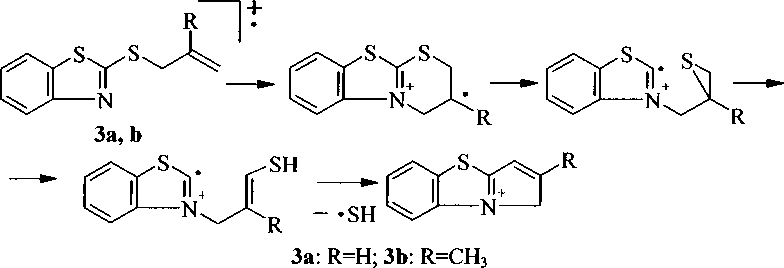
2-Аллилтиобензотиазол (За) был получен с высоким выходом (93 %) реакцией алилибромида (2а) с анионами 2-меркаптобензотиазола, нанесенными на полимерную матрицу. Кроме того, данным способом были получены и другие S-производные [6]. Также было показано, что быстрым и эффективным методом синтеза алкильных производных является метод с использованием ультразвука [7].
Однако большинство методов синтеза S-алкильных производных соединения 1 основано на использовании водных растворов щелочей или карбонатов щелочных металлов в качестве оснований, а также нагревании смеси для ускорения реакции. Но согласно данным [9], при нагревании в присутствии щелочи и воды соединение За подвергается изомеризации с образованием 2-(1-пропенилтио)бензотиазола (А), а затем гидролизу с образованием 2-гидроксибензотиазола (В):
За
В
При 65 °C через 150 минут смесь состоит из 11 % За, 67 % А и 22 % В. Через 24 часа присутствует только соединение В.
Целью настоящей работы является синтез S-производных 2-меркаптобензотиазола с использованием различных оснований и растворителей.
Обсуждение результатов
Изучено взаимодействие 2-меркаптобензотиазола с 3-бромпропеном (2а), 3-хлор-2-метилпропеном (2b), 1-бром-3-метилбутеном-2 (2с), 4-бромбутеном (2d), 3-бромпропином (2е), 3-бромциклогексеном (2f), иодуксусной кислотой (2g), этилхлорацетатом (2h). Реакцией тиазола 1 с аллилбромидом 2а нами осуществлен синтез соединения За в 2-пропаноле в присутствии изопропилата натрия (iPrONa), выход продукта составил 83 %. При использовании КОН выход соединения За оказался гораздо ниже - 32 %. Кроме того, КОН использовался при получении соединения 3f, выход продукта составил всего 36 %. Соединение За было получено нами с достаточно высоким выходом (68 %) в ацетоне с триэтиламином в качестве основания:
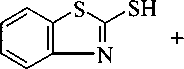
iPrONa
RX ----►
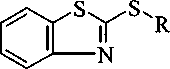
1 2а—h За—h
2а; 2с; 2d; 2е; 2f: X=Br; 2b; 2h: Х=С1; 2g: Х=1; 2а; За: R=CH2CH=CH2; 2b; 3b: R=CH2C(CH3)=CH2;
2c; 3c: R=CH2CH=C(CH3)2; 2d; 3d: R=CH2CH2CH=CH2; 2e; 3e: R=CH2C=CH; 2f; 3f: R= СУ~ ; 2g;
3g: R=CH2COOH; 2h; 3h: R=CH2COOC2H5
Реакцией соединения 1 с галогенпроизводными 2b-h в 2-пропаноле в присутствии изопропилата натрия синтезированы соответственно 2-(2-метил-2-пропенил)тиобензотиазол (ЗЬ), 2-(3-метил-2-бутенил)тиобензотиазол (Зс), 2-(3-бутенил)тиобензотиазол (3d), 2-(2-пропинил)тио-бензотиазол (Зе), 2-(2-циклогексенил)тиобензотиазол (31), (2-бензотиазолил)тиоуксусная кислота (3g) и этил(2-бензотиазолил)тиоацетат (ЗЬ). Ранее [10] соединение 3g получено взаимодействием соединения 1 с монохлоруксусной кислотой в щелочном растворе воды.
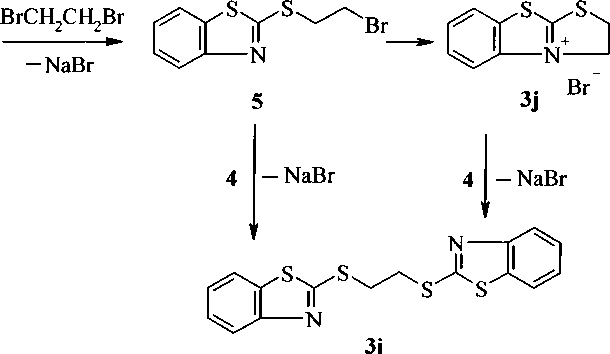
Согласно литературным данным, при взаимодействии соединения 1 с 1,2-дибромэтаном (2i) в этаноле при двукратном избытке 1 в присутствии К2СО3 в качестве основания образуется 1,2-6wc(2-бензотиазолил )тиоэтан (3i) с выходом 70 % [И]. Кроме того, существуют данные о синтезе бромида 2,3-дигидро[1,3]тиазоло[2,3-6][1,3]бензотиазолия (3j) с 75 %-ным выходом, при взаимодействии соединений 1 и 2i в диметилформамиде (ДМФА), в присутствии щелочи или К2СО3 [12]. Нами осуществлено взаимодействие соединений 1 и 2i при соотношении исходных реагентов 1:1 в 2-пропаноле и в присутствии изопропилата натрия, при этом установлено, что образуется смесь 3i и 3j. Реакция, по-видимому, протекает через промежуточный 2-(2-бро-мэтил)тиобензотиазол 5, который может циклизоваться с образованием 3j или реагировать с другой молекулой 4 с образованием 3L Соединение 3j также может реагировать с другой молекулой 4, в результате чего образуется соединение 3L В спектре ЯМР 'Н смеси продуктов реакции, полученной при соотношении исходных реагентов 1:1, присутствуют сигналы протонов, относящиеся к соединениям 3i и 3j, в соотношении 20:7 соответственно. При двукратном избытке 1 в суперосновной среде (диметилсульфоксид (ДМСО)-КОН-Н2О) образуется соединение 3i:
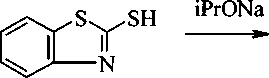
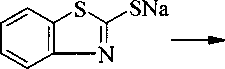
Нам удалось получить чистое соединение 3i при взаимодействии соединения 1 с бромистым винилом в среде ДМСО-КОН-Н2О. По-видимому, на первой стадии происходит нуклеофильное присоединение с образованием соединения 5:
DMSO КОН* Н2О
ВгСН=СН2 4а
-------*" 5 ------
-КВг —КВг
4а
3i
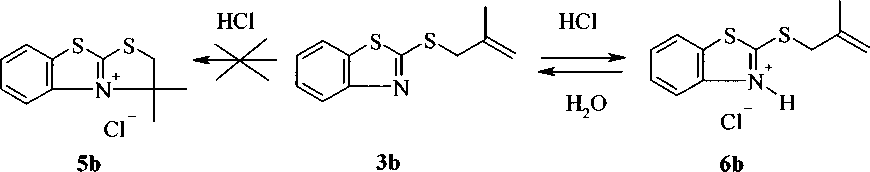
На примере соединения ЗЬ было исследовано взаимодействие с хлороводородной кислотой. Предполагалось, что в результате данной реакции может образоваться продукт с замыканием цикла 5Ь. Однако в действительности происходило образование соединения 6Ь, выпадающего из раствора в виде осадка. При действии воды на соединение 6Ь, возвращался исходный 2-(2-метил-2-пропенил )тиобензотиазол ЗЬ:
Структуры синтезированных соединений подтверждены данными масс-спектров и спектроскопии ЯМР 1Н.
В масс-спектрах соединений За, b, е, h присутствуют пики молекулярных ионов [М]+, причем для соединения Зе этот сигнал является максимальным. Сигналы ионов [М-СН3]+ являются максимальными в масс-спектрах соединений За, Ь. Это обусловлено образованием устойчивой ароматической тиазоло[2,3-Ь][1,3]бензотиазолиевой системы, при распаде молекулярного иона:
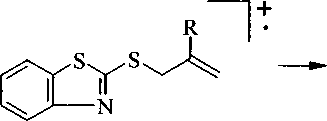
За, Ь
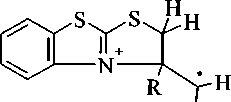
За: R=H; 3b: R=CH3
- -сн3
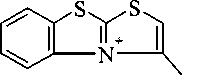
Кроме того, масс-спектры соединений За, Ь содержат пик [M-SH]+, характерный для S-аллильных производных. По-видимому, он обусловлен образованием пирроло-[2,1-6][1,3]бен-зотиазолиевой системы:
В масс-спектре соединения Зе, кроме того, присутствует сигнал иона [M-C3Hi]+, соответствующий отрыву пропинильного радикала.
В масс-спектре соединения ЗЬ, в отличие от соединений За, Ь, отсутствуют сигналы ионов [M-SH]+, [М-СН3]+, что, по-видимому, обусловлено невозможностью протекания выше описанных перегруппировок при фрагментации молекулярного иона.
Органическая химия_______________________________________
В спектре ЯМР 'Н протоны SCH2 группы соединений За и ЗЬ образуют синглет при 3,80 и 4,02 м.д. соответственно, соединения Зс дублет при 4,02 м.д., а соединения 3d триплет при 3,43 м.д.
Спектр ЯМР 'Н продуктов взаимодействия соединений 1 и 2i содержит синглет в области 3,85 м.д., соответствующий протонам -SCH2CH2S- группы, указывающий на соединение 3i, а также мультиплеты протонов SCH2 при 4,24 м.д. и NCH2-rpynn при 4,96 м.д., указывающие на соединение 3j.
Спектральные данные синтезированных соединений
|
Соединение |
Спектр ЯМР 'Н, 8, м.д. У, Гц) |
|
За |
3,80 (2Н, м, SCH2); 5,04 (2Н, м, =СН2); 5,80(1 Н, м, =СН); 7,02 (2Н, м, СНАг); 7,40 (Ш, м, СНдг); 7,68 (1Н, м, СНдг) |
|
ЗЬ |
1,89 (ЗН, с, СН3); 4,02 (2Н, с, SCH2); 4,96 (1Н, м, =СН2); 5,12 (1Н, м, =СН2); 7,21 (2Н, м, СНдг); 7,72 (Ш, м, СНдг); 7,88 (1Н, м, СНдг) |
|
Зс |
1,71, 1,75 (6Н, д, СПз, J =12,69); 4,02 (2Н, д, SCH2,7=7,73); 5,40 (Ш, м, СП); 7,11-8,02 (4Н, м, СНдг) |
|
3d |
2,59 (2Н, м, СН2); 3,43 (2Н, т, SCH2,7=7,31); 5,13 (2Н, м, =СН2); 5,89 (1Н, м, =СН); 7,29 (1Н, м, СНАг); 7,41 (1Н, м, СНАг); 7,75 (1Н, м, СНдг); 7,86 (1Н, м, СНАг) |
|
3f |
4,26 (2Н, с, СН2); 7,37 (1Н, м, СНдг); 7,47 (1Н, м, СНдг); 7,84 (Ш, дд, СИдт, 7=0,45,72=8,09); 8,02 (1Н, дд, СН^, 7=0,64,72=7,99) |
|
3g |
1,2 (ЗН, т, СН3,7=7,1); 4,16 (2Н, к, ОСН2,7=7,1); 4,32 (2Н, с, SCH2); 7,38 (1Н, м, СНдг); 7,47 (1Н, м, СНдг); 7,83(1Н, м, СН^); 8,03 (1Н, м, СНдг) |
|
31 |
3,85 (4Н, с, SCH2CH2S); 7,36-7,40 (2Н, м, СНдг);7,45-7,49 (2Н, м, СНдг); 7,80-7,82 (2Н, м, СН^); 8,01-8,03 (2Н, м, СНд,) |
|
3j |
4,20 (2Н, м, SCH2); 4,96 (2Н, м, NCH2); 7,74-8,30 (4Н, м, СНдг) |
Экспериментальная часть
Контроль индивидуальности синтезированных соединений осуществляли методом ТСХ на пластинках Silufol UV-254, элюент: 2-пропанол - гексан (3:1). Проявляли парами иода. Спектры ЯМР *Н полученных соединений записаны на спектрометре Bruker DRX-400 (400 МГц) в ДМСОч16, внутренний стандарт ТМС. Масс-спектры (ЭУ, 70 эВ) сняты на приборе ГЖХ/МС фирмы HEWLETT PACKARD, газовый хроматограф НР-5890, серия II, масс-селективный детектор НР-5972.
2-Аллилтиобензотиазол (За). Способ 1. Растворяют 0,23 г натрия (10 ммоль) в 15 мл 2-пропанола. К полученному раствору добавляют 1,67 г (10 ммоль) 1 и 0,85 мл (10 ммоль) 2а. Смесь кипятят в течение 3 часов. После охлаждения, раствор фильтруют. Соединения За извлекают диэтиловым эфиром после испарения растворителя из фильтрата. После испарения эфира получают соединение За в виде масла коричневого цвета 1,73 г, 83 %.
Способ 2. Растворяют 0,4 г (10 ммоль) КОН в 15 мл 2-пропанола. К полученному раствору добавляют 1,67 г (10 ммоль) 1 и 0,85 мл (10 ммоль) 2а. Смесь кипятят в течение 3 часов. После охлаждения раствор фильтруют. Соединение За извлекают диэтиловым эфиром в виде масла светло-коричневого цвета 0,66 г (32 %).
Способ 3. Растворяют 0,33 г (2 ммоль) 1 в 10 мл ацетона добавляют к полученному раствору 1 г (10 ммоль) триэтиламина, по каплям при перемешивании добавляют 0,17 мл (2 ммоль) 2а. Смесь оставляют на 24 часа при комнатной температуре. Отфильтровывают образовавшийся осадок, испаряют растворитель из фильтрата. Соединение За извлекают диэтиловым эфиром в виде масла коричневого цвета 0,28 г (68 %).
Общая методика получения соединений (3b-d, h). Растворяют 0,23 г (10 ммоль) натрия в 15 мл 2-пропанола. К полученному раствору добавляют 10 ммоль 1 и 10 ммоль алкилгалогенида (З-хлор-2-метилпропен (2b), 1 -бром-3-метилбутен-2 (2с), 4-бромбутен (2d), этилхлорацетат (2h)). Смесь кипятят в течение 3 часов. После охлаждения, раствор фильтруют. Соединения 3b-d, h извлекают диэтиловым эфиром после испарения растворителя из фильтрата. После испарения эфира получают соединения 3b-d, h в виде масла коричневого цвета:
2-(2-метил-2-пропенил)тиобензотиазол (ЗЬ). Масса 1,75 г, выход 79 %;
2-(3-метил-2-бутенил)тиобензотиазол (Зс). Масса 1,29 г, выход 52 %;
2-(3-метил-2-бутенил)тиобензотиазол (3d). Масса 1,62 г, выход 73 %.
Этил(2-бензотиазолил)тиоацетат (3h). Масса 1,66 г, выход 69 %.
2-(2-Циклогексенил)тиобензотиазол (3f). Растворяют 0,11 г (1 ммоль) КОН в капле воды, добавляют к 10 мл 2-пропанола. К полученному раствору добавляют 0,31 г (1 ммоль) соединения 1 и 0,314 г (1 ммоль) 2L Оставляют смесь на 24 часа при комнатной температуре, отфильтровывают выпавший осадок, испаряют растворитель. Вещество 3f извлекают гексаном, 0,18 г (36 %).
2-(2-пропинил)тиобензотиазол (Зе). Растворяют 0,23 г (10 ммоль) натрия в 10 мл 2-пропанола при нагревании, к полученному горячему раствору добавляют 0,67 г (4 ммоль) 1 и, медленно при перемешивании, 0,36 мл (4 ммоль) 2е. Реакционную смесь перемешивают 2 ч, затем фильтруют от осадка бромида натрия и испаряют растворитель при комнатной температуре. Вещество перекристаллизовывают из гексана, Зе выпадает в виде желтых кристаллов, 0,51 г, 53 %, т. пл. 45 °C.
(2-Бензотиазолил)тиоуксусная кислота (3g). Растворяют 0,23 г (10 ммоль) натрия в 15 мл 2-пропанола. К полученному раствору добавляют 1,67 г (10 ммоль) 1 и 1,96 г (10 ммоль) 2g. Смесь кипятят в течение 3 часов. После охлаждения, раствор фильтруют. Соединение 3g получают в виде осадка коричневого цвета при обработке вещества, оставшегося после испарения растворителя из фильтрата, дистиллированной водой, 1,69 г, 75 %, т. пл. 130-134 °C.
1,2-Бис(2-бензотиазолил)тиоэтан (3i). Способ 1. Растворяют 0,8 г (20 ммоль) КОН в 15 мл ДМСО. К полученному раствору добавляют 3,34 г (20 ммоль) 1 и 0,86 мл (10 ммоль) 2L Смесь перемешивают в течение 3 часов. Оставляют на сутки при комнатной температуре, добавляют избыток воды. Выпавший осадок 3i отфильтровывают и перекристаллилизовывают из этанола, 2,5 г, 69 %, т. пл. 148 °C.
Способ 2. Растворяют 0,8 г (20 ммоль) КОН в 15 мл ДМСО. К полученному раствору добавляют 3,34 г (20 ммоль) 1 и 0,72 мл (10 ммоль) винилбромида. Смесь перемешивают течение 3 часов. Оставляют на сутки при комнатной температуре, добавляют избыток воды. Выпавший осадок 3i отфильтровывают и перекристаллилизовывают из этанола, 2,82 г, 78 %, т. пл. 148 °C.
Хлорид 2-(2-метил-2-пропенил)тио-1Н-бензотиазолия (6Ь). Добавляют 2 мл (избыток) хлороводородной кислоты к 0,14 г (0,5 ммоль) соединения 1. Смесь оставляют на 24 часа при температуре -10 °C. Отфильтровывают образовавшийся желтый осадок, 0,13 г (51 %), т. пл. 50-54 °C.
Элементный анализ соединений 2-(2-метил-2-пропенил)тиобензотиазола, 2-(3-метил-2-буте-нил)тиобензотиазола, 2-(2-циклогексенил)тио-бензотиазола, 2-(2-пропинил)тиобензотиазола на С, Н, N и S соответствует расчетным.
Заключение
Взаимодействием 2-меркаптобензотиазола с галогеналкенами в 2-пропаноле в присутствии изопропилата натрия синтезированы: 2-(2-метил-2-пропенил)тиобензотиазол, 2-(3-метил-2-буте-нил)тиобензотиазол, 2-(2-циклогексенил)тио-бензотиазол, 2-(2-пропинил)тиобензотиазол. Найдено, что реакция 2-меркаптобензотиазола с 1,2-дибромэтаном протекает с образованием 2,3-дигидро[1,3]тиазоло[2,3-6][1,3]бензотиазолия и 1,2-бмс(2-бензотиазолил)тиоэтана, полученного также реакцией с бромистым винилом в суперосновной среде. Структура синтезированных соединений подтверждена данными хромато-масс-спектрометрии и ЯМР *Н.
Список литературы Синтез новых s-производных 2-меркаптобензотиазола
- Synthesis, antioxidant properties and radioprotective effects of new benzothiazoles and thiadiazoles/D. Cressier, C. Prouillac, P. Hernandez et al.//Bioorganic & Medicinal Chemistry. -2009. -№ 7. -P. 5275-5284.
- New anticandidous 2-alkylthio-6-aminobenzothiazoles/E. Sidóová, D. Loos, H. Bujdáková, J. Kallová//Molecules. -1997. -№. 2. -P. 36-42.
- Huang, W. Microwave-assisted one-pot synthesis and fungicidal activity of polyfluorinated 2-benzylthiobenzothiazoles/W. Huang, G.F. Yang.//Bioorg. Med. Chem. -2006. -№ 14. -P. 8280-8285.
- Organic reactions in ionic liquids: an efficient method for selective s-alkylation of 2-mercaptobenzothia(oxa)zole with alkyl halides/Y. Hu, Z.C. Chen, Z.G. Le, Q.G. Zheng//Synth. Commun. -2004. -Vol. 34, № 11. -P. 2039-2046.
- Ultrasound promoted synthesis of thioesters from 2-mercaptobenzoxa(thia)zoles/A. Duarte, W. Cunico, C.M.P. Pereira et al.//Ultrason. Sonochem. -2010. -Vol. 17. -P. 281-283.
- Dalai, D.S. Synthesis of 2-mercaptobenzothiazole and of 2-mercaptobenzimidazole derivatives using polimer-supported anions/D.S. Dalai, N.S. Pawar, P.P. Mahulikar//Organic Preparations and Procedures Int. -2005. -Vol. 37, № 6. -P. 539-546.
- An easy and fast ultrasonic selective S-alkylation of hetarylthiols at room temperature/T. Deligeorgiev, S. Kaloyanova, N. Lesev, Juan J. Vaquero//Ultrason. Sonochem. -2010. -Vol. 17. -P. 783-788.
- Thiazole orange derivatives: synthesis, fluorescence properties, and labeling cancer cells/X. Fei, Y. Gu, Y. Ban et al.//Bioorg. Med. Chem. -2009. -Vol. 17. -P. 585-591.
- Kocevar, M. Heterocycles. CI. Synthesis and isomerization of some allylthio nitrogen heterocycles/M. Kocevar, B. Stanovnik, M. Tisler//Croat. chem. acta. -1973. -Vol. 45, №. 3. -P. 457-446.
- Ким, Д.Г. Синтез солей тиазоло[2,3-b]бензотиазолия и тиазоло[2,3-b]бензоксазолия/Д.Г. Ким, И.М. Миронова, В.В. Авдин//Известия высших учебных заведений. Серия «Химия и химическая технология». -1993. -Т. 36. -Вып. 12. -С. 67-70.
- Casar, Z. A novel approach to N,N'-dimethyl and N,N'-ethylene bridged dibenzodithiadiazafulvalene/Z. Casar, D. Lorcy//Acta Chim. Slov. -2002. -Vol. 49. -P. 871-883.
- Sohar, P. Benzothiazoline derivatives. II. Preparation of N-substituted derivatives of 2-benzothiazolinethione by thiation of the 2-oxo analogs/P. Sohar, George H. Denny Jr., Robert D. Babson//J. of Heterocyclic Chem. -1969. -Vol. 6. -P. 163-174.


