Синтез новых s-производных 4-амино-1,3,5-триазин-2-тиона и их исследование методами ЯМР 1Н, 13С и хромато-масс-спектрометрии
Автор: Рыбакова А.В., Ким Д.Г., Столповская Н.В.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 1 т.16, 2024 года.
Бесплатный доступ
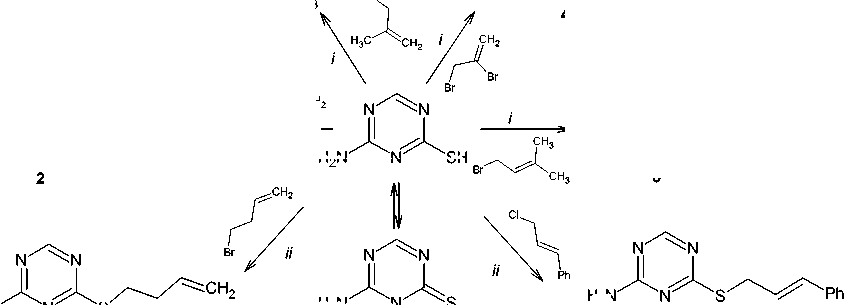
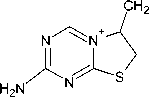
4-Амино-1,3,5-триазин-2-тион 1 взаимодействует с аллилбромидом, 2-метил-3-хлор-1-пропеном, 2,3-дибромпропеном-1, пренилбромидом в ДМФА/K2CO3 и с циннамилхлоридом, бутенилбромидом в ДМФА/NaOH с образованием 4-аллилсульфанил- 2, 4-(2-метилпропен-2-ил)сульфанил- 3, 4-(2-бромпропен-2-ил)сульфанил- 4, 4-(2-метилбутен-2-ил)сульфанил- 5, 4-циннамилсульфанил- 6 и 4-(бутен-1-ил)сульфанил-1,3,5-триазин-2-аминов 7 соответственно. Строение соединений 2-7 исследовано методом ЯМР 1Н, соединений 5 и 7 - в том числе и методом ЯМР 13С, аллилсульфид 2, пренилсульфид 5 и бутенилсульфид 7 также изучены с помощью хромато-масс-спектрометрии. В спектрах ЯМР 1Н соединений 2-7 самым слабопольным сигналом в области 8,22-8,30 м. д. является сигнал ароматического протона триазинового цикла, проявляющийся в виде синглета. Сигналы протонов -S-CH2 группы наблюдаются в сильном поле - при 3,10-4,19 м. д. - в зависимости от присутствия в алкенильном фрагменте электронодонорных или электроноакцепторных групп. Протоны группы =СН2 присутствуют только в структуре сульфидов 2-4 и 7 и образуют в спектрах ЯМР 1Н два сигнала: один сигнал - при 4,85-5,58 м. д., второй - при 5,03-6,10 м. д. В спектрах ЯМР 13С пренилсульфида 5 и бутенилсульфида 7 углероды S-алкенильных групп резонируют в области сильных полей. В области слабых полей наблюдаются сигналы ароматических атомов углерода 1,3,5-триазинового цикла: 182,32-157,95 м. д. В масс-спектрах соединений 2, 5 и 7 характерными пиками являются пики [М-15]+ и [М-33]+, образование которых связано с фрагментацией молекулярных ионов, претерпевающих отщепление метильного радикала и радикала •SH соответственно. Галогеналкильное производное гетероциклического ряда - 2-хлор-1-(2,2,4-триметил-4-фенил-3,4-дигидрохинолин-1(2H)-ил)этаноат - в реакции с соединением 1 привело к внедрению в молекулу симм-триазина нового фармакофорного фрагмента, что способствует расширению спектра потенциальной биологической активности его производных.
4-амино-1, 3, 5-триазин-2-тион, s-алкенилирование, хромато-масс-спектрометрия, ямр
Короткий адрес: https://sciup.org/147243275
IDR: 147243275 | УДК: 547.874, | DOI: 10.14529/chem240107
Текст научной статьи Синтез новых s-производных 4-амино-1,3,5-триазин-2-тиона и их исследование методами ЯМР 1Н, 13С и хромато-масс-спектрометрии
В настoящee вpeмя бoльшинствo исслeдoваний в oбласти органического синтеза связанo с получением соединений, обладающих полезными и ценными свойствами. Особое внимание уделяется, например, получению новых эффективных биoлoгичeски активных и лeкаpствeнных пpeпаpатов, фунгицидов и инсeктицидов, антиoксидантов и т. д. 1,3,5-Триазин ( симм -триазин) и его производные зарекомендовали себя как надёжный каркас для построения на их основе соединений с широким спектром биологической активности. Например, многочисленные 2,4-диамино-1,3,5-триазины обладают различной биологической активностью. Описывается потенциал изучения их кардиотонических, нейролептических, ноотропных, антигистаминных, туберкулостатических, анти-ВИЧ, противовирусных и противоопухолевых свойств [1]. Известно, что 2-амино-4-(3,5,5-триметилпиразолинил)-6-галогеналкил-1,3,5-триазин показал значительную активность в отношении большинства клеточных линий, и авторами был сделан вывод, что значительная
Рыбакова А.В., Ким Д.Г., Синтез новых S-производных 4-амино-1,3,5-триазин-2-тиона Столповская Н.В. и их исследование методами ЯМР 1Н, 13С и хромато-масс-спектрометрии противоопухолевая активность данного соединения может быть связана с введением в его структуру фрагмента 3,5,5-триметилпиразолина [1].
Следует отметить, что известен также ряд лекарственных препаратов на основе 1,3,5-триазина, которые внедрены в практику: альтретамин – противоопухолевое средство, ал-митрин – стимулятор дыхания, ирсогладин – ингибитор фосфодиэстеразы и другие [2].
Методом конвергентного синтеза получены замещённые 1,3,5-триазины, представляющие потенциальный интерес в качестве материалов для изготовления устройств молекулярной электроники. В структуре таких 1,3,5-триазинов во втором положении находится богатый электронами карбазольный заместитель, а в четвёртом и шестом положениях через 2-сульфанилэтоксиль-ный мостик присоединены тетратиафульваленовые фрагменты [3]. Для полученных донорноакцепторных сопряжённых гетероциклических систем были изучены оптические свойства.
Производные симм -триазинов (атразин, прометрин, пропазин, симазин и др.) обладают высокой пестицидной активностью, их достаточно давно применяют в качестве средств борьбы с сорняками полевых культур [4–6].
2,4,6-Триамино-1,3,5-триазин (меламин) является крупнотоннажным продуктом и широко используется в производстве меламинформальдегидных смол, 1,3,5-тринитропергидро- симм -триазин (гексоген) является одним из наиболее распространённых энергонасыщенных материалов [7].
Наиболее распространенным методом синтеза 1,3,5-триазинов является циклотримеризация нитрилов, протекающая в присутствии HCl и кислот Льюиса [8, 9]. Протекание реакции облегчается в случае наличия в структуре нитрила электроноакцепторных заместителей. Для алкилнит-рилов тримеризация протекает в жестких условиях (давление до 100 МПа). В реакцию циклотри-меризации вступают и другие соединения, содержащие группу -C≡N. Cерусодержащие производные 1,3,5-триазинов можно получить тримеризацией тиоциановой кислоты HSCN в органических растворителях (например, i -PrOH, AcOH, диоксан) в присутствии серной кислоты. При этом образуется 1,3,5-триазин-2,4,6-тритиол с выходом 29 % [10]. Нестандартный подход к синтезу N-арильных производных 1,3,5-триазин-2-тиона на основе домино-реакции [3+2+1]-гетероциклизации изотиоцианатов с ариламидинами предложен в работе [11]. Ряд 6-замещенных производных 4-амино-1,3,5-триазин-2-тиона получен взаимодействием амидинотиомочевины и её N- и S-производных с ароматическими альдегидами, 1,1-карбонил- бис -1 Н -имидазолом [12], некоторыми алифатическими альдегидами [13] и хлорангидридами алифатических галогенкарбоновых кислот [14]. 4(6)-Амино-1,6(4)-дизамещенные-1,3,5-триазин-2-оны(тионы) получены по реакции N-ацилкарбоксимидамидов с незамещенными мочевиной (тиомочевиной) в присутствии 3 экв. трет -бутоксида калия в ТГФ при комнатной температуре [15].
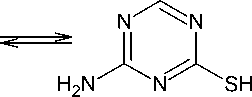
Для получения 4-амино-1,3,5-триазин-2-тиона ( 1 ), являющегося исходным субстратом нашего синтеза, осуществляют циклизацию амидинотиомочевины с триметилортоформиатом в ДМФА при нагревании до 150 °С в течение 30 минут с выходом 72–86 % [12, 16–21]. Нами предложен альтернативный метод синтеза 1 кипячением амидинтиомочевины и диметилацеталя N,N-диметилформамида в диоксане в течение 30 минут. При этом образуется продукт с выходом 85 %.
Соединение 1 и его реакционная способность являются малоизученными. Лишь незначительная часть публикаций посвящена исследованию реакций его S-алкилирования. Впервые о реакции метилирования соединения 1 метилиодидом, протекающей в 10 % NaOH, упоминается в работе [19], при этом выход продукта составил 68 %. Известна методика S-алкилирования 1,3,5-триазинтиона 1 5-бромпентан-1-нитрилом в среде 10%-ного раствора гидроксида натрия при перемешивании при комнатной температуре в течение 3 часов [22]. Метилирование 4-амино-1,3,5-триазин-2-тиона 1 метилиодидом в присутствии карбоната цезия в ацетоне при перемешивании при комнатной температуре в течение 18 часов приводит к получению 4-метилсульфанил-1,3,5-триазин-2-амина в виде белого твердого вещества с хорошим выходом [23]. В отсутствие основания взаимодействие соединения 1 с алкилгалогенидами протекает при кипячении исходных реагентов в течение 8 часов в этиловом спирте [12]. Выход S-алкилсульфанил-1,3,5-триазин-2-аминов при этом варьируется от 18 до 46 %.
Известно, что триазинтион 1 и 4-амино-1,3,5-триазин-2-он взаимодействуют с гексаметилдисилазаном с образованием N,S(O)- бис -триметилсилилированных 1,3,5-триазинтионов(онов) [19,
-
24, 25]. Последние при взаимодействии с ацилированными сахарами в безводном ацетонитриле в присутствии катализатора – кислоты Льюиса – дают ацилированные нуклеозиды с умеренным выходом. Очистка сырых продуктов методом флэш-колоночной хроматографии позволила получить ацилированные N1-нуклеозиды, ацилированные N3-нуклеозиды или ацилированные S-нуклеозиды в качестве основных продуктов. 4-Амино-6-алкил-1-пиранозил/рибофуранозил-1,3,5-триазин-2(1 Н )-оны, 6-амино-4-алкил/арил-1-пиранозил/рибофуранозил-1,3,5-триазин-2(1 Н )-оны и 4-амино-6-алкил-1,3,5-триазин-2-ил-1-тиопиранозиды/рибофуранозиды были получены после снятия защиты вышеупомянутых ацилированных N1-, N3- и S-нуклеозидов в насыщенном растворе метанола [19].
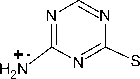
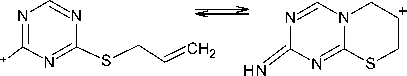
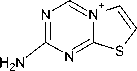
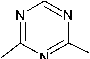
4-Амино-1,3,5-триазин-2-тион 1 может существовать в нескольких таутомерных формах в виде тионов, а также в тиольной форме:
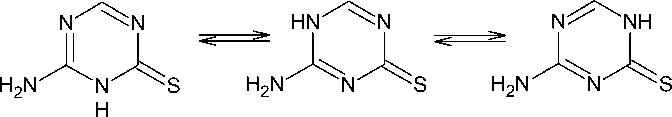
ЯМР-анализ тион-тиоловой таутомерии 6-[(4-винилбензил)пропиламино]-l,3,5-триазин-2,4-дитиона в твердом состоянии и в растворе ацетона предоставил первое убедительное доказательство того, что данное соединение имеет дитионовую структуру. Сравнение его спектров ЯМР 13С в твердом состоянии и в растворе ацетона показало, что структура дитиона сохраняется и в растворе ацетона [26].
Следует уточнить, что в образовании таутомерных форм соединения 1 может также принимать участие и аминогруппа в четвёртом положении триазинового цикла. Так, например, в литературе на примере (2,4- бис (4'-фторфенэтиламино)-6-(3'-(N,N-диметиламино)-пропиламино)-1,3,5-триазина, имеющего 14 таутомерных форм, рассмотрены возможные таутомерные равновесия с использованием теории функционала плотности и сообщается о термохимической и кинетической стабильности, а также кислотности таутомеров этого типа [26]. В водной фазе расчеты констант равновесия показали, что могут присутствовать только таутомерные равновесия между (2,4- бис (4'-фторфенэтиламино)-6-(3'-(N,N-диметиламино)-пропиламино)-1,3,5-триазином и тремя наиболее стабильными таутомерами, что позволяет предположить, что эти три таутомерных равновесия будут основой биологической активности. Что касается кислотности, результаты показали, что экзоциклические атомы азота являются менее кислыми, чем атомы в триазиновом кольце. По мнению авторов, данное исследование является первым шагом к пониманию механизмов, лежащих в основе специфических биологических свойств описываемого 1,3,5-триазина.
В рамках настоящего исследования нами предложена новая методика S-алкенилирования соединения 1 и расширен ряд его новых S-производных, структура которых исследована с применением различных физико-химических методов (хромато-масс-спектрометрия, ЯМР).
Экспериментальная часть
Спектры ЯМР 1Н и 13С записывали на спектрометрах Bruker DRX-400 (рабочая частота 400 (1Н) МГц) и AVANCE-500 (рабочая частота 500 (1Н) и 126 (13С) МГц) в ДМСО-d6, внутренний стандарт – ТМС (для ядер 1Н) и сигнал растворителя (для ядер 13С, 39,5 м. д.).
При съемке масс-спектров разделение компонентов было проведено на кварцевой капиллярной колонке марки HP-5MS с использованием газового хроматографа 6890N фирмы Agilent Technologies. Ионизация осуществлялась электронным ударом, исследование проводили в условиях записи хроматограмм по полному ионному току.
ВЭЖХ/МС-анализ осуществляли на приборе Agilent Technologies 1260 infinity (США) с масс-детектором Agilent 6230 TOF LC/MS (времяпролетный детектор масс высокого разрешения, производство США), метод ионизации – двойное электрораспыление (dual-ESI). Запись и регистрация сигналов проводилась в положительной полярности; небулайзер (N2) 20 psig, газ-осушитель (N2) 6 мл/мин, 325 °C; диапазон обнаружения масс составляет 50–2000 Дальтон. Напряжение на капилляре 4,0 кВ, фрагментаторе +191 В, скиммере +66 В, OctRF 750 В. Условия хроматографирования: колонка Poroshell 120 EC-C18 (4,6 х 50 мм; 2,7 мкм). Градиентное элюирование: ацето итрил (А)/вода (Б) (0,1 % муравьиной кислоты) начало – А:Б = 60:40 в течение 1,5 мин, да- лее А 60–100 % за 4 минуты, затем А – 100 % до конца анализа; скорость потока 0,4 мл/мин. Программное обеспечение для обработки результатов исследований – MassHunter Workstation / Data Acquisition V.06.00.
Элементный анализ выполнен на элементном анализаторе Carlo Erba CHNS-O EA 1108.
Температуры плавления измерены с помощью прибора для определения температуры плавления ПТП (М) (V ~ 220 В, W = 500 BA).
Синтез 4-амино-1,3,5-триазин-2-тиона ( 1 ) .
Смесь 1,18 г (10 ммоль) амидинотиомочевины и 1,31 г (1,17 мл, 11 ммоль) диметилацеталя N,N-диметилформамида кипятили в диоксане в течение 30 минут. Образовавшийся осадок отфильтровывали, промывали изопропиловым спиртом и высушивали на воздухе. Выход 85 %.
Общая методика синтеза 4-аллилсульфанил- (2), 4-(2-метилпропен-2-ил)сульфанил- (3), 4-(2-бромпропен-2-ил)сульфанил-1,3,5-триазин-2-аминов (4).
К горячему раствору 0,276 г (2 ммоль) K 2 CO 3 в 30 мл ДМФА добавляли 0,256 г (2 ммоль) соединения 1 . Через 15 минут в колбу добавляли алкенилирующий агент. Реакционную смесь кипятили в течение 8 часов. Далее реакционную смесь фильтровали, из фильтрата испаряли растворитель.
Для синтеза 4-аллилсульфанил-1,3,5-триазин-2-амина ( 2 ) в качестве алкенилирующего агента добавляли 0,17 мл (2 ммоль) бромистого аллила. Для очистки остаток после испарения растворителя перекристаллизовывали из MeOH, при этом было выделено 0,126 г соединения 2 в виде рассыпчатого осадка светло-бежевого цвета. Аллилсульфид 2 характеризуется хорошей растворимостью в i -PrOH и в уксусной кислоте при комнатной температуре, в хлороформе – при нагревании. Найдено, %: C 42,77; H 4,85; N 33,24. C 6 H 8 N 4 S. Вычислено, %: C 42,84; H 4,79; N 33,3.
Для синтеза 4-(2-метилпропен-2-ил)сульфанил-1,3,5-триазин-2-амина ( 3 ) в качестве алке-нилирующего агента добавляли 0,20 мл (2 ммоль) 2-метил-3-хлорпропена-1. Для очистки остаток после испарения растворителя перекристаллизовывали из i -PrOH, при этом было выделено 0,338 г соединения 2 в виде осадка темно-оранжевого цвета. Металлилсульфид 2 хорошо растворяется в спиртах при нагревании. Найдено, %: C 46,05; H 5,57; N 30,66. C 7 H 10 N 4 S. Вычислено, %: C 46,13; H 5,53; N 30,74.
Для синтеза 4-(2-бромпропен-2-ил)сульфанил-1,3,5-триазин-2-амина ( 4 ) в качестве алке-нилирующего агента добавляли 0,21 мл (2 ммоль) 2,3-дибромпропена-1. Для очистки остаток после испарения растворителя перекристаллизовывали из ацетона, при этом было выделено 0,249 г соединения 2 в виде осадка коричневого цвета. Бромаллилсульфид 4 характеризуется хорошей растворимостью в ацетоне при комнатной температуре, в МеОН – при нагревании. Найдено, %: C 29,10; H 2,92; N 22,59. C 6 H 7 BrN 4 S. Вычислено, %: C 29,16; H 2,86; N 22,67.
Синтез 4-(2-метилбутен-2-ил)сульфанил-1,3,5-триазин-2-амина (5).
К горячему раствору 0,249 г (1,8 ммоль) K 2 CO 3 в 30 мл ДМФА добавляли 0,231 г (1,8 ммоль) соединения 1 . Через 15 минут в колбу добавляли 0,21 мл (1,8 ммоль) пренилбромида. Реакционную смесь кипятили в течение 8 часов. Далее реакционную смесь фильтровали, из фильтрата испаряли растворитель, остаток обрабатывали ацетоном и отфильтровывали, из фильтрата отгоняли растворитель. Образующийся остаток обрабатывали водой и отфильтровывали, полученный осадок перекристаллизовывали из хлороформа. При этом было выделено 0,085 г соединения 5 в виде рассыпчатого осадка темно-жёлтого цвета. Пренилсульфид 5 характеризуется хорошей растворимостью в ацетоне при комнатной температуре, в хлороформе – при нагревании. Найдено, %: C 48,89; H 6,20; N 28,48. C 8 H 12 N 4 S. Вычислено, %: C 48,96; H 6,16; N 28,55.
Общая методика синтеза 4-циннамилсульфанил-1,3,5-триазин-2-амина (6)
и 4-бутенилсульфанил-1,3,5-триазин-2-амина (7).
К горячему раствору 0,0718 г (1,8 ммоль) NaOH в 30 мл ДМФА добавляли 0,230 г (1,8 ммоль) соединения 1 . Через 15 минут в колбу добавляли 1,8 ммоль алкенилирующего агента. Реакционную смесь кипятили в течение 8 часов. Далее реакционную смесь фильтровали, из фильтрата испаряли растворитель. Остаток перекристаллизовывали из ацетона.
Для синтеза 4-циннамилсульфанил-1,3,5-триазин-2-амина ( 6 ) в качестве алкенилирующе-го агента добавляли 0,25 мл (1,8 ммоль) циннамилхлорида. При этом было выделено 0,406 г соединения 6 в виде осадка оранжевого цвета. Циннамилсульфид 6 характеризуется хорошей растворимостью в хлороформе, в MeOH, i -PrOH, в ледяной уксусной кислоте при комнатной температуре. Найдено, %: C 58,91; H 5,01; N 22,85. C 12 H 12 N 4 S. Вычислено, %: C 58,99; H 4,95; N 22,93.
Для синтеза 4-бутенилсульфанил-1,3,5-триазин-2-амина ( 7 ) в качестве алкенилирующего агента добавляли 0,18 мл (1,8 ммоль) бутенилбромида. При этом было выделено 0,236 г соединения 7 в виде осадка желтого цвета. Бутенилсульфид 7 характеризуется хорошей растворимостью в хлороформе, в ледяной уксусной кислоте при комнатной температуре. Найдено, %: C 46,06; H 5,48; N 30,68. C 7 H 10 N 4 S. Вычислено, %: C 46,13; H 5,53; N 30,74.
Данные спектров ЯМР 1Н и 13С, Тпл и выход соединений 2–7 представлены в табл. 1.
Данные спектров ЯМР 1Н, 13С, Т пл и выход соединений 2–7
Таблица 1
|
Соединение |
Данные спектров ЯМР 1Н и 13С, δ, м. д. |
Т пл , °С |
Выход, % |
|
6 1 N N 5 H a 2 4 1' 2' 3' a H 2 N N 3 S H b 2 |
ЯМР 1Н : 3,71 (2Н, д.; 3J = 6,8 Гц, SCH 2 ); 5,09 (1Н, д. т.; 2J = 16,9, 3J = 1,5, =CH 2 (Н b )); 5,29 (1Н, д. д.; 2J = 16,9, 3J = 0,8, =CH 2 (H a )); 5,85– 5,96 (1Н, м., -CH=); 6,57 (2H, уш. с.; NH 2 ); 8,22 (1Н, с., H-6) |
139 |
37 |
|
6 1 N N 5 II 1 3' 2JI J.4 1' 3' 2' CH 2 H2N N3 S 4' CH 3 3 |
ЯМР 1Н : 1,78 (3H, с.; СН 3 ); 3,77 (2Н, с.; SCH 2 ); 4,85–4,86 (1H, м.; =СН 2 ); 5,03–5,04 (1H, м.; =СН 2 ); 6,78 (2H, уш. с.; NH 2 ); 8,23 (1H, с.; Н-6) |
145 |
93 |
|
6 1N N5 2 1' 3' 2 4 2' CH2 H 2 N N3 S Br 4 |
ЯМР 1Н : 4,19 (2Н, с.; SCH 2 ); 5,58 (1H, д.; 2J = 1,5, =СН 2 ); 6,10 (1H, д.; 2J = 1,5, =СН 2 ); 6,94 (2H, уш. с.; NH 2 ); 8,26 (1Н, с.; Н-6) |
85 |
75 |
|
6 4' 1 N N5 CH 3 2JI d4 1' 3' 2 5' H 2 N N3 S CH 3 5 |
ЯМР 1Н : 1,73 (3Н, с.; СН 3 ); 1,74 (3Н, с.; СН 3 ); 3,74 (2Н, д.; 3J = 7,8, SCH 2 ); 5,33 (1H, т.; 3J = 7,8, -СН=); 5,58 (2H, уш. с.; NH 2 ); 8,30 (1Н, с.; Н-6). |
92 |
24 |
|
ЯМР 13С : 17,95 (C-4ʹ, C-5ʹ); 28,32 (C-1ʹ); 118,22 (C-2ʹ); 137,22 (C-3ʹ); 164,88 (C-6); 165,01 (C-4); 182,32 (C-2). |
|||
|
6 1 N N5 2н 4 1' 2' 3' H 2 N N S 3 6 |
ЯМР 1Н : 3,91 (2H, д.; SCH 2 ); 6,35–6,40 (1Н, м.; –CH=); 6,68–6,71 (1H, м.; =CHPh); 7,23– 7,43 (5H, м, Ph); 7,61 (2H, уш. с.; NH 2 ); 8,26 (1H, c.; H-6). |
134 |
93 |
|
6 1 N N5 2 4 1' 2' 3' 4' H 2 N N3 S CH 2 7 |
ЯМР 1Н : 2,37–2,40 (2Н, м.; -СН 2 -); 3,09–3,13 (2Н, м.; SCH 2 ); 5,03–5,06 (1H, м.; =СН 2 ); 5,08–5,13 (2H, м.; =СН 2 ); 5,83–5,88 (1Н, м.; -СН=); 6,97 (2H, уш. с.; NH 2 ); 8,23 (1Н, с.; Н 6 ). |
107 |
72 |
|
ЯМР 13С : 28,25 (C-2ʹ); 32,95 (C-1ʹ); 116,38 (C-4ʹ); 136,50 (C-3ʹ); 157,95 (C-6); 164,75 (C-4); 179,80 (C-2). |
Синтез 2-((4-амино-1,3,5-триазин-2-ил)сульфанил)-1-(4-(4-хлорфенил)-2,2,4-триметил-3,4-дигидрохинолин-1(2H)-ил)этан-1-онa (8).
К раствору 0,231 г (1,8 ммоль) соединения 1 в метаноле прибавляли 0,63 мл (1,9 ммоль) 3М раствора метилата натрия в метаноле. Метанол отгоняли на ротационном испарителе. Образовавшуюся натриевую соль соединения 1 растворяли в 10 мл N,N-диметилацетамида, добавляли 0,65 г (1,8 ммоль) 2-хлор-1-(4-(4-хлорфенил)-2,2,4-триметил-3,4-дигидрохинолин-1(2H)-ил)этан-1-она. Реакционную массу перемешивали в течение 8 ч, выливали в 100 мл воды. Выпавший осадок отфильтровывали и высушивали. Затем перекристаллизовали из смеси изопропиловый спирт – диоксан. При этом было выделено 0,456 г соединения 8 в виде порошка белого цвета. S-алкилтриазин 8 характеризуется ограниченной растворимостью в хлороформе, спиртах, ацетоне и в ледяной уксусной кислоте при комнатной температуре. Выход 56 %. Тпл 204 °С. Найдено, %: C 60,86; H 5,34; N 15,40. C23H24ClN5OS. Вычислено, %: C 60,85; H 5,33; N 15,43.
Результаты и обсуждение
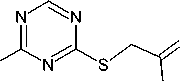
Так как реакция соединения 1 с галогенпроизводными углеводородов представляет собой процесс нуклеофильного замещения, то для увеличения нуклеофильности атома серы нами была выбрана щелочная среда. В системе ДМФА/K 2 CO 3 (либо ДМФА/NaOH, схема 1) реакцией алке-нилирования триазинтиона 1 аллилбромидом, 2-метил-3-хлор-1-пропеном, 2,3-дибромпропеном-1, пренилбромидом, циннамилхлоридом и бутенилбромидом нами впервые были получены 4-аллилсульфанил- ( 2 ), 4-(2-метилпропен-2-ил)сульфанил- ( 3 ), 4-(2-бромпропен-2-ил)сульфанил-( 4 ), 4-(2-метилбутен-2-ил)сульфанил- ( 5 ), 4-циннамилсульфанил- ( 6 ) и 4-(бутен-1-ил)сульфанил-1,3,5-триазин-2-амины ( 7 ) с достаточно хорошими выходами. Небольшой выход, наблюдающийся лишь в случае соединения 5 , связан, по-видимому, прежде всего со сложностью выделения его из реакционной среды. Следует отметить, что изменение системы ДМФА/K 2 CO 3 на ДМФА/NaOH существенно не влияет на выход продукта алкенилирования.
H2N N
CH2
Br
Br CH 2
CH 3
H 2 N
H 2 N
CH 3 Cl
H 2 N
SH
H 2 N
H2N N S
H2N N
H
HC
i HN
i: ДМФА-K2CO3; ii: ДМФА-NaOH
Схема 1. Синтез 4-алкенилсульфанил-1,3,5-триазин-2-аминов (2–7)
Самым слабопольным сигналом в спектрах ЯМР 1Н соединений 2–7 является сигнал ароматического протона триазинового цикла (см. табл. 1), проявляющийся в виде синглета в области 8,22–8,30 м. д. Протоны фенильного цикла в спектре ЯМР 1Н соединения 6 наблюдаются в виде мультиплетов в области ароматических протонов при 7,23–7,43 м. д. В сильном поле – при 3,10– 4,19 м. д. – в спектрах ЯМР 1Н продуктов алкенилирования 2–7 наблюдаются сигналы протонов -S-CH2 группы. В случае соединений 3 и 5 присутствие электронодонорной группы -CH3 в аллильном фрагменте не приводит к существенному смещению подобного сигнала в спектрах ЯМР 1Н данных соединений по сравнению с аналогичным сигналом в спектре аллилсульфида 2, в то время как удлинение алкенильного радикала на одно метиленовое звено в структуре соединения 7 вызывает существенное смещение (на 0,59 м. д.) протонов -S-CH2-группы в его спектре ЯМР 1Н в сторону сильного поля. Наличие в аллильном заместителе в соединении 4 атома брома, проявляющего электроноакцепторные свойства, приводит к сильному смещению (на 0,47 м. д.) сигнала протонов группы -S-CH2 в слабое поле по сравнению с аналогичным сигналом в спектре аллилсульфида 2. Тогда как наличие фенильного заместителя в соединении 6 (рис. 1), способст- вующего появлению сопряжения между кратной связью в цепи пропенила и Ph-ароматической системой, приводит к аналогичному смещению сигнала лишь на 0,20 м. д.
Протоны группы =СН2, присутствующие только в структуре сульфидов 2–4 и 7 , образуют два сигнала в спектрах ЯМР 1Н: один сигнал – в области 4,85–5,58 м. д., второй – в области 5,03– 6,10 м. д. Следует отметить, что для соединения 3 данный сигнал является более расщепленным за счёт дальних спин-спиновых взаимодействий этих протонов с протонами метильной группы.
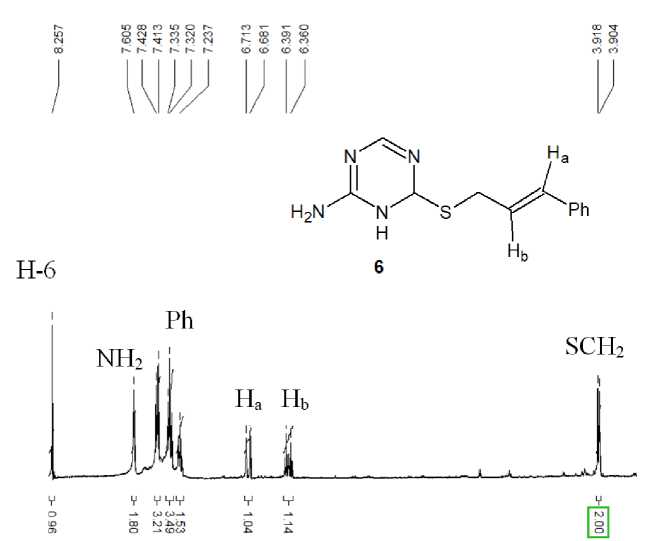
Рис. 1. Спектр ЯМР 1Н 4-циннамилсульфанил-1,3,5-триазин-2-амина 6
Наиболее расщепленным сигналом в спектрах ЯМР 1Н исследуемых соединений 2 , 5–7 является сигнал протона -CH=, который проявляется при 5,33–6,40 м. д. При этом его смещение для циннамилсульфида 6 в область 6,35–6,40 м. д. можно объяснить, по-видимому, влиянием фенильного заместителя, участвующего в сопряжении с кратной связью -CH= группы.
Сильнопольная часть спектров ЯМР 1Н металлилсульфида 3 и пренилсульфида 5 содержит сигналы алифатических протонов CH 3 -группы в виде синглетов при 1,78 м. д. (для соединения 3 ) и при 1,73; 1,74 м. д. (для соединения 5 ). Алифатические протоны -СН2-группы в спектре ЯМР 1Н бутенилсульфида 7 образуют сигнал, расщепленный за счёт спин-спиновых взаимодействий с соседними -S-CH 2 и -CH= протонами, в виде мультиплета при 2,37–2,40 м. д.
Положение сигнала протонов NH2-группы в спектрах ЯМР 1Н является нехарактеристичным, поскольку оно в значительной степени зависит от степени участия группы в возможном формировании водородных связей, концентрации и температуры [27]. Однако в нашем случае данной группе протонов, вероятнее всего, соответствуют уширенные синглеты в области 5,58–7,61 м. д.
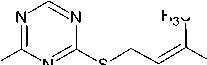
В спектрах ЯМР 13С пренилсульфида 5 и бутенилсульфида 7 (рис. 2) в области сильных полей резонируют углероды алкенильных групп. Так, сигналы при 28,32 и 32,95 м. д. можно отнести к сигналам углерода -S-CH 2 группы соединений 5 и 7 соответственно, а сигналы при 17,95 м. д. – к сигналу углеродов метильных групп соединения 5 , и при 28,25 м. д. – к сигналу метиленового углерода С-2ʹ соединения 7 .
Углерод групп -СН= наблюдаются в спектрах ЯМР 13С при 118,22 м. д. (для соединения 5 ) и 136,50 м. д. (для соединения 7 ), а углерод концевой группы =СН 2 – при 116,38 м. д. Более разветвлённый sp2-гибридизованный угрерод С-3ʹ, присутствующий в структуре пренилсульфида 7 , даёт сигнал при 137,22 м. д.
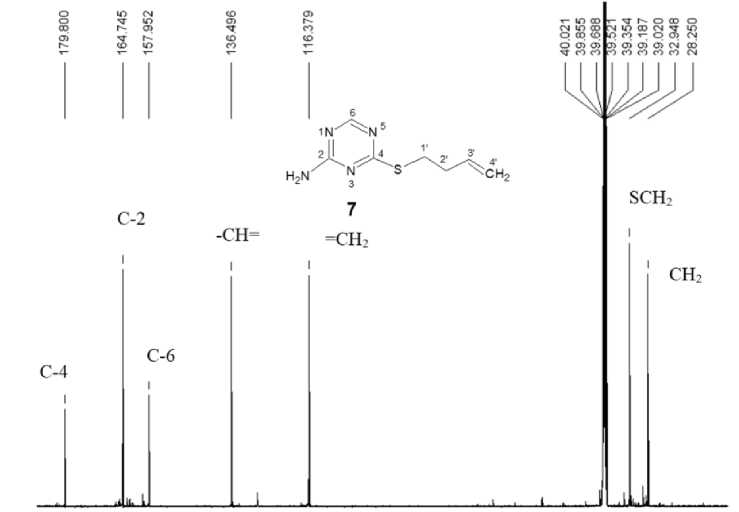
Рис. 2. Спектр ЯМР 13С 4-(бутен-1-ил)сульфанил-1,3,5-триазин-2-амина 7
Ароматические углеродные атомы резонируют в области слабых полей. Самым слабопольным сигналам в спектрах ЯМР 13С при 182,32 (для соединения 5 ) и 179,80 м. д. (для соединения 7 ), по-видимому, будет соответствовать углерод С-4 триазинового цикла, связанный с двумя атомами азота и одним атомом серы. Углерод С-2, связанный с тремя одинаковыми гетероатомами азота, резонирует при 165,01 и 164,75 м. д. соответственно для соединений 5 и 7 , а углерод С-6 – при 164,88 и 157,95 м.д.
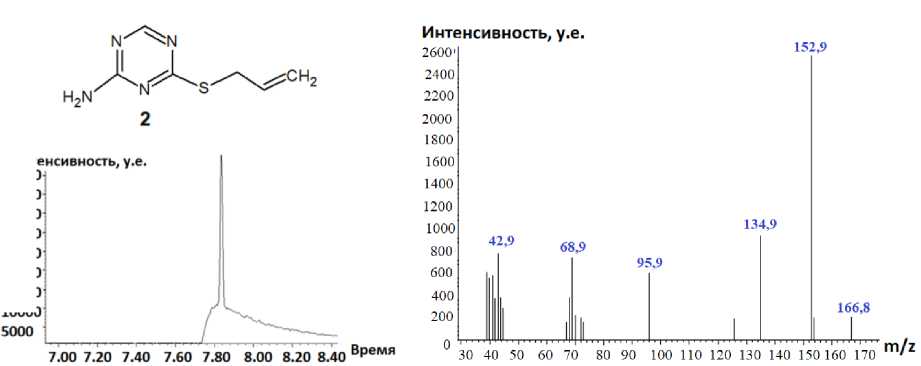
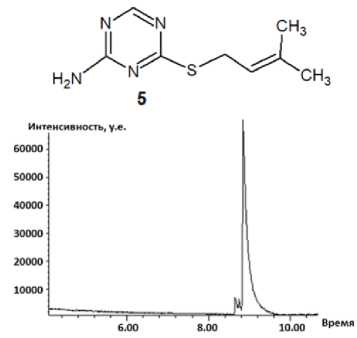
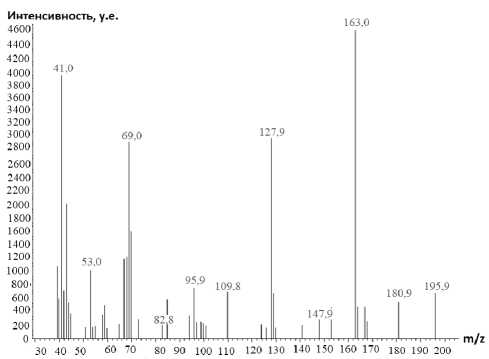
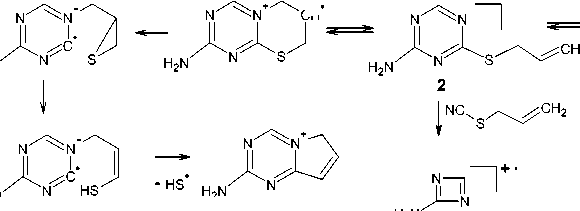
Методом хромато-масс-спектрометрии нами были исследованы аллилсульфид 2 , пренил-сульфид 5 и бутенилсульфид 7 (рис. 3–5). Следует отметить, что на хроматограмме, полученной в ходе ГХ-МС анализа соединения 5 , присутствует пик с максимальной интенсивностью, соответствующий данному соединению с молекулярной массой 196. Кроме того, наличие на хроматограмме минорных пиков, соответствующих масс-спектрам фрагментарных ионов с m/z 168 и m/z 181, свидетельствует о нестабильности молекулярного иона соединения 5 : в результате электронной ионизации он претерпевает фрагментацию, рассмотренную далее, с отрывом радикала •СН3 и последовательным отрывом молекулы НNC и атома водорода.
a)
б)
Рис. 3. Хроматограмма (а) и масс-спектр (б) 4-аллилсульфанил-1,3,5-триазин-2-амина (2)
В масс-спектре аллилсульфида 2 (см. рис. 3б) пик молекулярного иона с m/z 168 не обнаружен, но присутствует пик иона [M-1]+, образующийся при отщеплении атома водорода:
- . H
CH 2
m/z 167 (7%)
Фрагментарный ион [M-•H]+ является характерным для класса аминов [28, 29].
a)
б)
Рис. 4. Хроматограмма (а) и масс-спектр (б) 4-(2-метилбутен-2-ил)сульфанил-1,3,5-триазин-2-амина (5)
a)
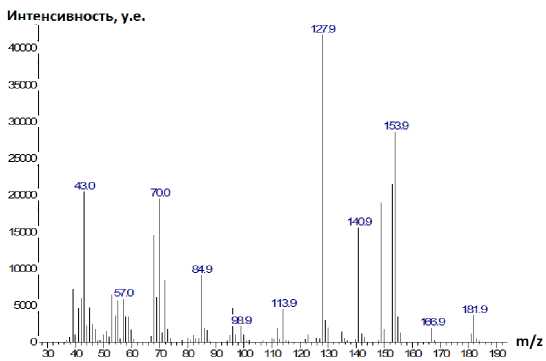
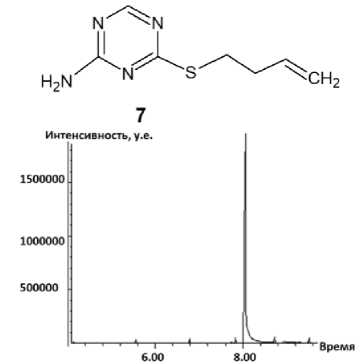
Рис. 5. Хроматограмма (а) и масс-спектр (б) 4-(бутен-1-ил)сульфанил-1,3,5-триазин-2-амина (7)
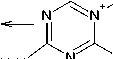
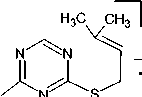
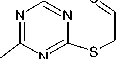
Характерными пиками в масс-спектрах соединений 2 , 5 и 7 являются пики [М-15]+ и [М-33]+, образование которых связано с отщеплением от молекулярного иона метильного радикала и радикала • SH соответственно (схемы 2-4). В случае аллилсульфида 2 пик с m/z 153, соответствующий иону [M-•СH3]+, является максимально интенсивным, тогда как в случае пренилсульфида 5 максимальной интенсивностью обладает пик с m/z 163, соответствующий иону [M- ^ SH] + . Для соединений 5 и 7 помимо отрыва радикала •SH протекает дальнейшее отщепление соответственно молекулы метилацетилена и ацетилена, приводящее к образованию одного и того же бициклического катиона 4-амино-7-тио-1,3,5-триазабицикло[4.2.0]окта-1,3,5-триена и появлению пика с m/z 141. Бициклический катион может быть получен и по другому пути фрагментации в случае бутенилсульфида 7 , заключающемуся в отщеплении аллильного радикала от молекулярного иона (см. схему 4).
При фрагментации молекулярного иона алифатических сульфидов достаточно часто проте- кает разрыв связи алкенильного заместителя с серой, причём, как известно [28], этот процесс может сопровождаться миграцией атома Н. Подобным образом происходит расщепление пренил- сульфида 5 и бутенилсульфида 7, что способствует появлению в их масс-спектрах пика с m/z 128, который можно отнести к катион-радикалу 4-амино-1,3,5-триазин-2-тиола. Для соединения 7
данный пик характеризуется интенсивностью 100 %.
- CH 3
+ .
H 2 N
H 2 N
CH m/z 135 (34%)
2N m/z 69 (27%)
m/z 153 (100%)
Схема 2. Фрагментация 4-аллилсульфанил-1,3,5-триазин-2-амина (2) при отщеплении •CH 3 - и •SH
H 3 C CH 3
H 2 N
S
H 2 N
H 3 C CH 3
CH
S
H 2 N
m/z 196 (14%)
+.
H 2 N
CH +3
H 3 C CH 3
H 8
H 2 N N HS
H 2 N m/z 128 (65%)
+.
SH
N
- HS
H 3 C CH 3 +
N +
H2N m/z 163 (100%)
CH 3
- NC
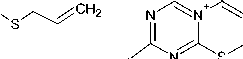
S
+ .
H 2 N
H2N m/z 69 (64%)
m/z 181 (12%)
CH m/z 141 (4%)
H 2 N
Схема 3. Фрагментация 4-(2-метилбутен-2-ил)сульфанил-1,3,5-триазин-2-амина (5) при отщеплении •CH 3 - и •SH
Помимо описанных путей фрагментации для соединений 2 и 5 следует отметить отщепление от молекулярного иона алкенилтиоционата и образование катион-радикала 1,3-диазет-2-амина, для которого соответствует пик с m/z 69 в масс-спектре. А также для соединений 5 и 7 наблюдается характерная для ароматических аминов фрагментация с последовательным элиминированием от м+• молекулы нnc и атома водорода [28] :
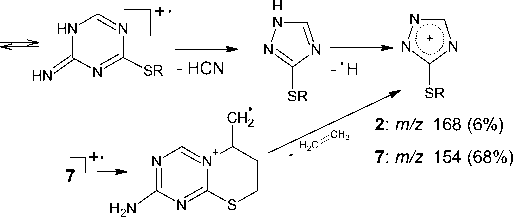
Пик с m/z 154 в масс-спектре бутенилсульфида 7 является достаточно интенсивным, что можно объяснить возможностью его образования и по другому пути фрагментации: при отщеплении молекулы этилена от молекулярного иона (см. схему 4).

H 2 N

H 2 N

- HS
m/z 149 (45%)
m/z 154 (68%)
m/z 141 (37%)
Схема 4. Фрагментация 4-(бутен-1-ил)сульфанил-1,3,5-триазин-2-амина (7) при отщеплении •CH 3 - и •SH
Реакции S-алкилирования триазинтиона 1 являются удобным и универсальным методом диверсификации структуры 1,3,5-триазинов и получения новых соединений с широким спектром практических полезных свойств. Использование гетероциклических алкиляторов позволяет вводить в молекулу симм -триазина дополнительный фармакофорный цикл. N-Хлорацетил-производные гидрохинолинового ряда нередко используют в качестве гетероциклических алки-ляторов [30], что позволяет получать системы, линеарно связанные с гидрохинолиновым циклом. Последние представляют большой интерес как биологически активные вещества [31], в связи с чем нами была изучена реакция алкилирования 4-амино-1,3,5-триазин-2-тиона 1 2-хлор-1-(2,2,4-триметил-4-хлорфенил-3,4-дигидрохинолин-1(2 H )-ил)этаноатом. Реакцию проводили в диметилацетамиде при комнатной температуре, предварительно получали натриевую соль соединения 1 . В данном случае, также как и в представленных выше примерах, реакция идёт только с участием атома серы с образованием 2-((4-амино-1,3,5-триазин-2-ил)сульфанил)-1-(4-(4-хлорфенил)-2,2,4-триметил-3,4-дигидрохинолин-1(2 H )-ил)этан-1-онa ( 8 ):
H 2 N
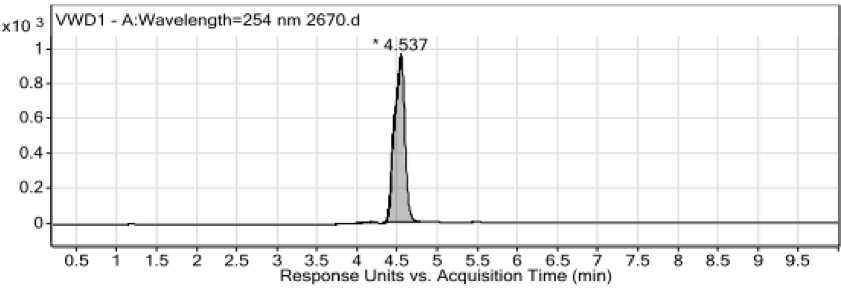
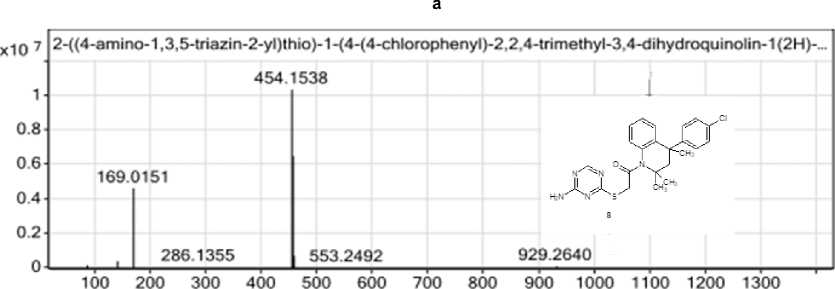
Структура соединения 8 подтверждена методом ВЭЖХ-МС-анализа. На рис. 6 представлены хроматограмма и масс-спектр соединения 8 .
Counts vs. Mass-to-Charge (m/z)
б
Рис. 6. Хроматограмма (а) и масс-спектр (б) 2-((4-амино-1,3,5-триазин-2-ил)сульфанил)-1-(4-(4-хлорфенил)-
2,2,4-триметил-3,4-дигидрохинолин-1(2 H )-ил)этан-1-онa 8
Выводы
Таким образом, в настоящем исследовании реакцией нуклеофильного замещения в системе ДМФА/K 2 CO 3 и ДМФА/NaOH из триазинтиона 1 и аллилбромида, 2-метил-3-хлор-1-пропена, 2,3-дибромпропена-1, пренилбромида, циннамилхлорида и бутенилбромида нами синтезированы неизвестные ранее 4-аллилсульфанил- 2 , 4-(2-метилпропен-2-ил)сульфанил- 3 , 4-(2-бромпропен-2-ил)сульфанил- 4 , 4-(2-метилбутен-2-ил)сульфанил- 5 , 4-циннамилсульфанил- 6 и 4-(бутен-1-ил)сульфанил-1,3,5-триазин-2-амины 7 соответственно. Строение полученных алкенилсульфи-дов 2–7 было установлено с использованием таких методов, как ЯМР 1Н, 13С и хромато-масс-спектрометрия. Использование галогеналкильных производных гетероциклического ряда позволило ввести в молекулу сим -триазина новый фармакофорный фрагмент, расширяя спектр потенциальной биологической активности производных 4-амино-1,3,5-триазин-2-тиона.
Список литературы Синтез новых s-производных 4-амино-1,3,5-триазин-2-тиона и их исследование методами ЯМР 1Н, 13С и хромато-масс-спектрометрии
- Brzozowski Z., Sqczewski F., Gdaniec M. // European Journal of Medicinal Chemistry. 2000. V. 35. P. 1053. DOI: 10.1016/s0223-5234(00)01194-6.
- До Ван Куи. Синтез и биологическая активность новых гибридных 1,3,5-триазинов на основе замещенных бигуанидинов и амидинотиомочевины: автореф. ... канд. хим. наук. Воронеж, Воронежский государственный университет, 2023. 24 с.
- Игнатенко Е.А., Горбунов А.А., Шкляева Е.В. и др. // Химия гетероциклических соединений. 2014. № 5. С. 752.
- Мартыненко В.И., Промоненков В.К., Кукаленко С.С. и др. // Пестициды. М.: Агропромиз-дат, 1992. 368 с.
- Жоробекова Ш.Ж., Кыдралиева К.А., Худайбергенова Э.М., Прохоренко В.А. // Международный журнал прикладных и фундаментальных исследований. 2019. № 6. С. 174. EDN: LJXPSR.
- Розингер К., Минн К., Бауер К. и др. 2-Амино-4-бициклоамино-1,3,5-триазины, гербицидное средство на их основе и способ борьбы с сорняками. Пат. KZ (А) № 9121, Бюл. 6, 15.06.2000. 71 с.
- Петров Е.С., Гильманов Р. З., Собачкина Т.Н. и др. // Вестник Технологического университета. 2021. Т. 24, № 2. С. 19. EDN: VCGGTE.
- Мартин Д., Бауэр М., Панкратов В.А. Успехи химии. 1978. Т. XLVII, вып. 10. C. 1814. DOI: 10.1070/RC 1978v047n10ABEH002288.
- Weinreb S.M., & Schaumann E. (eds.) et al. Category 2, Hetarenes and Related Ring Systems. 2004. P. 449. DOI: 10.1055/sos-sd-017-00728.
- Рыбин А.Г., Зильберман Э.Н., Этлис И.В. и др. // Химия гетероциклических соединений. 1986. № 9. С. 1246.
- Li N, Tu M., Jiang B. et al. // Tetrahedron Letters. 2013. V. 54. P. 1743. DOI: 10.1002/CHIN.201327172.
- Кружилин А.А. Синтез новых линеарно связанных и конденсированных гетероциклических ансамблей на основе производных амидинотиомочевины: дис. ... канд. хим. наук. Воронеж, 2019. 146 с.
- FurukawaM. Chem. Farm. Bull. 1978. V. 26. P. 314. DOI: 10.1248/cpb.26.314.
- Newton T.W. Herbicidal Azines. Пат. WO2014064094 (A1): МПК A01N43/66; A01N43/68; C07C279/18; C07D251/42; C07D251/48. заявитель и патентообладатель BASF SE. -№ WO2013EP72055; заявл. 22.10.2013; опубл. 01.05.2014. 136 с.
- Katritzky A.R., Rogovoy B.V., Vvedensky V.Y. et al. J. Org. Chem. 2001, V. 66. P. 6797. DOI: 10.1021/jo010416a.
- Kobe J., Stanovnik B., Tisler M. Monatshefte fur Chemie. 1970. V. 101. P. 724. DOI: 10.1007/bf00909892.
- Niedballa U. and Vorbruggen H. J. Org. Chem. 1974. Vol. 39, No. 25. P. 3672. DOI: 10.1021/jo00939a012.
- Piskala A. Collection of Czechoslovak Chemical Communications. 1967. Vol. 31. P. 3958. DOI: 10.1135@cccc19673966.
- Guo G., Li G., Liu D. et al. Molecules. 2008. V. 13(7). P. 1487. DOI: 10.3390/molecules13071487.
- De Lannoy J., Nasielski-Hinkens R. Bulletin des Societes Chimiques Belges. 1972. V. 81(11-12). P. 587. DOI: 10.1002/bscb.19720810158.
- Hartenstein R., Fridivich I. J. Org. Chem. 1967. V. 32. P. 1653. DOI: 10.1021/jo01280a095
- Yellin T.O., Gilman D.J. Haloalkylguanidine compounds, pharmaceutical compositions and methods, processes and intermediates. Пат. US4447441 США: МПК C07D213/76; C07D231/40; C07D239/42; C07D239/46; C07D241/20; C07D249/04; C07D249/06; C07D249/10; C07D249/14; C07D251/16; C07D277/48; (IPC1-7): A61K31/41; A61K31/415; C07D231/38; C07D249/04. заявитель и патентообладатель Imperial Chemical Industries PLC. - № US19820353502; заявл. 1.03.1982; опубл. 8.05.1984. - 64 с.
- Baxter A., Eyssade C., Guile S. Novel compounds. Пат. SE0300456 D0 Швеция: МПК A61K31/451; A61K31/495; A61K31/519; A61K31/53; C07D401/04; C07D401/14; C07D471/04; C07D473/00; C07D473/18; C07D473/30; C07D513/04; (IPC1-7): A61K31/451; A61K31/495; A61K31/519; A61K31/53; C07D401/04; C07D401/14; C07D471/04; C07D487/04; C07D513/04. заявитель и патентообладатель AstraZeneca AB. - № WO2004074278; заявл. 18.02.2004; опубл. 02.09.2004. 38 с.
- Hanna N.B., Masojidkova M., Fiedler P., & Piskala A. Collection of Czechoslovak Chemical Communications. 1998. V. 63(2). P. 222. DOI: 10.1135/cccc19980222.
- Hanna N.B., Zajicek J., & Piskala A. Nucleosides and Nucleotides. 1997. V. 16(1-2). P. 129. DOI: 10.1080/07328319708002528.
- Mizuno A., Toda Y., Itoh M., Kojima K., & Kadoma Y. Journal of Molecular Structure. 1998. V. 441(2-3). P. 149. DOI: 10.1016/s0022-2860(97)00253-6.
- Самсонова Л.Г. Применение ИК и ПМР спектроскопии при изучении строения органических молекул. Учебно-методическое пособие. 2016. Томск: ТГУ. 60 с. https:// e.lanbook.com/ book/80246.
- Лебедев А.Т. Масс-спектрометрия в органической химии. М.: БИНОМ. Лаборатория знаний. 2003. 493 с. ISBN 5-94774-052-4.
- Сильверстейн Р., Вебстер Ф., Кимл Д. Спектрометрическая идентификация органических соединений. М.: БИНОМ. Лаборатория знаний. 2012. 557 с. ISBN: 978-5-94774-392-0.
- Потапов М.А., Потапов А.Ю., Шихалиев Х.С. // Бутлеровские сообщения. 2023. Т. 74, № 5. С. 122. DOI: 10.37952/R0I-jbc-01/23-74-5-122.
- До Ван Куи, Фунг Тхи Чинь, Столповская Н.В. и др. // Известия высших учебных заведений. Серия «Химия и химическая технология». 2023. Т. 66, № 4. С. 17. DOI: 10.6060/ivkkt.20236604.6802.


