Синтез производных целлюлозы, содержащих фосфатные, амино- и меркаптогруппы
Автор: Торлопов М.А.
Журнал: Известия Коми научного центра УрО РАН @izvestia-komisc
Рубрика: Химические науки
Статья в выпуске: 3 (7), 2011 года.
Бесплатный доступ
Тозилцеллюлоза использована для получения аминобутилдезоксицеллюлозы, меркаптодезоксицеллюлозы и водорастворимого фосфата целлюлозы по реак- ции межмолекулярного нуклеофильного замещения. Получены препараты с мак- симальным содержанием азота - 5.1, серы - 18.7, фосфора - 19.5 %.
Производные целлюлозы, фосфаты целлюлозы
Короткий адрес: https://sciup.org/14992465
IDR: 14992465 | УДК: 547.458.8:577.114.4
Текст научной статьи Синтез производных целлюлозы, содержащих фосфатные, амино- и меркаптогруппы
Использование низкомолекулярных нуклеофильных агентов для получения функциональных производных целлюлозы требует, как правило, поляризации связи между атомом углерода и замещаемой группой. К числу производных целлюлозы с такими поляризующими группами относятся некоторые сложные эфиры целлюлозы – нитраты, эфиры сульфокислот, фосфаты. Особенное распространение для синтеза фукциональных производных целлюлозы получили эфиры целлюлозы и п -толуолсульфокислоты (тозилаты). На их основе были получены различные ангидропроизводные целлюлозы, в систематическое изучение которых значительный вклад внесли советские ученые под руководством З.А.Роговина [1].
В настоящее время использование тозилатов целлюлозы (тозилцеллюлозы) представляется весьма перспективным методом получения новых производных целлюлозы как в связи с появлением новых методов получения этого промежуточного продукта, так и с интересом к практическому применению некоторых функциональных производных целлюлозы, полученных с использованием тозил-целлюлозы. Прежде всего, это касается применения аминодезоксипроизводных целлюлозы в биомедицинских областях [2, 3].
В данной работе исследовано использование тозилцеллюлозы для получения трёх типов производных: аминобутилдезоксицеллюлозы, меркаптодезоксицеллюлозы и фосфата целлюлозы.
Материалы и методы
Методы анализа . Спектры ЯМР 13С записаны на приборе «Bruker Avance II 300» (рабочая частота 75 МГц) в DMSO-d 6 . ИК-спектры образцов – на спектрометре “Prestige-21”, в таблетках KBr в области 700-4000 см-1. Элементный анализ образцов (определение серы) осуществляли на приборе EA-1110 фирмы «CE instruments» после сжигания образца в токе кислорода с хроматографической регистрацией продуктов. Содержание фосфора в образцах определяли с помощью фотометрического метода (образование окрашенного комплекса с фосформолибденовой синью) [3] после полного гидролиза полимера серной кислотой. Анализ серы в составе тиольных групп осуществляли методом кислотно-основного титрования после исчерпывающего окисления тиольных групп пероксидом водорода.
Материалы . Хлопковая МКЦ производства АО «Полиэкс» (г. Бийск), п -толуолсульфохлорид (Ts-Cl, Acros). N,N -диметилацетамид (ДМАА), N,N -диметилформамид (ДМФА), триэтиламин (NEt 3 ) перед использованием перегоняли, LiCl сушили в вакууме при 100 оС в течение 12 ч. Остальные реактивы использовали без дополнительной очистки.
Тозилцеллюлозу получали по методу, подробно описанному в работе [2] . Кратко: МКЦ растворяли в системе LiCl/ДМАА, вносили предварительно приготовленную смесь Ts-Cl/триэтиламин (2 моль NEt 3 на каждый моль Ts-Cl) в ДМАА. Реакцию этерификации вели 24 ч при 70С.
ИК-спектр (KBr, ν max, см-1): 3323 ( ν OH),: 3062 ( ν Ar), 1175 (SO 2 -O), 816 (S-O), 770 (δС-Н Ar). ЯМР 13С (75 MГц, DMSO-d 6 , δ, м.д.): 22.13, 72.71, 78.6, 98.9, 102.2, 126 – 133.1.
Дезоксиаминобутилцеллюлозу (Ц-NHBu) получали по реакции нуклеофильного замещения то-зилцеллюлозы. Типовой синтез: 2 г тозилата целлюлозы со степенью замещения 1.70 (4.7 ммоль) растворяли в 20 см3 ДМФА. При перемешивании вносили 1.72 г н -бутиламина (23.5 ммоль). Полученную смесь термостатировали 48 ч при 650С. По окончании реакции гомогенную реакционную смесь охлаждали, выливали в 100 см3 этанола, осадок отделяли, промывали водой, затем этанолом до нейтральной реакции, сушили в вакууме при 400С. Выход Ц-NHBu в виде желтоватого порошка составил 1.10 г. Содержание азота: 5.1 % масс. Ц-NHBu хорошо растворим в ДМСО, ДМФА, ДМАА, водном растворе кислот, хлороформе.
ИК-спектр (KBr, ν max, см-1): 2954, (νR 2 NH), 1597 (δNH), 816 (S-O), 1175 (SO 2 ), сл.770 (δС-Н Ar). ЯМР 13С (75 MГц, DMSO-d 6 , δ, м.д.): 13.98, 20.01,38.6-40.3, 73.8, 98.9, 102.5, 126 – 130.2.
Дезоксимеркаптоцеллюлозу (Ц-SH) синтезировали следующим образом: 2.0 г тозилцеллюлозы со степенью замещения 1.70 (4.7 ммоль) растворяли в 20 см3 ДМФА. Затем при перемешивании вносили 1.52 г (23.5 ммоль) тиокарбамида (S=CN2H4). Полученную смесь термостатировали 48 ч при 900С. По окончании гомогенную реакционную смесь охлаждали, выливали в 100 см3 этанола, осадок отделяли, промывали водой, затем этанолом до нейтральной реакции. Полученную соль Бунте обрабатывали 1.0 %-ным водным раствором NaOH в течение суток при 200С, осаждали этанолом, отделяли и промывали 70 %-ным этанолом до нейтральной реакции, затем сушили в вакууме при 400С. Выход Ц-SH в виде светло-коричневого порошка 0.72 г. Содержание серы (SH-группы): 18.7 % масс. Ц-SH не растворима в ДМСО, ДМФА, ацетоне. Набухает в водных растворах NaOH. ИК-спектр (KBr, νmax,см-1): 3495 (νOH), 2924 (νCH2), 2580(νC-S), 1620 (C=N), 1365, 1178 (SO2), 816(S-O).
Фосфат целлюлозы (ФЦ). Типовой синтез: 2.0 г тозилата целлюлозы со степенью замещения 1.7 (4.7 ммоль) растворяли в 20 см3 ДМФА. При перемешивании вносили тетрабутиловую соль о-фосфорной кислоты (23.5 ммоль, соль готовили нейтрализацией о-фос-форной кислоты водным раствором тетрабутиламмония до рН=7,8 с последующим высу шиванием в вакууме). Полученную смесь термостатировали 48 ч при 600С. По истечении этого времени гомогенную реакционную смесь охлаждали, выливали в 100 см3 этанола, осадок отделяли, промывали 70 %-ным этанолом. Для получения Na-соли препарат растворяли в 0.4 н NaCl, осаждали этанолом и очищали методом диализа, после чего сушили в вакууме при 400С. Выход ФЦ-Na в виде желтоватого порошка 1.60 г. Содержание фосфора 19.5 %-масс. Хорошо растворим в воде, не растворим в ДМСО, ДМФА, ацетоне, этаноле.
ЯМР 13С (75 MГц, D 2 О, δ, м.д.): 67.3, 70-79.8, 98.2, 131.3. ЯМР 31P (D 2 О, δ, м.д.): 18.18.
Результаты и обсуждение
В данной работе для получения тозилцеллю-лозы использован один из наиболее эффективных методов, основанный на проведении реакции целлюлозы с п -толуолсульфохлоридом в системе LiCl/ДМАА. Благодаря гомогенному составу реакционной системы тозилирование осуществляется в мягких условиях при пониженной температуре. Варьированием состава реакционной смеси, продолжительности реакции возможно получать препараты модифицированной целлюлозы с различной степенью замещения. Для данного исследования нами использован препарат тозилата целлюлозы со степенью замещения 1.5. Выводы о распределении тозилатных групп в статистическом звене сделаны на основе расшифровки данных ЯМР 13С спектров. По этим данным полностью этерифици-рованы гидроксильные группы при С6-атоме ангид-роглюкозного звена и частично при С2, С3-атомах. Эти данные согласуются с результатами исследований, представленных в работах [5]. Более высокая реакционная способность гидроксильной группы при С6 углеродном атоме ангидроглюкозного звена объясняется пространственными факторами – относительно большей доступностью первичной спиртовой группы ангидроглюкозного звена.
Реакции нуклеофильного замещения тозила-тов целлюлозы проводились с целью получения дезоксицеллюлоз, содержащих N- и S-дезоксигруппы в составе элементарных звеньев, а также фосфатные группы (рисунок).
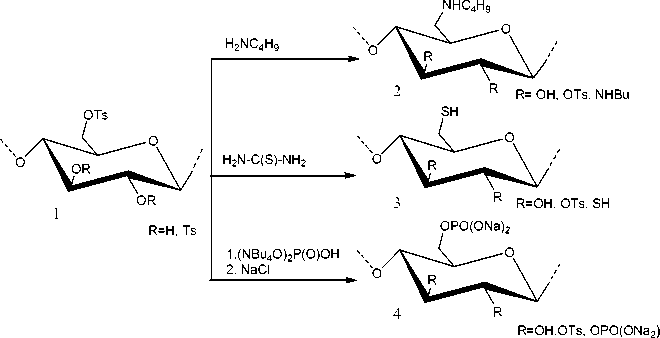
Рис. Схема трансформации тозилата целлюлозы (1) в дезоксиаминобу-тилцеллюлозу (2), дезоксимеркаптоцеллюлозу (3), фосфат целлюлозы (4).
Реакции межмолекулярного нуклеофильного замещения тозилцеллюлозы могут быть проведены в различных растворителях: воде, ацетоне, ДМСО и других. Выбор ДМФА для этой реакции обусловлен его высокой температурой кипения и способностью растворять как тозилцеллюлозу, так и все ис- пользованные нами нуклеофильные агенты. Избыток нуклеофильных агентов использовали для смещения направления реакции замещения в сторону образования целевых продуктов
Результаты замещения тозилатных групп при обработке тозилцеллюлозы н -бутиламином представлены в табл. 1.
Таблица 1
Результаты обработки тозилцеллюлозы пятикратным мольным избытком н-бутиламина в ДМФА, 650С
|
№ образца п.п. |
Продолжительность, ч |
Содержание азота, % мас. |
|
1 |
6 |
1.7 |
|
2 |
12 |
2.2 |
|
3 |
24 |
2.9 |
|
4 |
48 |
5.1 |
Приведенные результаты свидетельствуют о сравнительно медленной скорости реакции нуклеофильного замещения. В первые 24 ч содержание азота не превышает 2.9 % масс, увеличиваясь до 5.1 % масс через 48 ч реакции. Учитывая литературные данные [2] можно ожидать ускорение подобной реакции с увеличением температуры, однако в выбранных условиях синтеза её уровень определяется температурой кипения н -дибутиламина.
Полученный смешанный полисахарид, содержащий звенья аминодезоксиаминобутилцеллю-лозы, а также остатки тозильных групп, обладает интересными физико-химическими свойствами. Если исходная тозилцеллюлоза представляет собой гидрофобный полимер, растворимый в полярных апротонных растворителях, то после введения в ее структуру остатков бутиламина (содержание азота не менее 4 % мас.) смешанный полисахарид набухает или становится растворим в ацетоне, спиртах, подкисленных водных растворах, образует водорастворимые соли с органическими и неорганическими кислотами, т.е. обладает свойствами амфифильного полимера.
Тиокарбамид широко используется в органическом синтезе для получения сероорганических соединений, например меркаптанов, посредством обработки растворами щелочей промежуточного продукта – тиурониевых солей. Ранее меркаптосодержащие производные целлюлозы получены из галогендезоксицеллюлоз [6], из тозилцеллюлозы – действием сульфида натрия, восстановлением тиоцианатов и некоторых других производных [7]. В данной работе для получения Ц-SH использована реакция тиокарбамида с тозилцеллюлозой (со стадией гидролиза тиурониевых солей), результаты которой приведены в табл 2.
После 48-часовой обработки были получены образцы с содержанием серы (в составе меркаптогрупп) более 18 % масс. Следует отметить, что тиурониевые соли целлюлозы представляют определенный интерес ввиду их водорастворимости. Получаемая после их обработки водным NaOH Ц-SH не растворима в воде, но может быть растворена в водных щелочах, при условии степени замещения по SH-группам от 0.8 и выше.
Таблица 2
Результаты обработки тозилцеллюлозы пятикратным мольным избытком тиокарбамида в ДМФА, 900С
|
№ образца п.п. |
Продолжительность, ч |
Содержание серы в составе SH-групп %, мас. |
|
1 |
6 |
2.8 |
|
2 |
12 |
7.1 |
|
3 |
24 |
13.2 |
|
4 |
48 |
18.7 |
Использование реакции нуклеофильного замещения галоген- и тозилатпроизводных спиртов солями фосфорной кислоты встречается в химии нуклеозидов и их производных. По нашим данным, тозилцеллюлоза для этих целей ранее не использовалась. Для получения ФЦ нами применен метод, аналогичный синетзу дифосфата нуклеозида при кипячении с ацетонитриле смеси тетрабутиламиновой соли дифосфорной кислоты с хлоридом или тозилатом изопентенила [8]. Как показано ниже, данный метод вполне применим в химии высокомолекулярных соединений для получения фосфатов из тозилат и, по-видимому, галогенпроизвод-ных. Результаты взаимодействия тозилцеллюлозы с тетрабутиламиновой солью о -фосфорной кислоты в ДМФА приведены в табл. 3. Содержание фосфора в образцах рассчитано в Na-соли ФЦ.
Таблица 3
Результаты обработки тозилцеллюлозы тетрабутиламиновой солью о-фосфорной кислоты в ДМФА при 650С (48 ч)
|
№ образца п.п. |
Избыток (NBu 4 O) 2 P(O)OH на звено тозилцеллюлозы, моль/моль |
Содержание фосфора, % мас. |
|
1 |
1.1 |
2.6 |
|
2 |
2.0 |
2.9 |
|
3 |
3.0 |
15.2 |
|
4 |
5.1 |
19.5 |
Как следует из приведенных данных, наиболее полное замещение тозилатных групп наблюдается в случае пятикратного избытка соли o -фосфорной кислоты. Использование в данном случае тетрабутиламиновой соли обусловлено её растворимостью в ДМФА, в отличие от более доступных фосфатов Na или K. Получаемые по данному методу ФЦ-Na с высокой степенью замещения хорошо растворимы в воде.
На сегодняшний день известно несколько способов получения ФЦ. Большинство из них, однако, приводят к получению не растворимых в воде продуктов–этерификация целлюлозы фосфорной кислотой [9], ее ангидридом [10] или хлорангидри-дом [11] – вследствие образования как моно-, так и ди- , и триалкилфосфатов, «сшивающих» целлюлозу [1]. Для получения водорастворимых ФЦ с высо- кой степенью замещения существует ограниченное количество методов, имеющих, как правило, несколько стадий. По этим причинам предлагаемый способ получения ФЦ, несомненно, способен найти некоторое применение в препаративном синтезе, особенно препаратов ФЦ с определенным положением фосфатной группы в элементарном звене.
Таким образом, показана возможность использования тозилцеллюлозы для получения амино- и меркаптодезоксицеллюлоз, а также водорастворимых фосфатов целлюлозы с высокой степенью замещения.
Выводы
-
1. Предложен метод синтеза амфифильных производных целлюлозы, содержащих звенья де-зоксиаминобутилглюкозы.
-
2. Показана возможность синтеза меркаптодезоксицеллюлозы с помощью реакции нуклеофильного замещения тозилцеллюлозы тиокарбамидом и последующим гидролизом тиурониевой соли в воде.
-
3. Впервые синтезированы водорастворимые фосфаты целлюлозы реакцией нуклеофильного замещения тозилцеллюлозы тетрабутиламиновой солью фосфорной кислоты.
Работа выполнена при финансовой поддержке Министерства образования и науки РФ – госконтракта №16.512.11.2012 «Разработка методов получения физиологически активных веществ гемореологического действия на основе полусинтетических терпеноидов и растительных полисахаридов».
Список литературы Синтез производных целлюлозы, содержащих фосфатные, амино- и меркаптогруппы
- Роговин З.А. Химия целлюлозы. М.: Химия, 1972. С. 231.
- Knaus S., Mais U., Binder W.H. Synthesis, characterization and properties of methylaminoCellulose//Cellulose, 2003. No.10. P. 139-150.
- Heinze Th., Koschella1 A., Magdaleno-Maiza L., Ulrich A.S. Nucleophilic displacement reactions on tosyl cellulose by chiral amines//Polymer Bulletin, 2001. No. 46. P. 7-13.
- Основы аналитической химии/В.И. Фадеева, Т.Н. Шеховцева и др.; под. ред. Ю.А.Золотова. М.: Высш. шк., 2001. С. 463.
- Arai K., Yoda N. Preparation of water-soluble sodium deoxyCellulosesulfonate from homogeneously prepared tosylCellulose//Cellulose, 1998. No. 5. P. 51-58.
- Aoki N., Fukushima K., Kurakata H., Sakamoto M. 6-Deoxy-6-mercaptocellulose and its S-substituted derivatives as sorbents for metal ions//Reactive & Functional Polymers, 1999. No. 42. P. 223-233.
- Целлюлоза и ее производные/Под ред. Н.Байклза, Л.Сегала; пер. с англ. под ред. З.А.Рого-вина. Т. 2. М.: Мир, 1974.
- Youngha R, Scott A.I. Efficient one-step syntheses of isoprenoid conjugates of nucleoside 5-diphosphates//Organic letters, 2003. Vol. 5. No. 24. P. 4713-4715.
- Fricain J.C., Granja P.L., Barbosa M.A. Cellulose phosphates as Biomaterials. In vivo biocompatibility studies//Biomaterials, 2002. No. 23. P. 971-980.
- Петропавловский Г.А., Котельникова Н.Е. Дегидратация и фосфорилирование целлюлозы оксидом фосфора (5) в среде диметилформамида//Cellulose chemistry and technology, 1985. № 19. P. 591-600.
- Tian C.M., Xie X.J. The Effect of metal ions on thermal oxydative degradation of cotton cellulose ammonium phosphate//J. of thermal analysis and calorymetry, 2003. No. 73. P. 827.


