Синтез производных N-(5-(метилсульфанил)- 4H-1,2,4-триазол-3-ил)пиридин-2-амина и их 1,2,4-триазиновых предшественников
Автор: Штайц Ярослав Константинович, Ладин Евгений Дмитриевич, Шарутин Владимир Викторович, Копчук Дмитрий Сергеевич, Рыбакова Анастасия Владимировна, Шарафиева Эльвира Рашидовна, Криночкин Алексей Петрович, Зырянов Григорий Васильевич, Поспелова Татьяна Александровна, Матерн Анатолий Иванович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 2 т.15, 2023 года.
Бесплатный доступ
Зучено взаимодействие 5-циано-1,2,4-триазинов с 5-метилсульфанил-4 Н -1,2,4-триазол-3-амином в условиях отсутствия растворителя. В результате был получен продукт нуклеофильного ипсо -замещения цианогруппы в составе триазина на остаток соответствующего гетероциклического амина. Строение продукта было установлено на основе данных спектров ЯМР 1Н и масс-спектрометрии (электроспрей). В спектре ЯМР 1Н следует отметить наличие характеристичного трехпротонного синглета в области 2,61 м. д., который может быть отнесён к сигналу протонов метилсульфанильной группы. Последующее взаимодействие полученного продукта с 2,5-норборнадиеном в условиях автоклава позволило превратить 1,2,4-триазиновый цикл в пиридиновый. Было установлено, что метилсульфанильная группа не претерпевает каких-либо трансформаций в ходе реализации обеих стадий синтеза, что было подтверждено в том числе данными РСА полученного функционализированного пиридина. По данным РСА соединение 4 кристаллизуется в виде двух кристаллографически независимых молекул в нецентросимметричной пространственной группе Р -1 триклинной сингонии. Кристаллическая структура формируется за счёт образования множественных межмолекулярных контактов N∙∙∙H типа между двумя кристаллографически независимыми молекулами триазолилпиридин-2-амина. В спектре ЯМР 1Н последнего наблюдаются два дублета протонов нового пиридинового кольца в области 7,37 и 7,61 м. д. Таким образом, поведение 5-метилсульфанил-4 H -1,2,4-триазол-3-амина отличается от свойств его аналога, содержащего в положении С5 меркаптогруппу. А именно, нашей научной группой ранее было установлено, что в этом случае в ходе реализации ипсо -замещения цианогруппы триазина на фрагмент последнего амина происходила параллельная реакция десульфирования.
4н-1, 2, 4-триазол-3-амины, 5-циано-1, 2, 4-триазины, нуклеофильное ипсо-замещение, реакция аза-дильса-альдера, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147240932
IDR: 147240932 | УДК: 546.27+546.22+548.1+542.913 | DOI: 10.14529/chem230207
Текст научной статьи Синтез производных N-(5-(метилсульфанил)- 4H-1,2,4-триазол-3-ил)пиридин-2-амина и их 1,2,4-триазиновых предшественников
Производные 1,2,4-триазолов представляют интерес в области сельского хозяйства [1], в качестве ингибиторов коррозии [2], а также биологически активных соединений [3–5]. В частности, данный гетероцикл входит в состав противовирусных препаратов Риамиловир [6] и Триазид [7]. 1,2,4-Триазиновое ядро также представляет интерес с точки зрения фармакофорных свойств [810]. Ранее [11] нами была показана возможность введения остатков 4 H -1,2,4-триазол-3-аминов в состав 1,2,4-триазинового ядра в результате нуклеофильного ипсо -замещения цианогруппы в положении С5, при этом в случае наличия меркаптогруппы в положении С5 триазола параллельно реализовывалась реакция десульфирования, что было подтверждено в том числе встречным синтезом с участием 5-незамещенного 4 H -1,2,4-триазол-3-амина:
Solvent-free
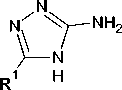
R1 = SH, H
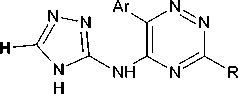
В данной работе нами продолжено изучение возможностей функционализации триазинового цикла фрагментами 4 H -1,2,4-триазол-3-аминов. А именно, было опробовано использование в аналогичном превращении 4 H -1,2,4-триазол-3-амина, имеющего в положении С5 метилсульфанильную группу.
Экспериментальная часть
Исходный 5-цианотриазин ( 1 ) был получен по ранее предложенной методике [11, 12] для аналогичных соединений. Все остальные реагенты коммерчески доступны.
Синтез 6-(4-бромфенил)-3-(4-хлорфенил)-N-(5-(метилсульфанил)-4H-1,2,4-триазол-3- ил)-1,2,4-триазин-5-амина (3)
Смесь 5-цианотриазина 1 (120 мг, 0,32 ммоль) и метилсульфанил-триазола 2 (47 мг,
0,36 ммоль) перемешивают на магнитной мешалке при 155 ºС в атмосфере аргона в отсутствии растворителя в течение 8 ч. Продукт выделяют колоночной хроматографией (хлороформ-этилацетат 9:1, R f 0,3) Получают 100 мг (65 %). Спектр ЯМР 1H (400 МГц, CDCl 3 , м. д., J /Гц): 8,35–8,32 (м, 2Н, С 6 H 4 Cl); 7,73–7,68 (м, 2Н, С 6 H 4 Br); 7,63–7,60 (м, 2Н, С 6 H 4 Br); 7,58–7,54 (м, 2Н, С 6 H 4 Cl); 2,61 (с, 3Н, CH 3 ). MS EI: m/z ( I , %): 474 (100), 475 (19,5) [M]+, 476 (97,2), 477 (18,9) [M+1]+, 478 (31,1), 479 (6,1), 480 (1,4) [M+2]+.
Синтез 3-(4-бромфенил)-6-(4-хлорфенил)-N-(5-(метилсульфанил)-4H-1,2,4-триазол-3- ил)пиридин-2-амина (4)
Реакция проводится в колбе-автоклаве в атмосфере аргона. Исходный 5-аминотриазин (100 мг, 0,21 ммоль) растворяют в 15 мл 1,2-дихлорбензола, после чего к нему добавляют 0,1 мл 2,5-норборнадиена (1,05 ммоль). Полученную смесь перемешивают в течение 24 ч при 215 ºС. Затем растворитель отгоняют при пониженном давлении, продукт выделяют колоночной хроматографией (хлороформ-этилацетат 9:1, R f 0,7). Получают 53 мг (53 %). Аналитический образец получен перекристаллизацией из этанола. Спектр ЯМР 1H (400 МГц, CDCl 3 , м. д., J /Гц): 12,37 (уш. с, 1Н, NH триазол); 7,83–7,80 (м, 2Н, С 6 H 4 Cl); 7,70–7,66 (м, 2Н, С 6 H 4 Br); 7,65–7,63 (уш. с, 1Н, NH); 7,61 (д, 1H, 3J = 7,6 Гц, H-3); 7,52–7,49 (м, 2Н, С 6 H 4 Br); 7,37 (д, 1H, 3J = 7,6 Гц, H-4); 7,33–7,30 (м, 2Н, С 6 H 4 Cl); 2,57 (с, 3Н, CH 3 ). Спектр ЯМР 13С (100 МГц, CDCl 3 , м. д.): 159,37; 154,59; 151,89; 149,31; 139,59; 137,23; 135,72; 134,11; 133,08; 130,55; 129,46; 128,10; 123,50; 121,98; 114,52; 14,12. MS EI: m/z ( I , %): 472 (100), 473 (21,6) [M]+, 474 (97,3), 475 (21) [M+1]+, 476 (31,1), 477 (6,7), 478 (1.4) [M+2]+. Найдено, % : C 50,82; H 3,18; N 14,80. Вычислено, %: C 50,81; H 3,20; N 14,81.
Масс-спектры (тип ионизации - электронный удар) записаны на приборе Shimadzu GCMS-QP2010 Ultra.
Спектры ЯМР 1H и 13С записаны на спектрометре Bruker Avance-400 (400 МГц, внутренний стандарт – SiMe 4 ).
Элементный анализ выполнен на CHN анализаторе РЕ 2400 II фирмы Perkin Elmer.
Рентгеноструктурный анализ (РСА) кристалла 4 проведен на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Bruker (Mo Kα-излучение, λ = 0,71073 Å, графитовый монохроматор). Все расчеты по определению и уточнению структур выполнены с помощью программ Olex2 [13], ShelXS-1997 [14] и ShelXL [15]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Положение атомов водорода уточняли по модели наездника (Uизо(H) = 1,2Uэкв(C)). Кристаллографические данные и результаты уточнения структур приведены в таблице. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 2150484; ; .
Кристаллографические данные, параметры эксперимента и уточнение структуры 4
|
Параметр |
4 |
|
Формула |
C 40 H 30 N 10 S 2 Cl 2 Br 2 |
|
М |
945,58 |
|
Сингония |
Триклинная |
|
Пр. группа |
Р– 1 |
|
a , Å |
11,82(4) |
|
b, Å |
13,82(5) |
|
c, Å |
15,68(6) |
|
α ,º |
112,1(2) |
|
β,º |
108,61(12) |
|
γ ,º |
93,97(13) |
|
V , Å3 |
2196(14) |
|
Z |
2 |
|
ρ (выч.), г/см3 |
1,430 |
|
µ , мм–1 |
2,103 |
|
F (000) |
952,0 |
|
Размер кристалла, мм |
0,5 × 0,39 × 0,3 |
|
Область сбора данных по 2 θ , град. |
5,46–58,68 |
|
Интервалы индексов отражений |
–15 ≤ h ≤ 15, –18 ≤ k ≤ 18, –20 ≤ l ≤ 20 |
|
Измерено отражений |
52968 |
|
Независимых отражений |
10206 |
|
R int |
0,1437 |
|
Переменных уточнения |
507 |
|
GOOF |
1,355 |
|
R -факторы по F 2 > 2 σ ( F 2) |
R 1 = 0,1239, wR 2 = 0,3833 |
|
R-факторы по всем oтражениям |
R 1 = 0,2097, wR 2 = 0,4239 |
|
Остаточная электронная плотность (max/min), e/A3 |
1,77/–0,80 |
Обсуждение результатов
В качестве исходного соединения в данной работе был использован 5-цианотриазин ( 1 ). Его взаимодействие с 5-метилсульфанилтриазол-3-амином ( 2 ) в условиях, использованных нами ранее для введения фрагментов других (гетеро)циклических аминов в состав триазинового ядра [16, 17], привело к получению 6-(4-бромфенил)-3-(4-хлорфенил)- N -[5-(метилсульфанил)-4 H -1,2,4-триазол-3-ил]-1,2,4-триазин-5-амина ( 3 ):
N
MeS H
N

Solvent-free
NH2
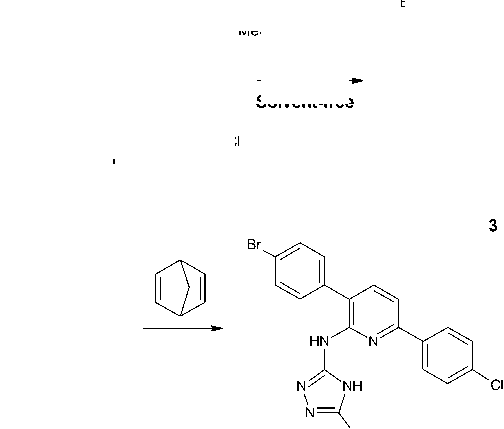
SMe
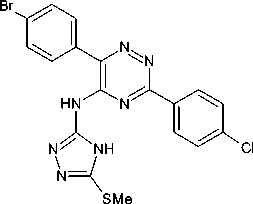
В отличие от ранее [11] описанного нами случая метилирование атома серы в составе триазола привело к изменению характера взаимодействия. А именно, метилсульфанильная группа не претерпела каких-либо изменений в ходе реализации этой стадии. Структура продукта 3 была подтверждена данными спектров ЯМР 1 Н и масс-спектрометрии (электроспрей). Так, в спектре ЯМР 1 Н может быть отмечено наличие характеристичного трехпротонного синглета в области 2,61 м. д., соответствующего метилсульфанильной группе.
Известно, что 1,2,4-триазины являются синтетическими предшественниками соответствующих пиридинов [18, 19]. Причем такой подход зачастую обеспечивает получение соединений, крайне труднодоступных с применением других методов. В соответствие с этим, мы провели взаимодействие триазина 3 с 2,5-норборнадиеном в условиях, которые были ранее использованы нами для получения пиридинов, имеющих в альфа-положении остатки другого гетероциклического амина, в частности, пиразол-4-амина [20], т. е. в автоклаве в среде 1,2-дихлорбензола при 215 ºС. Применение данных условий обусловлено тем фактом, что в традиционных условиях (кипячение в высококипящих органических растворителя, таких как о -ксилол или 1,2-дихлорбензол) подобное превращение не реализуется. В результате этого целевой 3-(4-бромфенил)-6-(4-хлорфенил)- N -(5-(метилсульфанил)-4 H -1,2,4-триазол-3-ил)пиридин-2-амин ( 4 ) был успешно получен с выходом 53 %. В ходе этой стадии также не наблюдалось каких-либо трансформаций метилсульфанильной группы. Структура продукта 4 была подтверждена данными спектров ЯМР 1 Н, 13С, масс-спектрометрии и элементного анализа. В частности, в спектре ЯМР 1 Н могут быть отмечены два дублета протонов нового пиридинового кольца в области 7,37 и 7,61 м. д. Кроме этого, нам удалось получить кристаллы соединения 4 , пригодные для РСА, и изучить его строение этим методом. Структура представлена на рис. 1.
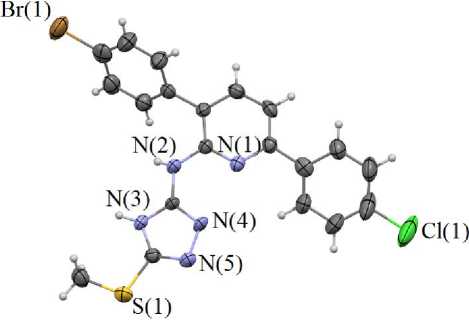
Рис. 1. Строение соединения 4 в представлении атомов эллипсоидами тепловых колебаний с 50%-ной вероятностью (показана одна из двух кристаллографически независимых молекул)
По данным РСА две кристаллографически независимые молекулы соединения 4 кристаллизуются в нецентросимметричной пространственной группе Р -1 триклинной сингонии. Формирование кристаллической структуры характеризуется множественными межмолекулярными контактами N—H типа между двумя кристаллографически независимыми молекулами триазолилпи-ридин-2-амина 4 . При этом расстояния между атомами азота и водорода меньше, чем сумма ван-дер-ваальсовых радиусов соответствующих атомов (2,65 А [21] (рис. 2).
Упаковка молекул соединения 4 характеризуется образованием длинных цепей за счёт межмолекулярных коротких контактов типа N—Br с расстоянием между указанными атомами для разных кристаллографически независимыми молекул 3,163 А и 3,088 А (рис. 3), тогда как сумма ван-дер-ваальсовых радиусов атомов составляет 3,38 А. Ранее в литературе уже была проанализирована природа межмолекулярных взаимодействий между связанными с углеродом галогенами (C-X, где X = F, Cl, Br или I) и электроотрицательными атомами (N, O и S). Поиск в Кембриджской структурной базе данных показал, что электроотрицательные атомы в различных состояниях гибридизации явно предпочитают образовывать контакты с Cl, Br и I (но не F) в направлении расширенной оси связи C-X на межатомных расстояниях, меньших суммы ван-дер-ваальсовых
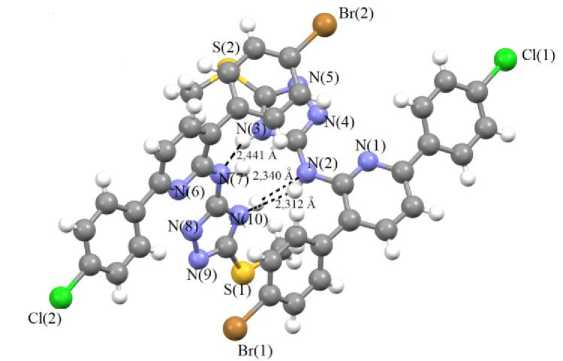
Рис. 2. Межмолекулярные контакты N∙∙∙H типа между двумя кристаллографически независимыми молекулами соединения 4
радиусов [22]. Недавно на основании данных квантово-химических расчетов, в частности, на основании топологического анализа распределения электронной плотности, были подтверждены выявленные по данным РСА контакты I—N на примере солей (Ph2I)2[M(CN)4] (где M = Ni, Pd), а также сделано отнесение их к галогенным связям. При этом атом галогена является электрофильным центром, атом азота - нуклеофильным. Установлено, что образование подобной галогенной связи происходит с участием неподелённой пары атома азота [23].
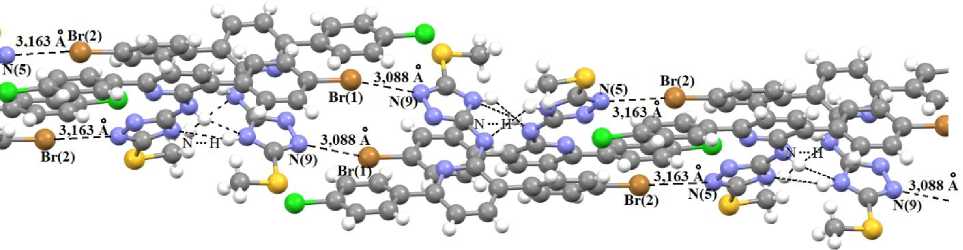
Рис. 3. Межмолекулярные контакты N—Br типа в кристалле соединения 4
Необходимо отметить, что пиридины, имеющие в альфа-положении остаток 4 H -1,2,4-триазол-3-амина, представляют непосредственный практический интерес, в частности, с точки зрения биологической активности. Так, среди этих соединений имеются ингибиторы ферментов [24, 25].
Выводы
Таким образом, нами показана возможность функционализации 1,2,4-триазинов фрагментом 5-метилсульфанил-4 H -1,2,4-триазол-3-амина в результате нуклеофильного ипсо -замещения цианогруппы в положении С5 триазина, а также последующего превращения триазинового цикла в пиридиновый в результате реакции с 2,5-норборнадиеном. При этом ранее нашей научной группой было установлено, что при наличии меркаптогруппы в положении С5 триазола имеет место десульфирование в ходе ипсо -замещения цианогруппы триазина. Однако, её замена на метилсульфанильную группу меняет характер взаимодействия, и в ходе реализации обеих стадий синтеза отсутствуют какие-либо её трансформации, что подтверждено в том числе данными РСА полученного замещенного пиридина.
Финансирование
Работа выполнена при поддержке Министерства науки и высшего образования Российской Федерации (грант № 075-15-2022-1118 от 29 июня 2022 г.).
Список литературы Синтез производных N-(5-(метилсульфанил)- 4H-1,2,4-триазол-3-ил)пиридин-2-амина и их 1,2,4-триазиновых предшественников
- The Significance of 1,2,4-Triazoles in Agriculture Science: A Review / S. Sahoo, K.N. Sindhu, K. Sreeveena // Research J. Pharm. and Tech. 2019; No. 12. P. 5091-5097. DOI: 10.5958/0974-360X.2019.00882.5.
- Ингибитор коррозии меди и медьсодержащих сплавов в нейтральных растворах хлоридов (варианты): патент РФ № 2679022 C2, 05.02.2019.
- 1,2,4-Triazoles: A Review of Synthetic Approaches and the Biological Activity / S. Maddila, R. Pagadala, SB. Jonnalagadda // Lett. Org. Chem. 2013. No. 10. P. 693-714. DOI: 10.2174/157017861010131126115448.
- Synthesis and biological evaluation of heterocyclic 1,2,4-triazole scaffolds as promising pharmacological agents / M. Kumari, S. Tahlan, B. Narasimhan et al. // BMC Chemistry 2021. No. 15. P. 5. DOI: 10.1186/s13065-020-00717-y.
- 1,2,4-Triazoles as Important Antibacterial Agents / M. Strzelecka, P. Swiatek // Pharmaceuticals 2021. No. 14. P. 224. DOI: 10.3390/ph14030224.
- Натриевая соль 2-метилтио-6-нитро-7-оксо-[5,1-c]-1,2,4-триазин-7-(4Н)-она, дигидрат, обладающая противовирусной активностью: патент РФ № 2294936, 10.03.2007 г.
- 5-Метил-6-нитро-7-оксо-1,2,4-триазоло[1,5-а]пиримидинид l-аргининия моногидрат: патент РФ № 2529487, 27.09.2014.
- 1,2,4-triazine derivatives: Synthesis and biological applications / M. Arshad, T.A. Khan, M.A. Khan // Int. J. Pharm. Sci. 2014. No. 5. P. 149-162. DOI: 10.1002/chin.201504278.
- An extensive review on 1,2,3 and 1,2,4-triazines scaffold-valuable lead molecules with potent and diverse pharmacological activities / D.S. Rao, G.V.P. Kumar1, B. Pooja et al. // Der Chemica Sinica 2016. No. 7. P. 101-130.
- Synthesis and Tuberculostatic Activity of Some 1,2,4-Triazines / E.V. Shchegol'kov, O.G. Khudina, A.E. Ivanova et al. // Pharm. Chem. J. 2014. No. 48. P. 383-386. DOI: 10.1007/s11094-014-1115-6.
- Reaction of 3-Amino-5#- and 3-Amino-5-sulfanyl-1,2,4-triazoles with 1,2,4-Triazine-5-carbonitriles / A.P. Krinochkin, M R. Guda, D.S. Kopchuk et al. // Russ. J. Org. Chem. 2022. No. 58. P. 188-191. DOI: 10.1134/S1070428022020051.
- Transformations of 1,2,4-Triazines in Reactions with Nucleophiles: V. SNH and ipso-Substitution in the Synthesis and Transformations of 5-Cyano-1,2,4-triazines / D.N. Kozhevnikov, V.N. Kozhevnikov, I S. Kovalev et al. // Russ. J. Org. Chem. 2002. No. 38. P. 744-750. DOI: 10.1023/A:1019631610505.
- OLEX2: a complete structure solution, refinement and analysis program / O.V. Dolomanov, L.J. Bourhis, R.J. Gilde et al. // J. Appl. Cryst. 2009. No. 42. P. 339-341. DOI: 10.1107/S0021889808042726.
- A short history of SHELX / G.M. Sheldrick // Acta Cryst. 2008. No. A64. P. 112-122. DOI: 10.1107/S0108767307043930.
- Crystal structure refinement with SHELXL / G.M. Sheldrick // Acta Cryst. 2015. No. C71. P. 3-8. DOI: 10.1107/S2053229614024218.
- Solvent-free synthesis of 5-(aryl/alkyl)amino-1,2,4-triazines and a-arylamino-2,2'-bipyridines with greener prospects / D.S. Kopchuk, N.V. Chepchugo, I.S. Kovalev et al. // RSC Adv. 2017. No. 7. P. 9610-9619. DOI: 10.1039/c6ra26305d.
- Synthesis of 5-[(Thiophen-3-yl)amino]-1,2,4-triazines / A.P. Krinochkin, M.R. Guda, D.S. Kopchuk et al. // Russ. J. Org. Chem. 2021. No. 57. P. 675-677. DOI: 10.1134/S1070428021040278.
- Reactions of triazines and tetrazines with dienophiles (Review) / A.M. Prokhorov, D.N. Kozhevnikov // Chem. Heterocycl. Compd. 2012. No. 48. P. 1153-1176. DOI: 10.1007/s10593-012-1117-9.
- Tandem inverse-electron-demand hetero-/retro-Diels-Alder reactions for aromatic nitrogen he-terocycle synthesis / A AR. Foster, M.C. Willis // Chem. Soc. Rev. 2013. No. 42. P. 63. DOI: 10.1039/C2CS35316D.
- 1#-Pyrazole-Appended Pyridines and Their 1,2,4-Triazine Precursors: A Rational Synthesis and in silico and in vitro Evaluation of Anti-Cancer Activity / A.P. Krinochkin, Y.K. Shtaitz, A. Ram-mohan et al. // Eur. J. Org. Chem. 2022. No. 22. P. e202200227. DOI: 10.1002/ejoc.202200227.
- Consistent van der Waals Radii for the Whole Main Group / M. Mantina, A.C. Chamberlin, R. Valero et al. // J. Phys. Chem. A. 2009. No. 113. P. 5806-5812. DOI: 10.1021/jp8111556.
- The Nature and Geometry of Intermolecular Interactions between Halogens and Oxygen or Nitrogen / J.P.M. Lommerse, A.J. Stone, R. Taylor et al. // J. Am. Chem. Soc. 1996. No. 118. P. 31083116. DOI: 10.1021/ja953281x.
- Суслонов В.В. Межмолекулярные взаимодействия с участием анионных комплексов пла-тины(11): дис. ... канд. хим. наук. СПб., 2022. 197 с.
- DNA-PK inhibitors: patent EP № 2841428 A1, 04.03.2015.
- Aminotriazole compounds useful as inhibitors of protein kinases: patent US №261268 A1, 24.11.2005.


