Синтез трифторметансульфоната висмута
Автор: Плотникова С.Е., Горбунова Е.М., Нифталиев С.И., Кузнецова И.В., Лучко А.М.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Химическая технология
Статья в выпуске: 3 (105) т.87, 2025 года.
Бесплатный доступ
Трифторметансульфонат висмута (III), называемый также трифлатом висмута, является экономичным, эффективным и экологически чистым катализатором синтеза органических продуктов. Трифлат висмута в России в настоящее время не производят, поэтому разработка технологии получения трифлата висмута является актуальной задачей. Трифлат висмута получали двумя способами - взаимодействием гидроксида висмута или оксида висмута с трифторметансульфоновой (трифликовой) кислотой. Получение трифлата висмута из гидроксида висмута является длительным процессом, который не протекает до конца и имеет выход не более 64 %. Оксид висмута, полученный термическим разложением гидроксида висмута, имеет несколько полиморфных модификаций. Нагревание проводили до 750 °С и охлаждали в течение 8 часов. Полученный таким образом γ-оксид висмута растворяется в трифликовой кислоте в течение 2 часов и образует растворы высокой концентрации. Определены значения растворимости трифлата висмута при различной кислотнотности раствора. Рентгенографическим исследованием. установлено, что образуется ноногидраттрифлата висмута - кристаллы игольчатой формы. α-фаза оксида висмута, полученная разложением гидроксида висмута при 450 °С, не растворялась в кислоте полностью. Процесс проводили в течение 4 часов, выход продукта 92 %. Образующиеся кристаллы бипирамидальной формы исследовали методом дифференциального термического анализа, который показал, что кристаллы представляют собой пентагидрат трифлата висмута, теряющий кристаллизационную воду в интервале температур 64–130 °С. До 320 °С вещество является термически устойчивым. При температуре 327 °С происходит плавление с разложением, что сопровождается образованием оксосульфатов висмута. По данным рентгенографической дифракции установлен состав образующихся фаз - Bi28O32(SO4)10 и Bi34.7O100S16. При дальнейшем нагревании до 380 °С разложение оксосульфатов висмута приводит к образованию устойчивой моноклинной модификации оксида висмута α-Bi2O3.
Трифторметансульфонат висмута (III), трифликовая кислота, α-фаза оксида висмута (III), γ-фаза оксида висмута (III), оксосульфат висмута, термический анализ
Короткий адрес: https://sciup.org/140313133
IDR: 140313133 | УДК: 542.06 | DOI: 10.20914/2310-1202-2025-3-217-223
Текст научной статьи Синтез трифторметансульфоната висмута
В настоящее время одной из главных проблем химической отрасли является зависимость технологических цепочек от зарубежных поставок специальной химии и катализаторов. Государством разрабатываются национальные проекты, которые направлены на развитие малотоннажной и среднетоннажной химии.
Трифторметансульфонат висмута (III), называемый также трифлатом висмута, является экономичным, эффективным и экологически чистым катализатором синтеза органических продуктов: циклических карбонатов [1], 2,3 – ненасыщенных O-гликозидов [2], гомоаллиловых эфиров и гомоаллилацетатов из альдегидов [3], ацилирования бензойного и пивалинового ангидридов [4], реакция гликозилирования производных сиаловой кислоты [5]. В условиях санкций закупка вещества сопровождается многими рисками и сложностями. Трифлат висмута в России в настоящее время не производят. Поэтому разработка технологии получения трифлата висмута является актуальной задачей.
Несмотря на большую востребованность в современной препаративной химии трифлатов, состав, строение, термическая устойчивость и другие свойства трифлатов остаются малоизученными. Между тем трифлаты представляют также интерес с точки зрения кристаллохимии и физики низких температур [6].
Из литературных источников известен способ производства солей висмута, включающий следующие стадии: окисление металлического висмута с получением оксида; растворение оксида висмута в кислоте [7, 8].
Материалы и методы
Трифлат висмута синтезировали двумя способами: взаимодействием гидроксида висмута с трифликовой кислотой и взаимодействием оксида висмута с трифликовой кислотой. Оксид висмута получали разложением гидроксида висмута. Процесс происходит по схеме:
1000 С 3100 С
ВЬОтЗНЮ -й2° > ВЬОт21Ь О - Н0 > ВЬОтЕЬО 23 2 23 2 23 2
4200 С
НО > Bi 2 O 3
Чистый оксид висмута имеет четыре кристаллических полиморфа, которые отличаются реакционной способностью.
При комнатной температуре оксид висмута Вi 2 О 3 имеет моноклинную модификацию, обозначаемую α-Вi 2 О 3 . При нагревании выше 727 °С он превращается в кубическую кристаллическую структуру типа флюорита δ-Вi 2 О 3 , которая сохраняется до точки плавления 824 °С.
Поведение δ-Вi 2 О 3 при охлаждении более сложное, с возможным образованием двух промежуточных метастабильных фаз: тетрагональная β-фаза или объемно-центрированная γ-кубиче-ская фаза. γ-фаза может существовать при комнатной температуре с очень медленной скоростью охлаждения, но α-фаза всегда образуется при охлаждении β-фазы [9].
Рассчитанные количества веществ помещали в колбу с дефлегматором и перемешивали с кислотой, магнитной мешалкой 79–1 Hot Plate Magnetic Stirrer, при постоянной температуре (50 °С). Реакцию проводили до установления равновесия. Условием равновесия являлась постоянная концентрация ионов висмута.
Концентрацию ионов металла определяли комплексонометрическим титрованием с индикатором ксиленовым оранжевым [10, 11]. Индикатор образует с металлом комплекс, окрашенный в красный цвет:
Вi3+Н 6 Ind = ВiН 3 Ind + 3Н+
Свободные ионы висмута образуют бесцветный растворимый комплекс, ксиленовый оранжевый приобретает желтое окрашивание.
Для определения концентрации ионов водорода использовали кислотно-основное титрование раствором NаОН.
Синтезированный образец трифлата висмута исследовали методом термического анализа на измерительном комплексе синхронного термического анализа STA 449 F3 (Netzsch, Германия) в платиновом тигле, в потоке N 2 , скорость нагрева 5 К/мин.
Рентгенофазовый анализ применяли для решения вопроса о фазовом составе полученного продукта. Эксперимент проводили на порошковом рентгеновском дифрактометре ARL X'tra, с длиной волны Cu (1,5406 A))
Тринокулярный микроскоп Levenhuk 740Т использовали для исследования морфологии синтезированных материалов.
Результаты и обсуждения
По первому способу получение трифлата висмута из гидроксида висмута проводили согласно реакции:
Bi(OH) 3 + 3СF 3 SО 3 H = Bi(СF 3 SО 3 ) 3 + 3Н 2 О
Перемешивание магнитной мешалкой проводили до установления равновесия (8 часов) при эквивалентном соотношении и при двукратном избытке кислоте, выход продукта составил 64 и 57% соответственно. Процесс не протекает до конца, о чем говорит наличие в растворе белого осадка. Возможно этим осадком является оксигидроксид висмута (III) ВiО(OH).
Для увеличения выхода продукта предложено получать трифлат висмута из оксида висмута (второй способ).
Гидроксид висмута нагревали до 750 °С, выдерживали в течение 1 часа. Порошок имел при 750 °С красно-коричневый цвет, характерный для δ-Вi 2 О 3 . Охлаждение до комнатной температуры проводили в течение 8 часов, т. к. при медленной скорости охлаждения возможно образование γ-фазы. При охлаждении цвет менялся на желтый (рисунок 1).
После охлаждения оксида приливали рассчитанный объем трифликовой кислоты, взятой с различным избытком и в эквивалентном соотношении оксида и кислоты (1:6) и перемешивали при 50 °С.
Уравнение взаимодействия оксида висмута (III) с кислотой имеет вид:
Вi 2 О 3 + 6СF 3 SО 3 H = 2Вi(СF 3 SО 3 ) 3 + 3Н 2 О

Рисунок 1. Фотография оксида висмута после прокаливания
Figure 1. Photo of bismuth oxide after calcination
По истечении 2 часов происходило полное растворение оксида и образование прозрачного раствора, что свидетельствует о полноте протекания реакции.
Данные по количеству исходных веществ и концентрации ионов Вi3+ и Н+ в полученных растворах представлены в таблице 1.
Таблица 1.
Результаты определения содержания ионов Вi3+ и ионов Н+
Table 1.
Results of determination of Вi3 + and H + ion content
|
Количество вещества Вi 2 О 3 , моль Amount of Вi 2 О 3 substance, mol |
Количество вещества НОТf, моль Amount of substance НОТf, mol |
Молярная концентрация ионов Вi3+, моль/дм3 Molar concentration of Вi3+ ions, mol/dm3 |
Molar concentration of H+ ions, mol/dm3 |
|
0,005 |
0,120 |
0,892 |
5,64 |
|
0,005 |
0,060 |
1,128 |
4,12 |
|
0,005 |
0,045 |
1,430 |
3,96 |
|
0,005 |
0,030 |
2,088 |
0,23* |
Значение концентрации ионов водорода для раствора 4 (0,23*) рассчитано с учетом гидролиза соли, поскольку кислотно-основное титрование нельзя применить из-за образования осадка гидроксида висмута (III).
После охлаждения растворов до комнатной температуры на вторые сутки наблюдается образование кристаллов при почти полном отсутствии жидкой фазы. Кристаллы, полученные при значительном избытке кислоты, при нахождении на воздухе, снова переходят в жидкую фазу – «плавятся». Содержание ионов висмута (III) в этих кристаллах, определенное комплексонометрическим титрованием составляет 25,6%, что соответствует ноногидрату трифлата висмута. Кристаллы имеют игольчатую форму.
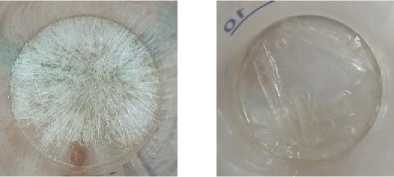
(1) (3)
Рисунок 2. Фотография кристаллов образцов (1) и (3)
Figure 2. Photos of crystals of samples (1) and (3)
Рентгенофазовый анализ продукта синтеза, полученного в кислой среде, показал, что образовался кристаллогидрат трифлата висмута с 9 молекулами воды.
Полученная дифрактограмма представлена на рисунке 3.
Таблица 2.
Фазовый состав продукта синтеза (Порошковый рентгеновский дифрактометр ARL X'tra, длина волны Cu (1,5406 A))
Table 2.
Phase composition of the synthesis product (ARL X'tra powder X-ray diffractometer, Cu wavelength (1.5406 A))
|
Ref. Code |
Score |
Compound Name |
Displacement [°2Тh.] |
Scale Factor |
Chemical Formula |
|
00– |
Bismuth |
С 3 Н 18 |
|||
|
050– 2218 |
69 |
nonaaqua triflate |
0.090 |
0.760 |
ВiF 9 О 18 S 3 |
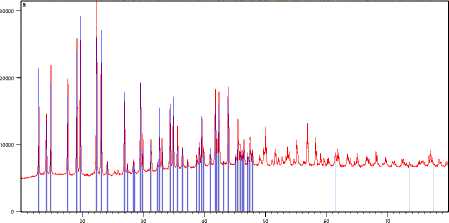
Position [°2Theta] (Copper (Cu))
Рисунок 3. Дифрактограмма продукта синтеза, полученного при избытке кислоты
Figure 3. Diffractogram of the synthesis product obtained with an excess of acid
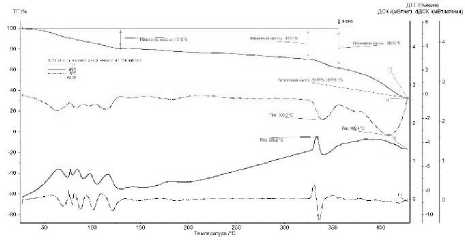
Рисунок 5. ТГ/ДСК диаграммы образца трифлата висмута, полученного из α-фазы Вi 2 О 3
Figure 5. TG/DSC diagrams of a bismuth triflate sample obtained from the α-phase of Вi 2 О 3
Опыт повторяли при прокаливании гидроксида висмута до 450 °С, в этом случае образуется α-фаза Вi 2 О 3 . Оксид и кислоту брали в эквивалентных количествах. Осадок желтого цвета в результате взаимодействия с кислотой приобретал белый цвет. Процесс проводили до установления равновесия (4 часа). Несмотря на добавление воды, небольшая часть осадка не растворилась, что свидетельствует о том, что α и γ-фаза оксида висмута имеют различный механизм взаимодействия с кислотой. В полученном растворе содержание ионов Вi3+ составило 1,471 моль/дм3. Выход продукта 92%. При медленном выпаривании раствора получили кристаллы и высушили их в эксикаторе при комнатной температуре (рисунок 4). Кристаллы имеют форму тетрагональной бипирамиды.

Рисунок 4. Фотография кристаллов, полученных при прокаливании гидроксида висмута до 450 °С
Figure 4. А Photograph of crystals obtained by calcination of bismuth hydroxide at 450 °C
Содержание воды в кристаллах, рассчитанное по концентрации висмута, составляет 12,31%, что близко к содержанию воды в пентагидрате трифлата висмута (12,04%).
Термический анализ соли, полученной из α-оксида висмута, представлен на рисуноке 5.
Результаты исследования приведены в таблице 3.
Таблица 3.
Результаты термического анализа трифлата висмута
Table 3.
Results of thermal analysis of bismuth triflate
|
Образец Sample |
Тип теплового эффекта Type of thermal effect |
Температурный интервал, °С |
Потеря массы, % |
|
Bi(SО 3 СF 3 ) 3 5Н 2 O |
Эндотермический |
64–130 |
19,18 |
|
Эндотермический |
327–355 |
38,12 |
|
|
Эндотермический |
380–450 |
67,38 |
Изменение массы в области температур 64–130 °С связано с потерей кристаллизационной воды. На дифференциальной ТГ кривой насчитывается 5 пиков, что позволяет предположить, что исследуемое вещество определяется формулой Bi(SО 3 СF 3 ) 3 5Н 2 O. Однако, потеря массы больше, чем для обезвоживания пентагидрата, она составляет 19,18%. При нагревании до 64 °С потеря массы составляет 6,66%, эффектов на этом интервале не наблюдается. Возможно, выделяется абсорбционная влага. Оставшаяся потеря массы 12,51% близка к содержанию воды в пентагидрате – 12,04%.
Дальнейшее нагревание сопровождается потерей массы при отсутствии пиков на дифференциальных кривых, что может быть связано с сублимацией соли или выделением углеродистых соединений фтора из иона трифлата. При температуре 327 °С происходит плавление с разложением, так как эндотермический эффект сопровождается уменьшением массы образца. По аналогии с термическим разложением сульфата висмута можно предположить образование оксосоли висмута.
Рентгенофазовый анализ прокаленного при 350 ˚С образца показал наличие в веществе трех фаз (таблица 4 и рисунок 7).
Установлено высокое содержание (суммарно более 99%) в образце двух оксосульфатов висмута, имеющих состав Вi 28 О 32 (SО 4 ) 10 и Вi 34.7 О 100 S 16 . Ни одна из идентифицированных фаз не содержит ни фтора, ни углерода.
Фазовый состав вещества, полученного при нагревании до 350 ℃
Это говорит о том, что происходит разложение трифлата висмута с выделением в газообразную фазу соединений фтора и углерода.
При дальнейшем нагревании до 380 °С разложение оксосульфатов висмута приводит к образованию устойчивой моноклинной модификации оксида висмута α-Вi 2 О 3 .
Таблица 4.
(Порошковый рентгеновский дифрактометр ARL X'tra, длина волны Cu (1,5406 A))
Table 4.
Phase composition of the substance obtained by heating to 350 ℃ (ARL X'tra powder X-ray diffractometer, Cu wavelength (1.5406 A))
|
Ref. Code |
Compound Name |
Displacement [°2Тh.] |
Scale Factor |
Chemical Formula |
SemiQuant [%] |
|
01–077–1727 |
Bismuth Oxide Sulfate |
-0.113 |
0.670 |
Вi 28 О 32 (SО 4 ) 10 |
37,4 |
|
01–075–0717 |
Bismuth Oxide Sulfide |
0.045 |
0.428 |
Вi 2 О 2 S |
0,5 |
|
98–004–9900 |
Bismuth Oxide Sulfate * |
-0.055 |
0.339 |
Вi 34.7 О 100 S 16 |
62,0 |
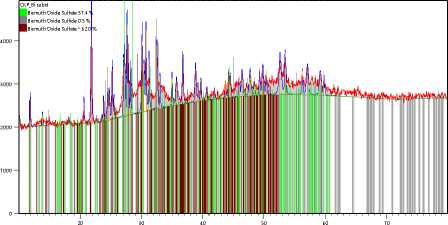
Position [°2Theta] (Copper (Cu))
Рисунок 6. Дифрактограмма продукта вещества, полученного в результате прокаливания образца трифлата висмута при 350 ℃
Figure 6. Diffractogram of the product obtained by calcination of a bismuth triflate sample at 350 ℃
Заключение
Получение трифлата висмута из гидроксида висмута является длительным процессом, который не протекает до конца. О чем говорит наличие в растворе белого осадка, возможно этим осадком является оксигидроксид висмута (III) ВiО(OH).
Для увеличения выхода продукта предложено синтезировать трифлат висмута из оксида висмута. Оксид висмута получали из гидроксида двумя различными режимами прокаливания: при нагревании до 750 °С образуется δ-Вi2 О3 , который при дальнейшем, медленном охлаждении переходит в γ-фазу. Полученный таким образом оксид растворяется в трифликовой кислоте в течение 2 часов и образует растворы высокой концентрации. В присутствии избытка кислоты растворимость трифлата висмута уменьшается. Образование трифлата висмута подтверждено рентгенографическим исследованием. Установлено, что образуется ноногидрат трифлата висмута. Кристаллы имеют игольчатую форму.
При нагревании гидроксида висмута до 450 °С образуется α-фаза оксида висмута (самая устойчивая). Она растворяется в кислоте в течение 4 часов. При выпаривании раствора образуются кристаллы бипирамидальной формы. Термический анализ показал, что кристаллы представляют собой пентагидрат трифлата висмута, теряющий адсорбционную и кристаллизационную воду в интервале температур 30–130 °С. До 320 °С вещество является термически устойчивым. При температуре 327 °С происходит плавление с разложением, что сопровождается образованием оксосульфатов висмута. По данным рентгенографической дифракции установлен состав образующихся фаз – Вi 28 О 32 (SО 4 ) 10 и Вi 34.7 О 100 S 16 . При дальнейшем нагревании до 380 °С разложение оксосульфатов висмута приводит к образованию устойчивой моноклинной модификации оксида висмута α-Вi 2 О 3 .


