Синтезы 1-аллил-2-пиридона
Автор: Ким Дмитрий Гымнанович, Бердникова Елена Владимировна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 24 (283), 2012 года.
Бесплатный доступ
Осуществлены синтезы 1-аллил-2-пиридона аллилированием 2-пиридона, гидролизом бромида 1-аллил-2-аминопиридиния и иодида 1-аллил-2-бромпиридиния, однореакторными синтезами из 2-аминопиридина и из иодида 1-аллипиридиния.
2-пиридон, 2-аминопиридин, 1-аллил-2-пиридон, однореакторный синтез, межфазный катализ, аллилирование, масс-спектры
Короткий адрес: https://sciup.org/147160227
IDR: 147160227 | УДК: 547.824
Текст научной статьи Синтезы 1-аллил-2-пиридона
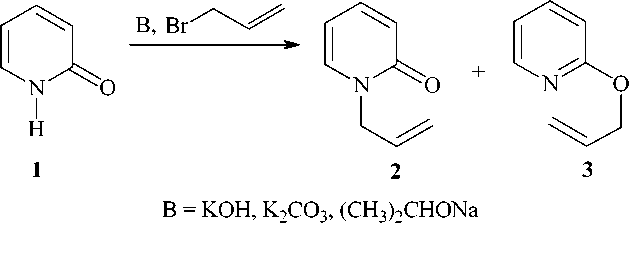
Ранее [1] было показано, что натриевая соль 2-пиридона, полученная из 2-пиридона (1) , реагирует с хлористым аллилом в этаноле с образованием 1-аллил-2-пиридона (2) с выходом 64 %. В более поздней работе [2] показано, что 2-пиридон реагирует с аллилгалогенидами в присутствии фторида цезия в диметилформамиде (ДМФА) с образованием смеси соединения 2 и 2-аллилоксипиридина (3) . Основным продуктом является соединение 2 , для которого наиболее высокий выход (85 %) наблюдается в случае аллилхлорида. Соотношение 1-аллил-2-пиридона к 2-аллилоксипиридину составляет для аллилхлорида 91:9, для аллилбромида 89:11 и для аллилио-дида 87:13.
Обсуждение результатов
В настоящей работе нами разработаны различные методы получения соединения 2 . Найдено, что 2-пиридон реагирует с бромистым аллилом в системе спирт – вода – КОН, ДМФА-K 2 CO 3 или в присутствии изопропилата натрия в изопропиловом спирте с образованием соединения 2 . Методом хроматомасс-спектрометрии в реакционной смеси нами помимо соединения 2 обнаружен 2-аллилоксипиридин.
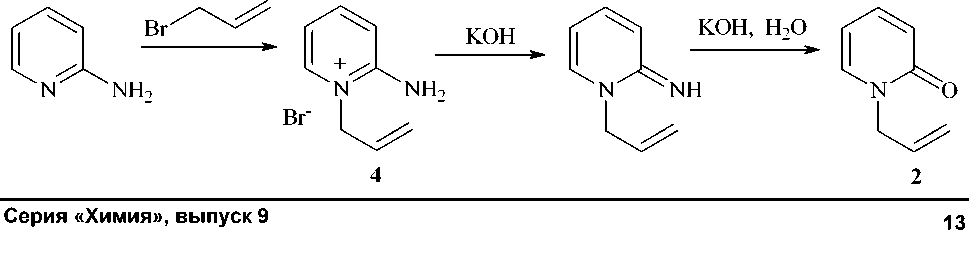
Соединение 2 получено нами щелочным гидролизом бромида 1-аллил-2-аминопиридиния (4) , который в свою очередь получен реакцией 2-аминопиридина с аллилбромидом в ацетоне по методу [3]:
Из 2-аминопиридина соединение 2 получено нами также однореакторным синтезом. Сущность данного способа заключается в том, что по методу Чичибабина – Розанцева [4] через соль диазония (5) была получена калиевая соль 2-оксипиридина (6) , которая без выделения подвергалась реакции с аллилбромидом в присутствии межфазного катализатора тетрабутиламмоний бромида (ТБАБ):
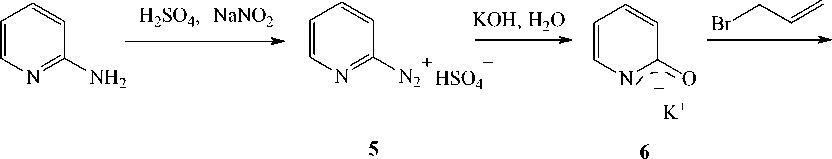

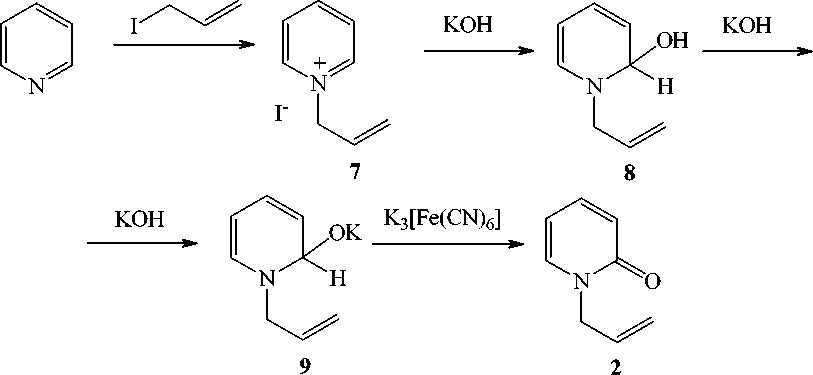
Другой метод заключается во взаимодействии иодида 1-аллилпиридиния (7) с КОН с образованием псевдооснования (8) и калиевой соли псевдооснования (9) и последующим окислением гексацианоферратом калия (III) до 1-аллил-2-пиридона. Ранее [5] аналогичное окисление осуществлено для галогенида 1-метилпиридиния, протекающее с образованием 1-метил-2-пиридона. По литературным данным [6] окислению подвергается анион псевдооснования.
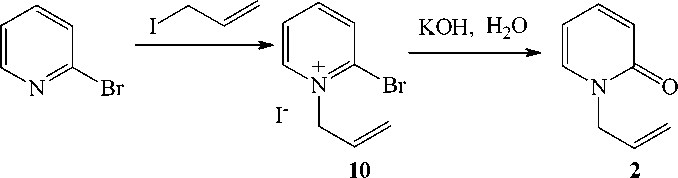
Следующий метод основан на щелочном гидролизе иодида 1-аллил-2-бромпиридиния (10) , который получен реакцией 2-бромпиридина с аллилиодидом. Сравнительно легкое замещение атома брома обусловлено влиянием пиридиниевого атома азота, обладающего электроноакцепторными свойствами.
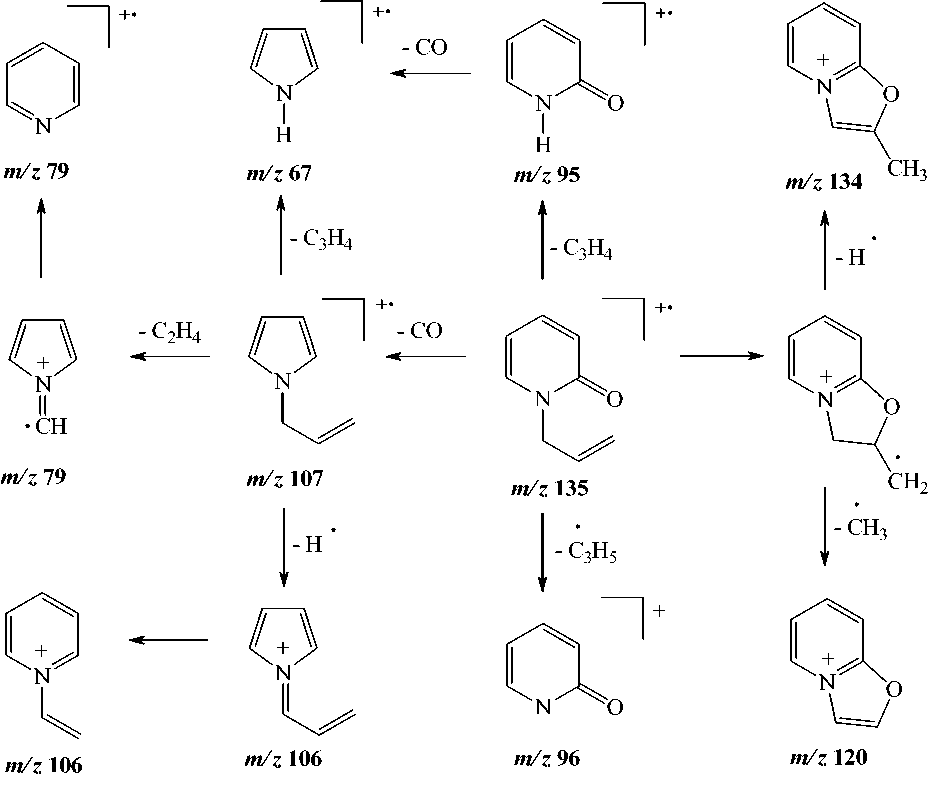
Методом масс-спектрометрии [7] нами исследован 1-аллил-2-пиридон. В масс-спектре его (рис. 1) имеется пик молекулярного иона, интенсивность которого меньше, чем пик [М–Н]+ и пик [М–СН3]+. По-видимому, это обусловлено тем, что при элиминировании Н и СН3 радикалов образуются оксазоло[3,2-a]пиридиниевые системы (m/z 134 и m/z 120), которые обладают ароматичностью. При фрагментации молекулярного иона [М]+• также происходит элиминирование СО с образованием катион-радикала N-аллилпиррола (m/z 107), элиминирование аллена с образованием катион-радикала 2-пиридона (m/z 95). В свою очередь катион-радикал N-аллилпиррола распадается с образованием катион-радикалов пиридина (m/z 79) и пиррола (m/z 67). Основные процессы фрагментации 1-аллил-2-пиридона приведены на схеме:
Масс-спектры изомеров 2 и 3 (рис. 2) очень близки, но есть и различия. Так, пик молекулярного иона в соединении 2 составляет 31 %, а в соединении 3 - 69 % от максимального пика, а пик с m/z 79 в соединении 2 составляет 31 %, а в соединении 3 - 82 %.
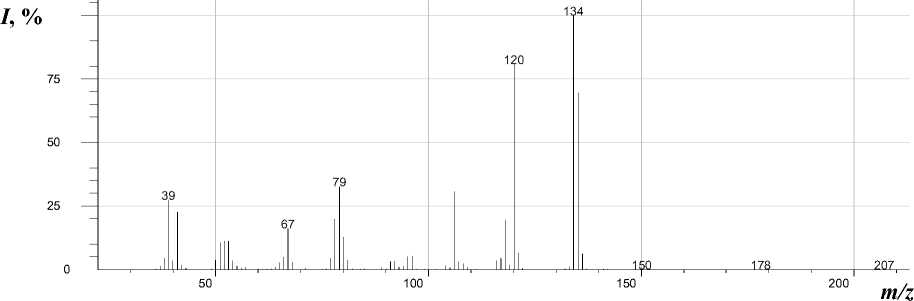
Рис. 1. Масс-спектр 1-аллил-2-пиридона
I , %
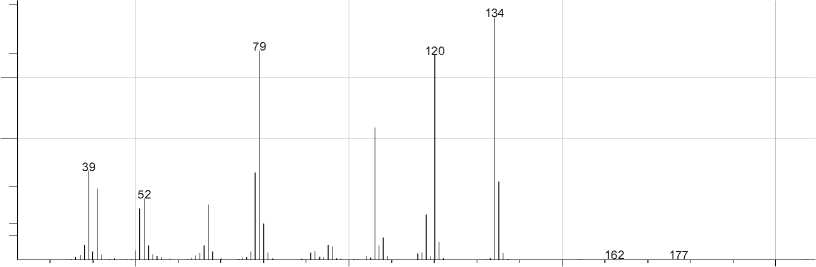
Рис. 2. Масс-спектр 2-аллилоксипиридина
m/z
Следует отметить, что время удерживания на хроматограмме 1-аллил-2-пиридона (5,28 мин) больше, чем 2-аллилоксипиридина (4,56 мин). Такое отнесение сделано путем сравнения с индивидуальным 1-аллил-2-пиридоном, который был выделен вакуумной перегонкой. По литературным данным [8] О-аллильные производные 2-хинолонов также имеют меньшее время удерживания, чем N-аллильные производные.
Экспериментальная часть
Спектр ЯМР 1Н записан на спектрометре Tesla (80 МГц), внутренний стандарт ТМС, растворитель ДМСО- d6 . Масс-спектры электронного удара сняты на хроматомасс-спектрометре ГХ/МС-ЭВМ фирмы Hewlet Packard, газовый хроматограф HP-5890, серия II, масс-селективный детектор MSD-5972 при энергии ионизации 70 эВ, а также на хроматомасс-спектрометре GCMS-QP2010 Ultra фирмы Shimadzu при энергии ионизации 70 эВ.
1-Аллил-2-пиридон
Метод А. В круглодонную колбу помещают 9,51 г (0,1 моль) 2-пиридона в 50 мл 2-пропанола, раствор 8,55 г (0,15 моль) КОН в 5 мл воды, 12,98 г (0,15 моль) бромистого аллила и кипятят с обратным холодильником в течение 3 ч. После охлаждения отфильтровывают KBr, отгоняют 2-пропанол, остаток подвергают вакуумной перегонке. Выход 10,75 г (79 %). Т. кип. 124°С (5 мм рт. ст.). Спектр ЯМР 1Н, δ, м.д.: 4,51 (дт, J=5,50; 1,50; NCH 2 ); 5,10 (м, =CH 2 ); 5,90 (м, CH=); 6,20 (тд, J=6,60; 1,10; H-5); 6,40 (д, J=9,10; H-3); 7,40 (м, H-4); 7,60 (дд, J=6,80; 1,10; H-6).
Метод Б. Смесь 2,07 г (15 ммоль) K 2 CO 3 , 7 мл ДМФА и 0,95 г (10 ммоль) 2-пиридона нагревают на водяной бане в течение 15 мин. Затем добавляют раствор 1,3 мл (15 ммоль) бромистого аллила в 2 мл ДМФА и нагревают на водяной бане в течение 2 ч. После охлаждения фильтруют, фильтрат испаряют, остаток обрабатывают CH 2 Cl 2 и отфильтровывают. После испарения CH 2 Cl 2 остается вещество в виде масла. Выход 1,24 г (92 %).
Метод В. В колбу помещают 2,62 г (0,01 моль) гидроиодида 1-аллил-2-иминопиридина в 10 мл воды. Добавляют 3 мл 20 %-ного раствора NaOH и нагревают с обратным холодильником в течение 13 ч (до исчезновения 1-аллил-2-иминопиридина, контроль ТСХ). Экстрагируют диэтиловым эфиром. Выход 1,02 г (76 %) .
Метод Г. К раствору 0,94 г (0,01 моль) 2-аминопиридина в 5 мл воды прибавляют 1 мл (0,18 моль) концентрированной серной кислоты. Смесь охлаждают до 0–5 °С. Затем при перемешивании приливают раствор 0,725 г (0,18 моль) NaNO 2 в 5 мл воды в течение 20 мин. К полученному раствору при комнатной температуре добавляют раствор 1,6 г (0,04 моль) NaOH в 5 мл воды, 0,1 г тетрабутиламмоний бромида и раствор 0,91 мл (0,01 моль) бромистого аллила в 10 мл CH 2 Cl 2 и перемешивают в течение 30 мин. Отделяют органический слой, сушат хлористым кальцием, фильтруют, отгоняют CH 2 Cl 2 . Выход 0,78 г (51 %).
Метод Д. В колбу помещают раствор 25 г (0,1 моль) иодида 1-аллилпиридиния в 70 мл воды и при 0°С добавляют раствор 16,8 г (0,3 моль) КОН в 30 мл воды, а затем раствор 65,8 г (0,2 моль) K3[Fe(CN)6] в 150 мл воды. Реакционную смесь перемешивают в течение 3 ч. Через сутки проводят экстракцию хлороформом (160 мл), сушат хлористым кальцием. Хлороформ отгоняют, а остаток подвергают вакуумной перегонке. Выход 13,50 г (40 %).
Метод Е. В колбе растворяют 0,48 г (0,0015 моль) иодида 1-аллил-2-бромпиридиния в 20 мл воды. Добавляют 5 мл 20 %-ного раствора NaOH и перемешивают в течение 1 ч. К раствору добавляют 20 мл диэтилового эфира, перемешивают и через 1 ч отделяют эфирный слой, который сушат CaCl 2 . Эфир отгоняют. Выход 84 %.
Заключение
1-Аллил-2-пиридон получен аллилированием 2-пиридона аллилбромидом в системе спирт – вода – КОН, ДМФА – K2CO3 или в присутствии изопропилата натрия в изопропиловом спирте, щелочным гидролизом бромида 1-аллил-2-аминопиридиния и иодида 1-аллил-2-бромпиридиния, однореакторными синтезами из 2-аминопиридина и иодида 1-аллипиридиния.
Список литературы Синтезы 1-аллил-2-пиридона
- N-Аллилпиридон-2 и 2-аллоксипиридин и продукты их гидрирования/Б.И. Михантьев, Е.И. Федоров, А.И. Кучерова, В.И. Потапова//Журнал общей химии. -1959. -Т. 29. -С. 1874-1875.
- Sato, T. CsF in Organic Synthesis. Tuning of N-or O-Alkylation of 2-Pyridone/T. Sato, K. Yoshimatsu, J. Otera//SYNLETT. -1995. -P. 845-846.
- Ким, Д.Г. Взаимодействие гидрогалогенидов 1-аллил-2-имино-1,2-дигидропиридина с галогенами/Д.Г. Ким, С.Е. Успенская//Известия вузов. Химия и хим. технол. -1993. -Вып. 9. -С.121-123.
- Чичибабин, А.Е. Натриевая соль α-пиридона/А.Е. Чичибабин, М.Д. Розанцев//Журнал русского физико-химического общества. -1915. -Т. 47. -С. 1571-1572.
- Mohrle, H. Oxydation von 1-methyl-und 1,3-dimethylpyridinimsalzen/H. Mohrle, H. Weber//Tetrahedron. -1970. -Vol. 26. -P. 2953-2958.
- Пожарский, А.Ф. Теоретические основы химии гетероциклов/А.Ф. Пожарский. -М.: Химия, 1985. -255 с.
- Лебедев, А.Т. Масс-спектрометрия в органической химии/А.Т. Лебедев. -М.: Бином. Лаборатория знаний, 2003. -496 с.
- Вершинина, Е.А. Синтез и исследование свойств производных 2-хинолона/Е.А. Вершинина, Д.Г. Ким//Вестник ЮУрГУ. Серия «Химия». -2010. -Вып. 4. -№ 31 (207). -С. 10-17.


