Синтезы 1-винил-2-пиридона
Автор: Ким Дмитрий Гымнанович, Бердникова Елена Владимировна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 36 (295), 2012 года.
Бесплатный доступ
Осуществлены синтезы 1-винил-2-пиридона винилированием 2-пиридона ацетиленом, реакцией 2-пиридона с 1,2-дигалогенэтаном, окислением бромида 1-(2-бромэтил)пиридиния.
2-пиридон, 1-винил-2-пиридон, 2-винилоксипиридин, бромид 1-(2-бромэтил)пиридиния, 1-(2-гидроксиэтил)-2-пиродон, амбидентный анион, оксазоло[3, 2-а]пиридиниевая система, винилирование, масс-спектр
Короткий адрес: https://sciup.org/147160241
IDR: 147160241 | УДК: 547.824
Текст научной статьи Синтезы 1-винил-2-пиридона
Впервые [1] 1-винил-2-пиридон (1) получен взаимодействием 2-пиридона (2-оксипиридин) с ацетиленом под давлением в присутствии щелочи. В присутствии эквимольного количества ацетата кадмия выход 1-винил-2-пиридона составил меньше 10 %, а основным продуктом являлся 2-винилоксипиридин (2) [2]. В работе [3] соединение 1 получено взаимодействием 2-аминопи-ридина с ацетиленом под давлением, а в работе [4] – реакцией 2-триметилсилилоксипиридина с винилацетатом в присутствии ацетата ртути.
Целью настоящей работы является синтез 1-винил-2-пиридона винилированием 2-пиридона ацетиленом под действием различных катализаторов, реакцией 2-пиридона с 1,2-дигалогенэта-ном и окислением бромида 1-(2-бромэтил)пиридиния.
Обсуждение результатов
В настоящей работе нами изучено взаимодействие 2-пиридона с ацетиленом под давлением в присутствии различных катализаторов при 170–180 °С в диоксане (схема 1). В присутствии оксидов, гидроксидов, хлоридов кадмия, ацетатов, оксидов, гидроксидов, хлоридов ртути, цинка и меди всегда образуется смесь N- и O-изомеров и общий выход не превышает 50 %, из которого выход соединения 1 составляет не более 20 %. Смесь N- и O-изомеров удается разделить вакуумной перегонкой, так как их температуры кипения сильно различаются (120 °С /9 мм рт. ст. и 54 °С /9 мм рт. ст.).
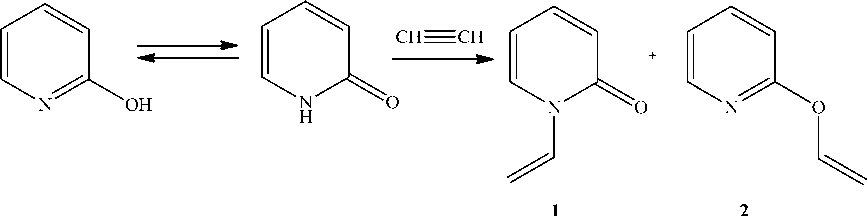
Схема 1. Винилирование 2-пиридона ацетиленом
В присутствии гидроксида калия с высоким выходом (90 %) образуется практически только 1-винил-2-пиридон.
Различное поведение 2-пиридона в реакции винилирования ацетиленом под действием щелочи или других катализаторов можно объяснить с точки зрения теории жестких и мягких кислот и оснований (ЖМКО) [5, 6]. 2-Пиридон под действием щелочи образует амбидентный анион и катион щелочного металла (жесткая кислота) будет предпочтительно координироваться с атомом кислорода (жесткое основание). В результате этого происходит экранирование атома кислорода, что затрудняет реакцию с его участием. В случае соединений кадмия, ртути, цинка и меди, кото- рые являются мягкими кислотами, координация происходит как по атому азота, так по атому кислорода, поэтому реакция протекает по двум реакционным центрам.
Нами установлено, что при 170–180 °С в диоксане не происходит изомеризации 2-винил-оксипиридина в 1-винил-2-пиридон под действием КОН и ацетилена и изомеризации 1-винил-2-пиридона в 2-винилоксипиридин под действием ацетата кадмия и ацетилена.
1-Винил-2-пиридон получен нами взаимодействием 2-пиридона с 1,2-дибромэтаном или с 1,2-дихлорэтаном в системе изопропилат натрия-изопропиловый спирт при кипячении и в системе ДМФА–K 2 СО 3 (схема 2), но выходы составляют меньше 10 %. По-видимому, вначале происходит алкилирование с образованием 1-(2-галогенэтил)-2-пиридона (3) , а затем дегидрогалогенирование.

X

X
N

-
1. i-PrONa + i-PrOH
-
2. DMF + K2CO3
H
X=Br,Cl
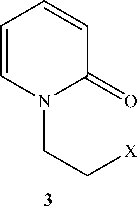
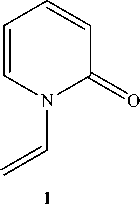
Схема 2. Синтез из 2-пиридона и 1,2-дигалогенэтана
Нами 1-винил-2-пиридон с низким выходом (5 %) получен последовательным действием на бромид 1-(2-бромэтил)пиридиния изопропилатом натрия, гидроксидом калия и гексацианоферратом (III) калия (схема 3). Вначале, по-видимому, образуется бромид 1-винилпиридиния (4) , затем калиевая соль псевдооснования (5) , которая окисляется до 1-винил-2-пиридона. Ранее [7], аналогичный способ осуществлен для иодида 1-аллилпиридиния, протекающий с образованием 1-аллил-2-пиридона с выходом 40 %.
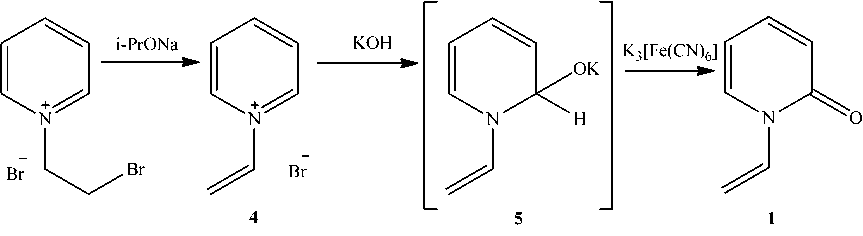
Схема 3. Синтез из бромида 1-(2-бромэтил)пиридиния
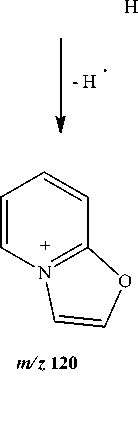
Методом масс-спектрометрии [8] нами исследован 1-винил-2-пиридон. В масс-спектре его (см. рисунок) имеется пик молекулярного иона, интенсивность которого меньше, чем интенсивность максимального пика [М–Н]+. По-видимому, это обусловлено тем, что при элиминировании атома водорода образуется оксазо-ло[3,2- a ]пиридиниевая система ( m/z 120), которая обладает ароматичностью. При фрагментации молекулярного иона [М]+•, также происходит элиминирование СО с образованием кати-он-радикала N-винилпиррола ( m/z 93). В свою очередь, катион-радикал N-винилпиррола распадается с образованием катион-радикала пиррола ( m/z 67). Основные процессы фрагментации 1-винил-2-пиридона приведены на схеме:
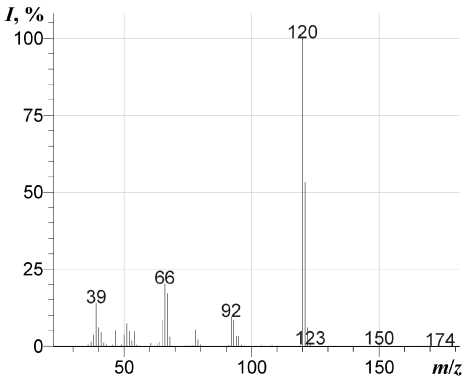
Масс-спектр 1-винил-2-пиридона
Органическая химия
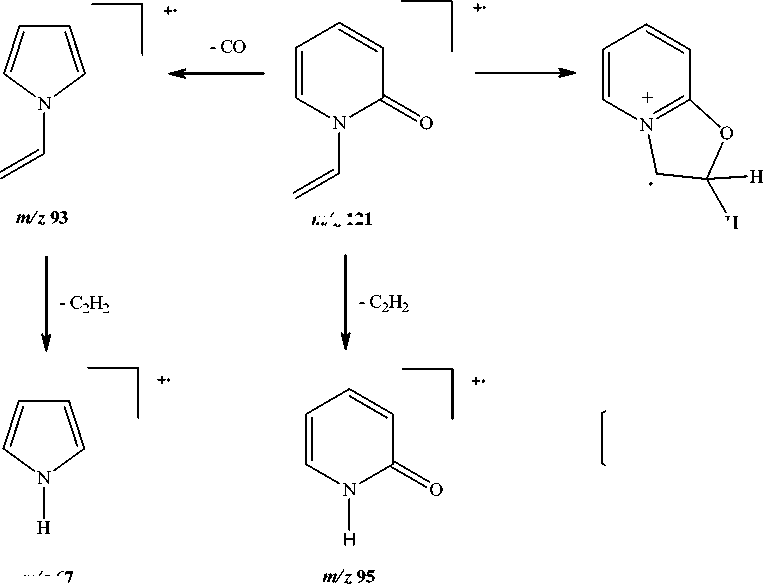
wi 121
nV". 67
Экспериментальная часть
1-Винил-2-пиридон
Способ 1
В автоклав, емкостью 1 л загружают 19 г (0,2 моль) 2-пиридона, 90 мл диоксана и 0,1 моль катализатора и подают ацетилен под давлением 15 атм, нагревают при 170–180 °С в течение 1 ч. После охлаждения отгоняют диоксан, остаток перегоняют в вакууме.
Способ 2
Смесь 0,285 г (0,003 моль) 2-пиридона, раствор 0,173 г (0,0075 моль) натрия в 5 мл изопропилового спирта и 0,388 мл (0,0045 моль) 1,2-дибромэтана или 0,511 мл (0,006 моль) 1,2-дихлорэтана кипятят в течение 4 ч. Через 12 ч фильтруют, испаряют, остаток экстрагируют дихлормета-ном. После испарения CH 2 Cl 2 остаток экстрагируют эфиром. Выход соединения 1 – 9 %.
Способ 3
Смесь 0,285 г (0,003 моль) 2-пиридона, 0,388 мл (0,0045 моль) 1,2-дибромэтана, 0,621 г (0,0045 моль) K 2 СО 3 , 10 мл ДМФА нагревают на водяной бане в течение 4 ч. После охлаждения фильтруют, фильтрат испаряют, остаток обрабатывают CH 2 Cl 2 и отфильтровывают. После испарения CH 2 Cl 2 остаток экстрагируют эфиром. Выход соединения 1 – 8 %.
Способ 4
В плоскодонную колбу помещают 0,213 г (0,0008 моль) бромида 1-(2-бромэтил)пиридиния, раствор 0,0184 г (0,0008 моль) натрия в 5 мл изопропилового спирта и перемешивают на магнитной мешалке в течение 1 ч. Затем, при охлаждении льдом добавляют 0,134 г (0,024 моль) KОН в 3 мл воды и 0,526 г (0,0016 моль) гексацианоферрата (III) калия, в 5 мл воды, перемешивают в течение 3 ч и оставляют стоять. Через 24 ч проводят экстракцию эфиром, эфир испаряют, получают соединение 1 . Выход 5 %.
Заключение
1-Винил-2-пиридон получен реакцией 2-пиридона с ацетиленом под давлением в присутствии катализаторов в диоксане, взаимодействием 2-пиридона с 1,2-дибромэтаном или 1,2-дихлорэтаном в системе ДМФА–K 2 CO 3 или в присутствии изопропилата натрия в изопропиловом спирте, а также последовательным действием на бромид 1-(2-бромэтил)пиридиния изопропилата натрия, гидроксида калия и гексацианоферрата (III) калия на бромид 1-(2-бромэтил)пиридиния.
Список литературы Синтезы 1-винил-2-пиридона
- Федоров В.И. Винилирование 2-оксипиридина и его некоторых хлор-и бромпроизводных/В.И. Федоров, Б.И. Михантьев, Г.И. Хорошавина//Химия гетероцикл. соединений. -Рига, 1967. -Сб. 1. -С. 215-219.
- Скворцова Г.Г. Синтез 2-винилоксипиридина/Г.Г. Скворцова, С.М. Тырина//Химия гетероцикл. соединений. -1968. -№ 6. -С. 1132-1133.
- Андриянков М. А. 1-Винил-2-пиридон из 2-аминопиридина/М. А. Андриянков, Г.Г. Скворцова//Журнал органической химии. -1984. -Т. 20. -Вып. 9. -С. 2030-2031.
- Kaye H. N-vinilation of heteroaromatic O-trimethylsilyl lactims/H. Kaye, S.-H. Chang//Tetrahedron. -1970. -Vol. 26. -P. 1369-1376.
- Гомпер Р. Связь между строением и реакционной способностью амбифукциональных нуклеофильных соединений/Р. Гомпер//Успехи химии. -1967. -Т. 36, № 5. -С. 803-823.
- Шевелев С.А. Двойственная реакционная способность амбидентных анионов/С.А. Шевелев//Успехи химии. -1970. -Т. 39, № 10. -С. 1773-1800.
- Ким Д.Г. Синтезы 1-аллил-2-пиридона/Д.Г. Ким, Е.В. Бердникова//Вестник ЮУрГУ. Серия «Химия». -2012. -Вып. 9. -№ 24 (283). -С. 13-17.
- Лебедев А.Т. Масс-спектрометрия в органической химии/А.Т. Лебедев. -М.: Бином. Лаборатория знаний, 2003. -496 с.


