Система CRISPR / CAS9 - инструмент для исследования наследственных сердечно-сосудистых заболеваний
Автор: Медведев Сергей Петрович, Закиян С.М.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Обзоры
Статья в выпуске: 4-2 т.19, 2015 года.
Бесплатный доступ
Поиск более эффективных и безопасных лекарств против сердечно-сосудистых заболеваний - одна из актуальных задач экспериментальной кардиологии и фармакологии. В случае с наследственными патологиями сердечно-сосудистой системы особую сложность представляет поиск генов, ответственных за развитие болезни и расшифровка их взаимодействия в развитии заболевания. Кроме того, важно определить однонуклеотидные полиморфизмы, влияющие на степень проявления болезней. В последние годы активно развивается направление, связанное с использованием систем редактирования геномов, таких как CRISPR/ Cas9. Системи CRISPR/Cas9 - удобный и относительно простой в использовании инструмент, позволяющий эффективно вносить направленные изменения в геномы культивируемых клеток человека, осуществлять нокаут генов, управлять их транскрипцией, вносить или исправлять генные мутации. Мы представляем обзор достижений в использовании системы CRISPR/Cas9 для исследования и терапии болезней, в том числе сердечно-сосудистых заболеваний.
Системи crispr/cas9, геномная инженерия, наследственные патологии сердечно-сосудистой системы
Короткий адрес: https://sciup.org/142140863
IDR: 142140863
Текст научной статьи Система CRISPR / CAS9 - инструмент для исследования наследственных сердечно-сосудистых заболеваний
Проблема разнообразия молекулярных механизмов наследственных сердечно-сосудистых заболеваний
В геноме человека известно около 25 тыс. генов. По данным ресурса Online Mendelian Inheritance in Man (OMIM, режим доступа: geneMap), на 05.09.2015 обнаружен 3 441 ген, мутации в котором приводят к фенотипическим эффектам, в том числе связанным с тяжелыми наследственными патологиями, а общее число разнообразных фенотипических проявлений – 5 566. Среди сердечно-сосудистых заболеваний, которые вносят наибольший вклад в общую заболеваемость населения, также сущест- вуют патологии, напрямую связанные с мутациями в определенных генах и передающиеся по наследству. Среди этих заболеваний можно выделить две большие группы: нарушения ритма сердца, связанные с дефектной работой ионных каналов кардиомиоцитов (синдром удлиненного интервала QT, синдром укороченного интервала QT, синдром Бругада, катехолами-нергическая полиморфная желудочковая тахикардия), и кардиомиопатии (гипертрофическая кардиомиопатия, дилатационная кардиомиопатия, аритмогенная дисплазия правого желудочка) [1]. В группу канало-патий входят распространенные в популяции заболевания, например синдром удлиненного интервала QT
(встречается с частотой 1 : 2 000). Известно 15 генов, кодирующих компоненты калиевых, натриевых и кальциевых каналов кардиомиоцитов, и более 700 мутаций в них, которые приводят к развитию синдрома [2, 3]. Другой характерный пример распространенного наследственного сердечно-сосудистого заболевания – гипертрофическая кардиомиопатия. Эта болезнь встречается с частотой до 1 : 500, и примерно половина случаев связана с мутациями генов, которые в основном кодируют структурные компоненты саркомеров. Количество известных генов, ассоциирова-ных с развитием гипертрофической кардиомиопатии, превышает 20, известных мутаций – 900 [4]. Большое число генов и мутаций, ответственных за развитие наследственных сердечно-сосудистых заболеваний, вызывает существенную вариабельность времени начала первых симптомов и тяжести их проявления (от полного отсутствия симптомов до тяжелых необратимых состояний). Вариабельность проявляется и на молекулярном уровне не только электрофизиологическими нарушениями, но и дисфункцией клеточных органелл (митохондрий, эндоплазматического ретикулума, лизосом), нарушением энергетического обмена, внутриклеточного транспорта и утилизации макромолекул, а также изменением структуры цитоскелета и работы сигнальных каскадов. Такое разнообразие патологических проявлений на клеточном и молекулярном уровнях у пациентов с одним и тем же диагнозом может являться причиной негативных результатов при поиске эффективной лекарственной терапии наследственных болезней сердца.
Модельные системы для изучения сердечно-сосудистых заболеваний
Для исследования молекулярных механизмов патогенеза наследственных болезней сердца, поиска мишеней для лекарственной терапии и тестирования потенциальных лекарств необходимы модельные системы и эффективные инструменты манипуляции с генами и геномами, предназначенные для проведения экспериментов in vitro .
При поиске новых лекарств и подходов к терапии сердечно-сосудистых заболеваний современная экспериментальная медицина использует несколько типов модельных систем. Это прежде всего модельные животные, преимущественно грызуны: лабораторные мыши и крысы. Грызунов активно используют для создания моделей острого инфаркта миокарда, аритмий различных типов и заболеваний сосудов [5–7]. Кроме того, отмечают линии лабора- торных животных, которые несут мутации, вызывающие наследственные сердечно-сосудистые заболевания [8, 9]. Несмотря на обилие информации о патогенезе и способах терапии сердечно-сосудистых заболеваний, полученный на лабораторных животных, выявили ограничения в использовании этих модельных систем, обусловленные различиями в физиологии сердечно-сосудистой системы (частота сердечных сокращений, особенности фазы реполяризации потенциала действия и т. д.) между грызунами и человеком. Это очевидно при моделировании синдромов, связанных с нарушением функционирования калиевых каналов, поскольку их типы у разных видов животных могут играть ключевую роль в процессе реполяризации кардиомиоцитов [8].
Решением подобной ситуации может стать использование кардиомиоцитов человека. Однако в связи с этим возникает еще одна проблема – доступность данного типа клеток для исследователей. Получение биопсии ткани миокарда при жизни пациентов является инвазивной процедурой, которая возможна при определенных оперативных вмешательствах (например, полостных операциях), что показано не для всего спектра сердечно-сосудистых заболеваний. Кроме того, объем биопсии, как правило, мал, а потенциал выживаемости и пролиферации дифференцированных кардиальных клеток низок. Эту проблему решили с развитием технологий получения, культивирования и направленной дифференцировки плюрипотентных клеток человека. Проводят исследования, основанные на использовании культур кардиомиоцитов, полученных в результате дифференцировки эмбриональных стволовых и индуцированных плюрипотентных стволовых клеток человека и животных.
В контексте моделирования сердечно-сосудистых заболеваний, как и многих других, преимущество имеют индуцированные плюрипотентных стволовые клетки, поскольку их можно получить в любой период жизни пациентов практически из любого типа дифференцированных клеток [10]. Разрабатывают надежные и эффективные методы направленной дифференцировки индуцированных плюрипотентных стволовых клеток в кардиомиоциты различных типов, включающие кардиомиоциты синусового узла, предсердные и желудочковые кардиомиоциты. Получаемые при дифференцировке индуцированных стволовых клеток кардиомиоциты схожи с кардиомиоцитами сердца по морфологии, экспрессии белковых маркеров, электрофизиологическим пока-
Индуцированные плюрипотентные стволовые клетки
Здоровый человек
Токсикологические исследования Поиск перспективных препаратов Фармакологические исследования Изучение механизмов патогенеза
Соматические клетки
CRISPR/Cas9
Панель изогенных линий, моделирующих заболевания человека
Редактирование генома
Пациенты
Пациент-специфичные соматические клетки
Контроль «Здоровые клетки»
CRISPR/Cas9
Редактирование генома
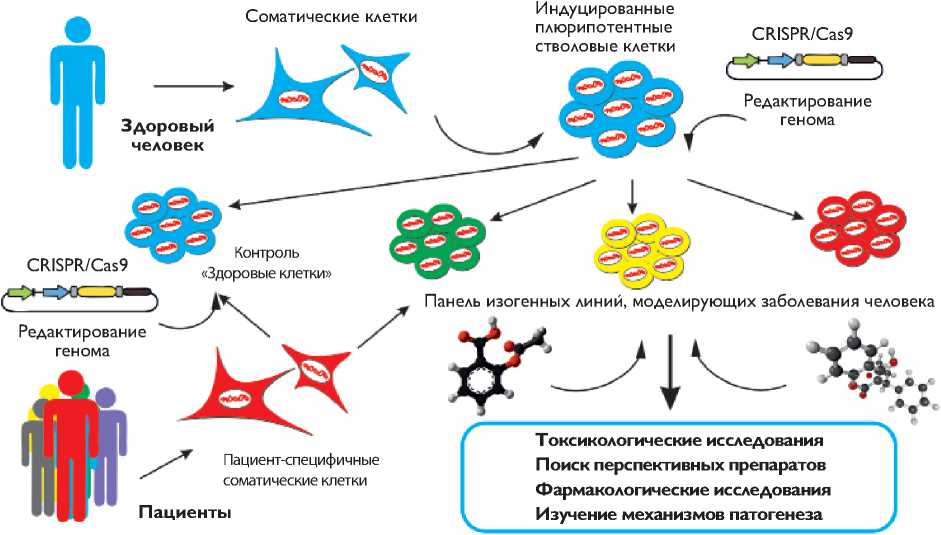
Схема создания пациент-специфичных и изогенных клеточных моделей наследственных заболеваний человека
зателям и чувствительности к химическим веществам [11, 12].
Система CRISPR/Cas9 в исследованиях моделей наследственных сердечнососудистых заболеваний
В современной молекулярной генетике изучение функций гена в норме и патологии сводится к двум основным стратегиям: нокауту, подавлению (loss-of-function), или сверхактивации (gain-of-function) работы гена. Для проведения подобных манипуляций in vitro (на культурах клеток) и in vivo (на модельных животных) необходимы эффективные инструменты. В начале 2013 г. появились работы, в которых описывали использование компонентов адаптивной иммунной системы бактерий CRISPR/Cas9 для редактирования геномов млекопитающих [13, 14]. Эта система обладает высокой эффективностью и специфичностью работы, но отличается простотой создания генетических конструкций. Для создания конструкции, опознающей конкретную последовательность ДНК в геноме, достаточно поместить синтетический фрагмент ДНК длиной около 20 нуклеотидов (спейсер) в специальный вектор, экспрессирующий некодирующую РНК (sgRNA) и нуклеазу Cas9. Спейсер является частью sgRNA, и его последовательность определяет специфичность связывания sgRNA с ДНК-мишенью (протоспейсеру в целевом геноме). Кроме того, необходимое условие работы нуклеазы Cas9 – наличие в целевом геноме последовательности, называемой PAM (protospacer adjacent motif), которая непосредственно примыкает к протоспейсеру. Для Cas9 бактерии Streptococcus pyogenes, которую используют наиболее часто, консенсус последовательности PAM выглядит следующим образом: 5’-NGG-3’. Связывание осуществляется по принципу комплементарности оснований РНК-ДНК. Комплекс sgRNA и нуклеазы Cas9 опознает место связывания и производит дву-нитевой разрыв в молекуле ДНК [15]. В таком виде систему CRISPR/Cas9 можно использовать в двух направлениях: нокаут генов за счет делеций и инсерций нуклеотидов, происходящих при негомологичном сшивании концов молекулы ДНК; CRISPR/Cas9-опос-ледованная гомологичная рекомбинация.
Негомологичное сшивание концов молекулы ДНК после разрыва, вызванного CRISPR/Cas9, часто приво- дит к формированию делеций или инсерций нуклеотидов, имеющих случайный размер, который обычно варьирует в пределах нескольких десятков нуклеотидов, а также случайный нуклеотидный состав. Этот подход можно использовать только для нокаута генов путем сдвига рамки считывания, когда нет необходимости в воспроизведении точного типа мутации. Для создания клеточных линий или модельных организмов с определенным типом мутаций (например, с конкретной точечной заменой одного нуклеотида), а также внесения искусственных конструкций в конкретное место генома используют CRISPR/Cas9-опос-ледованную гомологичную рекомбинацию. При этом для генерации двуцепочечного разрыва в молекуле ДНК используют систему CRISPR/Cas9. Одновременно с конструкцией, кодирующей компоненты системы CRISPR/Cas9, в клетку доставляется донорная молекула, содержащая участки гомологичных последовательностей в области разрыва. Помимо этих участков донорная молекула может содержать любые последовательности или однонуклеотидные замены, которые требуется внести в исследуемый геном. В качестве донорных молекул могут использоваться плазмиды, вирусные конструкции или одноцепочечные ДНК-олигонуклеотиды.
Преимущество геномной инженерии при создании модельных систем, особенно на основе пациент-спе-цифических индуцированных плюрипотентных стволовых клеток, – возможность создания изогенных моделей. С помощью этих моделей возможно решить проблемы, связанные с использованием пациент-спе-цифических клеток. Схема создания клеточных моделей на основе индуцированных плюрипотентных стволовых клеток представлена на рисунке .
Во-первых, при использовании пациент-специ-фических клеток невозможно подобрать адекватный контроль для исследования дифференцировки и оценки влияния различных воздействий на клетки. Контрольные клетки, полученные от здоровых людей, имеют другой генетический фон. Во-вторых, линии клеток могут отличаться друг от друга по спектру дифференцировки, иметь разную скорость деления и другие индивидуальные особенности, даже если их получили одним методом и в одной лаборатории. Безусловно, эти особенности могут влиять на точность результатов исследований. В-третьих, не хватает пациентов, которые смогли бы стать донорами соматических клеток, особенно в случаях редких наследственных заболеваний или разновидностях мутаций. Кроме того, для работы с пациентами необходим определенный набор разрешений и лицензий. При использовании методики геномной инженерии, такой как система CRISPR/Cas9, возможно избежать этих проблем [16]. Для исследования сердечно-сосудистых заболеваний данный подход уже успешно применили. В индуцированных плюрипотентных клетках пациента с синдромом удлиненного интервала QT второго типа исправили мутацию c.A2987T (N996I) в гене KCNH2. Кроме того, эту мутацию внесли в эмбриональные стволовые клетки. Исследование кардиомиоцитов, полученных при дифференцировке изогенных плюрипотентных клеток, установило роль данной мутации в развитии патогенеза и электрофизиологических аномалий, а также показало, что такую модель можно использовать для поиска и тестирования лекарств. При этом была применена классическая схема гомологичной рекомбинации без системы CRISPR/Cas9 [17]. Использование инструментов для стимуляции гомологичной рекомбинации может повысить эффективность создания таких моделей в десятки раз. Таким образом, возможно создать более широкие панели изогенных клеток, которые охватывают многие гены и мутации. Такие панели и масштабирование способов культивирования и направленной дифференцировки клеток позволят проводить скрининги больших библиотек потенциальных лекарственных препаратов и выявлять наиболее эффективные и безопасные.
Список литературы Система CRISPR / CAS9 - инструмент для исследования наследственных сердечно-сосудистых заболеваний
- Bezzina C.R., Lahrouchi N., Priori S.G. Genetics of sudden cardiac death//Circ. Res. 2015. Vol. 116. № 12. P. 1919-36.
- Hedley P.L., Jorgensen P., Schlamowitz S., Wangari R., Moolman-Smook J., Brink P.A., Kanters J.K., Corfield V.A., Christiansen M. The genetic basis of long QT and short QT syndromes: a mutation update//Hum. Mutat. 2009. Vol. 30. № 11. P. 1486-511.
- Mizusawa Y., Horie M., Wilde A.A. Genetic and clinical advances in congenital long QT syndrome//Circ. J. 2014. Vol. 78. № 12. P. 2827-33.
- Frey N., Luedde M., Katus H.A. Mechanisms of disease: hypertrophic cardiomyopathy//Nat. Rev. Cardiol. 2012. Vol. 9. № 2. P. 91-100.
- Borst O., Ochmann C., Schonberger T., Jacoby C., Stellos K., Seizer P., Flögel U., Lang F., Gawaz M. Methods employed for induction and analysis of experimental myocardial infarction in mice//Cell. Physiol. Biochem. 2011. Vol. 28. № 1. P. 1-12.
- Diaz J.A., Obi A.T., Myers D.D.Jr., Wrobleski S.K., Henke P.K., Mackman N., Wakefield T.W. Critical review of mouse models of venous thrombosis//Arterioscler. Thromb. Vasc. Biol. 2012. Vol. 32. № 3. P. 556-62.
- Jawien J. The role of an experimental model of atherosclerosis: apoE-knockout mice in developing new drugs against atherogenesis//Curr. Pharm. Biotechnol. 2012. Vol. 13. № 13. P. 2435-9.
- Salama G., London B. Mouse models of long QT syndrome//J. Physiol. 2007. Vol. 578. Pt. 1. P. 43-53.
- Zaragoza C., Gomez-Guerrero C., Martin-Ventura J.L., Blanco-Colio L., Lavin B., Mallavia B., Tarin C., Mas S., Ortiz A., Egido J. Animal models of cardiovascular diseases//J. Biomed. Biotechnol. 2011. Vol. 2011. P. 497841.
- Medvedev S.P., Shevchenko A.I., Zakian S.M. Induced Pluripotent Stem Cells: Problems and Advantages when Applying them in Regenerative Medicine//Acta Naturae. 2010. Vol. 2. № 2. P. 18-28.
- Zhang J., Wilson G.F., Soerens A.G., Koonce C.H., Yu J., Palecek S.P., Thomson J.A., Kamp T.J. Functional cardiomyocytes derived from human induced pluripotent stem cells//Circ. Res. 2009. Vol. 104. № 4. P. e30-41.
- Zwi L., Caspi O., Arbel G., Huber I., Gepstein A., Park I.H., Gepstein L. Cardiomyocyte differentiation of human induced pluripotent stem cells//Circulation. 2009. Vol. 120. № 15. P. 1513-23.
- Mali P., Yang L., Esvelt K.M., Aach J., Guell M., DiCarlo J.E., Norville J.E., Church G.M. RNA-guided human genome engineering via Cas9//Science. 2013. Vol. 339. № 6121. P. 823-6.
- Cong L., Ran F.A., Cox D., Lin S., Barretto R., Habib N., Hsu P.D., Wu X., Jiang W., Marraffini L.A., Zhang F. Multiplex genome engineering using CRISPR/Cas systems//Science. 2013. Vol. 339. № 6121. P. 819-23.
- Ran F.A., Hsu P.D., Wright J., Agarwala V., Scott D.A., Zhang F. Genome engineering using the CRISPR-Cas9 system//Nature Protocols. 2013. Vol. 8. № 11. P. 2281-308.
- Soldner F., Laganiere J., Cheng A.W., Hockemeyer D., Gao Q., Alagappan R., Khurana V., Golbe L.I., Myers R.H., Lindquist S., Zhang L., Guschin D., Fong L.K., Vu B.J., Meng X., Urnov F.D., Rebar E.J., Gregory P.D., Zhang H.S., Jaenisch R. Generation of Isogenic Pluripotent Stem Cells Differing Exclusively at Two Early Onset Parkinson Point Mutations//Cell. 2011. Vol. 146. № 2. P. 318-31.
- Bellin M., Casini S., Davis R.P., D'Aniello C., Haas J., Ward-van Oostwaard D., Tertoolen L.G., Jung C.B., Elliott D.A., Welling A., Laugwitz K.L., Moretti A., Mummery C.L. Isogenic human pluripotent stem cell pairs reveal the role of a KCNH2 mutation in long-QT syndrome//EMBO J. 2013. Vol. 32. № 24. P. 3161-75.


