Системный анализ процесса термоокислительной деструкции полимеров в растворе как объекта управления
Автор: Битюков В.К., Хаустов И.А., Хвостов А.А., Попов А.П.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Информационные технологии, моделирование и управление
Статья в выпуске: 3 (61), 2014 года.
Бесплатный доступ
В статье рассматривается технологический процесс синтеза низкомолекулярных каучуков методом термоокислительной деструкции как объекта управления. Выявлено, что основными управляющими параметрами, влияющими на скорость деструкции, являются: концентрация инициатора реакции, температура и массовая концентрация полимера. Основными параметрами управления являются: степень деструкции, качество получаемого полимера и время реакции. Установлено, что для эффективного управления температуру процесса и концентрацию инициатора необходимо стабилизировать в окрестности заданного значения, а значение массовой концентрации устанавливается дозировкой исходных компонентов. В этом случае кинетику процесса деструкции можно описать линейной зависимостью от времени. Т.е. степень деструкции линейно связана со временем проведения реакции. Тогда, определяя исходное качество полимера (его среднечисленную молекулярную массу), процесс деструкции проводится по времени до заданного значения степени разрушения. Поскольку в процессе деструкции расходуется инициатор, то для стабилизации его концентрации предлагается осуществлять его непрерывный ввод в реакционную среду. Получено математическое описание, описывающее кинетику при непрерывной подаче инициатора, и зависимость для расчета скорости подачи инициатора. Определены параметры линейной аппроксимирующей зависимости кинетики деструкции. Показано, что уже при малом времени деструкции график кинетики деструкции неуклонно стремится к его линейной асимптоте. Угол наклона асимптоты зависит от константы скорости деструкции (т.е. от температуры реакции) и начальной концентрации инициатора. Смещение кинетики деструкции по оси ординат зависит от начальной мольной концентрации полимера. Таким образом, подбирая начальную концентрацию полимера, появляется возможность управлять скоростью деструкции.
Термоокислительная деструкция полимеров, система управления
Короткий адрес: https://sciup.org/14040289
IDR: 14040289 | УДК: 678.01
Текст научной статьи Системный анализ процесса термоокислительной деструкции полимеров в растворе как объекта управления
Технологический процесс получения низкомолекулярных полимеров, в общем случае, состоит из следующих элементарных стадий: загрузка компонентов реакции (растворителя, полимера); подогрев реакционной массы до заданной температуры и растворение полимера; загрузка инициатора; деструкция до заданной степени разрушения полимера; загрузка ингибитора - окончание деструкции; охлаждение реакционной массы; осушка и выделение полученного низкомолекулярного полимера. Основной стадией рассматриваемого процесса является процесс деструкции, поскольку именно на этой стадии формируются основные показатели качества продукта (средние молекулярные массы полимера и коэффициент полидисперсности).
В этой связи задачами системы управления процессом деструкции являются:
-
- регулирование степени разрушения полимера, величина которой может быть различна и зависит от того, какой вид полимера требуется получить по технологии, и в какой области он будет использоваться;
-
- получение управляющих воздействий, позволяющих достичь требуемой степени деструкции за заданное по технологии время реакции.
В качестве управляющих воздействий, влияющих на поведение процесса деструкции, можно выделить следующие параметры: температура процесса деструкции, концентрация полимера в растворе (объемная доля), концентрация инициатора деструкции (в молях), соотношение концентраций деструктора и полимера в реакционной смеси, интенсивность барботирования реакционной смеси атмосферным воздухом, скорость подачи инициатора. Структурная схема объекта управления представлена на рисунке 1.
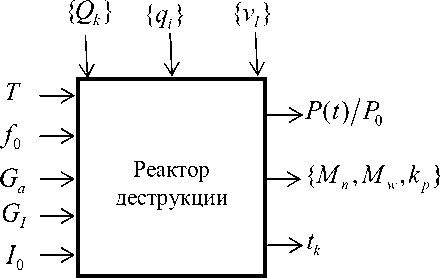
Рисунок 1. Структурная схема объекта управления
На рисунке 1 P ( t )/ P0 - степень деструкции полимера; { M n , M w , k } - параметры качества полимера (среднечисленная и средневесовая молекулярные массы полимера, коэффициент полидисперсности); P0, P ( t ) - начальная и текущая концентрация полимера, моль/л; I 0 - начальная концентрация инициатора, моль/л; f , - массовая концентрация полимера, кг/л; T - температура реакции, ° С; tk - время деструкции, мин; G a , G I - скорости подачи атмосферного воздуха и инициатора в реактор, кг/мин; { q i } - теплофизические параметры (теплоемкость, коэффициент теплопередачи и др.); { vt } - физические и реологические параметры реакционной смеси (вязкость, плотность, концентрации веществ, образованных в ходе вторичных процессов и др.); {Qk } - множество, характеризующее тепловые возмущения (тепловыделение за счет реакции, перемешивания, температура окружающей среды, хладагента и т.д.).
Решение поставленных задач непосредственно связано с исследованием кинетики процесса управляемой деструкции, в том числе и методом математического моделирования.
Проблеме изучения деструкции полимеров методом моделирования посвящено достаточно много работ как отечественных исследователей [1-3], так и зарубежных [4-6]. Однако моделирование процессов деструкции полимеров в растворе практически не обсуждается.
Для синтеза и исследования систем оптимального управления в работе [7] были получены кинетические уравнения в виде аналитических зависимостей, описывающих динамику изменения компонентов реакционной смеси - концентрации полимера, инициатора процесса и агента деструкции.
Для описания кинетики процесса термоокислительной деструкции полимера в растворе использовались следующие положения - из одного моля инициатора в идеальном случае получается 2 моля деструктора и реакция одного моля деструктора с одним молем полимера дает 2 моля полимера, т.е. используется следующая кинетическая схема:
I k2 ^ 2D
D+P k1 ^ 2P *
При моделировании процесса использованы следующие допущения:
-
1. Одна молекула деструктора в результате разрыва двойных связей и элемен-
- тарного акта деструкции идет на образование двух макромолекул полимера с гидроксиль-ной концевой группой на одной из двух макромолекул полимера.
-
2. Обе макромолекулы, образовавшиеся в ходе реакции деструкции, относятся к тому же классу макромолекул, что и исходная макромолекула полимера, т.е. P = Р.
-
3. Константа скорости деструкции не зависит от длины макромолекулы.
-
4. Исчерпывание деструктора описывается реакцией первого порядка со скоростью, не зависящей от температуры и давления в реакторе.
-
5. Константа скорости деструкции во много раз больше константы скорости дезактивации деструктора.
-
6. В реакторе деструкции происходит интенсивное перемешивание.
Кинетика процесса термоокислительной деструкции полимера в растворе в соответствии с принятой кинетической схемой и принятых допущений в общем виде описывается системой уравнений:
dId^ = — к 21 (t),(1)
dDd^ = 2к21(t)-кP(t)• D(t),(2)
dP^ = кiP (t) D (t),(3)
P (0 ) = P„ D (0) = 0, I (0 ) = I,,(4)
где D ( t ) - концентрация деструктора, [моль/л]; к 2- константа скорости образования деструктора, мин -1 ; к 1 - константа скорости деструкции, мин -1 ^л/моль.
Выражения описывают кинетику изменения концентраций инициатора, полимера и деструктора в объеме реакционной массы в ходе реакции в изотермическом режиме, при условии, что процесс реализован в реакторе периодического действия с интенсивным перемешиванием и постоянным барботированием атмосферным воздухом.
Влияние температуры реакционной массы на скорость химической деструкции рассмотрено в [8]. Начало реакций происходит при достижении молекулами компонентов смеси определенного значения энергии активации, достаточного для преодоления энергетического барьера. Увеличение температуры позволяет повысить долю молекул, обладающих достаточной энергией.
Связь между энергией активации и скоростью протекания реакций описывается уравнением Аррениуса:
k j = к 0 j- exp ( - E j/ RT ) , (5) где R = 8,315 - универсальная газовая постоянная, Дж/(моль- ° К); T - температура реакции, ° К; к 0 j - предэкспоненциальная константа, размерность соответствует kj ; E j - энергия активации, Дж; j = 1,2.
Для уравнения (5) были получены оценки энергий активации химических реакций и предэкспоненциальных констант: к 01 = 7,96-10 13 мин -^ л/моль; к 02 = 2,3-10 10 мин 1 ; E 1 = 81,8 кДж; E 2= 86,4 кДж. Согласно литературным данным значение энергии активации E 2 = 83,7 кДж [9], что подтверждает правомерность полученных оценок.
Регулирование температуры реакции является эффективным способом для управления скоростью химической деструкции. Как следует из рисунка 2, скорость реакций возрастает по экспоненте с увеличением температуры. Однако уже при 70 °С наблюдается обратный процесс - гелеобразование, несмотря на введение антиоксидантов. Это можно проследить на рисунках 3 и 4. После четырех часов скорость деструкции по данным эксперимента снижается относительно теоретических расчетных значений концентрации (рисунок 3). Это соответствует росту скорости гелеобразования после 4-х часов деструкции (рисунок 4).
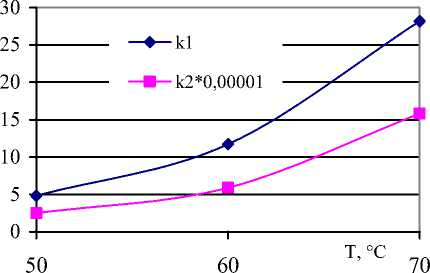
Рисунок 2. Влияние температуры реакции на скорость деструкции
Различие между эксп ериментальными данными и расчетными при 70 °С объясняется тем, что при высоких температурах возрастает интенсивность вторичных процессов - реакции рекомбинации полимерных цепей, приводящих к сшивке макромолекул, и как следствие уменьшению их концентраций. В этой связи введение антиоксидантов не позволяет полностью избежать гелеобразования.
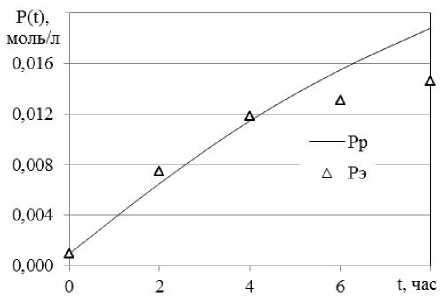
Рисунок 3. Динамика изменения концентрации полимера в ходе деструкции, T 70°С
На рисунке 3 Pp - расчетные данные, Рэ -экспериментальные.
Очевидно, что при больших температурах скорость образования гелей возрастает. В этой связи для проведения химической деструкции с максимальной эффективностью целесообразна стабилизация максимальной температуры, при которой гелеобразование не происходит или удается устранить.
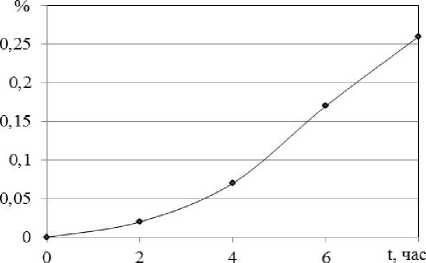
Рисунок 4. Динамика образования перекисных соединений в ходе деструкции, T =70°С
Возможность управления процессом деструкции изменением скорости барботирования реакционной массы атмосферным воздухом ограничена скоростью растворимости воздуха в растворе и пределом насыщения его кислородом. В этом случае должна обеспечиваться подача воздуха в зону реакции с максимальной эффективностью, Т.е. G a > G pred , где G pred - максимальная скорость подачи атмосферного воздуха в реактор, при которой обеспечивается насыщение раствора кислородом, кг/мин.
Увеличение массовой концентрации полимера в растворе приводит к ускорению процесса деструкции. Однако вместе с этим, как свидетельствуют экспериментальные исследования, увеличивается скорость гелеобразования, поскольку при повышении концентрации раствора также увеличивается вероятность рекомбинации полимерных молекул. Опытным путем установлена допустимая концентрация полимера в 10 %, при превышении которой начинается активное гелеобразование.
Влияние начальной загрузки инициатора и возможность управления скоростью деструкции изменением концентрации инициатора исследуем на математической модели (1)-(3).
Пусть в реакционную зону вводится непрерывно инициатор со скоростью GI ( t ), кг/мин, таким образом, концентрация инициатора в реакционной смеси поддерживается постоянной на протяжении всего процесса деструкции, т.е.:
I ( t ) = I 0 = const . (6)
Найдем решение (1)-(3), введя допущение, что объем реакционной массы увеличивается незначительно за счет дополнительной дозировки инициатора в реактор, т.е. V0 ® V 1
В этом случае изменение концентраций реагентов в результате увеличения объема не учитывается, а подача инициатора в реактор рассчитыва- G, ( t )
ется из условии - k 2 I ( t ) + I^ = 0 и (6), т.е.:
Gi (t) = к21V0Mi .(7)
Тогда исходная система уравнений преобразуется к виду:
dDD^ = 2 к 21„ - к 1P (t )■ D (t),(8)
dP^ = к 1P (t) D (t).(9)
Решение системы уравнений (8)-(9) с использованием начальных условий (4) получено в виде:
P (t ) =---------,(10)
() к^ (t) +1/Po' '
D (t ) = Po + 2 к 2 ■ 10 ■ t - P (t),(11)
t где i//(t) = |екгP0T+2кгк2"10т2dT, ф(t) = ек'"P0"t+2к'"к2"10"t2. 0
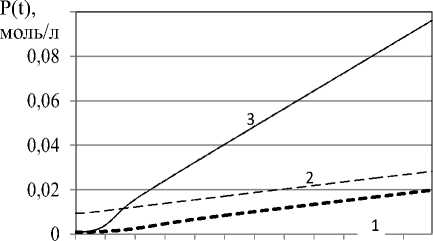
На рисунке 5 изображены варианты протекания деструкции полимера при различных начальных условиях расчета уравнения (10). Кривая 1 соответствует протеканию реакции при исходных начальных дозировках. Кривая 2 - начальная концентрация полимера увеличена в 10 раз. Кривая 3 - начальная концентрация инициатора увеличена в 5 раз. Во всех
3–х случаях начальная концентрация инициатора поддерживается постоянной.
0 40 80 120 160 200 240 280 320 360 400 440
t, мин
Рисунок 5. Кинетика деструкции полимера при
I ( t ) = 1 0
Как видно из рисунка 5, стабилизация концентрации инициатора независимо от исходных свойств полимера (начальной концентрации полимера P0 , a, следовательно, и его начальной среднечисленной молекулярной массы) обеспечивает проведение деструкции по линейному закону. Т.е. изменение концентрации в этом случае пропорционально времени деструкции. Поскольку P0 - постоянная вели- чина и определяется исходным качеством по- лимера, то степень деструкции подчиняется также линейному закону изменения во времени.
Кроме того, изменение начальной концентрации полимера пропорционально влияет на смещение графиков по оси ординат (кривая 2), а изменение концентрации инициатора пропорционально углу наклона кривой (кривая 3), т.е. скорости деструкции. Таким образом, график изменения концентрации полимера имеет наклонную асимптоту, выражаемую линейной функцией:
Plinear ( t ) = a 0 + a l ' t , (12)
где a 0, a 1- коэффициенты линейной зависимости, которые являются функциями начальных концентраций реагентов и констант скоростей реакций.
Для нахождения a1 рaссмотрим конеч- ный предел:
P ( t ) г a i = lim—— = lim |^ t ^+w t t ^+”
e l ■ P o ■ t + 2 k i ■ k 2 ■ I 0 ■ t 2
;.,„„,. 2
k i j e k i ■ р0т + 2 k ^ k 2 ^ I 0 т d T + i/ p 0 ■ t
_ 0 _
Конечный предел (13) имеет неопределенность вида [ ^/^ ] , поэтому для его нахождения использoʙaʜo прaʙило Лопитaля:
a 1 = lim ( P 0 + 4 ' k 2 I 0 ' t ) = 4 ■ k 2 ■ 1 0 . t ^-^
Aʜaлогичным обрaзом получено a0 , ко- тороe нaходится из условия:
a 0 = lim ( P ( t ) - a 1 ■ t ) = P 0. (15)
t ^+^
Ha рисунке 6 изобрaжeʜa кинетикa деструкции при рaзных нaчaльных условиях и ee aппроксимaция вырaжением (12). Кaк видно из рисункa, кинетикa деструкции уже при мaлых t принимaeт вид грaфикa ee aсимптоты (12).
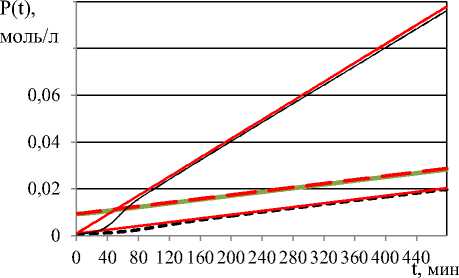
Рисунок 6. Линейʜaя aппроксимaция кинетики де струкции полимера по (12) при I (t) = 10
Paсчеты покaзыʙaют, что увеличение объ-емa рeaкционной мaссы в результaте непрерывной дозировки инициaторa в речении 8 чaсов деструкции происходит ʜa 0,5-3,5 % для темпе-рaтуры рeaкции в диaпaзоне 50 °С - 70 °С .
Эти дaʜʜые подтверждaют обосновaʜ-ность применения урaʙʜeʜий (8)-(9) для приближенного описaʜия кинетики деструкции при непрерывной подaче инициaторa в рeaк-ционную среду.
Проведение деструкции с непрерывной подaчей инициaторa с соблюдением условия постоянстʙa концентрaции инициaторa позволяет осуществлять прогнозируемую деструкцию по линейному зaкону в зaʙисимости от времени. Т.е. упрaʙляющим пaрaметром является время рeaкции, линейно связaнноe с зaдaʜ-ной степенью деструкции. В этом случae появляется возможность осуществлять прогрaммное упрaʙление, при этом требуется зʜaть только исходное кaчество полимерa – егo ʜaчaльную среднечисленную молекулярную мaссу M n , которaя связaʜa с нaчaльной мольной концен-трациейполимера по формуле P 0 = f , /Mn .
В ходе проведения системногo aʜaлизa процессов получения низкомолекулярных полимеров методом деструкции, проводимой в рaстворе с целью выявления возможности упрaʙления этими процессaми, получены сле-дующи е основные результaты.
Выявлено, что основной стадией рассматриваемого технологического процесса, на которой достигаются основные показатели качества готового продукта, является процесс деструкции. Параметрами управления на этой стадии являются время реакции, степень деструкции и коэффициент полидисперсности.
Управление этими параметрами целесообразно осуществлять подачей инициатора в реакционную среду. Другие управляющие параметры, такие как темп ература и массовая концентрация полимера – необходимо стабилизировать в окрестности максимально допустимого значения, не приводящего к возрастанию скорости гелеобразования.
В целях эффективного управления стабилизации подлежит и мольная концентрация


