Системный анализ процессов восстановления оксидов железа в атмосфере водяного газа в присутствии углерода
Автор: Вяткин Герман Платонович, Михайлов Геннадий Георгиевич, Кузнецов Юрий Серафимович, Качурина Ольга Ивановна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 15 (274), 2012 года.
Бесплатный доступ
Рассчитаны параметры равновесий, реализующихся при восстановлении оксидов железа в атмосфере водяного газа (СО-СО 2-Н 2-H 2О) в присутствии углерода. Для графической интерпретации полученных результатов впервые построена пространственная диаграмма, представляющая собой совокупность поверхностей трехфазных равновесий и линий четырехфазных равновесий, точка пересечения которых определяет параметры нонвариантного пятифазного равновесия. Установлены составы водяного газа, равновесного со смесями Fе 3O 4-С, Fе 3O 4-FеO-С, FeO-С, FeO-Fe-С, Fe-С и Fe 3O 4-FeO-Fe-C Предложен метод графического определения возможных составов водяного газа, равновесного с этими смесями.
Оксиды железа, водяной газ, углерод, фазовые равновесия, пространственная диаграмма
Короткий адрес: https://sciup.org/147156721
IDR: 147156721 | УДК: 669.1
Текст научной статьи Системный анализ процессов восстановления оксидов железа в атмосфере водяного газа в присутствии углерода
В работе [1] обсуждались некоторые особенности представления метастабильных параметров равновесия оксидов железа с водяным газом в виде пространственной диаграммы. Метастабильность анализируемых равновесий определяется тем обстоятельством, что при расчетах сознательно игнорировалось присутствие в качестве самостоятельной фазы сажистого углерода, появление которого возможно в результате протекания реакции 2CO = C + CO2 при некоторых концентрациях СО и при температурах выше 955 К. В настоящей статье излагаются результаты расчетов равновесных параметров систем:
Fe 3 O 4 –Fe–СО–СО 2 –Н 2 –Н 2 О–C при температурах ниже 850 К;
Fe 3 O 4 –FeO–СО–СО 2 –Н 2 –Н 2 О–C при температурах выше 850 К;
FeO–Fe–СО–СО 2 –Н 2 –Н 2 О–C при температурах выше 850 К.
Предполагается присутствие в таких системах большого избытка углерода в качестве устойчивой самостоятельной фазы, поэтому образование сажистого углерода не должно сказываться на равновесных параметрах систем.
Сначала определим параметры равновесия водяного газа с углеродом в отсутствии оксидов железа. В этом случае при расчетах параметров равновесного состояния следует учитывать две независимые реакции:
H 2 + CO 2 = H 2 O + CO,
A r G' T (1) = 36 580 - 33,465 T , Дж; (1)
C + CO 2 = 2CO,
A rG°T (2) = 172140-177,7 T , Дж. (2)
Трехкомпонентная двухфазная система СО–СО2– Н2–Н2О–C при фиксированных температуре и давлении имеет одну степень свободы. Расчеты равновесных концентраций газа базируются на трех уравнениях:
x CO x H2O x CO x CO2
K1 = = ; ;(3)
x CO2 x H2 x H2 x H2O
K2 = xO- P ;(4)
x CO2
2 X = XCO + x H2O + x CO2 + x H2 = 1, где xi – молярные доли компонентов газовой фазы;
K1 и K2 – константы равновесия реакций (1) и (2). Такая система трех уравнений с четырьмя неизвестными имеет множество решений. Для получения частного варианта необходимо задаться каким-либо параметром равновесного состояния системы. Наиболее простые расчетные выражения получаются, если задаться концентрацией xCO или суммой концентраций xCO + xCO2 . Например, задавшись величиной xCO , из уравнения (4) рассчиты- ваем xCO2 , xCO + xCO2 и отношение xCO xCO2 . Затем по уравнению (3) вычисляем отношение xH2xH2O. И, наконец, по условию нормировки (5), используя xCO + xCO2 , рассчитываем xH2 и xH2O. Некоторые результаты таких расчетов представлены в табл. 1. Аналогичные расчеты с использованием заданных величин xCO + xCO2 приводят к таким же результатам (табл. 2 и 3).
Таблица 1
Параметры равновесия системы Н 2 –Н 2 О–СО–СО 2 –С при заданных температурах и давлении 1 атм
|
Т = 700 К |
Т = 1000 К |
Т = 1500 К |
||||||||||||
|
x CO |
x CO2 |
x H2O |
x H 2 |
x CO + x H 2 |
x CO |
x CO2 |
x H2O |
x H 2 |
x CO + x H 2 |
x CO |
x CO2 |
x H2O |
x H 2 |
x CO + x H 2 |
|
0,001 |
3,7 ⋅ 10–2 |
0,275 |
0,720 |
0,721 |
0,05 ∗ |
1,28 ⋅ 10–3 |
1,64 ⋅ 10–2 |
0,932 ∗ |
0,982 |
0,05 |
1,3 ⋅ 10–6 |
7,3 ⋅ 10–5 |
0,95 |
1,00 |
|
0,003 |
3,3 ⋅ 10–2 |
0,515 |
0,450 |
0,453 |
0,10 ∗ |
5,12 ⋅ 10–3 |
3,05 ⋅ 10–2 |
0,864 ∗ |
0,964 |
0,10 |
5,1 ⋅ 10–6 |
1,4 ⋅ 10–4 |
0,90 |
1,00 |
|
0,005 |
9,1 ⋅ 10–2 |
0,593 |
0,311 |
0,316 |
0,20 ∗ |
0,0205 |
0,0513 |
0,728 ∗ |
0,928 |
0,20 |
2,0 ⋅ 10–5 |
2,5 ⋅ 10–4 |
0,80 |
1,00 |
|
0,007 |
0,179 |
0,592 |
0,222 |
0,229 |
0,30 ∗ |
0,0461 |
0,0625 |
0,591 ∗ |
0,891 |
0,30 |
4,6 ⋅ 10–5 |
3,2 ⋅ 10–4 |
0,70 |
1,00 |
|
0,010 |
0,366 |
0,495 |
0,130 |
0,140 |
0,40 ∗ |
0,0819 |
0,0639 |
0,454 ∗ |
0,854 |
0,40 |
8,2 ⋅ 10–5 |
3,7 ⋅ 10–4 |
0,60 |
1,00 |
|
0,011 |
0,443 |
0,441 |
0,105 |
0,116 |
0,50** |
0,1281** |
0,0557 |
0,316 ∗ |
0,816 |
0,50 |
1,3 ⋅ 10–4 |
3,8 ⋅ 10–4 |
0,50 |
1,00 |
|
0,012 |
0,527 |
0,379 |
0,083 |
0,095 |
0,60 ∗ |
0,184 |
0,0376 |
0,178 ∗ |
0,778 |
0,60 |
1,9 ⋅ 10–4 |
3,7 ⋅ 10–4 |
0,40 |
1,00 |
|
0,013 |
0,618 |
0,307 |
0,062 |
0,075 |
0,70 ∗ |
0,251 |
0,0097 |
0,0393 ∗ |
0,740 |
0,70 |
2,5 ⋅ 10–4 |
3,2 ⋅ 10–4 |
0,30 |
1,00 |
|
0,014 |
0,717 |
0,227 |
0,042 |
0,056 |
0,72 ∗ |
0,266 |
2,92 ⋅ 10–3 |
0,0115 ∗ |
0,730 |
0,80 |
3,3 ⋅ 10–4 |
2,5 ⋅ 10–4 |
0,20 |
1,00 |
|
0,0164 |
0,9836 |
0 |
0 |
0,0164 |
0,7283 |
0,2717 |
0 |
0 |
0,7283 |
∼ 1 |
∼ 0 |
∼ 0 |
∼ 0 |
∼ 1,00 |
Примечания: * концентрации нанесены на изотерму 1000 К на рис. 1 и 2; ** концентрации использованы для расчетов табл. 2; последняя строка – параметры равновесия системы СО–СО2–С.
Параметры равновесия системы Н 2 –Н 2 О–СО–СО 2 –С при 1000 К
Параметры равновесия системы Н 2 –Н 2 О–СО–СО 2 –С ( x CO + x CO2 = 0,5 )
Таблица 2
|
g = x CO + x CO 2 |
1 |
0,75 |
0,6281 |
0,5 |
0,25 |
|
x CO |
0,728 |
0,5785 |
0,5000 |
0,4127 |
0,2242 |
|
x CO2 |
0,272 |
0,1715 |
0,1281 |
0,0873 |
0,0258 |
|
x H2O |
0 |
0,0423 |
0,0557 |
0,0635 |
0,0549 |
|
x H 2 |
0 |
0,2077 |
0,3162 |
0,4365 |
0,6951 |
Таблица 3
|
Т , К |
700 |
800 |
900 |
1000 |
1093 |
1100 |
1200 |
1300 |
1400 |
|
x CO |
0,0116 |
0,0689 |
0,2299 |
0,4127 |
0,4797 |
0,4819 |
0,4960 |
0,4989 |
0,4997 |
|
x CO2 |
0,4884 |
0,4311 |
0,2701 |
0,0873 |
0,0203 |
0,0181 |
0,0040 |
0,0011 |
3,45 ⋅ 10–4 |
|
x H2O |
0,4076 |
0,2943 |
0,1657 |
0,0635 |
0,0202 |
0,0185 |
0,0057 |
0,0020 |
8,33 ⋅ 10–4 |
|
x H 2 |
0,0924 |
0,2057 |
0,3343 |
0,4365 |
0,4798 |
0,4815 |
0,4943 |
0,4980 |
0,4992 |
|
x CO + x H2 |
0,104 |
0,2746 |
0,5642 |
0,8492 |
0,9595 |
0,9634 |
0,9903 |
0,9969 |
0,9989 |
Параметры равновесий в системе Н 2 –Н 2 О– СО–СО2–С можно представить пространственной диаграммой в координатах Т – x CO – x H 2 (рис. 1). Фигуративные точки на поверхности MLFE определяют возможные составы водяного газа, равновесного с графитом. Образующими этой криволинейной поверхности являются изотермические прямые линии. Линии изотермических сечений поверхности MLFE , которые могут быть представлены проекциями на плоскость x CO – x H 2 , приведены на рис. 2. Для подтверждения линейности изотермических сечений на изотерму 1000 К и на рис. 1, и на рис. 2 нанесены точки, координаты которых представлены в табл. 1–3.
По поводу рис. 2 следует сделать такие замечания. Во-первых, точки на изотермах показывают множество возможных концентрации Н2 и СО, другими словами, координаты точек на изотермах характеризуют возможные сочетания xCO и xH2 в равновесном с графитом водяном газе. Во-вторых, изотермы соединяют точки с координатами xCO = 0, xH2 = 1 с точками, координаты которых определяют xCO - молярную долю СО в равновесном газе в системе СО–СО2–С – линия EF на рис . 1 есть кривая Белла – Будуара, координаты точек которой определяются точками пересечения изотерм с осью абсцисс на рис . 2. Таким образом, при заданной температуре xCO в водяном газе изменяется в пределах от 0 до xCO , тогда как xH2 - в пределах от 0 до 1. В-третьих, концентрации СО2 и Н2О определяются отрезками Af и Ag на рис . 2. Очевидно, что nA + Ag = xH2 + xH2O и mA + Af = xCO + xCO2 . И, наконец, с повышением температуры сумма xH2O+ xCO2 стремится к нулю, а сумма xH2 + xCO – к единице (см. табл. 3), то есть при высоких температурах (выше ~ 1100 К) водяной газ в присутствии графита характеризуется максимальной восстановительной способностью.
При анализе равновесий систем «оксиды железа – водяной газ – графит» следует учитывать, что при заданных давлении и температуре эти системы нонвариантны и состав газовой фазы должен быть строго фиксирован. Например, для определения параметров равновесия пятикомпонентной пятифазной системы Fe3O4-FeO-Fe a -СО-СО 2 -Н 2 -Н 2 О-C при 850 К следует рассчитывать равновесия трех независимых реакций:
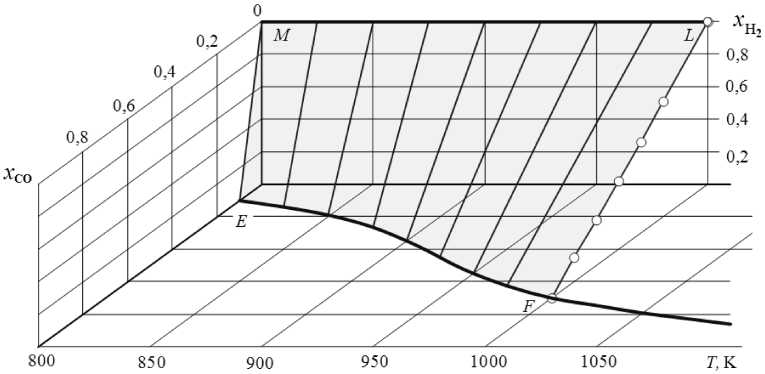
Рис. 1. Параметры равновесия водяного газа с графитом
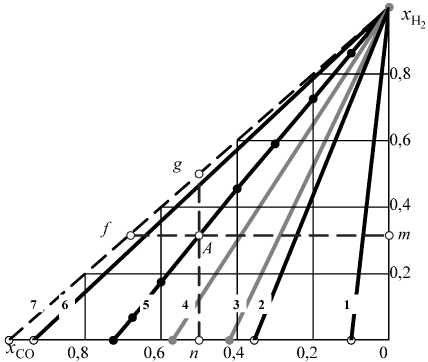
Рис. 2. Возможные концентрации газов-восстановителей в системе Н 2 –Н 2 О–СО–СО 2 –С: 1 – 800, 2 – 900, 3 – 917, 4 – 955, 5 – 1000, 6 – 1100, 7 - выше 1300 К ( x CO + x H 2 = 1 )
Fe3O4 + CO = 3FeO + CO 2 ,
A G T (6) = -10 034 - 38,635 T In T +
+271,78T, Дж;(6)
FeO + H2 = Fea + H2O,
ArGT(7) = 14 799-8,465T, Дж;(7)
C + CO2 = 2CO,
ArGT (2) = 172140 -177,7T, Дж.(2)
Система четырех уравнений с четырьмя неизвестными:
FeO + CO = Fea + CO2,
A r G T (12) = -21 785 + 25 T , Дж, Т < 1185 К; (12) FeO + H2 = Fea +H2O,
A rG°T (13) = 14 799-8,465 T , Дж, Т < 1185 К; (13)
xCO2
K 6 = ; K 7 = xCO
K 2 = x^ P ; S xt = 1
xCO2
имеет единственное решение:
x CO =
K 6 K 2
P
x CO2
K 62 K 2;
P ;
C + CO2 = 2CO,
ArGT (2) = 172140 -177,7T, Дж;(2)
14 Fe3O4 + CO = 3/4 Fea + CO2,
A r G T (14) = -18 844 - 9,66 T In T +
+ 86,695T, Дж;(14)
14Fe 3 O 4 + H 2 = 3/4Fe a + H 2 O,
A r G T (15) = 17 736 - 9,66 T In T +
+ 53,23T, Дж;(15)
C + CO2 = 2CO,
ArGT (2) = 172 140 -177,7T, Дж.(2)
x H 2
P - K 6 K 2 ( K 6 + 1) ,
P ( K 7 + 1)
x H2O =
- P - K 6 K 2 ( K 6 + 1)
7 P ( K 7 + 1)
.
Аналогично для определения параметров равновесия каждой из четырехкомпонентных четырехфазных систем:
Fe 3 O 4 -FeO-CO-CO 2 -H 2 -H 2 O-C при Т > 850 К;
FeO-Fe a -CO-CO2-H2-H2O-C при Т> 850 К;
Fe 3 O 4 -Fe a -CO-CO 2 -H 2 -H 2 O-C при Т < 850 К следует решать систему четырех уравнений, рассчитывая равновесия трех независимых реакций:
Fe3O 4 + CO = 3FeO + CO2,
A rG°T (10) = - 10 034 - 38,635 T In T +
+271,78T, Дж;(10)
Fe3O 4 + H2 = 3FeO + H2O,
A r G T (11) = 26 546 - 38,635 T In T +
+238,315T, Дж;(11)
C + CO2 = 2CO,
ArGT (2) = 172140-177,7T, Дж;(2)
Каждая из этих систем четырех уравнений, как и система (8), имеет единственное решение, определяемое уравнениями, аналогичными уравнениям (9). Результаты расчетов приведены в табл. 4–6 и на рис. 4 и 5. Эти рисунки согласуются с известным графиком, представляющим параметры устойчивости Fe3O4, FeO и Fe в газовой смеси СО–СО2 в присутствии углерода (рис. 3).
Пространственная диаграмма (рис. 4) определяет равновесные параметры устойчивости Fe 3 O 4 , FeO и Fe в атмосфере водяного газа в присутствии углерода. Заметим здесь, что криволинейная поверхность MGLFDCE , на которой лежат политер-мические линии AB , BC , BD и EF , соответствует поверхности MLFE на рис. 1. Для пояснения диаграммы проанализируем график, получающийся при проекции политермических линий AB , BC , BD и EF объемной диаграммы на плоскость x CO – x H 2 (рис. 5). Важнейшими параметрами, определяющими устойчивость Fe3O4, FeO и Fe, являются температура и концентрации в газовой фазе восстановителей x CO и x H 2 . Прямые линии 4–10 на рис. 5 представляют собой изотермы 850…1000 К (аналогичные таковым на рис. 2). Как было сказано в пояснениях к рис. 2, линии-изотермы соеди-
Таблица 4
Параметры равновесия в системе Fe 3 O 4 –FeO–ВГ–С при давлении 1 атм
|
Т , К |
850 |
860 |
870 |
880 |
890 |
900 |
910 |
917 |
|
x CO |
0,0545 |
0,0751 |
0,1029 |
0,1399 |
0,1892 |
0,2543 |
0,3395 |
0,4143 |
|
x CO2 |
0,0588 |
0,0842 |
0,1196 |
0,1689 |
0,2370 |
0,3308 |
0,4580 |
0,5731 |
|
x H 2 |
0,6613 |
0,6109 |
0,5498 |
0,4749 |
0,3826 |
0,2684 |
0,1265 |
0,0077 |
|
x H2O |
0,2254 |
0,2298 |
0,2277 |
0,2163 |
0,1912 |
0,1471 |
0,0760 |
0,0049 |
Примечание. Выше - 917 К (644 °С) в уравнениях (9) второе слагаемое числителей становится больше единицы и решения не имеют физического смысла.
Таблица 5
Параметры равновесия в системе FeO-Fe a -Br-C при давлении 1 атм
|
Т , К |
850 |
870 |
890 |
910 |
920 |
930 |
940 |
950 |
955 |
|
x CO |
0,0545 |
0,0891 |
0,1418 |
0,2217 |
0,2751 |
0,3399 |
0,4179 |
0,5118 |
0,5655 |
|
x CO2 |
0,0588 |
0,0889 |
0,1332 |
0,1951 |
0,2347 |
0,2812 |
0,3356 |
0,3991 |
0,4345 |
|
x H 2 |
0,6613 |
0,6050 |
0,5274 |
0,4192 |
0,3502 |
0,2691 |
0,1739 |
0,0625 |
- 5 - 10-5 |
|
x H2O |
0,2254 |
0,2170 |
0,1976 |
0,1640 |
0,1400 |
0,1098 |
0,0726 |
0,0226 |
- 2 - 10-5 |
Примечание. Выше ~ 955 К в уравнениях (9) второе слагаемое числителей становится больше единицы и решения не имеют физического смысла.
Таблица 6
Параметры равновесия в системе Fe 3 O 4 -Fe a -Br-C при давлении 1 атм
|
Т , К |
850 |
830 |
800 |
750 |
700 |
650 |
600 |
550 |
|
x CO |
0,0545 |
0,0315 |
0,0131 |
0,00261 |
4,17-Ю-4 |
5,0 - 10-5 |
4,32 - 10-6 |
2,4 - 10-7 |
|
x CO2 |
0,0588 |
0,0352 |
0,0152 |
0,00348 |
6,36 - 10-4 |
9,1 - 10-5 |
9,5 - 10-6 |
6,7 - 10-7 |
|
x H 2 |
0,6613 |
0,7048 |
0,7477 |
0,7901 |
0,8204 |
0,8480 |
0,8753 |
0,9019 |
|
x H2O |
0,2254 |
0,2285 |
0,2240 |
0,2038 |
0,1786 |
0,1518 |
0,1247 |
0,0981 |
Примечание. При температурах ниже ~ 700 К концентрации СО и СО 2 исчезающее малы, а концентрация водорода велика.
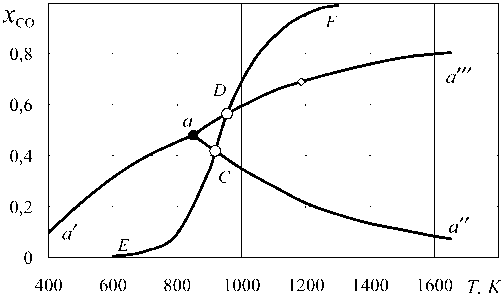
Рис. 3. Параметры равновесия в системе оксиды железа–СО–СО 2 –С: точка С – Т = 917 К, x CO = 0,419, x CO2 = 0,581; точка D – Т = 955 К, x CO = 0,5654, x CO2 = 0,4346
няют точку x CO = 0 и x H 2 = 1 с точками, координаты которых определяются параметрами равновесия реакции газификации углерода. Точки пересечения линий 3 и 4 (изотермы 917 и 955 К) на рис. 5 с осью x CO соответствуют координатам точки C ( x CO = 0,418 и x CO 2 = 0,582) и точки D ( x CO = 0,565 и x CO 2 = 0,435) и на рис. 3, и на рис. 4. Любые другие точки на изотермах определяют параметры устойчивости Fe a , FeO + Fe a , FeO, FeO + Fe3O 4 , Fe 3 O 4 . Как видно (см. рис. 5), эти параметры зависят от температуры.
Это можно показать расчетами, например, для 910 К (табл. 7, линия 7 на рис. 5 и линия GJ на рис. 4). Эта изотерма соединяет точку G с координатами x CO = 0 и x H 2 = 1 и точку J с координатами x CO = 0,385, x CO 2 = 0,615, которая характеризуют равновесие реакции (2) при температуре 910 К. Точка пересечения n изотермы с линией 2 ( BC )
соответствует концентрациям x CO = 0,3395 и x H 2 = 0,1265 в водяном газе, равновесном со смесью FeO + Fe 3 O 4 и графитом (табл. 4). Точка пересечения h изотермы с линией 1 ( BD ) соответствует концентрациям x CO = 0,2217 и x H 2 = 0,4192 в водяном газе, равновесном с FeO + Fe a и графитом (табл. 5). Любая точка на изотерме 910 К при xCO < 0,2217 и x H 2 > 0,4192 определяет параметры устойчивости Fe a ; любая точка при 0,3395 > x CO > 0,2217 и 0,1265 < x H 2 < 0,4192 - параметры устойчивости FeO; при 0,3395 < x CO = 0,3 85 и 0,1265 > x H 2 = 0 -устойчивость Fe 3 O 4 . Концентрации СО 2 и Н 2 О вычисляются по уравнениям:
xC2O xCO2 = ; xH2O = 1 - (xCO + xCO2 + xH2 ).
K 2
Таким образом, впервые представлена поли-термическая пространственная диаграмма фазовых
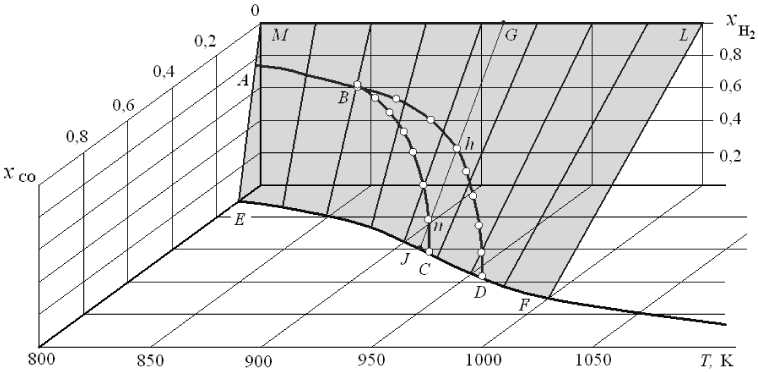
Рис. 4. Параметры равновесий в системах Fe 3 O 4 -FeO-Br-C (линия ВС ), FeO-Fe a -ВГ-С (линия BD ), Fe3O4-Fe a -Br—C (линия АВ ) и СО-СО 2 -С (линия ECDF) при давлении 1 атм

Рис. 5. Концентрации Н 2 и СО в системах
Fe 3 O 4 -FeO-Br-C (линия 2, ВС ), FeO-Fe a -ВГ-С (линия 1, BD ) и Fe 3 O 4 -Fe a -Br-C (линия 3, AB ); изотермы: 4 – 850, 5 – 870, 6 – 900, 7 – 910, 8 – 920,
9 - 940; 10 - 1000, 11 - > 1300 К ( x CO + x H 2 = 1)
Таблица 7
Результаты расчета концентрации восстановителей СО и Н 2 в водяном газе, равновесном с графитом и оксидами железа при 910 К и общем давлении 1 атм
На метастабильной диаграмме фазовых равновесий при восстановлении оксидов железа в атмосфере водяного газа в отсутствии углерода, как это было показано в работах [1, 2], области устойчивости Fe3O4, FeO и железа объемные и границы между областями представляют собой поверхности. В присутствии углерода в качестве самостоятельной фазы пространственные области вырож- даются в поверхность, а границы между ними – в линии.
Следует отметить такую закономерность – устойчивость Fe α , FeO, Fe 3 O 4 в водяном газе в контакте с твердым углеродом возрастает с повышением концентрации водорода при одновременном понижении концентрации монооксида, но при повышении суммарной концентрации этих газов.
Для количественной оценки восстановительных способностей СО и Н 2 , присутствующих в газовой фазе, по рекомендациям автора монографии [3] следует сравнивать количества кислорода, отобранного у оксидов этими восстановителями. Для этого, кроме приведенной в настоящей работе информации, необходимо задавать количественное соотношение восстановителей в исходной газовой смеси СО–Н 2 , так как соотношение восстановительных способностей зависит не только от температуры.
Заключение
-
1. Впервые построены пространственная диаграмма фазовых равновесий, реализующихся при восстановлении оксидов железа в атмосфере водяного газа в присутствии углерода, и их проекции.
-
2. Рассчитаны координаты политермических поверхностей, на которых заданы составы водяного газа, равновесного со смесями твердых фаз: Fe 3 O 4 –С, Fe 3 O 4 –Fe(С)–С, Fe 3 O 4 –FeO–С, FeO–С, FeO–Fe(С)–С и Fe(С)–С.
-
3. Разработанные методики могут быть использованы при анализах фазовых равновесий водяного газа с оксидами других металлов в отсутствии и присутствии углерода.
Список литературы Системный анализ процессов восстановления оксидов железа в атмосфере водяного газа в присутствии углерода
- Системный анализ процессов восстановления оксидов железа в атмосфере водяного газа/Г.П. Вяткин, Г.Г. Михайлов, Ю.С. Кузнецов, О.И. Качурина. -Изв. вузов. Черная металлургия. -2012. -№ 2.
- К термодинамике процессов восстановления оксидов железа в атмосфере водяного газа/Г.П. Вяткин, Г.Г. Михайлов, Ю.С. Кузнецов, О.И. Качурина. -Вестник ЮУрГУ. Серия «Металлургия». -2011. -Вып. 17. -№ 36 (253). -С. 33-38.
- Гольдштейн, Н.Л. Водород в доменном процессе/Н.Л. Гольдштейн. -М: Металлургия, 1971. -208 с.


