Системный канцероматозный лимфангит из невыявленного первичного очага, имитирующий поражение легких при новой коронавирусной инфекции COVID-19 (случай из практики)
Автор: Андрюхова Е.С., Крахмаль Н.В., Таширева Л.А., Вторушин С.В., Завьялова М.В., Перельмутер В.М.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 5 т.22, 2023 года.
Бесплатный доступ
Канцероматозный лимфангит характеризуется распространением опухоли по лимфатическим сосудистым структурам ткани легких с развитием вторичного продуктивного воспаления в интерстициальном компоненте. Клинические симптомы, рентгенологическая и макроскопическая картина канцероматозного лимфангита неспецифичны и практически не отличаются от интерстициальных поражений легких другой этиологии, что вызывает значительные трудности в диагностике и ведении больных с указанной патологией. Цель исследования - демонстрация диагностических трудностей в случае канцероматозного лимфангита с системным поражением внутренних органов из невыявленного первичного очага. Описание клинического случая. Представлено наблюдение канцероматозного лимфангита с системным поражением внутренних органов из невыявленного первичного опухолевого очага, имитирующим поражение легких при COVID-19. Пациент К., 58 лет, проходил лечение в течение 12 койко-дней в стационарах терапевтического профиля с диагнозом: Двусторонняя полисегментарная пневмония; Новая коронавирусная инфекция. Результаты клинико-лабораторных и инструментальных методов исследований были неспецифичны. Несмотря на проводимое лечение, у пациента прогрессировала почечная, дыхательная и сердечно-сосудистая недостаточность, что привело к летальному исходу. Изменения, обнаруженные при патологоанатомическом исследовании, расценены как системный канцероматозный лимфангит из невыявленного первичного опухолевого очага с поражением легких, сердца, печени, поджелудочной железы, селезенки, почек и надпочечников. Канцероматозный лимфангит симулировал интерстициальное поражение легких при новой коронавирусной инфекции COVID-19. Метастатическое поражение сердца имитировало ишемическую болезнь, а массивное метастатическое поражение почек привело к развитию и прогрессированию острой почечной недостаточности, которая, наряду с острой дыхательной и сердечной недостаточностью, послужила причиной смерти.
Канцероматозный лимфангит, новая коронавирусная инфекция, covid-19, поражение легких, лимфогенное метастазирование
Короткий адрес: https://sciup.org/140303539
IDR: 140303539 | УДК: 616.24-006-033.2-091.8+616.98 | DOI: 10.21294/1814-4861-2023-22-5-180-189
Текст научной статьи Системный канцероматозный лимфангит из невыявленного первичного очага, имитирующий поражение легких при новой коронавирусной инфекции COVID-19 (случай из практики)
Анализ гистологических форм новообразований, сопровождающихся диссеминированным опухолевым поражением лимфатических сосудов, показал, что при раке легкого с канцероматозным лимфангитом в доминирующем числе случаев (80 %) диагностируется аденокарцинома [4, 10]. При мелкоклеточном раке легких развитие канцерома-тозного лимфангита наблюдается в 8,8 % случаев [11]. Плоскоклеточная карцинома, являющаяся причиной поражения лимфатических коллекторов легких, чаще имеет локализацию в области головы и шеи [4].
Патогенез канцероматозного лимфангита связывают с первичным гематогенным поражением кровеносных сосудов легкого. За опухолевой эмболией мелких ветвей легочной артерии следует ретроградное лимфогенное распространение вплоть до лимфатических узлов корня легкого. Замещение опухолевой тканью региональных лимфоузлов блокирует отток лимфы, что приводит к повышению давления в лимфатических коллекторах легкого и, в свою очередь, запускает процесс прогрессирования ретроградной лимфогенной диссеминации с присоединением продуктивного интерстициального воспаления в легочной паренхиме [12, 13].
Макроскопическая картина данной патологии не имеет специфических признаков. В ряде случаев в паренхиме обнаруживают появление светлосерых тяжей, которые распространяются от корня легкого до висцеральной плевры. При гистологическом исследовании определяется двустороннее интерстициальное продуктивное воспаление с выраженным фиброзом межальвеолярных перегородок, отмечается перибронхиальный и периваскулярный фиброз. В лимфатических коллекторах легкого разного порядка, располагающихся в межальвеолярных перегородках, вокруг сосудов и бронхов, обнаруживаются опухолевые эмболы. В легочной ткани и в плевре выявляются очаги разрастания опухолевой ткани [14].
Клинические симптомы канцероматозного лимфангита также неспецифичны, к ним относятся нарастающая одышка, непродуктивный кашель, слабость [15]. Средний возраст больных колеблется в диапазоне от 40 до 49 лет [13].
Рентгенологическая картина при канцерома-тозном лимфангите практически не отличается от интерстициальных поражений легких другой этиологии. Более того, на начальных стадиях изменения на рентгенограмме обнаруживаются лишь у 30–50 % больных. Это вызывает значительные трудности в диагностике и ведении больных с канцероматозным лимфангитом [16]. Результаты вентиляционно-перфузионного сканирования легких у больных с канцероматозным лимфангитом зачастую не отличаются от нормальных значений [16]. Продемонстрированы высокая чувствительность (86 %) и специфичность (100 %) ПЭТ/КТ в диагностике канцероматозного лимфангита [17]. В настоящее время методом выбора для подтверждения указанного процесса является торакоскопия или бронхоскопия с биопсией и последующим гистологическим исследованием, однако выполнение этих диагностических манипуляций часто оказывается невозможным ввиду тяжести состояния пациента [1].
Отсутствие специфических клинических и лабораторных изменений при канцероматозном лимфангите, а также двусторонний интерстициальный характер поражения легочной ткани диктуют необходимость дифференциальной диагностики с такими состояниями, как атипичная пневмония, острый респираторный дистресс-синдром, тромбоэмболия легочной артерии, обструктивная болезнь легких, легочная гипертензия, сердечная недостаточность, саркоидоз, идиопатический легочной фиброз, эозинофильная пневмония, васкулиты, радиационный пневмонит, поражение легких лекарственной природы [18]. Прогноз при канцероматозном лимфангите неблагоприятный, 5-летняя выживаемость составляет 33 % [19]. Согласно данным М. Klimek (2019), выживаемость пациентов с канцероматозным лимфангитом составляет 129 дней с момента появления первых легочных симптомов и 20 дней с момента госпитализации [1].
Цель исследования ‒ демонстрация диагностических трудностей в случае канцероматозного лимфангита с системным поражением внутренних органов из невыявленного первичного очага.
Клиническое наблюдение
Представлено клиническое наблюдение кан-цероматозного лимфангита с системным поражением внутренних органов из невыявленного первичного опухолевого очага, имитирующим поражение легких при COVID-19.
Пациент К., 58 лет, провел 5 койко-дней в терапевтическом отделении клиник ФГБОУ ВО «Сибирский государственный медицинский университет» Минздрава России (с 4.01.22 по 8.01.22). Из анамнеза: со слов родственников и согласно записям в медицинской документации, считал себя больным с 25.12.21, когда после вакцинации от COVID-19 появились слабость в ногах и общая слабость. За медицинской помощью обратился по месту жительства, госпитализирован в ОГАУЗ «Шегарская районная больница», где проходил лечение с 29.12.21 по 3.01.22 с диагнозом: Двусторонняя полисегментарная пневмония. Новая коронавирусная инфекция? (от 3.01.22 IgM – положителен, КП=3,0, IgG – отрицателен). Осложнения: Дыхательная недостаточность III степени, сепсис. Получал антибактериальную, инфузионную и кислородотерапию. Несмотря на лечение, во время пребывания в стационаре на фоне нарастающей дыхательной недостаточности развилась острая почечная недостаточность, в связи с чем 3.01.22 пациент переведен в ОГАУЗ «Томская районная больница», где был поставлен диагноз: Острая почечная недостаточность, постренальная, с сохраненным диурезом. Новая коронавирусная инфекция. Стадия элиминации. Осложнения: Двусторонняя полисегментарная пневмония. Сепсис. Дыхательная недостаточность III степени. Продленная ИВЛ от 3.01.22. В Томской районной больнице при рентгенографии органов грудной клетки (4.01.22) в средних и нижних легочных полях и слева в проекции нижней доли визуализировались очаговые сливные тени с нечеткими контурами, смешанной интенсивности, однородной структуры, более интенсивно затемнены нижние отделы справа. Определялись реакция междолевой горизонтальной борозды справа, усиление легочного рисунка за счет сосудистого и интерстициального компонентов. Корни легких структурные с сосудистым компонентом. Заключение: двусторонняя полисегментарная интерстициальная пневмония с преимущественным поражением нижних отделов правого легкого. Минимальный гидроторакс справа. При УЗИ плевральных полостей (4.01.22) выявлен двусторонний гидроторакс (570 мл справа и 320 мл слева). По данным ЭКГ (4.01.22): ритм синусовый, тахикардия. Электрическая ось сердца отклонена влево. Гипертрофия левого желудочка. АВ-блокада I степени. Рубцовые изменения задней стенки левого желудочка. Для уточнения обнаруженных изменений выполнено УЗИ сердца, которое проводилось на фоне тахикардии, апикальный доступ затруднен, визуализация снижена. По данным исследования: камеры сердца не расширены, гипертрофии левого желудочка и патологической регургитации не было, глобальная сократимость левого желудочка соответствовала норме. Определялись гипокинез базальных перегородочных сегментов левого желудочка, уплотнение створок, фиброзного кольца аортального клапана, створок митрального клапана, стенки аорты. Систолическое давление в правом желудочке не повышено, диастолическая функция не оценена, перикард не изменен. По данным УЗИ органов брюшной полости и почек (4.01.22): умеренная гепатомегалия за счет правой доли, диффузные изменения паренхимы печени, поджелудочной железы, холецистолитиаз, признаки хронического холецистита, свободная жидкость в малом тазу в минимальном количестве, выраженные диффузные изменения почек, каликопиелоэктазия с обеих сторон, признаки почечной недостаточности, свободная жидкость в паранефральной области с обеих сторон. Выполнение внутривенной урографии было невозможным из-за высокого уровня креатинина. Общий анализ крови (4.01.22): лейкоцитоз – до 11,34×109/л, лимфопения – 7,9 %, моноцитоз – 83,8 %, увеличение количества базофилов ‒ до 2,2 %, незрелых гранулоцитов – до 1,5 %, снижение уровня эритроцитов – до 3,05×1012/л, гемоглобина – до 99 г/л, гематокрита – до 29,6 %. Биохимический анализ крови (4.01.22): повышение уровня глюкозы – до 10 ммоль/л, АСТ – до 83 U/L, мочевины – до 30,7 ммоль/л, креатинина – до 300 ммоль/л, СРБ – до 147 мг/л; снижение уровня калия – до 3,1 ммоль/л, общего белка – до 48 г/л. Отмечалось повышение фибриногена – до 5,8 г/л, D-димера – до 1558 нг/мл. Проводилось этиотропное, патогенетическое, симптоматическое лечение (кисло-родотерапия при SpO2 ниже 95 %, прон-позиция, антибиотикотерапия и инфузионная терапия).
Несмотря на проводимое лечение, прогрессировала почечная недостаточность, в связи с чем 4.01.22 пациент переведен в ОГБУЗ «Медико-санитарная часть № 2, г. Томска». С учетом того, что при ПЦР в мазках со слизистых оболочек носа РНК SARS-CoV-2 не обнаружено, для продолжения лечения больной переведен в клиники ФГБОУ ВО «Сибирский государственный медицинский университет» Минздрава России. При госпитализации состояние больного средней тяжести, артериальное давление – 140/80 мм рт. ст., частота сердечных сокращений – 108 в 1 мин, частота дыхания – 28 в 1 мин, температура – 36,6 °С.
Сатурация кислородом артериальной крови (SaO2) – 90 % на фоне инсуфляции кислорода 5 л в 1 мин. Уровень сознания расценивался как умеренное оглушение, по Шкале комы Глазго 13 баллов, продуктивному контакту не доступен. Аускульта-тивно дыхание ослаблено по всем полям, хрипы не выслушивались. Тоны сердца приглушены, ритмичные, без шумов и акцентов. При УЗИ плевральных полостей – двусторонний гидроторакс. По данным ЭКГ (5.01.22): резкое отклонение электрической оси сердца влево, синусовая тахикардия, ЧСС 110 в 1 мин, блокада передне-верхней ветви левой ножки пучка Гиса, изменение миокарда предсердий, признаки повышенной нагрузки на оба желудочка, нарушение процессов реполяризации в отведениях V1, AVL, V2, V4-V6, выраженные диффузные изменения миокарда желудочков, рубцовые изменения миокарда в передне-септальной области сердца. Общий анализ крови: лейкоцитоз – до 13,4×109/л, снижение уровня эритроцитов – до 3,4×1012/л, гемоглобина – до 110 г/л, гематокрита – до 33,1 %. Биохимический анализ крови: повышение уровня мочевины – до 33,5 ммоль/л, креатинина – до 239 ммоль/л, глюкозы – до 8 ммоль/л. Коагулограмма: повышение МНО – до 1,55, снижение общего фибриногена – до 1,14 г/л. Уровень прокальцитонина – 1,9 нг/мл (высокая степень риска развития сепсиса определяется при значении более 2 нг/мл). В общем анализе мочи определялись белок, большое количество лейкоцитов, эритроцитов и бактерий. Скорость клубочковой фильтрации (СКФ) по формуле СКD-EPI – 19 мл/мин/1,73 м2 (норма – 80–120 мл/мин/1,73 м2). С учетом полученных данных сформулирован диагноз: Пневмония внебольничная, двусторонняя, полисегментарная, неуточненной этиологии, тяжелое течение. Осложнения: Сепсис. Дыхательная недостаточность I степени. НИВЛ с 3.01.22 по 4.01.22. Острая почечная недостаточность (СКФ от 4.01.2022 по формуле СКD-EPI – 19 мл/мин/1,73 м2.
Несмотря на проводимую посиндромную терапию, состояние больного прогрессивно ухудшалось. При явлениях прогрессирующей почечной и дыхательной недостаточности 7.01.21 произошло снижение артериального давления до 70/40 мм рт. ст. Пациент переведен в отделение анестезиологии и реанимации, где начата аппаратная ИВЛ, однако отмечалось нарастание почечной, дыхательной, сердечно-сосудистой недостаточности, 8.01.22 в 8.50 – остановка сердца. Реанимационные мероприятия в течение 30 мин оказались неэффективными. В 9.20 зафиксирована биологическая смерть.
Заключительный клинический диагноз сформулирован как комбинированный по типу конкурирующих нозологий. Основное заболевание: Пневмония внебольничная, двусторонняя полисегментарная, неуточненной этиологии, тяжелое течение. Двусторонний экссудативный плеврит. Конкурирующее заболевание: Ишемическая болезнь сердца, острый повторный инфаркт миокарда от 8.01.22. Блокада передне-верхней ветви левой ножки пучка Гиса. Хроническая сердечная недостаточность IIA. Фоновое к основному: Новая коронавирусная инфекция от 3.01.22 (IgM+), вирус элиминирован от 5.01.22. Осложнения: Сепсис. Острая почечная недостаточность (СКФ от 4.01.22 по формуле СКD-EPI – 19 мл/мин/1,73 м2). Острая дыхательная недостаточность. Острая сердечно-сосудистая недостаточность. Сердечнолегочная реанимация от 8.01.22.
Основные изменения, обнаруженные на вскрытии: листки плевры тусклые с многочисленными, диффузно расположенными очагами плотной консистенции, диаметром до 5 мм. На разрезах в ткани легких диффузно определялись многочисленные очаги белого цвета с четкими границами, плотной консистенции, диаметром от 1 до 7 мм. В верхних долях легких в прикорневых участках определялись нечетко отграниченные поля, представленные светло-серой плотно-эластичной тканью. В ткани нижних долей легки – многочисленные очаги серовато-желтоватого цвета плотноватой консистенции без четких границ, диаметром до 2 см, в пределах которых альвеолярный рисунок сглажен. В перибронхиальных лимфоузлах – светло-серые плотные очаги. Вблизи правого и левого главных бронхов выявлялись четко отграниченные образования, диаметром до 1,5 см, хрящевидной плотности, дольчатого строения, на разрезе в виде серой атипичной ткани с голубоватым оттенком. Листки перикарда – тусклые с многочисленными, диффузно расположенными очагами светло-серого цвета, плотной консистенции, диаметром до 3 мм. В ткани миокарда левого желудочка, под эпикардом, интрамурально и под эндокардом – многочисленные, нечетко отграниченные очаги, диаметром от 1 до 7 мм. Листки брюшины – тусклые, на париетальном и висцеральном листках, капсуле печени, селезенки, серозной оболочке желчного пузыря, кишечника – многочисленные плотные очаги светло-серого цвета, диаметром до 3 мм. В брыжейке тонкой кишки и в парапанкреати-ческой клетчатке – множественные плотные образования округлой формы, светло-серого цвета, диаметром от 1 до 5 мм. В ткани печени, поджелудочной железы, почек, надпочечников, селезенки – многочисленные плотные образования светло-серого цвета с четкими границами, диаметром от 1 до 8 мм.
При гистологическом исследовании очагов, расположенных в серозных листках и в паренхиме внутренних органов, обнаружена картина низкодифференцированной карциномы с наличием фокусов, имеющих железистоподобный паттерн, и участков плоскоклеточного строения с обширными некрозами опухолевой ткани. Наряду с этим в ткани легких отмечался выраженный периброн-хиальный фиброз и лимфоидная инфильтрация межальвеолярных перегородок, участки дистеле-ктазов, склероз стенок внутриорганных артерий и артериол с лимфоидной инфильтрацией, периваскулярные лимфоидные инфильтраты. В просветах лимфатических сосудов межальвеолярных перегородок, в просветах перибронхиальных и пе-ривазальных лимфатических сосудов определялись опухолевые эмболы с лимфоидной инфильтрацией на периферии. В перибронхиальных лимфоузлах обнаружены метастазы (рис. 1, 2).
На этом фоне в препаратах из нижних долей легких обнаруживалась картина фибринозногнойной пневмонии с абсцедированием. Образования вблизи правого и левого главных бронхов соответствовали хондроидной гамартоме. В миокарде на фоне явлений острого серозного миокардита выявлено разрастание опухолевой ткани с участками плоскоклеточного строения, множественные опухолевые эмболы в просветах лимфатических капилляров. Очаги опухолевой ткани и эмболия в интраорганных лимфатических сосудах и в лимфатических сосудах капсулы обнаружены в ткани печени, поджелудочной железы, надпочечников. В ткани почек очаги опухолевой ткани наблюдались в капиллярных петлях клубочков. Эпителий проксимальных канальцев некротизирован. Базальная мембрана части канальцев разрушена. При патологоанатомическом исследовании первичный опухолевый очаг не обнаружен, кроме того, вызывал сомнение гистотип опухоли, поскольку распространение по лимфатическим капиллярам имитировало в гистологических срезах железистый паттерн.
С целью верификации гистотипа новообразования выполнено иммуногистохимическое исследование. В опухолевой ткани определялись позитивная экспрессия Multi-Cytokeratin (клон AE1/AE3, Leica) и Р63 (клон 7JUL, Leica), негативная экспрессия Cytokeratin 7 (клон OV-TL, Dako), Cytokeratin 20 (клон Ks20.8, Dako), CD 56 (клон 123С3, Dako), Chromogranin А (клон DAK-A3, Dako), Synaptophysin (клон 27G12, Leica) и TTF-1 (клон SPT24, Leica), что соответствовало плоскоклеточной карциноме. Опухоль имела вы-
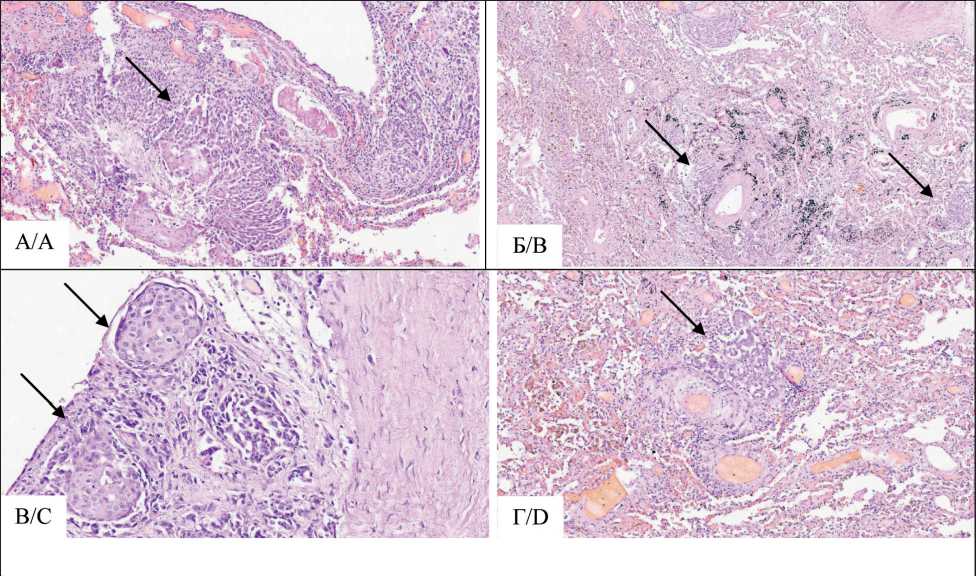
Рис. 1. Микрофото. Гистологические изменения в легочной ткани: А – плоскоклеточный паттерн карциномы в стенке бронха, ×10; Б – фокусы карциномы в легочной ткани, ×2; В – плоскоклеточный паттерн карциномы легкого, ×20; Г – фокусы карциномы в легочной ткани, ×10. Окраска гематоксилином и эозином. Примечание: микрофото выполнено авторами
Fig. 1. Microphoto. Histological changes in the lung tissue. A – squamous cell carcinoma pattern in the bronchial wall, ×10;
B – carcinoma foci in lung tissue, ×2; C – squamous cell pattern of lung carcinoma, ×20; D – carcinoma foci in lung tissue, ×10.
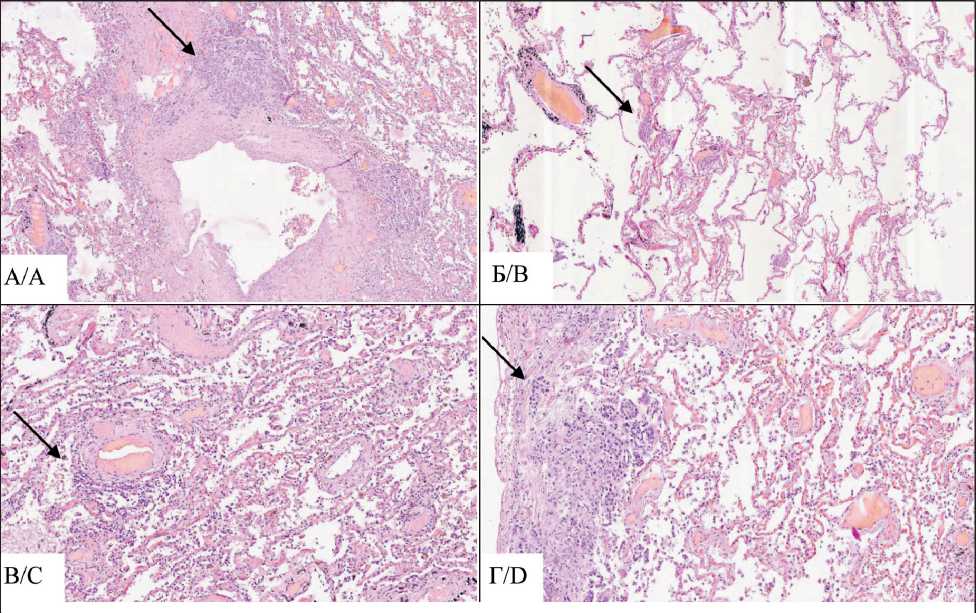
Рис. 2. Микрофото. Гистологические изменения в легочной ткани: А – периваскулярное расположение очагов карциномы в легочной ткани, ×10; Б – мелкие фокусы карциномы в просветах сосудов межальвеолярных перегородок, ×4; В – наличие лимфоидной инфильтрации вокруг сосудов в ткани легких, ×10; Г – фокусы карциномы в плевре, ×5. Окраска гематоксилином и эозином. Примечание: микрофото выполнено авторами
Fig. 2. Microphoto. Histological changes in the lung tissue:
A – perivascular location of carcinoma foci in lung tissue, ×10; B – small foci of carcinoma in the lumen of interalveolar septum vessels, ×4; C – presence of lymphoid infiltration around vessels in lung tissue, ×10; D – carcinoma foci in the pleura, ×5.
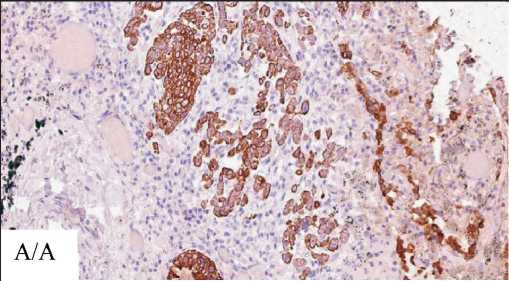
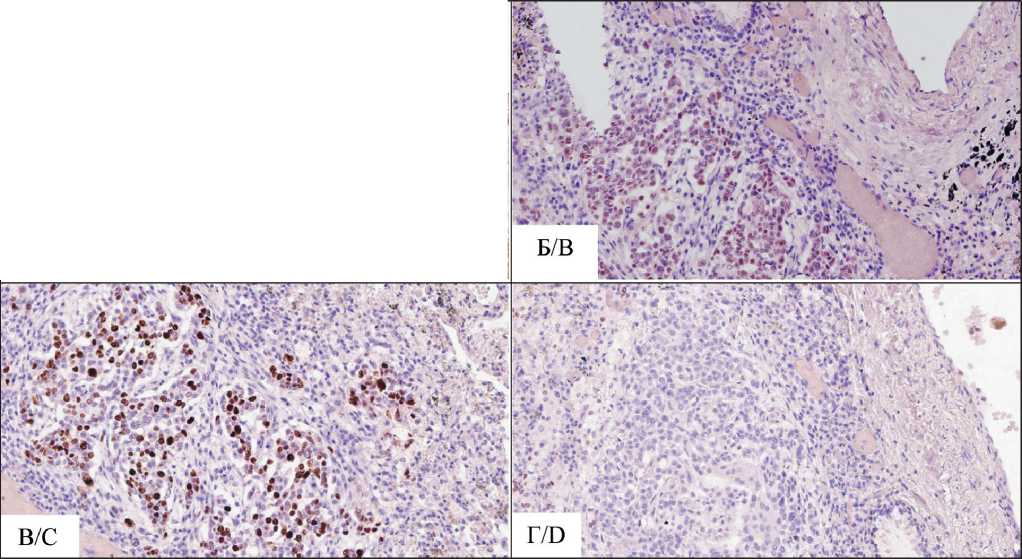
Рис. 3. Иммуногистохимическое исследование. Опухоль легкого: А – позитивная экспрессия Multi-Cytokeratin; Б – позитивная экспрессия р63 в опухолевых клетках; В – позитивная экспрессия Ki67 в опухолевых клетках; Г – отсутствие окрашивания TTF-1 в очагах опухолевой ткани, ×20. Примечание: микрофото выполнено авторами
Fig. 3. Immunohistochemistry, ×20. Lung tumor.
A – positive membrane expression of Multi-Cytokeratin; B – positive nuclear expression of p63 in tumor cells; C – positive nuclear expression of Ki67 in tumor cells; D – negative stain TTF-1 in tumor. Note: created by the authors
сокую пролиферативную активность, экспрессия Ki67 (клон SP6, Cell Marque) – 67 % (рис. 3). Вокруг фокусов опухолевой ткани, располагавщихся в межальвеолярных перегородках, вокруг бронхов и сосудов определялась позитивная экспрессия Podoplanin (клон D2-40, Cell Marque) и отсутствовала экспрессия CD34, что указывает на локализацию опухолевых эмболов в лимфатических сосудах (рис. 4).
Во время аутопсии для бактериологического исследования выполнен забор крови из правых
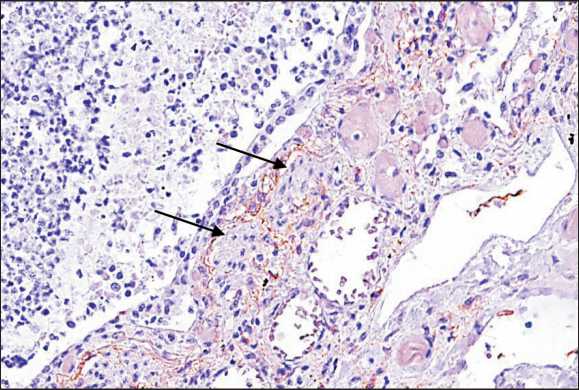
Рис. 4. Иммуногистохимическое исследование: позитивная экспрессия Podoplanin (D2-40, Cell Marque) вокруг очага опухоли, ×40.
Примечание: микрофото выполнено авторами Fig. 4. Immunohistochemistry, ×40. Positive expression of Podo-planin (D2-40, Cell Marque) around the tumor focus.
Note: created by the authors отделов сердца и ткани нижней доли правого легкого. При бактериологическом исследовании крови и ткани легкого обнаружен обильный рост Klebsiella pneumoniae.
Изменения, выявленные при патологоанатомическом исследовании, расценены как системный канцероматозный лимфангит из невыявленного первичного опухолевого очага с поражением легких, сердца, печени, поджелудочной железы, селезенки, почек, надпочечников. Заболевание осложнилось дыхательной, сердечной, почечной недостаточностью, обусловленной массивным опухолевым поражением органов. Полиорганная недостаточность явилась непосредственной причиной смерти.
Заключение
Канцероматозный лимфангит, не имеющий специфических клинических проявлений, способен имитировать интерстициальное поражение легких, в том числе при новой коронавирусной инфекции. В данном случае метастатическое поражение сердца создавало ложное впечатление о наличии изменений в рамках ишемической болезни, а массивное метастатическое поражение почек привело к развитию и прогрессированию острой почечной недостаточности, которая, наряду с острой дыхательной и сердечной недостаточностью, послужила причиной смерти. Обширная диссеминация опухоли путем распространения по лимфатическим коллекторам представляет большой теоретический интерес, открывая воз- можности для изучения механизмов отдаленного лимфогенного метастазирования. Отсутствие первичного опухолевого очага и массивное мета- статическое поражение внутренних органов отражает концепцию о независимости разных форм опухолевой прогрессии.
Список литературы Системный канцероматозный лимфангит из невыявленного первичного очага, имитирующий поражение легких при новой коронавирусной инфекции COVID-19 (случай из практики)
- Klimek M. Pulmonary lymphangitis carcinomatosis: systematic review and meta-analysis of case reports, 1970–2018. Postgrad Med. 2019 Jun; 131(5): 309–18. doi: 10.1080/00325481.2019.1595982.
- Doyle L. Gabriel Andral (1797–1876) and the first reports of lymphangitis carcinomatosa. J R Soc Med. 1989; 82(8): 491–3. doi: 10.1177/014107688908200814.
- Trapnell D.H. Radiological Appearances of Lymphangitis Carcinomatosa of the Lung. Thorax. 1964; 19: 251–60. doi:10.1136/thx.19.3.251.
- Babu S., Satheeshan B., Geetha M., Salih S. A rare presentation of pulmonary lymphangitic carcinomatosis in cancer of lip: case report. World J Surg Oncol. 2011; 9: 77. doi: 10.1186/1477-7819-9-77.
- Yamamoto T., Nakane T., Kimura T., Osaki T. Pulmonary lymphangitic carcinomatosis from an oropharyngeal squamous cell carcinoma: a case report. Oral Oncol. 2000; 36(1): 125–8. doi: 10.1016/s1368-8375-(99)00060-3.
- Tighe D., Cavilla S., Simcock R. Pulmonary lymphangitic carcinomatosis from head and neck squamous cell carcinoma. Int J Oral Maxillofac Surg. 2014; 43(7): 806–10. doi: 10.1016/j.ijom.2013.12.003.
- Iguchi H., Hashimoto K., Sunami K., Yamane H. A case of fatal respiratory failure after surgery for advanced supraglottic laryngeal carcinoma. Acta Otolaryngol Suppl. 2004; (554): 71–3. doi: 10.1080/03655230410018327.
- Zieske L.A., Myers E.N., Brown B.M. Pulmonary lymphangitic carcinomatosis from hypopharyngeal adenosquamous carcinoma. Head Neck Surg. 1988; 10(3): 195–8. doi:10.1002/hed.2890100308.
- Fend F., Gruber U., Fritzsche H., Rothmund J., Breitfellner G., Mikuz G. Occult papillary carcinoma of the thyroid with pulmonary lymphangitic spread diagnosed by lung biopsy. Klin Wochenschr. 1989; 67(13): 687–90. doi: 10.1007/BF01718031.
- Digumarthy S.R., Fischman A.J., Kwek B.H., Aquino S.L. Fluorodeoxyglucose positron emission tomography pattern of pulmonary lymphangitic carcinomatosis. J Comput Assist Tomogr. 2005; 29(3): 346–9. doi: 10.1097/01.rct.0000163952.03192.ef.
- Jiménez-Fonseca P., Carmona-Bayonas A., Font C., Plasencia-Martínez J., Calvo-Temprano D., Otero R., Beato C., Biosca M., Sánchez M., Benegas M., Varona D., Faez L., Antonio M., de la Haba I., Madridano O., Solis M.P., Ramchandani A., Castañón E., Marchena P.J., Martín M., de la Peña F.A., Vicente V.; EPIPHANY study investigators and the Asociación de Investigación de la Enfermedad Tromboembólica de la Región de Murcia. The prognostic impact of additional intrathoracic findings in patients with cancer-related pulmonary embolism. Clin Transl Oncol. 2018; 20(2): 230–42. doi: 10.1007/s12094-017-1713-3.
- Belhassine M., Papakrivopoulou E., Venet C., Mestdagh C., Schroeven M. Gastric adenocarcinoma revealed by atypical pulmonary lymphangitic carcinomatosis. J Gastrointest Oncol. 2018; 9(6): 1207–12. doi: 10.21037/jgo.2018.07.06.
- Bruce D.M., Heys S.D., Eremin O. Lymphangitis carcinomatosa: a literature review. J R Coll Surg Edinb. 1996; 41(1): 7–13.
- Pandey S., Ojha S. Delays in Diagnosis of Pulmonary Lymphangitic Carcinomatosis due to Benign Presentation. Case Rep Oncol Med. 2020. doi: 10.1155/2020/4150924.
- Okayama M., Kanemitsu Y., Oguri T., Asano T., Fukuda S., Ohkubo H., Takemura M., Maeno K., Ito Y., Niimi A. A Rare Case of Isolated Chronic Cough Caused by Pulmonary Lymphangitic Carcinomatosis as a Primary Manifestation of Rectum Carcinoma. Intern Med. 2018; 57(18): 2709–12. doi: 10.2169/internalmedicine.0572-17.
- Charest M., Armanious S. Prognostic implication of the lymphangitic carcinomatosis pattern on perfusion lung scan. Can Assoc Radiol J. 2012; 63(4): 294–303. doi: 10.1016/j.carj.2011.04.004.
- Prakash P., Kalra M.K., Sharma A., Shepard J.A., Digumarthy S.R. FDG PET/CT in assessment of pulmonary lymphangitic carcinomatosis. Am J Roentgenol. 2010; 194(1): 231–6. doi: 10.2214/AJR.09.3059.
- Yahng S.A., Kang H.H., Kim S.K., Lee S.H., Moon H.S., Lee B.Y., Kim H.S., Seo E.J. Erdheim-Chester disease with lung involvement mimicking pulmonary lymphangitic carcinomatosis. Am J Med Sci. 2009; 337(4): 302–4. doi: 10.1097/MAJ.0b013e31818d7a64.
- Im Y., Lee H., Lee H.Y., Baek S.Y., Jeong B.H., Lee K., Kim H., Kwon O.J., Han J., Lee K.S., Ahn M.J., Kim J., Um S.W. Prognosis of pulmonary lymphangitic carcinomatosis in patients with non-small cell lung cancer. Transl Lung Cancer Res. 2021; 10(11): 4130–40. doi: 10.21037/tlcr-21-677.


