Склерозирующая мукоэпидермоидная карцинома щитовидной железы на фоне аутоиммунного тиреоидита
Автор: Рябченко Е.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 4 т.22, 2023 года.
Бесплатный доступ
Актуальность. Склерозирующая мукоэпидермоидная карцинома щитовидной железы (СМКЩЖ) является недавно признанным злокачественным новообразованием щитовидной железы. Впервые о СМКЩЖ сообщили в 1991 г. Этот тип опухоли может развиться в связи с тиреоидитом Хашимото (ТХ). Существуют два варианта мукоэпидермоидной карциномы щитовидной железы - обычный и склерозирующий. СМКЩЖ недавно была признана ВОЗ отдельным заболеванием. Цель исследования - презентация клинического случая: пациентка после оперативного лечения с диагнозом склерозирующая мукоэпидермоидная карцинома щитовидной железы на фоне аутоиммунного тиреодита. Описание клинического случая. Пациентка, 51 года, наблюдалась в течение 2 лет. По результатам лабораторного и инструментального обследования у нее был уставлен диагноз аутоиммунного тиреодита с узлообразованием. У пациентки не было симптомов компрессии шеи. Уровень тиреотропного гормона (ТТГ) составлял 15,8 (диапазон 0,4-4,0), антитела к пероксидазе (АТ-ТПО) - 150 Ме/мл. При сцинтиграфии щитовидной железы выявлен доминирующий холодный узел (1,5×2 см) в правой доле. При контрольном ультразвуковом исследовании шеи отмечена отрицательная динамика, при тонкоигольной аспирационной биопсии получена фолликулярная опухоль на фоне ТХ, что послужило поводом к экстрафасциальной тиреодэктомии. Пациентка находится под динамическим наблюдением в течение 10 мес.
Щитовидная железа, аутоиммунный тиреодит, тонкоигольная аспирационная биопсия, тиреоидэктомия, фолликулярная опухоль
Короткий адрес: https://sciup.org/140302027
IDR: 140302027 | УДК: 616.441-006.6+616.441-002 | DOI: 10.21294/1814-4861-2023-22-4-154-158
Текст научной статьи Склерозирующая мукоэпидермоидная карцинома щитовидной железы на фоне аутоиммунного тиреоидита
В литературе сообщается примерно о 40 случаях склерозирующей мукоэпидермоидной карциномы щитовидной железы (СМКЩЖ), которую следует дифференцировать от обычной мукоэпидермоидной карциномы. Обычная мукоэпидермоидная карцинома щитовидной железы (ЩЖ) впервые описана R.M. Rhatigan et al. в 1977 г. [1]. Склерозирующая мукоэпидермоидная карцинома щитовидной железы отличается от обычной мукоэпидермоидной карциномы ЩЖ [2] и впервые была описана J.K. Chan et al. [3] как злокачественное новообразование ЩЖ низкой степени злокачественности на фоне ТХ. Экспрессия p63 предполагает наличие солидного клеточного гнезда по сравнению с фолликулярным клеточным происхождением [4]. Большинство из описанных в литературе случаев СМКЩЖ были выявлены у больных женского пола [5, 6]. Только в 4 из 40 зарегистрированных наблюдений пациенты с СМКЩЖ были мужского пола.
Цель исследования – демонстрация клинического случая пациентки после оперативного лечения с диагнозом СМКЩЖ на фоне аутоиммунного тиреодита.
Описание клинического случая
51-летняя женщина в течение 2 лет наблюдалась по поводу аутоиммунного тиреодита с узлообразованием. На протяжении всего периода наблюдения выполнялось УЗИ шеи и лимфатических узлов. За год до операции по данным УЗИ выявлено, что щитовидная железа не увеличена, ее размеры: перешеек – 3 мм, правая доля – 42×14×13 мм (объем – 3,8 см3), левая доля – 42×12×13 мм (объем – 3,2 см3). Контуры железы четкие, неровные. Структура железы диффузно неоднородна за счет гиперэхогенных тяжей и множественных гипо- и гиперэхогенных участков различной формы и размеров, без четких контуров и границ, имитирующих множественные гипоэхогенные узлы справа по верхнему краю доли, размерами 9×5 мм. Регионарные лимфатические узлы не увеличены. Заключение: диффузные изменения щитовидной железы по типу АИТ, узловая форма TIRADS-II. Биопсия не выполнялась. При контрольном ультразвуковом исследовании шеи отмечена отрицательная динамика, при тонкоигольной аспирационной биопсии узла ЩЖ – фолликулярная опухоль на фоне ТХ. Выполнена непрямая ларингоскопия для определения подвижности голосовых связок. У пациентки не было признаков компрессии органов шеи. Уровень тиреотропного гормона (ТТГ) –
15,8 (диапазон 0,4–4,0), антитела к пероксидазе (АТ-ТПО) – 150 Ме/мл. При сцинтиграфии ЩЖ в правой доле выявлен доминирующий холодный узел, размерами 1,5×2 см.
Выполнена экстрафасциальная тиреоидэктомия. Лимфодиссекция шеи не выполнялась, поскольку не было клинического подтверждения и признаков поражения лимфатических узлов. Все 4 паращитовидные железы идентифицированы и сохранены. На операции определялась экстрати-реоидная инвазия. Размер узла – 1,2×1,8×1,5 см.
По данным ИГХ-исследования операционного препарата: PanCk-положительная экспрессия в железистом компоненте. TTF-положительная экспрессия в опухолевых клетках. Calcitonin-отрицательная экспрессия, p63-положительная экспрессия в эпидермальных клетках. Заключение: иммунофенотип интратиреоидного склерозирующего мукоэпидермального рака pT3a,ICD-O Code-8430/3. При гистологическом исследовании выявлено инфильтрирующее новообразование на фоне густо склерозированной стромы и беспорядочно разбросанных гнезд относительно однородных многоугольных клеток с эозинофильной цитоплазмой, проявляющих легкую или умеренную ядерную атипию. Присутствовали очаги плоскоклеточной дифференцировки, а также столбчатые клетки с апикальным муцином. В строме обнаружены многочисленные эозинофилы. Пулы муцина были выделены специальным красителем PAS-Alcian blue. Опухолевые гнезда продемонстрировали положительную реакцию на иммуногистохимические окрашивания CK 5/6 и TTF-1. Заключение: низкодифференцированная опухоль без лимфоваскулярной или периневральной инвазии. Стромальный воспалительный инфильтрат содержал эозинофилы, плазматические клетки и лимфоциты. В прилегающей ткани щитовидной железы – хронический воспалительный инфильтрат, состоящий преимущественно из эозинофилов наряду с плазматическими клетками и лимфоцитами (рис. 1–3).
При контрольной компьютерной томографии головы, шеи и грудной клетки через 2 мес после операции не выявлено рецидива заболевания в ложе ЩЖ, а также каких-либо изменений в легких и лимфоузлах шеи. При динамическом наблюдении в течение 10 мес после операции не отмечено признаков рецидива заболевания.
Обсуждение
Склерозирующая мукоэпидермоидная карцинома ЩЖ является новообразованием низкой сте-
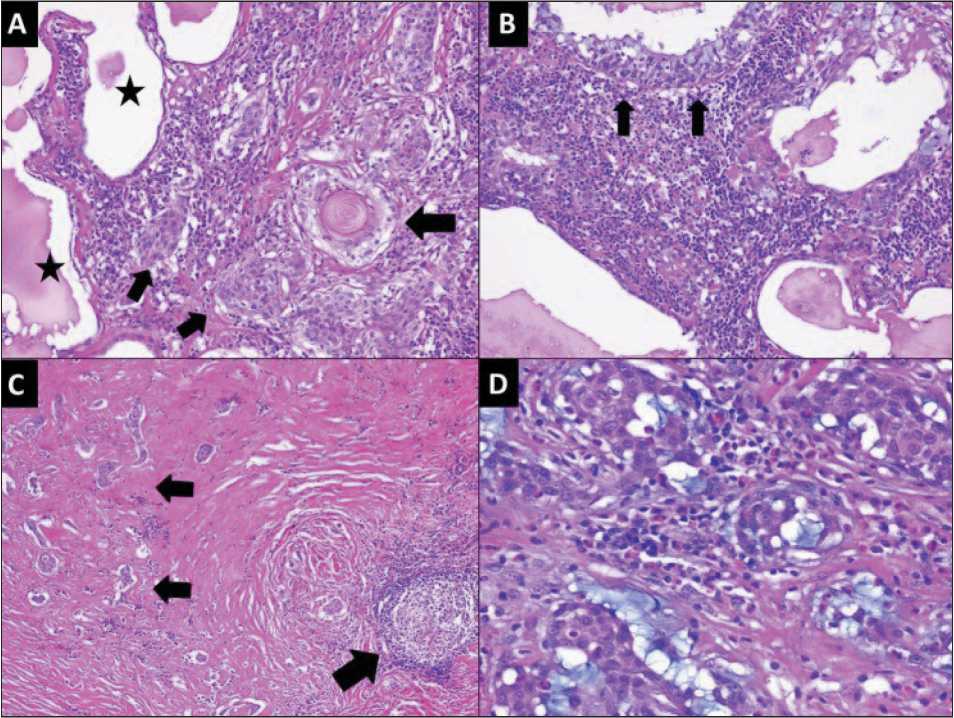
Рис 1. Микрофото. А – опухоль, демонстрирующая комбинацию плоскоклеточных клеток (большая стрелка), промежуточных клеток (маленькие стрелки) и кистозных пространств (звездочки); B – кистозные пространства, выстланные муцинозными клетками (стрелки); C – небольшие гнезда опухолевых клеток (маленькие стрелки) были видны на фоне склеротической стромы. Также был виден лимфоидный фолликул (большая стрелка); D – промежуточная строма между опухолевыми клетками показала богатый эозинофилами воспалительный инфильтрат.
Окраска гематоксилином и эозином, ×400
Fig. 1. Microphoto. A – tumor exhibiting combination of squamoid cells (large arrow), intermediate cells (small arrows) and cystic spaces (stars); B – сystic spaces lined by mucinous cells (arrows);
C– small nests of tumor cells (small arrows) were seen against sclerotic background stroma. A lymphoid follicle was also seen (large arrow); D – intervening stroma between tumor cells showed eosinophil rich inflammatory infiltrate. Hematoxylin and eosin staining, ×400
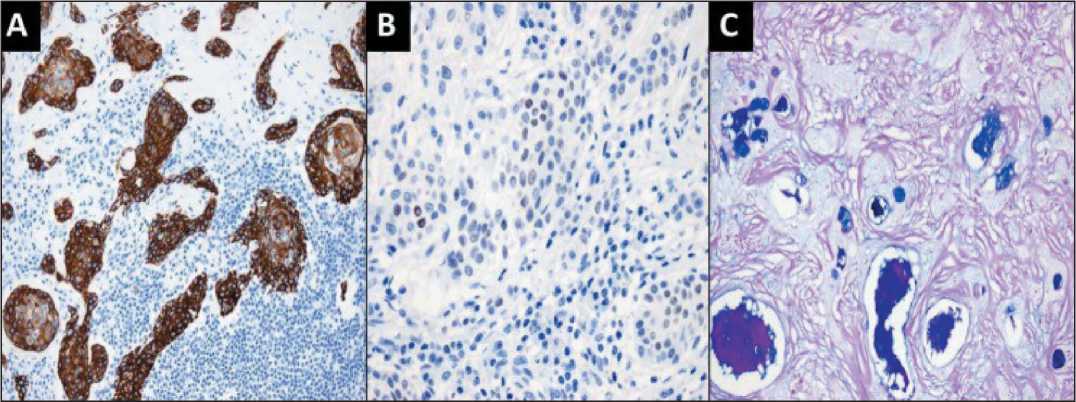
Рис. 2. Микрофото. Опухолевые клетки с цитоплазматическим и мембранозным окрашиваним: А – цитокератин 5/6 и ядерное окрашивание; B – иммуногистохимические окрашивания TTF-1; C – периодическое специальное окрашивание кислотно-Шифф-альциановым синим выделяет внутрипросветной и интрацитоплазматический муцин, ×200
Fig. 2. Microphoto. Tumor cells exhibited cytoplasmic and membranous staining for (A) cytokeratin 5/6 and nuclear staining for (B) TTF-1 immunohistochemical stains. (C) Periodic acid-Schiff-alcian Blue special stain highlights intraluminal and intracytoplasmic mucin, ×200
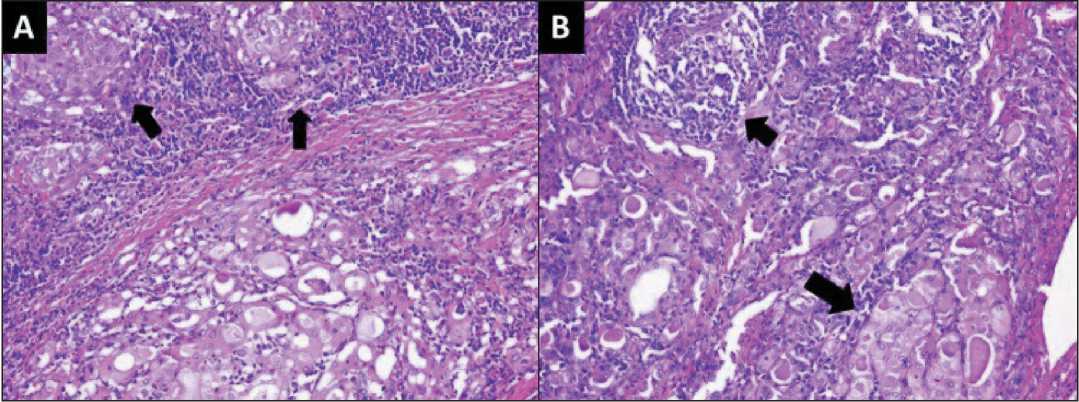
Рис. 3. Микрофото. А – граница раздела опухолевых гнезд (стрелки) с прилегающей тканью щитовидной железы; Б – в прилегающей ткани щитовидной железы наблюдались заметные изменения клеток Гюртле (большая стрелка) и скопления лимфоидных клеток (короткая стрелка). Окраска гематоксилином и эозином, ×200
Fig. 3. Microphoto. A) Interface of tumor nests (arrows) with adjacent thyroid tissue. B) Adjacent thyroid tissue exhibited prominent Hurthle cell change (large arrow) and lymphoid aggregate (short arrow).
Hematoxylin and eosin staining, ×200
пени злокачественности. Недавно ВОЗ признала СМКЩЖ отдельным заболеванием щитовидной железы [6, 7]. Большинство зарегистрированных случаев имеет благоприятный прогноз, с длительным сроком выживания (до 12 лет) после операции. Однако зарегистрировано 7 случаев агрессивного течения СМКЩЖ с ранней смертностью. Большинство пациентов жалуются на медленно развивающуюся безболезненную припухлость в передней части шеи. Средний возраст больных составляет 55,2 года [5, 8, 9]. В литературе сообщается о случаях СМКЩЖ с развитием отдаленных метастазов, при этом наиболее часто поражаются легкие, затем кости и печень [5].
Гистологически обычная мукоэпидермоидная карцинома сходна с СМКЩЖ, обе опухоли имеют более крупные слои эпидермоидных клеток, очевидные кистозные пространства и отсутствие сосудистой инвазии [9–13]. Также СМКЩЖ следует дифференцировать от первичной плоскоклеточной карциномы ЩЖ, которая встречается очень редко. Плоскоклеточный рак характеризуется выражен- ной атипией и частым митозом, а также отсутствием склероза и эозинофилии. СМКЩЖ также может имитировать склерозирующую болезнь Ходжкина, в этом случае дифференцировать от лимфомы позволяют отсутствие клеток Рида–Штернберга и отсутствие положительности CD15, CD30 и CD45 [5, 14, 15].
Список литературы Склерозирующая мукоэпидермоидная карцинома щитовидной железы на фоне аутоиммунного тиреоидита
- Rhatigan R.M., Roque J.L., Bucher R.L. Mucoepidermoid carcinoma of the thyroid gland. Cancer. 1977; 39(1): 210–4. doi: 10.1002/1097-0142- (197701)39:1<210::aid-cncr2820390133-3.0.co;2-h.
- Sim S.J., Ro J.Y., Ordonez N.G., Cleary K.R., Ayala A.G. Sclerosing mucoepidermoid carcinoma with eosinophilia of the thyroid: report of two patients, one with distant metastasis, and review of the literature. Hum Pathol. 1997; 28(9): 1091–6. doi: 10.1016/s0046-8177(97)90064-2.
- Chan J.K., Albores-Saavedra J., Battifora H., Carcangiu M.L., Rosai J. Sclerosing mucoepidermoid thyroid carcinoma with eosinophilia. A distinctive low-grade malignancy arising from the metaplastic follicles of Hashimoto’s thyroiditis. Am J Surg Pathol. 1991; 15(5): 438–48.
- Hunt J.L., LiVolsi V.A., Barnes E.L. p63 expression in sclerosing mucoepidermoid carcinomas with eosinophilia arising in the thyroid. Mod Pathol 2004; 17: 526–9. doi: 10.1038/modpathol.3800021.
- Lai C.Y., Chao T.C., Lin J.D., Hsueh C. Sclerosing mucoepidermoid carcinoma with eosinophilia of thyroid gland in a male patient: a case report and literature review. Int J Clin Exp Pathol. 2015; 8(5): 5947–51.
- Requena M., Percovich J.C., Sambo M.E., Andía V.M. Conservative Management of Sclerosing Mucoepidermoid Carcinoma with Eosinophilia of the Thyroid Gland: 12 Years Follow-Up after an Atypical Initial Therapy. Adv Diabetes Endocrinol 2017; 2(1): 2.
- Pantola C., Kala S., Athar M., Thakur S. Sclerosing mucoepidermoid carcinoma with eosinophilia of the thyroid: A cytological dilemma. J Cytol. 2016; 33(1): 37–9. doi: 10.4103/0970-9371.175511.
- Ames E., Campbell M.J., Afify A., Krane J.F., Huang E.C. Sclerosing mucoepidermoid carcinoma with eosinophilia: Cytologic characterization of a rare distinct entity in the thyroid. Diagn Cytopathol. 2018; 46(7): 632–5. doi: 10.1002/dc.23914.
- Shehadeh N.J., Vernick J., Lonardo F., Madan Sh.K., Jacobs J.R., Yoo G.H., Kim H.E., Ensley J.F. Sclerosing mucoepidermoid carcinoma with eosinophilia of the thyroid: a case report and review of the literature. Am J Otolaryngol 2004; 25(1): 48–53. doi: 10.1016/S0196-0709-(03)00096-6.
- Sang-wook Son, Kye-ho Lee, Jai Hyuen Lee, Na-Hye Myong, Dong-soo Yoo. Mucoepidermoid Carcinoma with Distant Metastases to the Kidney, Adrenal Gland, Skull and Gluteus Maximus Muscle: a Case Report. Investig Magn Reson Imaging. 2016; 20(1): 66–70. doi: 10.13104/imri.2016.20.1.66.
- Toper M.H., Sarioglu S. Molecular Pathology of Salivary Gland Neoplasms: Diagnostic, Prognostic, and Predictive Perspective. Adv Anat Pathol. 2021; 28(2): 81–93. doi: 10.1097/PAP.0000000000000291.
- Healey W.V., Perzin K.H., Smith L. Mucoepidermoid carcinoma of salivary gland origin. Classification, clinical-pathologic correlation, and results of treatment. Cancer. 1970; 26(2): 368–88. doi: 10.1002/1097-0142(197008)26:2<368::aid-cncr2820260219-3.0.co;2-k.
- Shafique K., Zhang P.J., Montone K.T., Song S., Livolsi V.A., Baloch Z. Pathologic grading of mucoepidermoid carcinomas of the salivary gland and its effect on clinicopathologic follow-up: an institutional experience. Hum Pathol. 2020; 98: 89–97. doi: 10.1016/j.humpath.2020.02.001.
- Hong D.S., Fakih M.G., Strickler J.H., Desai J., Durm G.A., Shapiro G.I., Falchook G.S., Price T.J., Sacher A., Denlinger C.S., Bang Y.J., Dy G.K., Krauss J.C., Kuboki Y., Kuo J.C., Coveler A.L., Park K., Kim T.W., Barlesi F., Munster P.N., Ramalingam S.S., Burns T.F., Meric-Bernstam F., Henary H., Ngang J., Ngarmchamnanrith G., Kim J., Houk B.E., Canon J., Lipford J.R., Friberg G., Lito P., Govindan R., Li B.T. KRASG12C Inhibition with Sotorasib in Advanced Solid Tumors. N Engl J Med. 2020; 383(13): 1207–17. doi: 10.1056/NEJMoa1917239.
- Loong H.H., Du N., Cheng C., Lin H., Guo J., Lin G., Li M., Jiang T., Shi Z., Cui Y., Jin X., Yao J., Xing Y., Yao M., Wang K., Mok T.S.K., Liu L. KRAS G12C mutations in Asia: a landscape analysis of 11,951 Chinese tumor samples. Transl Lung Cancer Res. 2020; 9(5): 1759–69. doi: 10.21037/tlcr-20-455.


