Сложности диагностики тромбоэмболии легочной артерии в клинической практике
Автор: Макарова Н.В., Бусалаева Е.И., Туйзарова И.А., Визе-хрипунова М.А.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Клиническая медицина
Статья в выпуске: 3, 2022 года.
Бесплатный доступ
Тромботическое поражение венозного русла нижних конечностей, прежде всего глубоких вен, представляет собой острое состояние, которое развивается в результате комплексного действия ряда факторов. При этом непосредственная угроза жизни больного связана с развитием острой тромбоэмболии легочной артерии (ТЭЛА). Широкий спектр симптомов, наслаивающихся на проявления основного заболевания, обусловливает тяжесть состояния пациента, затрудняет своевременную диагностику и лечение, способствует неблагоприятному прогнозу и высокой смертности. В связи с этим относительный риск развития ТЭЛА необходимо оценивать у всех пациентов независимо от возраста. В статье приводятся данные об эпидемиологии, факторах риска, особенностях течения и методах диагностики тромбоэмболических осложнений в реальной клинической практике. Описан клинический случай внебольничной пневмонии у молодого мужчины с малосимптомным тромбозом глубоких вен нижних конечностей и развитием множественной ТЭЛА. Это сочетание определило тяжесть его состояния, трудности прижизненной диагностики сопутствующей патологии и неблагоприятный прогноз. Диагноз был подтвержден при аутопсии выявлением тромбов разной степени зрелости в сосудистом русле легких.
Тромбоэмболия легочной артерии (тэла), внебольничная пневмония, венозная тромбоэмболия, факторы риска
Короткий адрес: https://sciup.org/14124912
IDR: 14124912 | УДК: 616.131-005.7 | DOI: 10.34014/2227-1848-2022-3-35-42
Текст научной статьи Сложности диагностики тромбоэмболии легочной артерии в клинической практике
Введение. Тромбоэмболия легочной артерии (ТЭЛА) – одно из самых драматически протекающих острых сосудистых заболеваний человека, часто имеющее летальный исход. Это грозное осложнение может быть результатом целого ряда патологических состояний и заболеваний, затрагивающих профессиональную сферу деятельности врача любой специальности [1–4]. Широкий спектр симптомов, которые наслаиваются на проявления основного заболевания, обусловливает тяжесть состояния пациента, затрудняет своевременную диагностику и лечение, способствует неблагоприятному прогнозу и высокой смертности [5–7].
Данные по заболеваемости и смертности при ТЭЛА до настоящего времени нуждаются в уточнении, поскольку большое число случаев данной патологии остается клинически нераспознанным и выявляется лишь при аутопсии. По данным литературы, распространенность ТЭЛА колеблется от 23 до 220 случаев на 100 тыс. населения в год. Смертность от ТЭЛА в общей популяции составляет 2,1–6,2 %. При обычных патологоанатомических вскрытиях ТЭЛА выявляют в 4–33 % случаев всех аутопсий, а в старших возрастных группах этот показатель увеличивается до 60 %. Проведение целенаправленного анализа результатов аутопсий свидетельствует о том, что в 50–80 % случаев ТЭЛА клинически не диагностировалась, а в ряде случаев данная патология включалась лишь как предположительный диагноз. Даже массивная легочная эмболия прижизненно диагностируется только в 40–70 % случаев [1–4].
В настоящее время ТЭЛА, тромбоз глубоких и подкожных вен относят к венозным тромбоэмболическим осложнениям (ВТЭО), которые обусловливают высокую смертность и становятся важнейшей проблемой клинической медицины. По данным официальной статистики Минздрава России, в стране ежегодно выявляется около 80 000 новых случаев тромботических поражений венозного русла нижних конечностей, прежде всего глубоких вен. Легочная эмболия регистрируется ежегодно с частотой 35–40 случаев на 100 тыс. населения. При этом непосредственная угроза жизни больного связана не с собственно тромботическим поражением венозного русла, а с развитием ТЭЛА. В течение месяца после выявления тромбоза глубоких вен от легочной эмболии умирают до 6 % пациентов [1, 2, 8, 9].
До середины 90-х гг. XX в. большинство исследований по данной проблеме было сосредоточено на пациентах хирургического профиля в связи с высоким уровнем распространения среди них венозных тромбоэмболий (ВТЭ). Как следствие, получило признание представление о необходимости профилактики ВТЭ именно у хирургических пациентов. Однако целенаправленные эпидемиологические исследования последующих лет показали, что риск развития ВТЭ и ТЭЛА у пациентов с другими заболеваниями аналогичен таковому у хирургических больных. Более чем у половины больных с симптоматическими ВТЭ была установлена терапевтическая, а не хирургическая патология [1, 2].
В рекомендациях ESC по диагностике и лечению острой легочной эмболии, разработанных в сотрудничестве с Европейским респираторным обществом в 2019 г., подчеркивается существование большого числа внешних и внутренних факторов риска (ФР), наличие которых повышает вероятность, или относительный шанс (ОШ), развития ВТЭ. Считается, что ВТЭ является следствием взаимодействия между постоянными ФР, связанными с пациентами, и временными ФР, обусловленными конкретной клинической ситуацией. Их выявление и категоризация имеют большое значение для оценки предрасположенности к заболеванию, определения его прогноза и риска рецидива, а следовательно, являются определяющими при принятии решения о проведении и/или продлении антикоагулянтной терапии [1, 2, 8, 9].
Среди постоянных ФР отмечаются генетически обусловленные нарушения гемостаза, предрасполагающие к развитию ВТЭО. Своевременное выявление генетически обусловленных нарушений свертывающей и противосвертывающей систем крови, а также повышенной склонности к тромбозу сосудов позволяет выделить группу риска по развитию ТЭЛА и повысить эффективность профилактических мероприятий у предрасположенных лиц [1, 2, 8, 9].
В целом ВТЭ могут рассматриваться как часть кардиоваскулярного континуума, имеющая общие для сосудистых заболеваний ФР, такие как табакокурение, ожирение, гиперхолестеринемия, гипертония и сахарный диабет [1, 2, 8]. Особое место в прогнозе ВТЭО занимают варикозная болезнь и тяжелые наследственные тромбофилии. Распространенными триггерами развития ВТЭ являются инфекции, особенно пневмония и инфекции мочевыводящих путей [1, 2, 8].
Согласно рекомендациям ESC (2019) клиническая вероятность ВТЭО у конкретного пациента определяется по трёхуровневой системе: низкий риск (ОШ 0–3), промежуточный риск (ОШ 4–10), высокий риск (ОШ≥11). Возможно применение двухуровневой шкалы определения риска ТЭЛА: 0–5 – маловероятна, ≥6 – вероятна.
В настоящее время для оценки клинической вероятности ТЭЛА используются канадская шкала (Wells et al., 2000) и пересмотренная женевская шкала (Le Gal G. et al., 2006), включенные в международные стандарты обследования и лечения ТЭЛА. Шкала Wells включает 7 показателей (клинические признаки тромбоза глубоких вен, тромбоз глубоких вен или ТЭЛА в анамнезе, хирургия или иммобилизация в последние 4 нед., тахикардия 100 уд./мин и более, кровохарканье, злокачественная опухоль в активной стадии, альтернативный диагноз менее вероятен). Клиническую вероятность ТЭЛА можно оценить как низкую при значении суммарного показателя по шкале Wells 0–1 балл, промежуточную – от 2 до 6 баллов, высокую – 7 баллов и более [1, 2].
Шкала Geneva состоит из 8 показателей (тромбоз глубоких вен или ТЭЛА в анамнезе, частота сердечных сокращений более 75 уд./мин, хирургия или перелом в течение последнего месяца, кровохарканье, злокачественная опухоль в активной стадии, односторонняя боль в конечности, боль в ноге при пальпации или односторонний отек, возраст старше 65 лет). По шкале Geneva вероятность ТЭЛА при суммарном балле 3 и менее рассматривают как низкую, от 4 до 10 баллов – промежуточную, более 11 баллов – высокую [1, 2, 5].
Все вышеизложенное определяет важность целенаправленного поиска и прижизненной диагностики ВТЭО, оценки вероятности ТЭЛА и ее профилактики в группах риска, повышения качества диагностики и лечения данных состояний при их развитии.
В качестве иллюстрации приводим собственное наблюдение.
Пациент М., 27 лет. Госпитализирован с жалобами на покашливание со скудной мок- ротой слизисто-гнойного характера, повышение температуры до 38 °С, одышку смешанного характера при ходьбе, общую слабость, снижение аппетита.
Работает программистом и много времени проводит сидя за компьютером. Курит в течение 10 лет около одной пачки сигарет в день.
Из анамнеза. Считает себя больным около недели, когда без видимой причины появились и постепенно стали нарастать кашель со скудной мокротой, одышка и слабость. Обратился к участковому терапевту, который при аускультации легких выслушал жесткое дыхание, несколько ослабленное в нижних отделах слева, число дыхательных движений (ЧДД) в покое – 17 в мин. Тоны сердца ясные, ритм правильный, число сердечных сокращений (ЧСС) – 78 уд./мин. Артериальное давление (АД) – 120/80 мм рт. ст. Со стороны других органов и систем – без особенностей.
Данные общего анализа крови представлены в табл. 1.
Таблица 1
Table 1
Динамика общего анализа крови пациента М.
Blood test dynamics of patient M.
|
Дата Date |
Эр, ×1012/л RBC, ×1012/l |
Hb, г/л Hb, g/l |
Тр, х10 9 /л Th, x10 9 /l |
СОЭ*, мм/ч ESR, mm/h |
Л, Х10 9 /Л WBC, Х10 9 /1 |
С/я, % Sn/n, % |
П/я, % S/n, % |
Лф, % Lph, % |
М, % M, % |
|
1.07 |
4,77 |
146 |
189 |
38 |
11,9 |
69 |
4 |
21 |
6 |
|
2.07 |
5,1 |
142 |
192 |
24 |
11,2 |
59 |
3 |
17 |
13 |
|
3.07 |
4,77 |
145 |
190 |
33 |
10,4 |
67 |
3 |
22 |
7 |
|
4.07 |
4,2 |
125 |
134 |
25 |
6,6 |
71 |
1 |
23 |
3 |
Примечание. Эр – эритроциты, Hb – гемоглобин, Тр – тромбоциты, Л – лейкоциты, С/я – сегментоядерные нейтрофилы, П/я – палочкоядерные нейтрофилы, Лф – лимфоциты, М – моноциты. * – скорость оседания эритроцитов по Панченкову.
Note. RBC – red blood cells, Hb-hemoglobin, Th – thrombocytes, WBC – white blood cells, Sn/n – segmentonuclear neutrophils, S/n – stab neutrophils, Lph –lymphocytes, M – monocytes. * – erythrocyte sedimentation rate according to Panchenkov.
При рентгенологическом исследовании (рис. 1) в прямой и левой боковой проекциях в нижней доле левого легкого определяется диффузное усиление легочного рисунка, на уровне сегментов S8-9 – участок инфильтрации неоднородной структуры с неровными контурами. Корни структурны, тяжисты. Тень сердца, дуга аорты без особенностей. Синусы, купол диафрагмы с обеих сторон без видимых изменений.
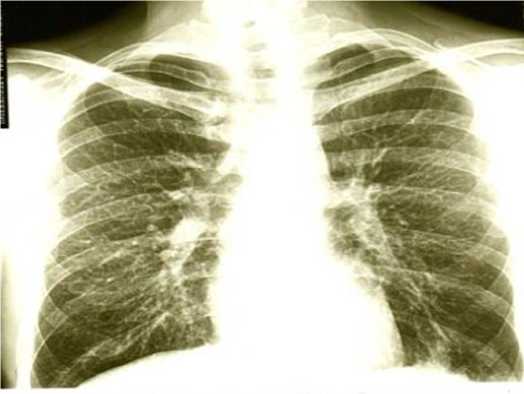
Рис. 1. Рентгенограмма органов грудной полости пациента М.
Fig. 1. Chest X-ray of patient M.
Осмотр при госпитализации (на 9-й день с момента появления жалоб): больной астенического телосложения; перкуторный легочный звук с умеренным притуплением в подлопаточной области слева. При аускультации дыхание везикулярное, над зоной притупления на фоне жесткого дыхания умеренное количество влажных мелкопузырчатых хрипов. ЧДД 19 в мин. Тоны сердца приглушены, ритм правильный, ЧСС 88 уд./мин, АД 120/70 мм рт. ст., температура тела 37,2 °С. Результаты общего анализа крови представлены в табл. 1 (от 2 июля).
Биохимическое исследование крови (стандартная панель): все показатели в пределах референсных значений. В коагулограмме при поступлении повышение фибриногена А до 4,44 г/л.
Начато эмпирическое этиотропное лечение пневмонии: цефтриаксон внутривенно 2,0 в сут в сочетании с кларитромицином 1,0 в сут парентерально, амброксол по 1 таблетке 3 раза в день.
На фоне лечения пациент отмечал усиление одышки, сердцебиение при ходьбе, выраженную общую слабость, сухой приступообразный кашель. При аускультации в легких сохранялись жесткое дыхание и влажные мелкопузырчатые хрипы в подлопаточной области слева, ЧДД 18 в мин. Тоны сердца приглушены, ритм правильный. АД 115/70 мм рт. ст., ЧСС 80 уд./мин, температура тела 37,2 °С.
4 июля (13-й день с момента появления жалоб и 3-й день госпитализации) пациент отметил усиление одышки при малейшей нагрузке, учащенное сердцебиение, при ходьбе стал резко бледнеть и задыхаться, появилась боль по внутренней поверхности правого бедра. Пальпация в проекции сосудистых пучков нижних конечностей: без патологических уплотнений и отека, по внутренней поверхности правого бедра определялась пальпаторная болезненность по ходу поверхностной бедренной вены. Со стороны легких аускультативная картина без существенной динамики, ЧДД 18 в мин. Тоны сердца приглушены, ритмичные, дующий систолический шум на верхушке без иррадиации. АД 110/70 мм рт. ст., ЧСС 98 уд./мин. Документировано повышение уровня D-димера в 4,5 раза.
При повторном активном опросе врачом больной вспомнил, что за несколько дней до появления температуры чувствовал боль по медиальной поверхности бедра, усиливающуюся при ходьбе, но она утихла и пациент о ней забыл. С учетом предполагаемого острого тромбофлебита сосудов нижних конечностей и ТЭЛА полностью пересмотрена тактика ведения, к лечению добавлен гепарин, запланировано проведение эхокардиоскопии, ультразвуковой доплерографии сосудов нижних конечностей, ангиопульмонографии.
Однако больной нарушил постельный режим, самовольно вышел курить на лестнич- ную площадку, где начались судороги и наступила внезапная потеря сознания.
В агональном состоянии была проведена эхокардиография. Во всех полостях сердца обнаружены тени, подозрительные на формирующиеся тромботические массы. Несмотря на проводимые реанимационные мероприятия, пациент скончался.
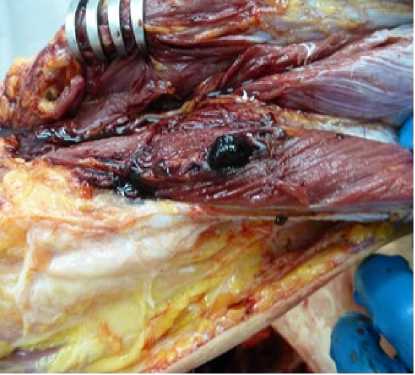
При патологоанатомическом исследовании выявлена варикозная болезнь вен нижних конечностей. В просвете глубоких вен, сосудов легких определялись тромботические массы темно-красного цвета (рис. 2). Гистологическое исследование легких показало утолщение стенок сосудов, местами расширение сосудов, истончение части стенок, в просвете определялись тромбы смешанного строения, часть – с признаками организации. Диагностирована тромбоэмболия ствола, бифуркации ветвей меньшего калибра, множественные инфаркты правого и левого легкого (рис. 3).
а
Рис. 2. Тромботические массы в просвете вен нижних конечностей (a) и сосудов легких (b)
Fig. 2. Thrombotic masses in the lumen of lower extremity veins (a) and lung vessels (b)
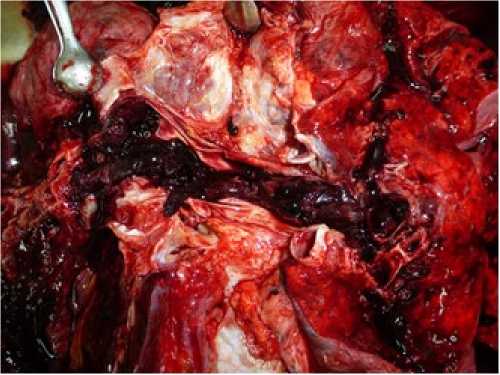
b
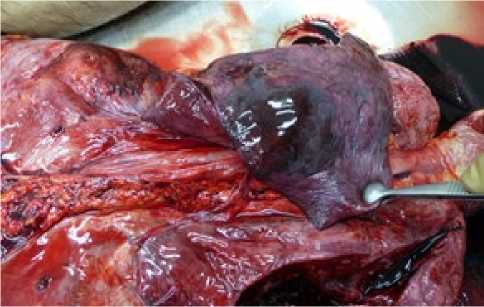
Рис. 3. Инфаркт легкого
Fig. 3. Pulmonary apoplexy
Возможно ли было заподозрить развитие ТЭЛА в описанном случае?
У молодого мужчины имелась совокупность ФР развития ВТЭО, как внешних (мало- подвижный образ жизни, условия труда, курение), так и внутренних (патология венозного русла с бессимптомными тромбозами глубоких вен нижних конечностей). Заболевание внебольничной пневмонией усугубило ситуацию по развитию ВТЭО и привело к развитию ТЭЛА у предрасположенного лица.
По шкале Geneva у пациента выявлены следующие критерии: односторонняя боль в нижней конечности – 3 балла; ЧСС>95 уд./мин – 5 баллов; боль в ноге при пальпации и односторонний отек – 4 балла. Всего 12 баллов, т.е. вероятность развития ТЭЛА – высокая.
Осложнения множественной ТЭЛА с поражением легких и явлениями организации тромбов разной степени зрелости у пациента с латентным течением варикозной болезни глубоких вен нижних конечностей определили тяжесть его состояния, сложности прижизненной диагностики проявлений ТЭЛА на фоне внебольничной пневмонии и привели к летальному исходу.
Таким образом, у практикующих врачей должна быть настороженность в отношение ТЭЛА у пациентов не только хирургического профиля. Необходим тщательный и целенаправленный сбор жалоб, данных анамнеза и объективного осмотра, оценка параметров системы гемостаза независимо от возраста пациента. Поиск ФР развития ТЭЛА, включающий применение диагностического протокола лабораторных и инструментальных исследований, современных рекомендаций и мирового опыта с распределением пациентов по степени риска развития ТЭЛА, позволяет повысить эффективность лечебных мероприятий на ранних стадиях заболевания. Непременным условием успеха будет строгое выполнение врачами всех специальностей современных клинических рекомендаций, разработанных на основе совокупного мирового опыта.
Список литературы Сложности диагностики тромбоэмболии легочной артерии в клинической практике
- Рекомендации ESC по диагностике и лечению острой легочной эмболии, разработанные в сотрудничестве с Европейским респираторным обществом (ERS), 2019. Российский кардиологический журнал. 2020; 25 (8): 3848.
- Konstantinides S., Meyer G., Becattini C. 2019 ESC Guidelines for the diagnosis and management of acute pulmonaryembolism developed in collaboration with the European Respiratory Society (ERS). European Heart Journal. 2020: 41; 543-603.
- Димитриева О.В., Бусалаева Е.И., Васильева Н.П. Тромбоэмболия легочной артерии в реальной клинической практике. Забайкальский медицинский вестник. 2020: 4; 17-26.
- Крукович А.А., Примак Н.В., Захарчук Н.В., Мокшина М.В. Тромбоэмболия легочной артерии: вопросы диагностики и прогноза. Тихоокеанский медицинский журнал. 2017; 4: 31-37.
- Блинова В.В., Богданова Т.М., Семенова В.А., Вологина А.П. Тромбоэмболия легочной артерии у пациентов с постоянной элекгрокардиостимуляцией: трудности диагностики. Современные проблемы науки и образования. 2020; 1. URL: http://science-education.ru/ru/article/view?id=29580 (дата обращения: 08.06.2021).
- Тарасова Л.В., Димитриева О.В., Бусалаева Е.И., Васильева Н.П. Тромбоэмболия легочной артерии как раннее проявление злокачественного новообразования поджелудочной железы. Терапия. 2020; 4: 160-167.
- Капсултанова Д.А., Ползик Г.Б., Файкова Г.А. Клинический случай тромбоэмболии легочной артерии. Вестник КазНМУ. 2016; 2: 24-27.
- Российские клинические рекомендации по диагностике, лечению, профилактике венозных тромбоэмболических осложнений. Флебология. 2015; 9 (4/2): 4-46.
- Mazzolai L., Aboyans V., Ageno W. Diagnosis and management of acute deep vein thrombosis: a joint consensus document from the European Societyof Cardiology working groups of aorta and peripheral vascular diseases and pulmonary circulation and right ventricular function. Eur. Heart J. 2018; 39: 4208-4218.


