Сложности морфологической диагностики меланоцитарных образований кожи (клинический случай)
Автор: Артемьева Анна Сергеевна, Семилетова Юлия Вадимовна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 3 т.20, 2021 года.
Бесплатный доступ
Актуальность. В структуре онкологической заболеваемости населения России злокачественные новообразования кожи занимают лидирующее место, в то время как на долю меланомы приходится всего 1,8 %. Меланома - редкая, но агрессивная опухоль. Ранняя диагностика и адекватный своевременный подход к лечению данной патологии - ключ к высоким показателям общей и безрецидивной выживаемости. Однако в реальности действия клинициста-онколога напрямую зависят от правильности патоморфологического заключения. Опыт и знания именно патоморфолога являются определяющими в дальнейшей судьбе пациента. Дифференциальная диагностика меланоцитарных образований кожи представляет собой сложную задачу даже для опытного патолога в ряде случаев, особенно в пограничных ситуациях. Описание клинического случая. Представлен опыт лечения пациентки 36 лет с подозрением на меланому. Пациентка обратилась с жалобами на наличие пигментного образования на коже туловища. В онкодиспансере по месту жительства выполнено хирургическое удаление данного образования с отступом около 1 см. При гистологическом заключении диагностирована меланома. При пересмотре в другом онкологическом учреждении федерального уровня, не специализирующегося на лечении пациентов с опухолями кожи, меланома подтверждена, но изменена толщина опухоли на меньшую. Однако при пересмотре в федеральном онкологическом учреждении, профильном по лечению больных меланомой кожи, диагноз меланомы не подтвержден, диагностирован невус. В статье подробно рассмотрены причины ошибочной диагностики злокачественного новообразования с указанием этапности дифференциальной диагностики. Заключение. На примере данного клинического случая продемонстрированы неоднородность клинического мышления, необходимость референсного анализа пограничных меланоцитарных образований кожи в условиях специализированных учреждений в руках опытного патолога с необходимой специальной подготовкой. Описаны объективные сложности в патоморфологической диагностике, которые дополнительно могут быть усугублены отсутствием критически важной клинико-инструментальной информации, артефактами на этапе эксцизии или биопсии, этапе макроскопического исследования и вырезки, ориентации фрагментов при заливке в парафиновый блок.
Меланома, диагностика, патоморфология, иммуногистохимия
Короткий адрес: https://sciup.org/140254497
IDR: 140254497 | УДК: 616.5-006.81.04-076 | DOI: 10.21294/1814-4861-2021-20-3-144-150
Текст научной статьи Сложности морфологической диагностики меланоцитарных образований кожи (клинический случай)
Актуальность
В структуре онкологической заболеваемости злокачественные опухоли кожи занимают ведущее место. При этом на долю меланомы приходится всего 1,8 %. В 2018 г. в Российской Федерации меланомой кожи заболело 11 392 человека [1]. В 2018 г. от меланомы кожи (МК) в России умерло 1 757 мужчин и 1 956 женщин, грубый показатель смертности (оба пола) составил 2,53 на 100 000 населения [1].
Согласно клиническим рекомендациям 2019 г. [2], а они совпадают с рекомендациями NCCN, для определения тактики лечения больных меланомой кожи целесообразно выполнение на первом этапе эксцизионной биопсии пигментного образования кожи с отступом не более 0,5 см. Если диагноз меланомы подтверждается, то в дальнейшем выполняется широкая реэксцизия рубца с соответствующим толщине первичной опухоли отступом в сроки 4–8 нед. В случае если меланома имеет толщину >0,8 мм, выполняется биопсия сигнальных лимфатических узлов (БСЛУ). Считается, что риск метастазов в регионарные лимфоузлы минимален, если меланома тонкая, меньше 0,8 мм, в этом случае вероятность поражения лимфатических узлов менее 10 %. Поэтому толщина МК является не только прогностически значимой величиной, но и определяющей дальнейшую лечебную тактику. Также согласно как Российским, так и мировым клиническим рекомендациям, в гистологическом заключении по первичной опухоли должно быть отражено: определение максимальной толщины опухоли в мм (по Бреслоу); определение уровня инвазии по Кларку; указание о наличии или отсутствии изъязвления первичной опухоли; определение митотического индекса (количество митозов на 1 мм2) при толщине опухоли до 1 мм включительно; наличие транзиторных или сателлитных метастазов; нейротропизм; десмоплазия; оценка краев резекции на наличие опухолевых клеток, выраженность интратуморальной лимфоидной инфильтрации.
Меланома – достаточно редкая, но агрессивная опухоль. Ранняя диагностика и адекватное своевременное лечение МК – ключ к высоким показателям общей и безрецидивной выживаемости. Однако в реальности действия клинициста-онколога напрямую зависят от правильности патоморфоло-гического заключения, соответственно, опыт и знания патоморфолога являются определяющими в дальнейшей судьбе пациента. В ряде случаев дифференциальная диагностика меланоцитарных образований кожи представляет собой сложную задачу даже для опытного патолога, особенно в пограничных ситуациях. Классификация ВОЗ опухолей кожи постулирует этапный патогенез меланоцитарных образований и выделяет в пределах биологического континуума помимо крайних проявлений невус – доброкачественный клональный процесс и меланому – злокачественную агрессивную опухоль. Кроме того, выделяют целый ряд промежуточных с точки зрения морфологических характеристик и клинического течения категорий (диспластический невус, меланоцитарная опухоль с неопределенным злокачественным потенциалом – MELTUMP, поверхностная атипическая меланоцитарная пролиферация неясного значения – SAMPUS, меланоцитома и т.п.) [3]. В большом количестве случаев диагноз меланомы, поставленный не в профильном онкологическом учреждении, при дальнейшем пересмотре не подтверждается. В связи с этим мы решили рассмотреть данный клинический случай.
Пациентка Ф., 36 лет, в ноябре 2019 г. обратилась в клинический областной диспансер по месту жительства (учреждение второго уровня) с жалобами на наличие множественных пигментных образований на коже туловища и конечностей. Со слов пациентки, она часто загорает и в последнее время отметила медленный рост некоторых невусов. При осмотре выявлено образование на коже спины, подозрительное на меланому. В амбулаторных условиях 21.11.19 онкологом выполнена эксцизионная биопсия с отступом 1 см при диаметре образования – 5 мм. Из гистологического заключения: «Эпителиоидноклеточная пигментная меланома на фоне существующего невуса, с инвазией по Кларку 2, слабой лимфоидной инфильтрацией по краю, толщиной 2 мм, митогенная – 1 митоз на мм2, без лимфоваскулярной инвазии, периневрального роста, опухолевых эмболов в сосудах не обнаружено». Рекомендовано наблюдение в связи с допустимым по клиническим стандартам отступом при иссечении.
Далее пациентка самостоятельно обратилась в специализированное федеральное учреждение III уровня. При пересмотре гистологического материала патоморфологом центра сделано следующее заключение: «В готовом препарате на фоне дермального невуса неизъязвленная малопигментная эпителиоидноклеточная меланома, с инвазией по Кларку 3, лимфоидная инфильтрация отсутствует, толщиной опухоли по Бреслоу 0,5 мм, 1 митоз на 1 мм2, края резекции интактны».
В связи с наличием противоречивых заключений, пациентка направляет материал на пересмотр в лаборатории г. Москвы и «НМИЦ онкологии им. Н.Н. Петрова» (г. Санкт-Петербург), где выполняется повторный анализ двумя независимыми патологами, специализирующимися на патологии кожи. При патоморфологическом и иммуногистохимическом исследованиях диагностирован смешанный меланоцитарный невус с признаками врожденного. Края резекции интактны.
На обзорном увеличении образование в виде плоской папулы или бляшки диаметром около 3,5 мм с четкими контурами, симметричное (рис. 1). Распределение пигмента равномерное в пределах компартмента (меланоцитарное образование может быть разделено на отделы – горизонтальные уровни: эпидермальный, юнкциональный – на границе эпидермиса и дермы, дермальный (по слоям дермы при достаточной толщине образования)): пигмент сосредоточен преимущественно в эпидермальной и юнкциональной частях образования, наблюдается равномерное уменьшение его количества к донным отделам в дерме. Не наблюдается распространения интраэпидермального компонента за пределы дермального компонента, так называемый симптом «плеча», нередко встречающийся в меланомах, отсутствует.
Детальный анализ архитектурных характеристик данного образования показал, что оно состоит из довольно крупных, но в целом сходного размера гнезд (при оценке размера и формы гнезд необходимо принимать во внимание ориентацию фрагментов кожи), состоящих из укрупненных, но монотонных меланоцитов с хорошо выражен-
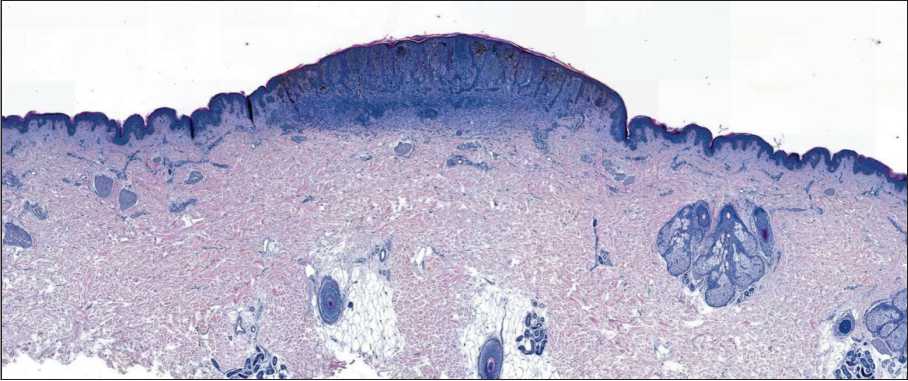
Рис. 1. Микрофото. Образование кожи. Обзорное увеличение. Окраска гематоксилином и эозином
Fig. 1. Microphoto. Skin lesion. Panoramic magnification. Hematoxylin and Eosin staining
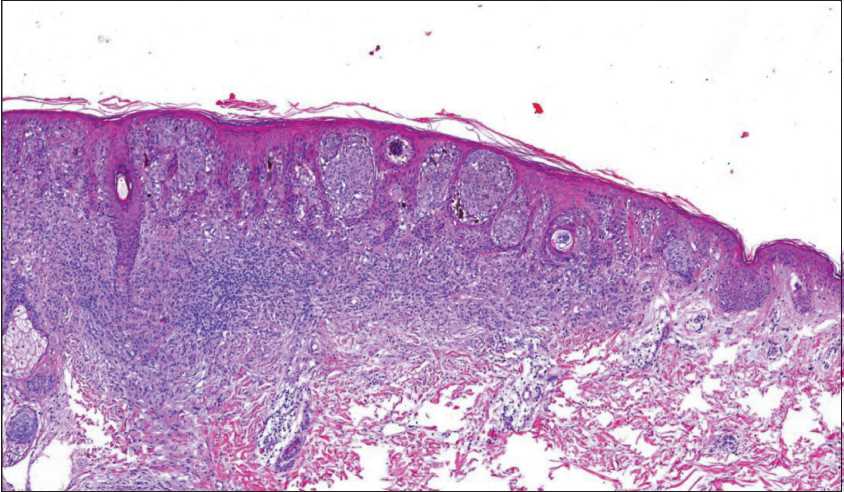
Рис. 2. Микрофото. Признаки созревания: уменьшение размеров гнезд и размера меланоцитов от поверхностных отделов образования к глубоким. Распространение невусных клеток вдоль структур придатков кожи, что характерно для врожденных невусов.
Окраска гематоксилином и эозином, ×200
Fig. 2. Microphoto. Signs of maturation: a decrease in the sizes of nests and melanocytes from the superficial to deep parts of the lesion. The spread of nevus cells along the structures of skin appendages, which is characteristic of congenital nevi. Staining with hematoxylin and eosin, ×200
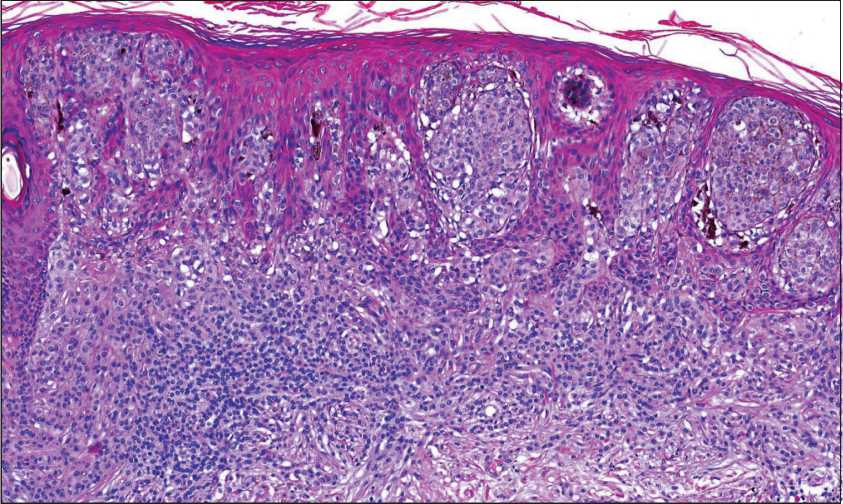
Рис. 3. Микрофото. Цитологическая монотония, уменьшение размера клеток и ядер клеток от поверхностных отделов образования к глубоким. Отсутствие митозов в меланоцитах.
Окраска гематоксилином и эозином, ×200
Fig. 3. Microphoto. Cytological monotony, a decrease in the size of cells and cell nuclei from the superficial to deep parts of the lesion. Lack of mitosis in melanocytes. The hematoxylin and eosin staining, ×200
ной светло-эозинофильной цитоплазмой (рис. 2). Размер гнезд уменьшается от центра образования к его краям и от поверхностных отделов к глубоким, где они распадаются на отдельные клетки, в том числе с признаками нейротизации. Лентигинозного компонента нет, образование латерально оканчивается гнездами небольшого размера. Также отсутствует педжетоидное распространение в эпидермисе, часть крупных гнезд располагается довольно высоко, что создает впечатление поглощения ими эпидермиса (consumption), что встречается при меланомах. Однако отсутствие клеточной атипии и полиморфизма, в целом высокая архитектурная упорядоченность свидетельствуют в пользу доброкачественной природы образования.
В пределах образования митозов в меланоцитарных клетках не выявлено (рис. 3). Индекс Ki67 в среднем составил на всю площадь образования менее 1 %, окрашенные клетки выявлялись только в эпидермальном компоненте. При оценке цитологической атипии действующая классификация ВОЗ рекомендует помимо субъективной качественной оценки использовать также и полуколичественную, сравнивая размер ядра меланоцита в пределах образования с ядром нормального покоящегося базального кератиноцита. Если воспользоваться этой рекомендацией, то в данном образовании размеры ядер самых крупных эпидермальных и юнкциональных меланоцитов соответствуют 1–1,5 размерам ядра базального кератиноцита, при этом отсутствует гиперх-ромазия, хроматин распределен равномерно в пределах ядер, в части клеток визуализируются плохо различимые мелкие базофильные ядрышки. Вариабельность размеров ядер в пределах каждого из компартментов образования (в эпидермальном, юнкциональном и в дермальном на разных уровнях) минимальна. Описанные изменения в совокупности не позволяют (в соответствии с критериями) отнести образование даже к дисплазии низкой степени [3].
В данном клиническом случае помимо принципиального расхождения заключений в отношении потенциала злокачественности данного меланоцитарного образования кожи, обращает на себя внимание вариабельность оценки в разных учреждениях как толщины образования, так и уровня его расположения в слоях дермы (по Кларку). Вероятно, это связано в первую очередь с завышенной оценкой более крупных меланоцитов в поверхностных отделах образования, формирующих довольно крупные гнезда как атипичных, поглощающих эпидермис, и последующей оценкой толщины этой части образования в качестве толщины «меланомы». Вариабельность же в оценке толщины может быть дополнительно обусловлена субъективным выбором среза, в котором она измерялась. В серийных срезах с парафинового блока внешний вид образования и его структурных элементов может варьировать в довольно широких пределах. Низкая сходимость в оценке уровня инвазии по Кларку связана с отсутствием константных анатомических границ между слоями дермы и неточностью определения границы между уровнями.
Вышесказанное обнажает целый ряд объективных сложностей в данной области патологии, которые обусловлены нечеткостью и низкой воспроизводимостью ряда диагностических критериев и необходимостью специализированной подготовки патолога в данной области.
При дифференциальной диагностике мелано-цитатных образований кожи патологу необходимо оценить целый ряд архитектурных критериев: размер, четкость контура, симметричность образования (относительно вертикальной оси: симметричность силуэта в целом, отдельно симметричность эпидермального компонента и дермального компонента, симметричность распределения пигмента и воспалительного инфильтрата); равно-мерность/симметричность распределения структурных элементов (отдельных меланоцитов в эпидермисе, гнезд меланоцитов в юнкциональной зоне и дерме); признаки созревания (уменьшение размера гнезд меланоцитов и самих меланоцитов по направлению от поверхностных отделов образования к глубоким); вариабельность размера гнезд меланоцитов в пределах уровня (на уровне эпидермиса, на юнкциональном уровне, в разных слоях дермы); равномерность расположения гнезд и/ или меланоцитов в эпидермисе, расстояние между ними, наличие или отсутствие сливающихся гнезд и гнезд, ориентированных параллельно поверхности эпидермиса; наличие педжетоидного распространения в эпидермисе; наличие дискогезии меланоцитов (дискретное расположение клеток в пределах ядра в результате потери межклеточной адгезии) в пределах гнезд; вовлечение придатков кожи. Также необходимо оценить клеточные характеристики меланоцитов (степень выраженности цитоплазмы; размеры, форма, характер хроматина ядра, наличие ядрышка) и степень их атипии. При наличии четких воспроизводимых критериев оценки диагностика меланоцитарных образований не представляла бы столь большой сложности [4].
Но помимо оценки критерия патологу необходимо учесть его вес в контексте остальных морфологических характеристик, а также модифицирующих факторов, которыми являются: возраст (эпидемиология и структура заболеваемости различными по степени злокачественности меланоцитарными образованиями зависят от возраста, периода активного роста), гормональный статус (беременность, прием гормональных препаратов), локализация (аногенитальная зона, млечные линии, область крупных суставов, пупочная область и т. п.). В связи с этим морфологическая диагностика меланоцитарных образований на уровне «первого впечатления» или узнавания (импрессионизм) неэффективна, особенно в неоднозначных и пограничных случаях, она требует скрупулезной последовательной оценки и взвешивания каждого из параметров с учетом всех имеющихся данных. Такая ситуация приводит к необходимости углубленной специализации, корреляции с клиническими и инструментальными данными, что возможно осуществить в условиях специализированных учреждений.
Роль иммуногистохимического исследования в дифференциальной диагностике меланоцитарных образований кожи ограничена, так как на сегодняшний день нет маркеров, патогномоничных для меланомы. Большинство иммуногистохимических маркеров оцениваются с точки зрения локализации экспрессии и ее распределения в пределах образования в разных его частях. Так, одним из часто используемых маркеров является HMB-45, экспрессия которого в меланоцитарных невусах ограничена эпидермальным и юнкциональным отделами образования. Меланомы нередко диффузно экспрессируют HMB-45 на всю толщину образования (отсутствует градиент окрашивания), но могут мозаично или тотально терять экспрессию этого меланоцитарного маркера, что и ограничивает его использование в ситуациях дифференциальной диагностики образований разного потенциала злокачественного течения. В определенной степени полезным может быть использование Ki67, который также оценивается в разных отделах образования, и уменьшение доли позитивных клеток от поверхностных отделов образования к глубоким является дополнительным признаком, свидетельствующим о сохранении созревания. Но оценка нередко затруднена за счет воспалительного инфильтрата.
Кроме того, для дифференциального диагноза различных меланоцитарных образований используют белок-регулятор клеточного цикла р16, что обусловлено частыми молекулярными нарушениями, приводящими к потере функции гена, кодирующего данный белок, в патогенезе меланомы. Однако значение данного маркера также ограничено, особенно если он используется один. Позитивным окрашиванием рекомендуется считать наличие ядерной, а не только цитоплазматической экспрессии, для меланом характерна гомогенная потеря экспрессии данного белка, некоторые исследователи предлагают учитывать и субклональную/ очаговую потерю. В любом случае интерпретация результатов окрашивания р16 должна зависеть от морфологического контекста и результатов окрашивания другими маркерами (IHC expression of p16 in melanocytic lesions) [5].
Как и во многих других локализациях, комбинированное использование панели маркеров дает более обнадеживающие результаты, так, одним из вариантов может служить комбинация Ki67, HMB-45 и р16 (Ap16-Ki67-HMB45 IHC scoring system as an ancillary diagnostic tool in the diagnosis of melanoma) [6].
Также в меланомах значительно чаще обнаруживается гиперэкспрессия еще одного регулятора клеточного цикла cyclinD1 по сравнению с меланоцитарными невусами. Что позволяет использовать его в качестве самостоятельного маркера, но может повысить уверенность в диагнозе, при использовании в панели маркеров (Expressionofc-Kit, p-ERKandcyclinD1 in malignant melanoma: an IHC study and analysis of prognostic value) [7].
В обсуждаемом случае, помимо Ki67 были использованы антитела к HMB-45 (экспрессия ограничена поверхностными отделами образо- вания), р16 (мозаичное окрашивание) и cyclinD1 (единичные слабо позитивные меланоциты в пределах образования). Результаты иммуногистохимического окрашивания также свидетельствуют в пользу невуса.
Список литературы Сложности морфологической диагностики меланоцитарных образований кожи (клинический случай)
- Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2018 году (заболеваемость и смертность). М., 2019. 250 с.
- Носов Д.А., Алексеев Б.Я., Волкова М.И., Гладков О.А., Попов А.М., Харкевич Г.Ю. Практические рекомендации RUSSCO. Злокачественные опухоли: 2019; 3s2 (Том 9): 498-506.
- WHO. Classification of skin tumours. IARC, Lyon, 2018.
- Massi G., LeBoit P.E. Histological diagnosis of nevi and melanoma. Second Edition. Springer, 2014. 752 p.
- Koh S.S., Cassarino D.S. Immunohistochemical expression of p16 in melanocytic lesions: an updated review and meta-analysis. Arch Pathol Lab Med. 2018; 142(7): 815-828.
- Uguen A., Talagas M., Costa S., Duigou S., Bouvier S., DeBraekeleer M., Marcorelles P. A p16-Ki-67-HMB45 immunohistochemistry scoring system as an ancillary diagnostic tool in the diagnosis of melanoma. Diagn Pathol. 2015 Oct 26; 10: 195. DOI: 10.1186/s13000-015-0431-9
- Oba J., Nakahara T., Abe T., Hagihara A., Moroi Y., Furue M. Expression of c-Kit, p-ERK and cyclin D1 in malignant melanoma: an immunohistochemical study and analysis of prognostic value. J Dermatol Sci. 2011 May; 62(2): 116-23. DOI: 10.1016/j.jdermsci.2011.02.011


