Случаи диффузной В-крупноклеточной лимфомы с функционально значимыми интронными мутациями в гене ТР53
Автор: Воропаева Елена Николаевна, Воевода Михаил Иванович, Поспелова Татьяна Ивановна, Максимов Владимир Николаевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 1 т.19, 2020 года.
Бесплатный доступ
Актуальность. Наличие в гене ТР53 функционально значимых интронных изменений было продемонстрировано в экспериментах in vitro и на выборках больных отдельными вариантами неходжкинских лимфом. До настоящего времени при изучении ТР53 в опухолевой ткани больных диффузной В-крупноклеточной лимфомой (ДВККЛ) исследования были сосредоточены на поиске мутаций в 5-8 экзонах гена. По этим причинам требуются дальнейшие исследования спектра изменений в интронных последовательностях гена ТР53 и определение их функционального эффекта при ДВККЛ. Описание. В статье представлены два клинических наблюдения, которые представляют интерес как впервые публикуемые в российской научной литературе случаи выявления функционально значимых интронных мутаций ТР53 в опухолевой ткани ДВККЛ. Первый клинический случай ДВККЛ характеризовался экстранодальным опухолевым поражением в дебюте заболевания, выраженными симптомами опухолевой интоксикации, высокой параклинической активностью опухоли, развитием раннего рецидива гемобластоза с экстранодальным очагом поражения в забарьерной ткани, резистентным к лечению. Второй описанный клинический случай ДВККЛ характеризовался исходно массивным опухолевым поражением, быстропрогрессирующим течением заболевания, выраженными симптомами опухолевой интоксикации, высокой параклинической активностью опухоли и плохим ответом на терапию с последующей генерализацией лимфомы. Заключение. Мутации в гене ТР53 являются драйвером опухолевого процесса, служат не только маркером агрессивного течения опухоли, но и независимым предиктором снижения чувствительности к лечению. Представленные клинические случаи показывают, что необходимы углубленный анализ результатов секвенирования ТР53 при опухолях и функциональная оценка всех выявляемых изменений, в том числе в интронах гена и с привлечением методов анализа in silico.
Секвенирование, интронные мутации, ген тр53, неходжкинские лимфомы, прогноз
Короткий адрес: https://sciup.org/140254315
IDR: 140254315 | УДК: 616-006.441:575.113:575.24/.25 | DOI: 10.21294/1814-4861-2020-19-1-134-140
Текст научной статьи Случаи диффузной В-крупноклеточной лимфомы с функционально значимыми интронными мутациями в гене ТР53
Несмотря на всю сложность генетических изменений, происходящих в геноме злокачественной клетки, мутации гена ТР53 являются наиболее частым, универсальным нарушением, обнаруживаемым при широком круге злокачественных новообразований. Являясь драйвером опухолевого процесса, они служат не только маркером агрессивного течения опухоли, но и независимым предиктором снижения чувствительности к лечению [1] .
Частота и спектр мутаций в гене ТР53 описаны при диффузной В-крупноклеточной лимфоме (ДВККЛ) на небольших выборках пациентов [2, 3]. Однако в центре внимания исследователей, как правило, были мутации в 5–8 экзонах гена, кодирующих ДНК-связывающий домен белка. Интронные мутации ТР53 долгие годы не входили в круг интересов исследователей. Например, в Catalogue Of Somatic Mutations In Cancer, The TP53 UMD mutation database in human cancer (2017 release) и IARC TP53 mutation Database (2012 release) перечислены только аберрации в кодирующих последовательностях гена ТР53 [4–6]. Лишь небольшое число интронных мутаций гена ТР53 аннотировано в Human Gene Mutation Database [7].
Наличие в гене ТР53 функционально значимых интронных изменений было продемонстрировано в экспериментах in vitro и на выборках больных отдельными вариантами неходжкинских лимфом [8, 9]. В частности, описаны интронные мутации, которые в результате альтернативного сплайсинга приводят к генерированию изоформ белка р53, отсутствующих в норме. Для данных изоформ характерны не только утрата транскрипционной активности и канонических функций опухолевого супрессора, но и появление способности придавать несущим их клеткам высокий метастатический потенциал [10].
До настоящего времени при изучении ТР53 в опухолевой ткани больных ДВККЛ исследования были сосредоточены на поиске мутаций в 5–8 экзонах гена [1, 2], поэтому требуются дальнейшие исследования спектра изменений в интронных последовательностях гена ТР53 и определения их функционального эффекта при ДВККЛ.
В статье описаны 2 клинических наблюдения ДВККЛ, которые представляют интерес как впервые публикуемые в российской научной литературе случаи выявления функционально значимых интронных мутаций ТР53 в опухолевой ткани лимфомы.
Клиническое наблюдение 1
Пациент Ч., 73 лет, поступил в гематологическое отделение Городского гематологического центра г. Новосибирска с жалобами на боли в десне, лихорадку до 38,5 ºС в вечернее время суток, трудности при пережевывании пищи, потливость по ночам, повышенную утомляемость.
Считает себя больным в течение 2 мес, когда отметил боль в 6 верхнем зубе слева, отек щеки и десны. После удаления зуба сохранялся отек тканей. При рентгенографии костей черепа выявлено образование верхней челюсти слева, выполнена биопсия. При иммуногистохимическом исследовании верифицирована ДВККЛ CD20+, неспецифицированная. По данным мультиспираль-ной компьютерной томографии лицевого скелета выявлено объемное образование левой гайморовой пазухи размером 23,8×22×19,5 мм, вызывающее деструкцию нижней и латеральной стенок пазухи, а также альвеолярного отростка верхней челюсти, распространяющееся на жировую клетчатку шеи и ротовую полость.
При дообследовании: ЛДГ – 708 МЕ/л, Фг – 5,7 г/л, СОЭ – 38 мм/ч. По данным трепанобиопсии: специфическое поражение костного мозга.
Поставлен диагноз: ДВККЛ CD20+, неспеци-фицированная, IVE стадии с поражением левой гайморовой пазухи, альвеолярного отростка верхней челюсти, жировой клетчатки шеи и ротовой полости, костного мозга, впервые выявленная; группа высокого риска по Международному прогностическому индексу (МПИ).
В связи с возрастом и соматической отягощен-ностью рекомендованы курсы по протоколу R-СОР (ритуксимаб, циклофосфан, винкристин и преднизолон). После 2 курсов терапии отмечено уменьшение объема образования, нормализация носового дыхания. После 6 курсов терапии констатирована ремиссия, проводилось введение Ритуксимаба 1 раз в 3 мес. Однако спустя полгода пациент отметил увеличение правого яичка, консультирован онкоурологом, выполнена орхэктомия справа. По данным гистологического и иммуногистохимического исследований верифицирована ДВККЛ CD20+, неспецифицированная. По данным КТ в малом тазу выявлено мягкотканное образование 12×10×6,6 см. Диагностирована ДВККЛ CD20+, неспецифицированная, IVE стадии с поражением левой гайморовой пазухи, альвеолярного отростка верхней челюсти, жировой клетчатки шеи и ротовой полости, костного мозга, первая ремиссия; I ранний рецидив IVE стадии с поражением правого яичка, лимфоузлов малого таза, индукция ремиссии; группа высокого риска по МПИ. Проведено 6 курсов полихимиотерапии, после второго по протоколу R-CHOP (ритуксимаб, циклофосфан, винкристин, доксорубицин и преднизолон) констатирована резистентность к лечению, направлен на высокодозную химиотерапию. На очередной курс терапии пациент не явился в связи с летальным исходом от прогрессирования заболевания.
В ходе прямого секвенирования по Сенгеру в опухолевой ткани ДВККЛ выявлены изменения в гене ТР53: сеймсенс мутация p.L252L в кодирующей последовательности; мутация в 6 интроне IVS6-36G>C (рис. 1).
Данный клинический случай ДВККЛ характеризовался экстранодальным опухолевым по- ражением в дебюте заболевания, выраженными симптомами опухолевой интоксикации, высокой параклинической активностью опухоли, развитием раннего рецидива гемобластоза с экстранодальным очагом поражения в забарьерной ткани, резистентным к лечению.
Выявленная у пациента при секвенировании интронная мутация IVS6-36G>C имеет доказанную биологическую значимость. В экспериментах in vitro было показано, что IVS6-36G>C в отсутствие изменений в кодирующей последовательности гена приводит к выживанию клеток в условиях химиотерапии и длительно ингибирует апоптоз [11]. Согласно данным литературы, она связана с семейными формами рака молочной железы, риском возникновения рака простаты и предрасположенностью к раку щитовидной железы у детей [11, 12].
Мутация расположена в 6 интроне гена ТР53 и, согласно данным The Human Cancer Mutation Database, относится к изменениям, влияющим на сплайсинг [7]. Хотя замена IVS6-36G>C расположена далеко от экзон/интронного стыка, где обычно находятся сайты сплайсинга, описаны другие механизмы влияния изменения нуклеотидной последовательности в некодирующих регионах на созревание молекулы мРНК. В частности, мутации в интронах способны генерировать новые сайты сплайсинга, которые, конкурируя с исходными сайтами, замедляют сплайсинг мРНК. В ряде случаев такой новый сайт может распознаваться системой процессинга РНК как аутентичный сайт сплайсинга, тогда в процессированную мРНК включается часть интрона. Это приводит к сдвигу рамки считывания и образованию укороченного белка.
Клиническое наблюдение 2
Пациент Г., 46 лет, поступил в гематологическое отделение Городского гематологического центра г. Новосибирска c жалобами на слабость, температуру в вечернее время до 38 ºС, ночную профузную потливость, потерю веса на 9 кг за 12 мес, увеличение всех групп периферических лимфоузлов.
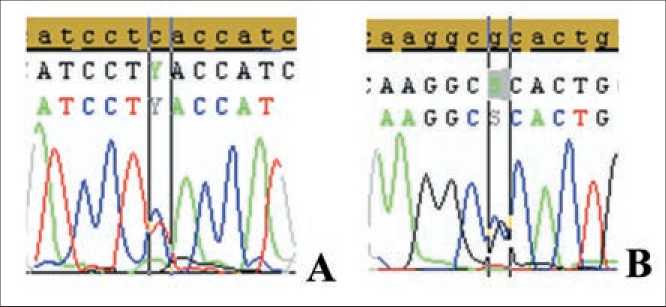
Рис. 1. Результаты секвенирования: А – мутация p.L252L, В – интронная мутация IVS6-36G>C
Fig. 1. Sequencing results: A – p.L252L mutation, B intron mutation of IVS6-36G>C
Считает себя больным в течение полугода, когда впервые обнаружил безболезненное увеличение надключичного лимфоузела справа до 0,5 см. Консультирован ЛОР-врачом – без патологии, инфекционистом – выявлен хронический вирусный гепатит С минимальной степени активности. После консультации онколога проведена операционная биопсия увеличенного лимфоузла. По данным гистологического и иммуногистохимического исследования верифицирована диффузная В-крупноклеточная неспецифицированная лимфома СД20+; уровень экспрессии маркера Ki67 опухолевыми клетками 35 %, BCL6-, СД10-. Направлен к гематологу.
Объективно: состояние средней степени тяжести, пальпируются все группы периферических лимфоузлов, плотные, безболезненные, шейные лимфоузлы справа – массивное поражение. Селезенка на 5 см ниже реберной дуги. По данным дообследования: УЗИ органов брюшной полости – выраженная спленомегалия (площадь селезенки – 78 см2); КТ органов грудной клетки – лимфоузлы в средостении увеличены до 3–4 см; в биохимическом анализе крови: Фг – 4,4 г/л, ЛДГ – 741 МЕ/л, ЩФ – 456 Е/л, Тп – 6 Ед, СРБ – 24 Ед.; в ОАК – СОЭ 25 мм/ч. В трепанобиоптате скопления крупноклеточных опухолевых элементов.
На основании жалоб, анамнеза, объективного осмотра, данных лабораторно-инструментального обследования был выставлен диагноз: диффузная В-крупноклеточная, неспецифицированная СД20+ лимфома IVS стадии с поражением всех групп периферических лимфоузлов, лимфоузлов средостения, селезенки, костного мозга, впервые выявленная. Группа промежуточного/высокого риска по МПИ.
Получил 6 курсов полихимиотерапии по протоколу R-СНОР с положительной динамикой в виде уменьшения объема опухоли, однако в августе 2011 г. в межкурсовой промежуток отметил интенсивные боли в эпигастрии. По данным обследования имеются признаки прогрессирования заболевания: увеличение абдоминальных лимфоузлов, лимфоузлов малого таза до массивных, выраженная спленомегалия (объем селезенки 452 мл), появление очагов поражения в костях – позвонках L2, L4, L5, S1, костях таза, поражение стенки мочевого пузыря, плевры с двух сторон. Экстренно госпитализирован в отделение с выраженным болевым синдромом.
По жизненным показаниям проведена терапия по протоколу высокодозной химиотерапии DHAP (цисплатин, цитозар, дексаметазон), которую перенес удовлетворительно. Однако в межкурсовой период пациент скончался от прогрессирования гемобластоза.
В ходе прямого секвенирования по Сенгеру в опухолевой ткани ДВККЛ были выявлены следующие изменения в гене ТР53: миссенс мутация p.T155I, мутация сдвига рамки считывания p.A189Pfs и интронная мутация IVS5+43G>T (рис. 2). Все мутации были в гомозиготном состоянии, что свидетельствовало о потере гетерозиготности в гене ТР53 в опухолевой ткани ДВККЛ у данного пациента.
Описанный клинический случай ДВККЛ характеризовался исходно массивным опухолевым поражением, быстропрогрессирующим течением заболевания, выраженными симптомами опухолевой интоксикации, высокой параклинической активностью опухоли и плохим ответом на терапию с последующей генерализацией лимфомы.
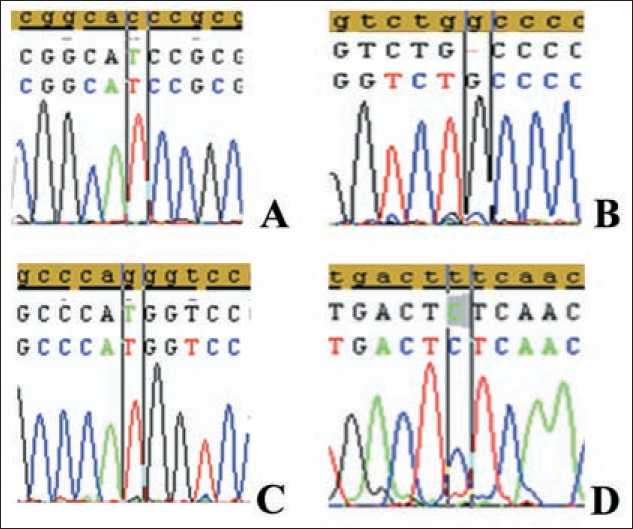
Рис. 2. Результаты секвенирования: А – мутация p.T155I, В – мутация p.A189Pfs, С – интронная мутация IVS5+43G>T, D – интронная мутация IVS4-30Т>С
Fig. 2. Sequencing results:
A – p.T155I mutation, B p.A189Pfs mutation, С – intron mutation of IVS5+43G>T, D – intron mutation of IVS4-30Т>С
В ходе секвенирования, помимо патогенной миссенс-мутации p.T155I и мутации сдвига рамки считывания p.A189Pfs, приводящей к синтезу укороченного неактивного белка р53, в опухолевом материале было выявлено две интронные мутации, не фиксированные в специализированных базах данных.
В базе данных dbSNP в позиции IVS5+43 описана другая однонуклеотидная замена G>С (rs765032410, NC_000017.11:g.7675010C>G), однако ни популяционная частота редкого аллеля (Minor allele frequency – MAF), ни клиническое значение rs765032410 не известны [13]. Однако согласно прогнозу NetGene2 [14], IVS5+43G>Т приводит к образованию дополнительного акцепторного сайта сплайсинга, который отсутствует в норме, что может приводить к включению в последовательность м-РНК части 5 интрона, преждевременному образованию стоп-кодона в 189 положении и синтезу укороченного варианта белка р53, лишенного функциональной активности. Отдельно также следует отметить IVS4-30Т>С ввиду того, что в 4 интроне ТР53 расположен альтернативный промотор гена, участвующий в синтезе изоформы delta133, которая в норме экспрессируется в лимфоидной ткани [15]. Однако на данный момент оценить ее влияние на транскрипцию гена не представляется возможным.
Таким образом, результаты молекулярногенетического анализа свидетельствуют о наличии в опухолевой ткани ДВККЛ у данного пациента множественных функционально значимых мутаций ТР53, в том числе интронных, сочетающихся с потерей нормального аллеля гена.
Заключение
В литературе описаны интронные мутации в гене ТР53 , которые приводят к генерированию в результате альтернативного сплайсинга отсутствующих в норме изоформ белка р53. Для данных изоформ характерны не только утрата
Список литературы Случаи диффузной В-крупноклеточной лимфомы с функционально значимыми интронными мутациями в гене ТР53
- Xu-Monette Z.Y., Wu L., Visco C., Tai Y.C., Tzankov A., Liu W.M., Montes-Moreno S., Dybkaer K., Chiu A., Orazi A., Zu Y., Bhagat G., Richards K.L., Hsi E.D., Zhao X.F., Choi W.W., Zhao X., van Krieken J.H., Huang Q., Huh J., Ai W., Ponzoni M., Ferreri A.J., Zhou F., Kahl B.S., Winter J.N., Xu W., Li J., Go R.S., Li Y., Piris M.A., Møller M.B., Miranda R.N., Abruzzo L.V., Medeiros L.J., Young K.H. Mutational profile and prognostic significance of TP53 in diffuse large B-celllymphoma patients treated with R-CHOP: report from an International DLBCL Rituximab-CHOP Consortium Program Study. Blood. 2012 Nov 8; 120(19): 3986-96. DOI: 10.1182/blood-2012-05-433334
- Young K.H., Weisenburger D.D., Dave B.J., Smith L., Sanger W., Iqbal J., Campo E., Delabie J., Gascoyne R.D., Ott G., Rimsza L., Müller-Hermelink H.K., Jaffe E.S., Rosenwald A., Staudt L.M., Chan W.C., Greiner T.C. Mutations in the DNA-binding codons of TP53, which are associated with decreased expression of TRAIL receptor-2, predict for poor survival in diffuse large B-cell lymphoma. Blood. 2007 Dec 15; 110(13): 4396-405. DOI: 10.1182/blood-2007-02-072082
- Tamimi Y., Al-Harthy S., Al-Haddabi I., Al-Kindi M., Babiker H., Al-Moundhri M., Burney I. The p53 mutation/deletion profle in a small cohort of the Omani population with Diffuse Large B-Cell Lymphoma. Sultan Qaboos Univ Med J. 2014 Feb; 14(1): e50-8. DOI: 10.12816/0003336
- Bouaoun L., Sonkin D., Ardin M., Hollstein M., Byrnes G., Zavadil J., Olivier M. TP53 Variations in Human Cancers: New Lessons from the IARC TP53 Database and Genomics Data. Hum Mutat. 2016 Sep; 37(9): 865-76. DOI: 10.1002/humu.23035
- Leroy B., Fournier J.L., Ishioka C., Monti P., Inga A., Fronza G., Soussi T. The TP53 website: an integrative resource centre for the TP53 mutation database and TP53 mutant analysis. Nucleic Acids Res. 2013 Jan; 41(Database issue): D9629. DOI: 10.1093/nar/gks1033


