Случай глазных проявлений токсического воздействия гидроксихлорохина
Автор: Казарян Армине Амасевна, Пономарва Елена Николаевна
Журнал: Клиническая практика @clinpractice
Рубрика: Случай из практики
Статья в выпуске: 2 (6), 2011 года.
Бесплатный доступ
На основании собственного опыта и анализа существующих немногочисленных статей по данной тематике авторами диагностирован и описан клинический пример редкого симптомокомплекса, связанного с приемом гидроксихлорохина у пациентки, страдающей саркоидозом и сахарным диабетом 1 типа. Выявление симптомов данного поражения в обычной практике врача-офтальмолога представляется сложным из-за редкости заболевания, отсутствия информированности и преемственности между врачами других специальностей, в частности между ревматологами и пульмонологами. В описании клинического случая приведены рекомендации Американской академии офтальмологии по эффективному скринингу пациентов, принимающих гидроксихлорохин.
Гидроксихлорохин, хлорохиновая ретинопатия, хлорохиновая макулопатия, плаквенил
Короткий адрес: https://sciup.org/14338372
IDR: 14338372
Текст научной статьи Случай глазных проявлений токсического воздействия гидроксихлорохина
Хлорохин и гидроксихлорохин (ГХ) – препараты, получившие применение при лечении ревматологических и кожных заболеваний еще в начале 50-х годов XX века. Хлорохин с момента получения в 1934 г. широко известен как противомалярийный препарат. ГХ синтезирован в 1946 г. [1, 2] и в настоящее время активно используется в виде нескольких химических производных. В России наиболее известна такая торговая марка препарата гидроксихлорохина сульфата, как ГХ. В настоящее время ГХ относится к числу так называемых «малых» иммунодепрессантов и используется в лечении многих ревматичес- ких заболеваний, а также входит в схемы лечения саркоидоза. Точный терапевтический механизм действия препарата до конца не ясен. Предполагается, что ГХ ингибирует эн-досомальный толл-подобный рецептор, в связи с чем нарушает активацию В-клеток и клеток, отвечающих за фагоцитоз, в частности дендритных [3].
Внимание офтальмологов препараты данной группы привлекли еще 1957 г., когда Cambiaggy впервые описал случай возникновения одного из проявлений токсичности препарата – хлорохиновой ретинопатии (ХР) [4], а в 1967 г. Shearer и Dubois впервые в медицинской литературе сообщили о ретинопа- тии, вызванной ГХ [5]. В исследованиях на животных оказалось, что ГХ почти на 60% менее токсичен хлорохина [6], что и обусловливает доминирующее применение в медицине первого. Токсические эффекты препаратов на глаз очень разнообразны и включают ретинопатию, кератопатию, нарушение функции цилиарного тела, помутнение хрусталика.
Актуальность
Поражение глаз при приеме хлорохиновых производных, в частности ГХ, встречается достаточно редко, в связи с чем наблюдается отсутствие осведомленности практикующих офтальмологов по этой теме, что дополняется трудностью диагностики поражений глаз в связи с их вариабельностью. Кроме того, отмечается полное отсутствие каких-либо наблюдений в отечественной офтальмологической литературе, исключая официальные инструкции к препарату. Актуальность темы продиктована в том числе достаточно широким применением препарата в медицине, а также необратимостью и фатальным нарушением зрительных функций при некоторых формах токсического поражения глаз.
Фармакокинетика ГХ
Препарат хорошо распределяется в организме, накапливаясь в тканях с высоким уровнем обмена – в печени, почках, легких, селезенке, где концентрация может превышать плазменную в 200-700 раз, а также в центральной нервной системе, эритроцитах, лейкоцитах и в тканях, богатых меланином, таких как пигментный эпителий, хороидея, в том числе радужная оболочка и цилиарное тело [7], а также в роговице, обусловливая возникновение побочных эффектов.
В печени ГХ частично превращается в активные этилированные метаболиты и выводится в основном почками, а также с желчью. Из организма препарат выводится крайне медленно – период полуэлиминации составляет около 50 дней (из цельной крови) и 32 дня (из плазмы). Учитывая такой низкий клиренс из организма, симптомы токсичности могут возникать еще спустя 3-6 мес. после отмены препарата [8].
Глазные проявления токсичности ГХ
Проявления токсичности препарата зависят от ряда факторов: ежедневная и кумуля- тивная доза, продолжительность лечения, состояние печени и почек, возраст пациента, предшествующие заболевания сетчатки, а также некоторые наследственные факторы (например, мутация в гене ABCA4) [9]. Рекомендованная ежедневная доза препарата должна составлять не более 6,5 мг/кг массы тела с учетом наличия у пациента ожирения. Поскольку препарат не накапливается в жировой ткани, расчет его дозы у полных людей может приводить к значительному превышению ежедневной дозы.
Одним из самых ранних проявлений токсичности хлорохина и его производных является кератопатия, основе которой – отложение солей препарата в эпителии роговицы [10] и/или соединение солей препарата с нуклеопротеинами клеток стромы роговицы [11], которые могут появляться спустя 2-3 нед. после начала приема лекарственного средства [10]. Как правило, наличие кератопатии не является причиной отмены препарата [12]. Отложения носят весьма разнообразный характер – от диффузных точечных помутнений до радиальных изогнутых линий, концентрирующихся вблизи центральной части роговицы, так называемая вортекс-кератопатия (воронкообразная или мутовчатая кератопатия) [10]. Частота кератопатии, по данным Easterbrook, не превышает 5% у пациентов, получающих ГХ в ежедневной дозе 400 мг/кг [8]. Как правило, изменения роговицы редко приводят к снижению зрения и полностью обратимы при отмене препарата. Однако у некоторых пациентов наблюдается фотофобия и эффект halo при взгляде на источники света.
Нарушение функции цилиарной мышцы очень редко возникает при приеме ГХ и является полностью обратимым [13]. Более развернутых данных о дисфункции цилиарного тела в литературе нет.
Наиболее изученной и более актуальной является проблема поражения сетчатки при приеме ГХ, так называемая хлорохиновая ретинопатия (проявления идентичны при приеме хлорохина), которая, как правило, ограничена только макулярной зоной – хлорохиновая макулопатия (ХМ) или может приводить к поражению всей площади сетчатки – пигментная ХР. Easterbrook дал четкое определение понятия ХМ как двустороннего стойкого, как минимум двухкратно воспроизводимого дефекта полей зрения [8].
Пациенты могут предъявлять жалобы на снижение и искажение зрения, трудности при чтении, нарушение цветового зрения, световые вспышки, фотофобию, появление дефектов в центральном поле зрения. Офтальмоскопически поражение макулы на ранних стадиях представляет собой исчезновение фове-ального рефлекса, что, однако, по мнению многих авторов, является изменением обратимым. Впоследствии развивается нарушение пигментации по типу колец в зоне фовеа, часто с сохранением фовеолы, с классическим проявлением так называемой макулопатии по типу «бычий глаз» – кольцо депигментации, окруженное, в свою очередь, кольцом гипер- и депигментации. При тяжелых формах маку-лопатии возникает выраженная атрофия пигментного эпителия сетчатки (ПЭС) в макуле с «обнажением» крупных хориоидальных сосудов. В более поздних стадиях поражения характерно отложение пигмента на периферии сетчатки и сужение ретинальных сосудов. При таких формах ретинопатии острота зрения, как правило, не превышает 0,1 [14].
Частота возникновения ретинопатии при соблюдении рекомендованной дозы препарата 6,5 мг/кг в день, по данным многих авторов, составляет от 0-4% [15]. В большом исследовании, основанном на ретроспективном анализе, из 1207 пациентов, получавших ГХ, только у 1 пациента зарегистрирована ретинопатия (0,08%) [16]. В целом при режиме дозирования не более <6,5 мг/кг (худощавый пациент) в течение первых 5 лет приема препарата и при отсутствии нарушения функции почек/печени частота возникновения ретинопатии очень низкая (<1/1000) [7, 17].
Механизм ретинотоксичности
Механизм ретинотоксичности ГХ интенсивно изучался, однако однозначного мнения до настоящего времени не сформировано. В исследованиях на животных выявлено, что патологические изменения в сетчатке возникают задолго до видимых офтальмоскопических признаков ретинотоксичности [18].
Одними из самых обсуждаемых гипотез ретинотоксичности препарата являются:
-
а) его связывание с пигментом ПЭС, что приводит к повышению концентрации препарата в клетке [19];
-
б) влияние на фагоцитоз клеток ПЭС [10], вероятно, связанное с основным механизмом
действия препарата на толл-подобный рецептор, а также влияние на ганглиозные клетки [20] и далее на фоторецепторы в перифове-альной зоне, что подтверждается гистологическими находками [21].
По-видимому, все эти события имеют место быть, и концепция механизма токсичности препарата может выглядеть так [22]:
-
(1) Скопление солей ГХ в клетках ПЭС и их связывание с гранулами меланина.
-
(2) Нарушение функции фагоцитоза клеток ПЭС и «сбрасывание» наружных сегментов фоторецепторов вследствие лизосомотропного действия производных хлорохина [23].
-
(3) Внутриклеточное образование миелиновых телец, которые нарушают метаболизм в клетках ПЭС.
-
(4) Деструкция палочек и колбочек как результат дефицита функции клеток ПЭС.
Однако в более поздних сообщениях не наблюдается корреляции между токсичностью и связыванием препарата с меланином [24, 25, 26]. Основной современной гипотезой ретинотоксичности является представление о том, что пусковым механизмом ретинопатии является критический уровень накопления липидных комплексов в ганглиозных и биполярных клетках, а также в глиальных клетках сетчатки – клетках Мюллера [27, 28, 29, 30]. Впоследствии эти процессы могут приводить к повреждению ДНК клетки и ее гибели путем некроза [30]. В качестве дополнительных механизмов токсичности препарата выступают повышение уровня внутриклеточного pH, что приводит к нарушениям процесса рецепции на клеточной поверхности [15], снижение активности ферментных систем [31, 32] и снижение продукции простагландинов [9].
Методы диагностики
Основными и значимыми методами диагностики лекарственного поражения глаз являются рутинные исследования – исследование остроты зрения, биомикроскопия переднего отрезка глаза и офтальмоскопия.
Среди дополнительных методов диагностики в случае хлорохиновой токсичности выступают тест Амслера, поле зрения, исследование цветовой и контрастной чувствительности, электроретинография, электро-окулография, фоторегистрация глазного дна, оптическая когерентная томография (ОКТ), ангиография сетчатки, аутофлюоресценция сетчатки, исследование темновой адаптации, чувствительность и специфичность которых вариабельна, по мнению разных авторов.
Тест Амслера является наиболее доступным, воспроизводимым, простым для самостоятельного использования пациентом, достаточно чувствительным и дешевым методом скрининга пациентов с предполагаемым диагнозом хлорохиновая ретинотоксичность [10]. С целью повышения чувствительности предпочтительнее использование цветовой – красной сетки Амслера [33].
Исследование поля зрения является основным дополнительным методом диагностики поражения глаза при приеме ГХ, и результат проведенного дважды и воспроизводимого исследования лежит в основе определения ХМ. При исследовании выявляются относительные или абсолютные парацентральные скотомы. Предпочтительно использование программы 10-2 на анализаторе поля зрения Хамфри [10], а также с целью повышения чувствительности исследования возможно использование сине-желтого паттерна [34].
Исследование цветовой чувствительности общепринятыми методами, разработанными для определения врожденной патологии (методы упорядочивания цветовых оттенков, изохроматические таблицы), по-видимому, нецелесообразно в связи с небольшими размерами приобретенных дефектов. Крупные оптотипы в тестах на исследование врожденных цветоаномалий проецируются на диагностическую зону макулярной области, что вызывает пространственную суммацию и ответ, который не отражает истинного цветоощущения и топографического распределения нарушений. Очевидно, что такие методы оказываются малочувствительными для обнаружения как локального нарушения цвето-восприятия сетчатки, так и в случае начальных стадий приобретенной патологии цветового зрения. С помощью этих методов можно выявить нарушение цветовосприятия только при довольно грубой патологии, которую можно выявить и при офтальмоскопии. Тем не менее, некоторые авторы прибегают к исследованию цветового зрения при ХР общепринятыми способами и получают результаты в виде снижения красно-зеленого паттерна цветового зрения [35]. Использование компь- ютеризированных методов исследования цветового зрения, как например, программы "Offon" (МБН, Москва) может наряду с тестом Амслера и анализатором Хамфри стать скрининговым методом для определения нарушения цветового зрения для пациентов с данной патологией.
Окулография как метод выявления ранних изменений при ХР, по данным Moschos и соавторов, менее чувствителен, чем мультифокальная ЭРГ [36], к тому же специфичность метода, по данным разных авторов, является неоднозначной [22].
Исследование темновой адаптации и макулярное время восстановления в современных исследованиях по ретинотоксичности практически не применяются, в том числе и из-за низкой специфичности этих методов при данной патологии.
Изменения на ганцфельд ЭРГ зафиксированы от супернормальных значений до субнормальной, негативной и даже отсутствующей ЭРГ [37] и в основном встречались при диффузной патологии сетчатки [11]. Частота патологической ЭРГ имела линейную корреляцию с продолжительностью лечения препаратом – от 9% (1-2 года лечения) до 22% (3-8 лет лечения) [31].
Чаще всего среди электроретинографичес-ких методов авторы используют мфЭРГ, которая, по прогнозам некоторых авторов, может претендовать на альтернативу исследованию поля зрения. Так, типичное снижение амплитуд ЭРГ-кривой в парацентральной области зафиксировано у пациентов, принимающих ГХ, с нормальным полем зрения и при отсутствии изменений на глазном дне [36, 38].
ФАГ как метод диагностики хлорохиновой премакулопатии практически не используется в связи с низкой чувствительностью на этой стадии, а также инвазивностью метода. Для диагностики ранних структурных изменений при ХМ наибольшей перспективой обладают неинвазивные методы: ОКТ и аутофлюоресценция сетчатки, результаты использования которых при данной патологии в литературе практически отсутствуют.
Скрининг
Вопрос офтальмологического скрининга пациентов, получающих ГХ, и целесообразности его проведения остается вопросом очень дискутабельным. Так, в 1993 г. офталь- мологами лондонского Royal College проведение скрининга таких пациентов признано нецелесообразным [39], тем не менее, под давлением дерматологов и ревматологов в 1999 г. все же были опубликованы рекомендации по ведению таких пациентов [12].
Вопрос дискуссии, безусловно, ясен – стоимость проводимых исследований при скрининге несравнима с частотой поражения глаз при хлорохиновой токсичности, которая крайне мала. Тем не менее, поражение сетчатки является серьезным и необратимым последствием приема препарата, что обусловливает целесообразность хотя бы минимального скринингового исследования.
Наиболее известным является протокол-рекомендация Американской академии офтальмологии 2002 г. по ведению пациентов, получающих производные хлорохина [19] (см. Приложение 1).
Прогноз
Прогноз для зрения при своевременно зафиксированных осложнениях терапии ГХ достаточно благоприятный, особенно в отношении роговицы и цилиарного тела. Изменения роговицы полностью обратимы спустя 6-8 нед. после отмены препарата [40]. Изменения сетчатки при ранних стадиях поражения также могут быть обратимы. Тем не менее, в некоторых случаях, особенно на развитых стадиях патологического процесса, поражения сетчатки могут прогрессировать и даже после отмены препарата в течение 3-6 мес. [19].
В нашей практике мы наблюдали случай токсического поражения глаз у пациентки с редкой сочетанной патологией – саркоидозом внутригрудных лимфоузлов и сахарным диабетом 1 типа.
Пациентка А., 1982 г. рождения поступила в офтальмологическое отделение 29 июня 2010 г. с жалобами на постоянный дискомфорт и ощущение инородного тела в обоих глазах, светобоязнь, снижение зрения вдаль и вблизи, нестабильность зрения, болезненность в глазных яблоках, преимущественно в левом глазу.
22 апреля 2010 г. впервые обратилась к офтальмологу по срочным показаниям, когда ночью отметила выраженную болезненность, слезотечение, покраснение левого глаза. В поликлинике по месту жительства поставлен диагноз – иридоциклит, сухой синдром лево- го глаза, по поводу чего получала антибиоти-котерапию, стероиды, нестероидные противовоспалительные средства (НПВС), препараты искусственной слезы в виде инстилляций с умеренно положительным эффектом – жалобы на дискомфорт и покраснение конъюнктивы продолжали беспокоить. 14 мая 2010 г. появились схожие симптомы воспаления в правом глазу: поставлен диагноз иридоциклит, рецидивирующая эрозия роговицы, в связи с чем назначены НПВС, дексаметазон, препараты искусственной слезы в виде инстилляций. На фоне проведенной терапии симптомы воспаления были купированы.
Из анамнеза известно, что пациентка с тринадцатилетнего возраста страдает сахарным диабетом 1 типа, получает короткодействующий инсулин – актрапид и пролонгированный лантус, на фоне которых за весь период наблюдения пациентки сахарный диабет остается компенсированным (гликированный гемоглобин – 6,5%). Кроме того, при ежегодном обследовании, в начале октября 2009 г., на рентгенограмме органов грудной клетки обнаружено увеличение внутригрудных лимфоузлов. После дообследования (кроме гистологической верификации) поставлен диагноз – саркоидоз внутригрудных лимфоузлов. От назначения системных стероидов решено было отказаться из-за сахарного диабета, и назначен гидроксихлорохин (ГХ) в дозе 400 мг в день. Масса тела пациентки на момент назначения составляла 55 кг. Ежедневная доза препарата при учете астенического телосложения составила 7,3 мг/кг Через несколько недель после назначения ГХ больная отметила тошноту и неоднократную рвоту, в связи с чем в начале января 2010 г. доза препарата была снижена пациенткой до 200 мг в день. Тем не менее сохранялись жалобы на тошноту, ухудшился аппетит. В феврале 2010 г. больная прекратила прием ГХ. При контрольном рентгеновском исследовании грудной клетки обнаружено уменьшение размеров внутриг-рудных лимфоузлов.
При осмотре в офтальмологическом отделении выявлена поверхностная инъекция конъюнктивы, складки конъюнктивы у латерального края нижнего века, кератопатия по типу диффузных субэпителиальных точечных помутнений на обоих глазах, цилиарная болезненность при пальпации, преимущественно на правом глазу, вялая реакция зрачка на свет справа, в вертикальном направлении вытянутый зрачок на обоих глазах (рис. 1).
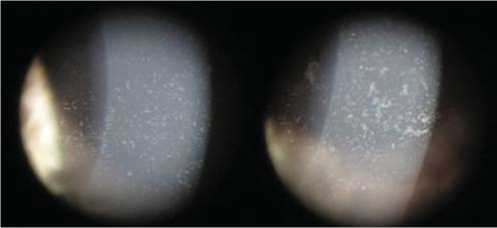
Рис. 1. Субэпителиальные помутнения в роговице.
Острота зрения OD=0,5 shp.(-1,5 D)=1,0, OS=0,6 shp.(-1,0D)=1,0. До первого проявления текущего заболевания пациентка отмечала хорошее зрение вдаль без коррекции. Внутриглазное давление при исследовании на пневмотонометре составило в обоих глазах 15 мм рт. ст.
В макулярной зоне обоих глаз отмечалась сохранность фовеолярного рефлекса, но вокруг фовеолы, особенно на левом глазу, отмечалась легкая пигментация в форме овала. Кроме того, паравазально и в макулярной зоне отмечалось множество зернистых желтоватых включений. Типичных для диабетической ретинопатии офтальмоскопических изменений глазного дна не зафиксировано. В поле зрения (компьютерный периметр Хамфри 302) дефектов не обнаружено. Тест Амслера отрицательный на обоих глазах.
При проведении оптической когерентной томографии в зоне фовеа отмечали единичные локусы нарушения целостности слоя окончаний фоторецепторов, без нарушения архитектоники слоев сетчатки (рис. 2).
Пациентке назначена противовоспалительная терапия (НПВС, дексаметазон в каплях), мидриатики, кератопротективное лечение.
За период наблюдения в отделении выявлена неустойчивая положительная динамика со стороны роговицы – снижение интенсивности субэпителиальных помутнений, в течение дня пациентка отмечала колебания остроты зрения (при авторефрактометрии колебания рефракции в течение дня составляли от -3,0 до -1,0 диоптрии), эффект расфокусировки и периодически возникающие боли в глазах. После закапывания мидриатиков, особенно симпатомиметического действия, она отмечала улучшение. На фоне проводимого лечения пациентка отмечала стабилизацию зрения, уменьшение болей, светобоязни и дискомфорта. Объективно наблюдалось незначительное уменьшение помутнений роговицы.
Пациентка выписана на амбулаторное наблюдение 15 июля 2010 г. с рекомендацией проведения электроретинографического исследования (макулярной ЭРГ) в отсроченном порядке из-за кератопатии. На амбулаторном этапе пациентке оставлены препараты искусственной слезы, не содержащие консервант, и мидриатики. При выписке острота зрения правого глаза c коррекцией sph -0,75=1,0; левого глаза с коррекцией sph -0,5 cyl -0,5 ax =1,0.
29 июля 2010 г., на следующий день после проведенной флюоресцентной ангиографии, пациентка вновь обратилась в офтальмологическое отделение КБ № 83 с жалобами на боль, покраснение и слезотечение левого глаза. На представленных результатах флюоресцентной ангиографии обнаружено просачивание красителя в месте локального нарушения проницаемости сосудистой стенки – локализация микроаневризм (рис. 3).
29 июля 2010 г. острота зрения: ОD sph -0,75=1,0; ОS sph -0,75=0,8. Внутриглазное давление на пневмотонометре ОD – 15 мм рт. ст., ОS – 8 мм рт. ст.
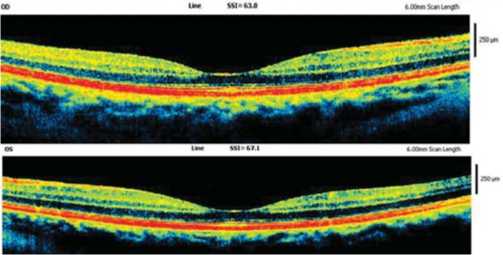
Рис. 2. ОКТ макулярной зоны.
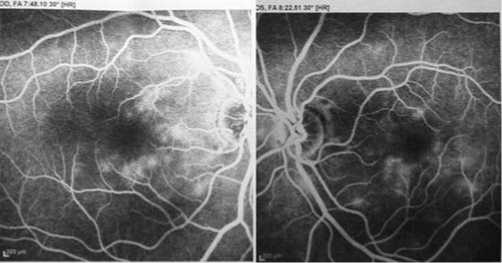
Рис. 3. Ангиографическая картина (поздняя фаза)
По данным УЗИ, в левом глазу определялась щелевидная, спонтанно возникшая отслойка сосудистой оболочки. Клинически в этом же глазу выявлялась перилимбальная инъекция, мелкие прозрачные преципитаты роговицы, вялая реакция зрачка на свет. Назначены НПВС, стероиды, мидриатики. При очередном амбулаторном визите пациентка жалобы не предъявляла, внутриглазное давление на пневмотонометре – 12 мм рт. ст. Спустя 1 мес. наблюдений отмечено полное исчезновение признаков кератопатии, стабильное состояние рефракции.
Выполнено электроретинографическое исследование сетчатки на электроретинографе фирмы МБН (Россия): выявлена супернормальная амплитуда а-волны макулярной ЭРГ на красный и зеленый стимулы, субнормальная b-волна на синий стимул на обоих глазах и на зеленый стимул – в левом глазу, что, возможно, обусловлено преимущественным вовлечением в патологический процесс парафо-веолярной зоны. Нормальная макулярная ЭРГ на красный стимул свидетельствует о сохранности фовеолярной зоны сетчатки. Кроме того, отмечалось уменьшение индекса осцилляторных потенциалов до 7, что может быть объяснено изменениями внутренних слоев сетчатки связанными с сахарным диабетом, и/или токсическим влиянием ГХ на внутренние слои, что согласуется с одной из гипотез ретинотоксичности. Таким образом, изменение ЭРГ скорее отражает сочетанное влияние гипергликемии в рамках сахарного диабета и токсического влияния ГХ.
На декабрь 2010 г. жалобы на зрение отсутствовали, сохранялся устойчивый показатель рефракции, нормальное состояние роговицы; при офтальмоскопии отмечали уменьшение проявления пигментации по типу овального кольца, выявленного при первичном осмотре.
Обсуждение
Учитывая анамнез пациентки, общесоматические жалобы (диспептические явления), рецидивирующее течение заболевания глаз, сочетание дисфункции цилиарного тела, патологии роговицы, а также, возможно, вовлечение макулярной зоны, можно думать о системном характере поражения. Перечисленные офтальмологические нарушения не характерны для течения типичных осложнений сахарного диабета. Учитывая относительно недавний прием препарата хлорохинового ряда, в том числе в первые 2 мес. лечения саркоидоза лимфоузлов в неадекватных ежедневных дозах, способность препарата кумулировать в организме и вызывать побочные эффекты даже спустя 3-6 мес. после его отмены, характерные клинические проявления токсичности препарата (кератопатия, дисфункция цилиарного тела, макулопатия), устойчивость к противовоспалительной терапии, с высокой долей вероятности можно предположить токсическое воздействие вещества хлорохиновой группы на орган зрения.
Учитывая данные обзора литературы, остаются не ясными следующие вопросы: почему в такой низкой кумулятивной дозе препарат ГХ оказал токсическое воздействие? Почему поражение глаз протекало по типу острых проявлений в отдаленном периоде после отмены препарата ГХ?
Проявление токсичности препарата в столь низких кумулятивных дозах (в данном случае порядка 50 г) может объясняться индивидуальной чувствительностью к препарату, а также наличием хронического заболевания (сахарный диабет 1 типа), способствующего изменению обмена веществ. Например, неблагоприятное воздействие на функцию печени и почек, лизосомную активность, запускание процесса гликозилирования белков, что в свою очередь может изменить привычный путь выведения ГХ или затормозить его. Кроме того, пациентка ежедневно принимает другие лекарственные препараты – инсулины, в состав которых входят консерванты, в частности м-крезол, утилизирующейся печенью, и, возможно, эти препараты могут в какой-то степени тормозить выведение ГХ за счет конкуренции за метаболизм. Несмотря на распространенное мнение о хроническом токсическом влиянии препарата, нельзя исключить вероятность возникновения острого токсического поражения, связанного с приемом ГХ.
Проявление признаков токсичности в отдаленные сроки после отмены ГХ укладывается в сроки полувыведения препарата (50 дней из цельной крови), а приступообразный характер течения симптомов токсичности (в частности дисфункции цилиарного тела) может быть связан также и с родом занятия пациентки – длительная работа за компьютером. Последнее могло быть причиной напряжения цилиарного тела, приводящего к нару- шению процессов обмена в пигментном эпителии, который выступает в роли депо ГХ.
Таким образом, наличие сопутствующей патологии, в частности сахарного диабета 1 типа, может быть отнесено к неизвестным факторам риска по протоколу-рекомендации Американской академии офтальмологии и, по-видимому, определяет более частый и тща- тельный офтальмологический скрининг у таких пациентов при приеме производных хлорохина.
Кроме того, может быть оправдано применение термина «хлорохиновая офтальмопатия» при одновременном поражении нескольких структур глаза вследствие хлорохиновой токсичности.
ПРИЛОЖЕНИЕ 1
Протокол-рекомендация Американской академии офтальмологии (2002) по скринингу пациентов, получающих производные хлорохина:
-
1. Отсутствие скрининга в первые 5 лет терапии, при соблюдении следующих условий:
-
a) Нормальные показатели офтальмологических исследований перед началом терапии.
-
б) Доза препарата менее чем 6,5 мг/кг в день.
-
2. Ежегодный скрининг в первые 5 лет после начала лечения рекомендуется для пациентов с высоким или неизвестным риском из-за высоких или неизвестных доз препарата или других осложняющих факторов:
-
a) Другие факторы риска могут включать почечную и печеночную недостаточность.
-
б) Пациенты старше 60 лет, пациенты с макулодистрофией и пациенты с дистрофией сетчатки могут иметь высокий риск развития токсичности.
-
c) Ожирение может также быть фактором риска, являясь причиной неправильного дозирования препарата.
-
d) Предшествующий прием хлорохина или ГХ может увеличивать кумулятивную дозу препарата.
Первое исследование должно проводиться в течение первого года от начала терапии и включать следующие методы:
-
1. Полное офтальмологическое обследование, включая максимально корригируемую остроту зрения, исследование сетчатки и роговицы.
-
2. Исследование с использованием теста Амслера или поля зрения на анализаторе Хамфри программы 10-2.
-
3. Исследование цветового зрения является необязательным.
-
4. Фоторегистрация глазного дна является необязательным.
-
5. Флюоресцеиновая ангиография и мультифокальная ЭРГ не относится к
обязательным исследованиям, но обоснована у пациентов с уже имеющейся макулопатией или же при наличии необычных факторов риска.
|
Возраст |
Частота |
|
20-29 лет |
Как минимум 1 раз за период |
|
30-39 лет |
Как минимум 2 раза за период |
|
40-64 года |
Каждые 2-4 года |
|
65 лет и старше |
Каждые 1-2 года |
При отсутствии факторов риска частота производимых исследований в течение первых пяти лет терапии составляет:
У пациентов с изначально низким риском исследование должно быть проведено ранее запланированного при условии повышения дозы препарата, увеличения массы тела, развития нарушения функции печени или почек.
Пациенты с высоким риском в течение первых пяти лет лечения и все пациенты, получающие препарат более 5 лет, должны ежегодно обследоваться с включением дополнительных методов исследования.
У пациентов с высоким риском исследование на анализаторе Хамфри 10-2 может быть дополнено использованием сетки Амслера.
Периодическое фотографирование глазного дна может использоваться, особенно у пациентов с возрастными изменениями сетчатки или другой патологией, с целью дифференциальной диагностики между гидроксихлорохиновой токсичностью и другой патологией.
Список литературы Случай глазных проявлений токсического воздействия гидроксихлорохина
- Goodman L.S., Gilman A. The Pharmacological Basis of Therapeutics. New York: Macmillan, 1975. P. 1049-64.
- The History of Malaria, an Ancient Disease. Atlanta, GA: Centers for Disease Control and Prevention.
- Kalia S., Dutz J.P. New concepts in antimalarial use and mode of action in dermatology//Dermatologic Therapy. 2007. Vol. 20 (4). P. 160-174.
- Cambiaggi A. Unusual ocular lesions in a case of systemic lupus erythematosus. AMA//Arch. Ophthalmol. 1957. Vol. 57. P. 451-3.
- Shearer R.V., Dubois E.L. Ocular changes induced by long term hydroxychloroquine (Plaquenil) therapy//Am. J. Ophthalmol. 1967. Vol. 64. P. 245-252.
- McChesney E.W. Animal toxicity and pharmacokinetics of hydroxychloroquine sulfate//Am. J. Med. 1983. Vol. 75. P. 11-18.
- Инструкция по применению к препарату ГХ http://www.regmed.ru/InstrShow2.asp?InstrLinkNx= a21ba25ba94ba23b.
- Easterbrook M. The ocular safety of hydroxychloroquine//Semin. Arthritis & Rheumatism. 1993. Vol. 23 (2 Suppl 1). P. 62-67.
- Shroyer N.F., Lewis R.A., Lupski J.R. Analysis of the ABCR(ABCA4) gene in 4aminoquinoline retinopathy//Am. J. Opthalmol.2001. Vol. 131. P. 761-6.
- Yam J.C., Kwok A.K. Ocular toxicity of hydroxychloroquine//Hong Kong Med. J. 2006. Vol. 12 (4). P. 294304.
- Bernstein H.N. Chloroquine ocular toxicity//Surv. Ophthalmol. 1967. Vol. 12. P. 415-47.
- Jones S.K. Ocular toxicity and hydroxychloroquine: guidelines for screening//Br. J. Dermatology. 1999. Vol. 140. P. 37.
- Tehrani R., Ostrowski R.A., Hariman R., Jay W.M. Ocular toxicity of hydroxychloroquine//Semin. Ophthalmology. 2008. Vol. 23 (3). P. 201-209.
- Клиническая офтальмология. Систематизированный подход. Дж. Кански. 2009. 944 с.
- GonzalezNoriega A., Grubb J.H., Talkad V., Sly W.S. Chloroquine inhibits lysosomal enzyme pinocytosis and enhances lysosomal enzyme secretion by impairing receptor recycling//J. Cell Biol. 1980. Vol. 85. P. 839-852.
- Levy G.D., Munz S.J., Paschal J. et al. Incidence of hydroxychloroquine retinopathy in 1,207 patients in a large multicenter outpatient practice//Arthritis Rheum. 1997. Vol. 40. P. 1482-86.
- Weisinger H.S., Pesudovs K., Collin H.B. Management of patients undergoing hydroxychloro quine (Plaquenil) therapy//Clin. Exp. Optom. 2000. Vol. 83. P. 32-36.
- Rosenthal A.R., Kolb H., Bergsma D. et al. Chloroquine retinopathy in the rhesus monkey//Invest. Ophthalmol. Vis. Sci. 1978. Vol. 17. P. 1158-75.
- Marmor M.F., Carr R.E., Easterbrook M. et al. Recommendations on screening for chloroquine and hydroxychloroquine retinopathy: a report by the American Academy of Ophthalmology//Ophthalmology. 2002. Vol. 109 (7). P. 1377-82.
- RodriguezPadilla J.A., Hedges T.R., 3rd, Monson B. et al. Highspeed ultrahighresolution optical coherence tomography findings in hydroxychloroquineretinopathy//Arch. Ophthalmol. 2007. Vol. 125 (6). P. 775-80.
- Hodgkinson B.J., Kolb H. A preliminary study of the effect of chloroquine on the rat retina//Arch. Ophthalmol. 1970. Vol. 84. P. 509-15.
- Tzekov R. Ocular toxicity due to chloroquine and hydroxychloroquine: electrophysiological and visual function correlates//Doc. Ophthalmol. 2005. Vol. 110 (1). P. 111-120.
- Rynes R.I. Antimalarial drugs/Textbook of Rheumatology. In: Kelley WN, Harris ED, Ruddy S, Sledge CB eds. Textbook of Rheumatology, Philadelphia: W.B. Saunders Co., 1997. P.747-58.
- Ivanina T.A., Zueva M.V., Lebedeva M.N. et al. Ultrastructural alterations in rat and cat retina and pigment epithelium induced by chloroquine//Graefes Arch. Clin. Exp. Ophthalmol. 1983. Vol. 220 (1). P. 32-38.
- Kuhn H., Keller P., Kov
- Leblanc B., Jezequel S., Davies T. et al. Binding of drugs to eye melanin is not predictive of ocular toxicity//Regul. Toxicol. Pharmacol. 1998. Vol. 28. P. 124-32.
- Duncker G., Bredehorn T. Chloroquineinduced lipidosis in the rat retina: functional and morphological changes after withdrawal of the drug.//Graefes Arch. Clin. Exp. Ophthalmol. 1996. Vol. 234. P. 378-81.
- Duncker G., Schmiederer M., Bredehorn T. Chloroquineinduced lipidosis in the rat retina: a functional and morphological study//Ophthalmologica. 1995. Vol. 209. P. 79-83.
- Gregory M.H., Rutty D.A., Wood R.D. Differences in the retinotoxic action of chloroquine and phenothiazine derivatives//J. Pathol. 1970. Vol. 102. P. 139-50.
- Tanenbaum L., Tuffanelli D.L. Antimalarial agents. Chloroquine, hydroxychloroquine, and quinacrine//Arch. Dermatol. 1980. Vol. 116. P. 587-591.
- Wada A., Sakurai S., Kobayashi H. et al. Suppression by phospholipase A2 inhibitors of secretion of catecholamines from isolated adrenal medullary cells by suppression of cellular calcium uptake//Biochem. Pharmacol. 1983. Vol. 32. P. 1175-78.
- Yanoff M., Tsou K.C. A tetrazolium study of the whole eye: effect of chloroquine in the incubation medium//Am. J. Ophthalmol. 1965. Vol. 59. P. 808-810.
- Almony A., Garg S., Peters R.K. et al. Threshold amsler grid as a screening tool for asymptomatic patients on hydroxychloroquine therapy//Br. J. Ophthalmol. 2005. Vol. 89 (5). P. 569-574.
- Razeghinejad M.R., Torkaman F., Amini H. Blueyellow perimetry can be an early detector of hydroxychloroquine and chloroquine retinopathy//Med. Hypotheses. 2005. Vol. 65 (3). P. 629-630.
- Vu B.L., Easterbrook M., Hovis J.K. Detection of color vision defects in chloroquine retinopathy//Ophthalmology. 1999. Vol. 106. P. 1799-1803.
- Moschos M.N., Moschos M.M., Apostolopoulos M. et al. Assessing hydroxychloroquine toxicity by the multifocal ERG//Doc. Ophthalmol. 2004. Vol. 108. P. 47-53.
- Nylander U. Ocular damage in chloroquine therapy//Acta Ophthalmol (Copenh). 1967. Suppl 92. P. 171.
- Tzekov R.T., Serrato A., Marmor M.F. ERG findings in patients using hydroxychloroquine//Doc. Ophthalmol. 2004. Vol. 108. P. 87-97.
- Royal College of Ophthalmologists. Chloroquine, Hydroxychloroquine and the Eye. London: RCO, 1993.
- Easterbrook M. Is corneal deposition of antimalarial any indication of retinal toxicity?//Can. J. Ophthalmol. 1990. Vol. 25. P. 249-251.


