Случай лечения грибковой перипротезной инфекции с применением имплантата с углеродным покрытием
Автор: Малюченко Л.И., Николаев Н.С., Любимова Л.В., Преображенская Е.В., Ефимов Д.Н.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клинический случай
Статья в выпуске: 6 (60), 2022 года.
Бесплатный доступ
Введение. Эндопротезирование - наиболее частый метод хирургического лечения пациентов с терминальной стадией артроза коленного сустава. От 2 до 7 % прооперированных занимают пациенты с ревматоидным артритом. Воспалительный процесс в суставе, низкий реабилитационный потенциал, длительная терапия гормональными и генно-инженерными биологическими препаратами, низкое качество кости формируют высокий риск развития перипротезной инфекции. У данной группы пациентов сапрофитный микроорганизм Candida albicans с большей частотой образует биопленки на компонентах эндопротезов, что представляет трудности в лечении перипротезной инфекции.Цель исследования: демонстрация клинического случая и обоснование лечения перипротезной инфекции коленного сустава, вызванной Candida albicans, с помощью ревизионного имплантата с антибиопленочным покрытием.Материалы и методы. Представлен клинический случай, оценены результаты обследования и лечения пациента 46 лет с вторичным гонартрозом на фоне ревматоидного артрита с развившейся перипротезной инфекцией. Хирургическое лечение проведено методом двухэтапной санации с применением в составе спейсера имплантата, покрытого двумерно-упорядоченным линейно-цепочечным углеродом, легированным серебром, на фоне этиотропного внутривенного введения флуконазола на этапах лечения.Результаты. Вероятная причина развития грибковой перипротезной инфекции - снижение активности иммунной системы на фоне приёма цитостатиков и гормональных препаратов в сочетании с частым бесконтрольным приёмом антибактериальных препаратов по поводу инфекции мочеполовой системы. Выбор хирургической тактики в пользу двухэтапной ревизии обоснован выделением «difficult to treat» микроорганизма (Candida albicans). Своевременная диагностика и выбранный метод лечения в комплексе позволили достичь положительного исхода лечения грибковой перипротезной инфекции (отсутствие рецидива на сроке наблюдения 12 месяцев после второго этапа санации).Выводы. Клинический случай демонстрирует эффективность применения на этапе санации спейсера, покрытого двумерно-упорядоченным линейно-цепочечным углеродом, легированным серебром, для лечения перипротезной инфекции, вызванной «difficult to treat» микроорганизмом Candida albicans, способным к продуцированию биопленок.
Перипротезная инфекция, candida albicans, двухэтапная ревизия, спейсер, углеродное покрытие, серебряное напыление
Короткий адрес: https://sciup.org/143179590
IDR: 143179590 | УДК: 617.58.77-616-002.828 | DOI: 10.20340/vmi-rvz.2022.6.CASE.1
Текст научной статьи Случай лечения грибковой перипротезной инфекции с применением имплантата с углеродным покрытием
УДК 617.58.77-616-002.828
Эндопротезирование – наиболее частый метод хирургического лечения пациентов с терминальной стадией артроза коленного сустава. В мире каждый год выполняется около 2 млн таких операций с тенденцией к постоянному увеличению числа имплантаций. По данным ряда авторов, к 2030 году количество операций первичного эндопротезирования коленного сустава вырастет до 3,48 млн [1, 2]. Некоторую часть занимают пациенты с ревматоидным артритом, и их число колеблется от 2 до 7 % [3, 4]. Сложность лечения этой категории пациентов связана с наличием воспалительного процесса в суставе, низким реабилитационным потенциалом, длительной терапией гормональными и генноинженерными биологическими препаратами, а также с низким качеством кости. Всё это способствует замедлению заживления послеоперационной раны, создавая высокий риск развития инфекционных осложнений, которые могут достигать 2 % [5].
Candida albicans (C. albicans) является сапрофитным микроорганизмом, бессимптомно колонизирующим желудочно-кишечный тракт, мочеполовую систему, ротовую полость и кожу большинства людей [6]. У людей со здоровой иммунной системой C. albicans часто безвреден, но применение антибактериальной или иммунодепрессивной терапии может привести к его разрастанию и вызвать заболевание, проявления которого варьируют от поверхностных инфекций слизистых оболочек и кожи (молочница, вагинальные дрожжевые инфекции и опрелости) до гематогенно-диссеминированных инфекций со значительной смертностью, приближающейся к 40 % [7, 8].
Грибковые инфекции опасны не только для людей с ослабленным иммунитетом (больные ВИЧ, пациенты с ревматоидным артритом или онкологические больные, получающие цитостатическую или иммуносупрессивную терапию), но и для здоровых людей с имплантированными медицинскими устройствами [9].
-
C. albicans продуцирует высокоструктурированные биопленки, заключённые во внеклеточный матрикс. Как только биопленка Candida образуется на имплантированном медицинском устройстве, она потенциально может вызывать диссеминированные инфекции кровотока и приводить к инвазивным системным инфекциям тканей и органов.
Поскольку грибковые биопленки в значительной степени устойчивы к современной фармакотерапии, для лечения инфекций обычно требуются высокие дозы противогрибковых препаратов вместе с удалением колонизированного медицинского устройства [10, 11].
Методом верификации диагноза является выделение культуры C. albicans при микробиологическом и цитологическом исследовании пунктата или биоптата.
Грибковые возбудители по статистике составляют незначительную долю в этиологии инфекционных артритов [12]. Phelan LV с соавт. указывают частоту грибковой перипротезной инфекции (ППИ) на уровне 1 % [13]. В нашей практике мы наблюдали один случай перипротезной инфекции, вызванной C. albicans .
Цель и задачи: продемонстрировать клинический случай и обосновать тактику лечения пери-протезной инфекции коленного сустава, вызванной C. albicans .
Материал и методы
Проанализирован период работы Федерального центра травматологии, ортопедии и эндопротезирования с 2014 по 2021 год. В 2014 г. была введена в эксплуатацию штатная бактериологическая лаборатория. Все биологические материалы исследуются на базе Центра. По данным медицинской статистики за данный период времени (8 лет) частота инфекционных осложнений после всех проведённых оперативных вмешательств составила 0,4 %. Из них на долю перипротезной инфекции, вызванной грибами, приходится один случай, что составляет 0,0016 %.
Материалом исследования является клинический случай лечения перипротезной грибковой инфекции коленного сустава. Хирургическое лечение проведено методом двухэтапной санации. На первом этапе в составе спейсера применялся имплантат, покрытый двумерно-упорядоченным линейноцепочечным углеродом, легированным серебром (ДУ ЛЦУ+Ag), с фиксацией на костный цемент с добавлением амфотерицина В.
Покрытия ДУ ЛЦУ+Ag на этапе исследования были изучены на предмет антибактериальной активности, поверхностной бактерицидной активности, устойчивости к механическим воздействиям, антибиопленочной активности, биологической совместимости [14].
Настоящее исследование выполнено в соответствии с этическими стандартами, изложенными в Хельсинкской декларации Всемирной медицинской ассоциации «Этические принципы медицинских ис следований с участием человека», пересмотра 2013 г., перевод на русский язык; рекомендациями по проведению, описанию, редактированию и публикации результатов научной работы в медицинских журналах, подготовленных Международным комитетом редакторов медицинских журналов (раздел II E «Защита участников исследования») . Пациент дал информированное письменное согласие на применение имплантата указанной модификации и публикацию клинического наблюдения.
Пациент А., 46 лет, страдает ювенильным ревматоидным артритом с 4-летнего возраста, проходил длительное лечение глюкокортикоидами. Из сопутствующих заболеваний: с 2020 г. страдает хроническим интерстициальным нефритом на фоне длительного приема нестероидных противовоспалительных средств (НПВС), мочекаменной болезнью с обтурацией левого мочеточника камнем и выполнением уретероцистонеостомии 29.09.2020 г., по поводу чего пациент начал часто и бесконтрольно принимать антибактериальные препараты.
Первичное обращение в Центр – в июле 2013 г. с жалобами на боли в правом коленном суставе, ограничение движений в суставе, использование при ходьбе костылей, затруднения при самообслуживании. После дообследования был диагностирован правосторонний вторичный гонартроз III стадии на фоне ювенильного ревматоидного артрита (рис. 1).
Ввиду неэффективности консервативного лечения патологии суставов пациенту было выполнено оперативное лечение – цементное эндопротезирование правого коленного сустава эндопротезом фирмы Zimmer (бедренный компонент NexGen LPS C, тибиальный компонент 3, вкладыш 10 мм).
Послеоперационный период и реабилитация – без особенностей, пациент вернулся к труду. На контрольной рентгенограмме – эндопротез с цементной фиксацией компонентов в правильном положении, цементная мантия вокруг феморального и тибиального компонентов эндопротеза распределена равномерно (рис. 2).
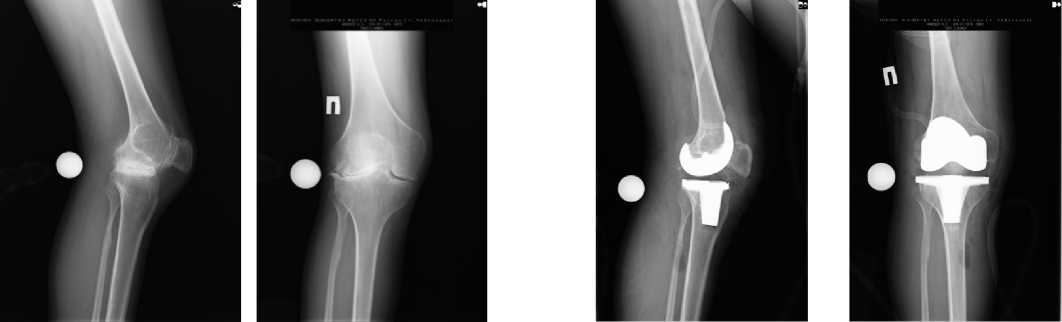
Рисунок 1. Рентгенограмма правого коленного сустава пациента А. в двух проекциях до операции
Figure 1. X-ray of the right knee joint of patient A. in two projections before surgery
Рисунок 2. Рентгенограмма правого коленного сустава пациента А. в двух проекциях после операции
Figure 2. X-ray of the right knee joint of patient A. in two projections after surgery
Диагностика перипротезной инфекции (ППИ) проводилась с учетом Европейских критериев диагностики ППИ (EBJIS 2019 The European Bone and Joint Infection Society 2018).
Оценка эффективности лечения проводилась с помощью клинического осмотра, шкалы функции коленного сустава Knee Society Score (KSS), анкеты качества жизни EuroQol (EQ5D5L) (с EuroQol visual analogue scale (EQ VAS)), визуальной аналоговой шкалы боли (ВАШ).
Результаты
Через 93 месяца после первичной операции состояние пациента ухудшилось. Впервые появились боли в правом коленном суставе, температура тела поднялась до 39 °C, в области коленного сустава появилась гиперемия с локальной гипертермией. Нарушилась опороспособность конечности, при ходьбе пришлось использовать костыли. На рентгенограмме выявлена нестабильность бедренного компонента эндопротеза коленного сустава (рис. 3).
Под ультразвуковой навигацией трехкратно выполнены пункции правого коленного сустава. В двух образцах отмечены высокий цитоз с нейтро-филезом (7500 (нейтрофилов 86 %) – 9400 (нейтрофилов 86 %) клеток в 1 мкл), в одном образце – ци-тоз 20 клеток в 1 мкл.
По Европейским критериям диагностики ППИ, увеличение в синовиальной жидкости количества лейкоцитов более 2000 кл/мкл, палочкоядерных гранулоцитов – более 70 % является одним из малых критериев, подтверждающих инфекционную природу воспаления перипротезной ткани.
В первом пунктате правого коленного сустава с высоким цитозом на третьи сутки обнаружен рост C. albicans , подтверждённый затем во втором пунк-тате. В пунктате с низким цитозом роста микроорганизмов не было.
Диско-диффузионным методом в соответствии с Рекомендациями по определению чувствительности микроорганизмов к антимикробным препаратам (Версия 2021-01 (CLSI)) выявлена чувствительность к флуконазолу.
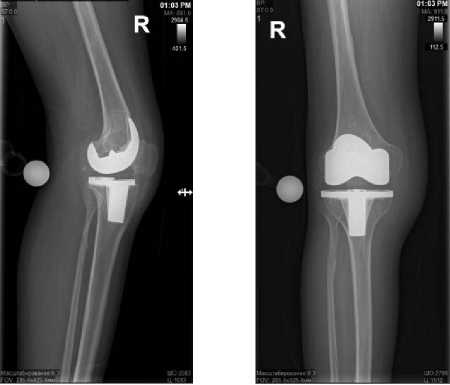
Рисунок 3. Рентгенограмма правого коленного сустава пациента А. в двух проекциях через 93 месяца после первичного эндопротезирования
Figure 3. X-ray of the right knee joint of patient A. in two projections after 93 months after primary endoprosthetics
В анализе крови отмечалось повышение маркеров воспаления: СРБ (104 мг/л), СОЭ (114 мм/час), пресепсина (351 пг/мл), прокальцитонина (0,092). Объём движений в суставе ограничен: фиксированная контрактура в положении сгибания 30°, разгибание невозможно из-за выраженного болевого синдрома, функциональные нарушения по шкале KSS оценены как неудовлетворительные; по шкале EQ5D5L – 0,155; по опроснику EQ VAS – в 20 %; по ВАШ – в 9 баллов. Диагностирована септическая нестабильность бедренного компонента эндопротеза правого коленного сустава. Учитывая грибковую этиологию перипротезной инфекции, относящуюся к «difficult to treat» (DTT) инфекции, определены показания для двухэтапного санирующего ревизионного эндопротезирования правого коленного сустава.
На первом этапе санации интраоперационно подтверждена нестабильность бедренного компонента, тибиальный компонент стабилен. Установлены цементный артикулирующий спейсер, выполненный из перестерилизованного бедренного компонента Zimmer NexGen LPS Right C с покрытием из ДУ ЛЦУ+Ag и тибиальным компонентом All poly size 3 12 мм (с целью профилактики образования микробных биопленок), на 40 гр цемента De Puy CMW 3 с гентамицином с добавлением 400000 Ед амфотерицина В (рис. 4).
В бактериологическую лабораторию доставлено шесть образцов интраоперационного материала (два мазка, два тканевых биоптата, аспират из полости сустава, удаленные компоненты эндопротеза). В дальнейшем рост C. albicans был подтверждён во всех образцах. Исследование удалённых компонентов эндопротеза для дальнейшего микробиологического анализа полученных смывов с целью разрушения возможных биопленок проводилось после предварительной обработки в ультразвуковой машине BRANSON 8510 (США) в течение 5 мин при частоте 40 ± 2 кГц и мощности 0,22 ± 0,04 Вт/см2.
Послеоперационный период протекал без особенностей. В условиях стационара пациент получал противогрибковую терапию флуконазолом внутривенно капельно в дозировке 200 мг 1 раз в сутки в течение 7 дней, также рекомендовано продолжить прием флуконазола перорально в дозе 300 мг в сутки в течение 6 недель на амбулаторном этапе.
На контрольных рентгенограммах после установки артикулирующего спейсера правого коленного сустава – цементный артикулирующий спей-сер правого коленного сустава; угол между механической осью правой бедренной кости и анатомической осью голени 5° (вальгус); угол вальгусного отклонения бедренной кости (между анатомической и механической осями) – 5°; состояние после рефиксации бугристости большеберцовой кости двумя винтами (рис. 5).
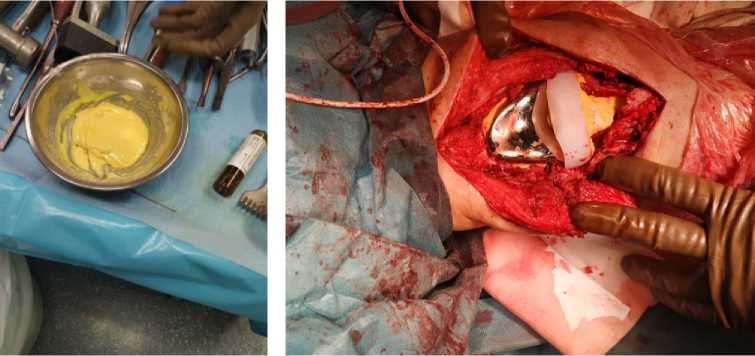
Рисунок 4. Подготовка и установка артикулирующего спейсера коленного сустава на первом этапе ревизионного эндопротезирования
Figure 4. Preparation and installation of an articulating spacer of the knee joint at the first stage of revision arthroplasty
Через 2,5 месяца пациент был приглашен на проведение второго этапа ревизии правого коленного сустава. На догоспитальном этапе проведена оценка эффективности первого этапа санации. Лабораторные исследования крови показали снижение маркеров воспаления до нормальных значений: СРБ (2,3 мг/л), СОЭ (7 мм/час), в пунктате правого коленного сустава цитоз составил 5 клеток в 1 мкл, роста микрофлоры не обнаружено. Второй этап ревизионного эндопротезирования правого коленного сустава выполнен протезом фирмы Zimmer NexGen LCCK Femoral Component C right-Stem 15 x 30 mm - 2 Distal Femoral Block size C 5 mm -2 Posterior Femoral Block size C 5 mm – Tibial Component Precoat 3-Stem 12,7 x 30 mm - 2 Tibial Block Precoat size 3 – 5 mm – Liner constrained Yellow/C,D 14 мм (рис. 6).
После второго этапа санации пациент также получал курсовой прием противогрибковой терапии флуконазолом длительностью 7 недель.
Срок наблюдения на этапе катамнеза составил 12 месяцев после хирургического лечения перипро-тезной инфекции, вызванной C. albicans . Не выявлено признаков рецидива перипротезной инфекции как клинически (послеоперационный рубец – без признаков воспаления; объём движений в правом коленном суставе на момент написания статьи – сгибание до 80°, разгибание полное; показатели по шкале KSS оценены как удовлетворительные; по шкале EQ5D5L – 0,795; EQ VAS = 85 %; ВАШ – 1 балл; опорная нагрузка на правую нижнюю конечность – в полном объёме, активное разгибание сохранено), так и рентгенологически – на представленных рентгенограммах компоненты эндопротеза стабильны.
Ограничения исследования
В силу редкой встречаемости перипротезной инфекции, вызванной C. albicans , описанный случай не дает возможности достоверно судить о широкой клинической эффективности покрытия (спейсера) двумерно-упорядоченного линейноцепочечным углеродом, легированным серебром.
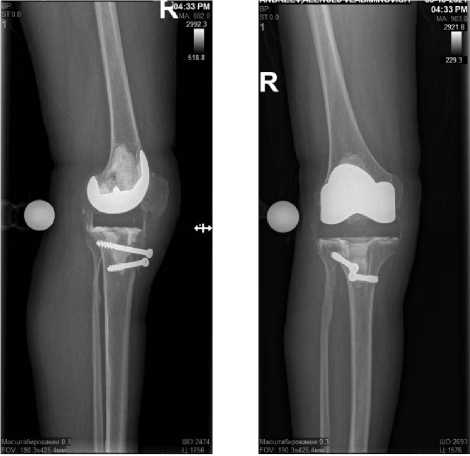
Рисунок 5. Рентгенограмма правого коленного сустава пациента А. в двух проекциях после установки артикулирующего спейсера
Figure 5. X-ray of the right knee joint of patient A. in two projections after the installation of the articulating spacer
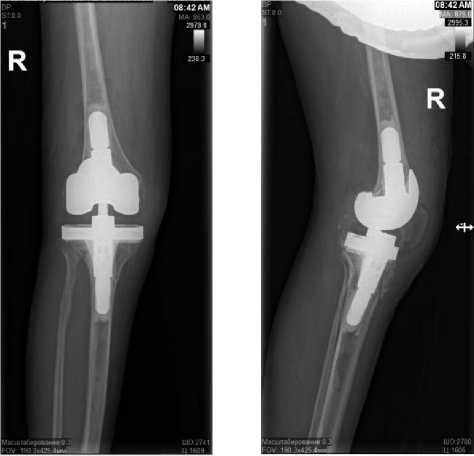
Рисунок 6. Контрольные рентгенограммы правого коленного сустава пациента А. в двух проекциях после имплантации постоянного эндопротеза
Figure 6. Control radiographs of the right knee joint of patient A. in two projections after implantation of a permanent endoprosthesis
Обсуждение и выводы
Грибковое поражение костей и суставов, в том числе эндопротезированных, по литературным данным, чаще всего происходит гематогенным путём на фоне эпизода кандидемии у пациентов с ослабленным иммунитетом [15]. Наш клинический случай не является исключением, поскольку пациент имел иммунодефицит на фоне длительного приёма цитостатиков и гормональных препаратов по поводу системного заболевания (ревматоидный артрит). Бесконтрольный приём антибактериальных препаратов для лечения инфекции мочевыводящих путей, вероятнее всего, мог вызвать эпизод кандидемии.
Лечение инфекции костей и суставов является сложной задачей, особенно если грибковые микроорганизмы поражают протезированный сустав. Ряд грибов, в том числе и C. albicans , выделенный у нашего пациента, имеет способность к формированию биопленок на металлических конструкциях, тем самым ухудшая результаты элиминации данной инфекции.
Для хирургического лечения пациента с грибковой перипротезной инфекцией коленного сустава нами было принято решение провести двухэтапную санацию с использованием на первом этапе спей-сера, состоящего из перестирилизованного бедренного компонента, покрытого ДУ ЛЦУ+Ag, который, как известно, обладает антибиопленочной активностью по отношению к антибиотикорезистентным штаммам S. aureus и P. aeruginosa с ранее выявленной высокой способностью к пленкообразованию.
Предположено, что данный тип спейсера в сочетании с костным цементом, пропитанным 400000 ЕД амфотерицина В, будет также эффективно работать в отношении антибиопленочной активности C. albicans . Системная противогрибковая терапия на сроке наблюдения 12 месяцев с момента последней операции показала положительные результаты в виде санации грибковой инфекции.
Возможно успех лечения также связан со своевременным выявлением возбудителя перипро-тезной инфекции, что позволило этиологически подойти к проблеме выбора медикаментозной терапии и запланировать данную хирургическую тактику. Данный клинический случай представляет собой единичное наблюдение, однако в реальной практике, когда грибковая инфекция не поддаётся санации, можно предложить данную методику как альтернативный способ лечения. Наблюдение за пациентом будет продолжено для определения долгосрочных результатов эффективности санирующего оперативного лечения.
Список литературы Случай лечения грибковой перипротезной инфекции с применением имплантата с углеродным покрытием
- Середа А.П., Кочиш А.А., Черный А.А., Антипов А.П., Алиев А.Г, Вебер Е.В., Воронцова Т.Н., Божкова С.А., Шубняков И.И., Тихилов Р.М. Эпидемиология эндопротезирования тазобедренного и коленного суставов и перипротезной инфекции в Российской Федерации. Травматология и ортопедия России. 2021;27(3):84-93. https://doi.org/10.21823/2311-2905-2021-27-3-84-93. [Sereda A.P., Kochish A.A., Chernyy A.A., Antipov A.P., Aliev A.G, Veber E.V., Vorontsova T.N., Bozhkova S.A., Shubnyakov I.I., Tikhilov R.M. Epidemiology of hip and knee arthroplasty and periprosthetic infection in the Russian Federation. Travmatologiya iortopediya Rossii [Traumatology and Orthopedics in Russia]. 2021;27(3):84-93. (In Russ). https://doi.org/10.21823/2311-2905-2021-27-3-84-93].
- Sloan M., Premkumar A., Sheth N.P. Projected Volume of Primary Total Joint Arthroplasty in the U.S., 2014 to 2030. J Bone Joint Surg Am. 2018;100(17):1455-1460. https://doi.org/10.2106/JBJS.17.01617
- Jamsen E, Virta LJ, Hakala M, Kauppi MJ, Malmivaara A, Lehto MU. The decline in joint replacement surgery in rheumatoid arthritis is associated with a concomitant increase in the intensity of anti-rheumatic therapy: a nationwide register-based study from 1995 through 2010. Acta Orthop. 2013 Aug;84(4):331-7. https://doi.org/10.3109/17453674.2013.810519. Epub 2013 Jun 25. PMID: 23992137; PMCID: PMC3768029
- Хлабошина В.Н., Амирджанова В.Н. Генно-инженерные биологические препараты при эндопротезировании суставов у больных ревматоидным артритом. Современная ревматология. 2014;(4):72-75. http://dx.doi.org/10.14412/2074-2711-2014-4-72-75. [Khlaboshina V.N., Amirdzhanova V.N. Genetically engineered biological preparations for joint arthroplasty in patients with rheumatoid arthritis. Sovremennaya revmatologiya [Modern rheumatology]. 2014;(4):72-75. (In Russ). http://dx.doi.org/10.14412/2074-2711-2014-4-72-75].
- Harris WH, Sledge CB. Total hip and total knee replacement (2). N Engl J Med. 1990 Sep 20;323(12):801-7. https://doi.org/10.1056/NEJM199009203231206. PMID: 2136367
- Achkar JM, Fries BC. Candida infections of the genitourinary tract. Clin Microbiol Rev. 2010 Apr;23(2):253-73. https://doi.org/10.1128/CMR.00076-09. PMID: 20375352; PMCID: PMC2863365
- Calderone RA, Fonzi WA. Virulence factors of Candida albicans. Trends Microbiol. 2001 Jul;9(7):327-35. https://doi.org/10.1016/s0966-842x(01)02094-7. PMID: 11435107
- Wenzel RP. Nosocomial candidemia: risk factors and attributable mortality. Clin Infect Dis. 1995 Jun;20(6):1531-4. https://doi.org/10.1093/clinids/20.6.1531. PMID: 7548504
- Kullberg BJ, Oude Lashof AM. Epidemiology of opportunistic invasive mycoses. Eur J Med Res. 2002 May 31 ;7(5):183-91. PMID: 12069910
- Mermel LA, Allon M, Bouza E, Craven DE, Flynn P, O'Grady NP, Raad II, Rijnders BJ, Sherertz RJ, Warren DK. Clinical practice guidelines for the diagnosis and management of intravascular catheter-related infection: 2009 Update by the Infectious Diseases Society of America. Clin Infect Dis. 2009 Jul 1;49(1):1-45. https://doi.org/10.1086/599376. Erratum in: Clin Infect Dis. 2010 Apr 1;50(7):1079. Dosage error in article text. Erratum in: Clin Infect Dis. 2010 Feb 1;50(3):457. PMID: 19489710; PMCID: PMC4039170
- Andes DR, Safdar N, Baddley JW, Playford G, Reboli AC, Rex JH, Sobel JD, Pappas PG, Kullberg BJ; Mycoses Study Group. Impact of treatment strategy on outcomes in patients with candidemia and other forms of invasive candidiasis: a patient-level quantitative review of randomized trials. Clin Infect Dis. 2012 Apr;54(8):1110-22. https://doi.org/10.1093/cid/cis021. Epub 2012 Mar 12. PMID: 22412055
- Кимайкина О.В., Найданов В.Ф., Бурков Д.В. [и др.] Грибковые инфекции суставов. Случаи из практики. Проблемы медицинской микологии. 2018; 20(№ 4):34-38. [Kimaykina O.V., Naydanov V.F., Burkov D.V., et al. Fungal infections of the joints. Cases from practice. Problemy meditsinskoy mikologii [Problems of medical mycology]. 2018; 20(4):34-38. (In Russ)].
- Phelan DM, Osmon DR, Keating Mr, Hanssen AD. Delayed reimplantation arthroplasty for candidal prosthetic joint infection: a report of 4 cases and review of the literature. Clin Infect Dis. 2002 Apr 1;34(7):930-8. https://doi.org/10.1086/339212. Epub 2002 Feb 26. PMID: 11880958.
- Николаев Н.С., Любимова Л.В., Пчелова Н.Н., Преображенская Е.В., Алексеева А.В. Использование имплантатов с покрытием на основе двумерно-упорядоченного линейно-цепочечного углерода, легированного серебром, для лечения перипротезной инфекции. Травматология и ортопедия России. 2019;25(4):98-108. https://doi.org/10.21823/2311-2905-2019-25-4-98-108. [Nikolaev N.S., Lyubimova L.V., Pchelova N.N., Preobrazhenskaya E.V., Alekseeva A.V. Use of Implants Coated with Silver-Doped 2D-Ordered Linear-Chain Carbon for the Treatment of Periprosthetic Infection. Travmatologiya i ortopediya Rossii[Traumatology and Orthopedics in Russia]. 2019;25(4):98-108. (In Russ). https://doi.org/10.21823/2311-2905-2019-25-4-98-108].
- Slenker AK, Keith SW, Horn DL. Two hundred and eleven cases of Candida osteomyelitis: 17 case reports and a review of the literature. Diagn Microbiol Infect Dis. 2012 May;73(1):89-93. https://doi.org/10.1016/j.diagmicrobio.2012.02.004. PMID: 22578942


