Случай первично множественного синхронного радиоиндуцированного рака в клинической практике
Автор: Меньшиков К.В., Султанбаев А.В., Мусин Ш.И., Измайлов А.А., Меньшикова И.А., Чалов В.С., Султанбаева Н.И., Липатов Д.О.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Клинический случай
Статья в выпуске: 4 т.13, 2023 года.
Бесплатный доступ
В структуре заболеваемости наблюдается рост числа пациентов с вторичными злокачественными новообразованиями. Кроме того, в отдельных подгруппах после радикального лечения рака пожизненный риск развития вторичных злокачественных новообразований может достигать 33%. Вторичные злокачественные новообразования остаются важной причиной смерти пациентов, получивших радикальное лечение по поводу рака. Представленный клинический случай демонстрирует развитие первично-множественных злокачественных новообразований после лучевой терапии и химиотерапии. Пациентка в 39 лет по поводу диффузной крупноклеточной В-клеточной неходжскинской лимфомы прошла радикальный курс лечения. Через 10 лет у пациентки были выявлены радиоиндуцированные первично множественные опухоли: злокачественная миофибросаркома правого желудочка сердца IIIB стадии — G2T3N0M0, рак левой молочной железы IIIA стадии — T3N2M0. Определение тактики лечения для данной категории больных остается особенно сложным.
Неходжкинская лимфома, миофибросаркома, радиоиндуцированные новообразования, рак молочной железы
Короткий адрес: https://sciup.org/140304597
IDR: 140304597 | DOI: 10.18027/2224-5057-2023-13-4-84-92
Текст научной статьи Случай первично множественного синхронного радиоиндуцированного рака в клинической практике
Известно, что ионизирующее излучение повреждает ДНК и вызывает генетические мутации. Система репарации ДНК эффективна при большинстве ее повреждений, но особую сложность представляют двухцепочечные разрывы, при которых в некоторых случаях репарация приводит к ошибкам и, как следствие, к возникновению мутаций и дальнейшему канцерогенезу. В клетках млекопитающих различные механизмы репарации в ответ на повреждение ДНК поддерживают стабильность генома, контролируя либо клеточный цикл, либо восстановление самого повреждения. Эти механизмы известны как реакция на повреждение ДНК, которая включает несколько избирательно активируемых путей в зависимости от генетического повреждения [1]. Особое значение для радиобиологии имеют механизмы, которые обнаруживают и восстанавливают одноцепочечные и двухцепочечные разрывы. Можно выделить ряд отдельных механизмов восстановления в зависимости от типа повреждения ДНК [1]. Одноцепочечные разрывы восстанавливаются в основном с помощью механизма базовой эксцизионной репарации с участием нескольких белков, таких как PARP1, XRCC1 или LIGASE 3. Двухцепочечные разрывы восстанавливаются с помощью двух основных механизмов: гомологичная рекомбинация, для которой тре- буются большие участки гомологии, и негомологичное концевое соединение [2]. Негомологичное концевое соединение активно преимущественно в период от G1 до ранней S фазы клеточного цикла, тогда как гомологичная рекомбинация происходит в поздних фазах S и G2. Оба механизма участвуют в репарации радиоиндуцированных двухцепочечных разрывов. Клетки млекопитающих дефектны по белкам, участвующим в этих процессах (DNA-PKcs или RAD54), тем самым увеличивая чувствительность к ионизирующему излучению [3–5]. Большая часть наших текущих знаний о генотоксических эффектах ионизирующего излучения получена из исследований in vitro, осуществляемых в соматических клетках. Но если радиоиндуцированные генетические повреждения происходят в стволовых клетках, во время сперматогенеза и/или оогенеза, могут возникать хромосомные перестройки, имеющие наследственный эффект. Особенно важное значение для половых клеток имеют белки, участвующие в распознавании и репарации двухцепочечных разрывов гомологичной рекомбинацией, которая происходит в течение мейотической профазы I. На этой стадии гомологичная рекомбинация необходима для правильного расхождения гомологичных хромосом, запускаемого запрограммированными двухцепочечными разрывами, процесс которого катализируется родственным ДНК-топоизомеразе-II белком Spo11 [6]. В дополнении к белку
Spo11, для образования двухцепочечных разрывов требуются другие белки [7]. Некоторые из них, участвующие в процессе рекомбинации, были идентифицированы в последние несколько лет. Белок репликации A (RPA) является компонентом переходных мейотических узелков, в то время как MLH1 является маркером кроссоверов событий [8–9]. Профаза мейоза I находится под контролем точки системы, распознающей те хромосомы, которые остаются неспаренными на стадии пахитены и приводят к ее сайленсингу за счет привлечения белков, таких как BRCA1 и ATR [10]. Таким образом, половые клетки в зависимости от клеточного цикла будут содержать определяемые количества различных белков, участвующих в распознавании и восстановлении двухцепочечных разрывов с помощью гомологичной рекомбинации (ATR, ATM, RAD51, BRCA1, BRCA2, MSH2 и MSH3 среди прочих). Наличие этих белков может сделать мейотические клетки менее чувствительными к двухцепочечным разрывам, индуцируемым ионизирующим излучением, в отличие от других типов клеток. Однако на данном этапе неизвестно, как эти белки взаимодействуют, когда радиоиндуцированные генетические нарушения происходят в период мейотической профазы I. Лучевая терапия значительно увеличила выживаемость онкологических больных. Однако это лечение не обходится без вторичных эффектов, среди которых наибольшей проблемой является гонадная дисфункция и радиоиндуцированные вторичные опухоли [11,12]. Несмотря на то, что сейчас можно оценить дозу фракционированной лучевой терапии на основании математических моделей, данных о генотоксических эффектах все еще недостаточно [12].
В последние десятилетия достигнутые успехи в лечении лимфомы Ходжкина и неходжкинской лимфомы позволяют добиваться полного излечения пациентов. Кроме того, используемые методы в лечении лимфомы Ходжкина и неходжкинских лимфом способствуют достижению более высоких результатов выживания в сравнении с другими злокачественными новообразованиями. Однако из-за молодого возраста пациентов комбинированное применение потенциально вредных терапевтических опций позволяет ожидать в последующем негативные последствия, представляющие собой существенную угрозу для пациентов. Действительно, у успешно пролеченных больных в ходе длительного наблюдения отмечается высокая частота поздних побочных эффектов терапии, в том числе ятрогенных заболеваний легких, сердца и щитовидной железы [13–15]. Технологические достижения в области лучевой терапии [4–11] за счет высоко конформных методик потенциально увеличивают контроль за распределением доз на органы риска. У пациентов с лимфомой Ходжкина после проведенной терапии отмечается развитие поздних нежелательных явлений, таких как радиационный пневмонит [12], гипотиреоз [13] и сердечно-сосудистые заболевания [14,15]. Следует соблюдать осторожность при применении современных методов лучевой терапии, помня про неотъемлемый риск вторичных злокачественных новообразований [16].
Число пациентов со вторичными злокачественными опухолями растет, и в настоящее время они составляют при- мерно шестую часть из всех зарегистрированных случаев рака. Кроме того, в отдельных подгруппах выживших после лечения рака пожизненный риск развития вторичных злокачественных новообразований может достигать 33% [17]. Также, по-видимому, они являются важной причиной смерти пациентов, получивших радикальное лечение и излечившихся от рака, особенно среди детей. Среди пациентов со вторым случаем рака 13% умерли от первичной злокачественной опухоли, в то время как более половины (55%) умерли от второго злокачественного новообразования [17]. Выживаемость при детских злокачественных новообразованиях увеличилась с 1970 по настоящее время, и 5-летняя выживаемость в настоящее время превышает 80% в целом и может достигать до 98–99% в зависимости от конкретного диагноза [18–21].
В одном из крупных исследований [22] обработаны данные из общедоступной базы данных SEER за апрель 2013 года. В этой базе данных SEER собрана информация о заболеваемости раком и выживаемости из 18 популяционных онкологических регистров по всей территории Соединенных Штатов, охвачено приблизительно 28% населения в целом. Было выявлено 2116163 пациента с первичными злокачественными новообразованиями, которые были диагностированы в период с 1992 по 2008 год, среди которых у 170865 (8,1%) развилась вторая злокачественная опухоль. Среднее время наблюдения за всей когортой составило 7,09 года, а при стратификации по типу первичного рака среднее наблюдение составило более 6 лет при всех типах первичного рака, за исключением пациентов с первичным раком легких, у которых средний период наблюдения составил 4,18 года. Большинство пациентов (60%) со вторым злокачественным новообразованием были в возрасте более 65 лет и старше, чем пациенты без второй злокачественной опухоли (66 лет против 63 лет; Р < 0,001). Из них 63% были мужчинами, и у 73% был пролечен рак предстательной железы, молочной железы, толстой кишки или мочевого пузыря. У большинства пациентов со вторым злокачественным новообразованием (55%) был высоко- или умереннодифференцированный первичный рак.
Самый высокий риск развития вторичной опухоли наблюдался у пациентов с диагнозом неходжскинская лимфома: он был почти в 3 раза выше по сравнению с пациентами с первичным ракома простаты (отношение рисков [ОР] 2,70; 95% доверительный интервал [95% ДИ] 2,58–2,83) и женщинами, перенесшими рак молочной железы (ОР 2,88; 95% ДИ 2,69–3,07). Кроме того, как мужчины, так и женщины, перенесшие рак мочевого пузыря (мужчины: ОР 1,88 [95% ДИ 1,84–1,92], женщины: ОР, 1,66 [95% ДИ 1,60–1,72]) и рак почки (мужчины: HR, 1,86 [95% ДИ 1,80–1,92], женщины: ОР 1,53 [95% ДИ, 1,46–1,60]) имели значительно более высокий риск развития второго злокачественного новообразования по сравнению с выжившими после рака предстательной железы и молочной железы (рис. 1.) [17].
Данное исследование, в котором установлено, что выжившие после лечения НХЛ подвергаются повышенному риску развития вторичного рака легких, также согласуется с предыдущими исследованиями, которые, скорее всего, связаны с терапевтическими алкилирующими агентами
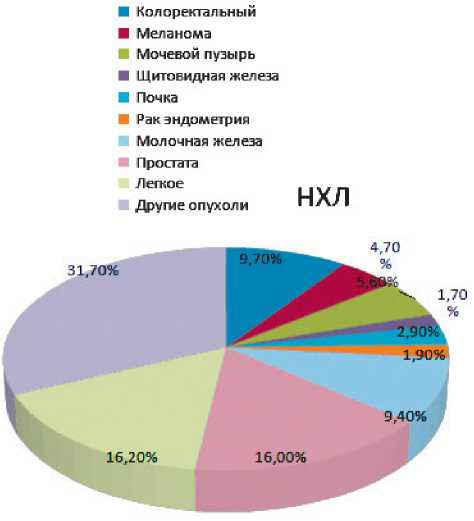
Рисунок 1. Распределения вторичных злокачественных новообразований после лечения неходжкинских лимфом [17].
что соответствовало лимфопролиферативному заболеванию. Пациентке произведена биопсия надключичного лимфоузла слева и трансторакальная биопсия опухоли средостения под КТ-контролем. Диагноз был верифицирован морфологически как CD20 положительная диффузная крупноклеточная В-клеточная неходж-скинская лимфома. Стадия заболевания по Ann Arbor расценена как IIB, что соответствовало поражению лимфатических узлов по одну сторону от диафрагмы и наличию симптомов интоксикации. При трепанобиопсии костного мозга поражения не выявлено.
и лучевой терапией, обычно используемыми при лечении лимфом [23–25].
В исследовании, проведенном в Челябинском онкологическом диспансере, изучена группа из 232 больных, у которых после лучевой терапии первой опухоли впоследствии возникли первично-множественные метахронные опухоли. Временной интервал до появления второй опухоли составил 91,81 (95% ДИ 80,57–103,05) мес., для мультицентрических множественных опухолей в одном органе — 86,03 (95% ДИ 60,18–111,88) мес., для системных опухолей и опухолей парных органов — 91,00 (95% ДИ 61,67–120,33) мес., для несистемных множественных опухолей различных органов — 93,34 (95% ДИ 79,3–107,35) мес. В целом от начала лучевой терапии первой опухоли пациенты прожили в среднем 127,03 (95% ДИ 114,02–140,03) мес. [26]. Так же описаны случаи радиоинду-цированных сарком различных локализаций через достаточно длительное время после проведения лучевой терапии [27–29].
Ниже мы приводим клиническое наблюдение одновременно двух вторичных злокачественных новообразований у пациентки после успешного излечения неходжкинской лимфомы.
КЛИНИЧЕСКИЙ СЛУЧАЙ
Пациентка Ф., 1971 г. р., в 2010 году впервые обратилась с жалобами на слабость и симптомы интоксикации в Республиканский клинический онкологический диспансер. На момент начала заболевания возраст пациентки составлял 39 лет. При дообследовании выявлено наличие внутригрудной и надключичной лимфоаденопатии,
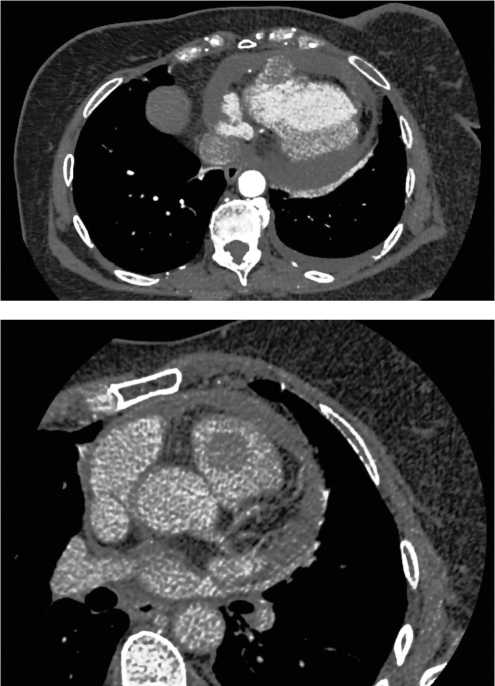
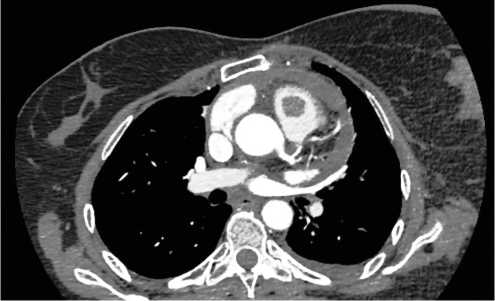
Рисунок 2 а, б, в. Данные компьютерной томографии.
Опухоль правого желудочка с прорастанием в перикард.
Опухоль левой молочной железы.
По поводу данного заболевания пациентке проведено 6 курсов химиотерапии в режиме R-CHOP с кумулятивной дозой доксорубицина 540 мг. После завершения химиотерапии был проведен курс лучевой терапии на средостение и надключичные зоны до 40 Гр. В последующем пациентка получала терапию ритуксимабом в дозе 375 мг /м 2 с интервалом в 21 день до одного года. Зарегистрирована стойкая ремиссия в течении 10 лет.
В 2021 году больная самостоятельно обнаружила опухолевидное образование в левой молочной железе. 16.08.2021 года выполнена трепан-биопсия в условиях РКОД. Диагноз подтвержден морфологически как люминальный А рак молочной железы — Эр (+ + +), Пр (+ + +), Her 2 neu (–), Ki 67 ~ 15 %. В процессе дообследования при КТ ОГК выявлено наличие опухоли правого желудочка сердца. По данным КТ — картина опухолевого образования правого желудочка с прорастанием в перикард. Констатировано наличие перикардиального выпота, плеврального выпот слева, опухоль левой молочной железы, аксиллярная лимфаденопатия слева, ателектаз S4 слева (рис. 2а-в).
Проведено ПЭТ-КТ. Выявлено наличие опухоли правого желудочка, с прорастанием перикарда, признаками инвазии передней и задней створки трикуспидального клапана, субокклюзией выходного отдела правого желудочка; в правых отделах сердца (правый желудочек, с распространением на проксимальные отделы легочного ствола) крупный метаболический активный очаг 50 × 62 × 79 мм, SUVmax = 20,76, выпот в полости перикарда 15 мм в поперечнике. Также выявлена опухоль левой молочной железы с метастазами в подмышечные лимфоузлы: в центральных отделах и наружных квадрантах левой молочной железы метаболически активный очаг 26 × 37 × 66 мм, SUVmax = 9,73. Немногочисленные метаболически активные левые подмышечные л /узлы I–III уровней до 15 мм, SUVmax = 11,48. (рис. 3а, б).
22.09.2021 года выполнена биопсия опухоли правого желудочка, получены биоптаты миокарда с двумя фрагментами опухоли из веретеновидных клеток. Морфологически — саркома. Гистоимунофенотип опухоли не соответствует метастазу карциномы молочной железы и лимфоме. По данным иммуногистохимического исследования — группа интимальных сарком, подгруппа недиференцированной плеоморфной саркомы, кардиальная миксофибросаркома. Проведено молекулярно-генетическое тестирование, мутации в гене EGRF не обнаружено, как и транслокации ALK и ROS-1.
Таким образом, у пациентки установлен диагноз первично-множественного синхронного рака: C38.0 Злокачественное новообразование сердца — микрофибросаркома правого желудочка с прорастанием передней стенки правого желудочка IIIB стадии — G2T3N0M0, рак левой молочной железы IIIA стадии — T3N2M0, В-кле-точная крупноклеточная неходжкинская лимфома IIB стадии. Из сопутствующей патологии: гипертоническая болезнь II стадии, риск 3.
С учетом наличия двух активных злокачественных новообразований хирургическое лечение технически признано неосуществимым, принято решение о лекарственной терапии. По поводу люминального А подтипа рака молочной железы пациентка с 01.09.2021 года начала терапию тамоксифеном в стандартной терапевтической дозировке. Так как в 2010 году она выбрала кумулятивную дозу доксорубицина по поводу злокачественного новообразования правого желудочка, начата терапия в режиме гемцитабин + доцетаксел. Проведено два курса химиотерапии, зарегистрирована гематологическая токсичность IV ст. (эпизод фебрильной нейтропении), гастроинтестинальная токсичность III ст., кожная токсичность I ст. По данным контрольного обследования зарегистрирована разнонаправленная динамика: частичный ответ по опухоли в молочной железе (уменьшение на 40 %) и прогрессирование по опухоли правого желудочка (увеличение размера более чем на 25 %).
С учетом прогрессии по опухоли правого желудочка и зарегистрированной токсичности произведена смена режима на пазопаниб, как ингибитор тирозинкиназ с другим профилем нежелательных явлений. Пациентке проведено 6 курсов терапии папозанибом в дозе 800 мг в сутки. По данным контрольного обследования после 3-х курсов терапии пазопанибом зарегистриро-
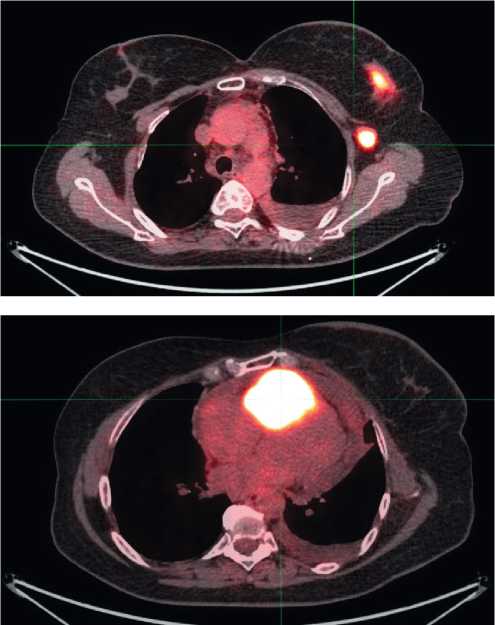
Рисунок 3. ПЭТ КТ. А — опухоль молочной железы с метастазами в подмышечные лимфоузлы. Б — опухоль правого желудочка.
вана стабилизация заболевания (увеличение размеров опухоли правого желудочка до 10 %) и прежние размеры опухоли левой молочной железы. Нежелательные явления на фоне терапии пазопанибом — кожная токсичность I ст., эпизоды артериальной гипертензии I ст., возможно, связанные с основным заболеванием. После 6 курса терапии зарегистрирована прогрессия заболевания, и пациентка умерла на фоне прогрессирования сердечной недостаточности.
ОБСУЖДЕНИЕ
Приведенное клиническое наблюдение следует рассматривать как случай развития первично множественных синхронных злокачественных новообразований, обусловленных ранее проведенной лучевой терапией. По данным многих исследований доказано, что частота вторичных злокачественных новообразований у излеченных после лимфомы Ходжкина и неходжкинских лимфом пациентов более значительна, чем в общей популяции [30,31]. Кроме того, в литературе имеется мнение, что пациенты с лимфомой Ходжкина, выжившие после второй злокачественной опухоли, также могут подвергаться повышенному риску развития последующих новообразований, частота которых увеличивается в 5,4 раза. При этом кумулятивная заболеваемость повторными опухолями составляет 13,3% [31,32]. В описанном клиническом случае пациентка получила химиолучевое лечение по поводу неходжкин-ской лимфомы, и, соответственно, риск развития второго злокачественного новообразования превышал подобный показатель в общей популяции.
По данным некоторых авторов, вторичные злокачественные новообразования являются ятрогенными и наиболее значимыми долгосрочными последствиями применения лучевой терапии, доля которых среди поздних эффектов составляет 75–80% [31,33]. В одном из самых крупных исследований, проведенном в Нидерландах, изучены пациенты, получавшие лечение по поводу лимфопролиферативных заболеваний в 7 голландских университетах, больницах или онкологических центрах или в аффилированных больницах по месту жительства. Пациенты были младше 51 года на момент установления диагноза, и были пролечены между 1965 и 1995 годами с помощью лучевой терапии и/или химиотерапии, после чего прожили не менее 5 лет. Лечение пациенты получали в соответствии с протоколами лечения европейских сообществ по исследованию и лечению рака, лечение рецидивов не было стандартизировано [34–38]. Методы лучевой терапии также изменились с течением времени, от терапии кобальтом-60 в 1960-х до линейных ускорителей с 1970-х и далее. Пациенты обычно получали 40 Гр, от 1,5 до 2,0 Гр за фракцию, если проводилась только лучевая терапия, и от 30 Гр до 36 Гр, если они также получали химиотерапию. Облучение мантийного поля (включая медиастинальные, подмышечные и шейные узлы) было наиболее часто применяемым методом с начала 1970-х до конца 1980-х гг. С конца 1980-х гг. все большее число пациентов получали более ограниченные поля облучения (облучение только вовлеченных зон). Исследуемая популяция включала 3122 выживших после лечения первого злокачественного заболевания. За время наблюдения у 832 пациентов развилось второе, у 126 пациентов- третье и у 16-четвертое злокачественное новообразование, не связанное с ранее пролеченными. Медиана интервала между лечением первого новообразования и вторым злокачественным новообразованием составила 19,4 года (IQR 13,8–25,8), а медиана интервала между второй и третьей злокачественной опухолью — 4,3 года (IQR, 1.0–10.1). Пятилетняя выживаемость составила 42,6% для пациентов, у которых развилась вторая опухоль, и 42,9% после третьей опухоли. Двести девяносто больных со вторым злокачественным новообразованием (34,9% всех у которых развился второй злокачественный процесс) и 35 пациентов с третьим злокачественным процессом (27,8%) умерли в первый год после постановки диагноза. У женщин рак молочной железы был наиболее часто наблюдаемой второй (n = 184) и третьей опухолью (n = 46), что составило 43,9% всех вторичных и 54,8% всех третьих злокачественных новообразований [39].
Следует отметить, что у нашей пациентки синхронно развились две злокачественные опухоли, которые мы расценили как последствие лечения В-клеточной лимфомы 10 лет назад. Обе опухоли, как рак молочной железы, так и опухоль правого желудочка, развились в области ранее проведенной лучевой терапии. Не следует забывать о лечении кардиотоксичным цитостатиком доксорубицином. Радиоиндуцированный характер опухолей установлен на основании следующих признаков:
-
• наличие предшествующей лучевой терапии;
-
• опухоли возникли в области пояе облучения или рядом с ним;
-
• длительность латентного периода более 4 лет;
-
• вторичная и первичная опухоли имели различное гистологическое строение [40,41].
В приведенном клиническом наблюдении пациентка соответствует всем критериям радиоиндуцированной опухоли, обе опухоли развились в зане ранее проведенной лучевой терапии, совершенно различное гистологическое строение, и длительность латентного периода составила более 10 лет.
К сожалению, выживаемость у пациентов с радиоинду-цированными опухолями оставляет желать лучшего. В приведенном выше исследовании показано, что в течение первого года после установления диагноза вторичной опухоли погибают до 34,9% пациентов, при третьем злокачественном новообразовании этот показатель составляет 27,8%. В описанном наблюдении пациентка имела одновременно две различные злокачественные опухоли, и саркома правого желудочка была наиболее агрессивной. На фоне проводимой терапии удалось добиться контроля за раком молочной железы, но радиоиндуцированная кардиальная миксофибро-саркома продемонстрировала неблагоприятное течение.
Клинические случаи
ЗАКЛЮЧЕНИЕ
Радиоиндуцированные злокачественные опухоли развиваются в долгосрочной перспективе как последствия ранее проведенной лучевой терапии. Несомненно, успехи в лечении злокачественных новообразований с использованием продвинутых методик лучевой терапии позволяют достигать длительной выживаемости пациентов. Но это в свою очередь несет также вполне определенные риски развития радио-индуцированных опухолей. С учетом развития технологий в лучевой терапии ожидается, что риски развития вторичных злокачественных новообразований со временем будут снижаться. Однако как пациенты, пролеченные по поводу опухолей, так и врачи должны быть хорошо осведомлены о том, что риск развития новых первичных злокачественных новообразований остается повышенным после проведенного лечения, а особенно лучевой терапии. По этой причине опции для лечения второго злокачественного новообразования могут быть ограничены, и эти ограничения будут еще более выражены при развитии третьей опухоли.
Одним из важных факторов раннего выявления вторичных новообразований является тщательное диспансерное наблюдение за группой риска, т. е. за пациентами, ранее получившими химиолучевое лечение по поводу различных локализаций, и не ограничивающееся сроком 5 лет с момента окончания лечения. Следует отметить, что опухоли, ассоциированные с лучевой терапией, имеют различный гистогенез и клиническую картину, что затрудняет диагностику и выбор оптимального метода лечения, что и было продемонстрировано в приведенном наблюдении.
Список литературы Случай первично множественного синхронного радиоиндуцированного рака в клинической практике
- Lord, C. J. ; Ashworth, A. The DNA damage response and cancer therapy. Nature 2012, 481, 287-294.
- Valerie, K. ; Povirk, L. F. Regulation and mechanisms of mammalian double-strand break repair. Oncogene 2003, 22, 5792-5812.
- Jaco, I. ; Muñoz, P. ; Goytisolo, F. ; Wesoly, J. ; Bailey, S. ; Taccioli, G. ; Blasco, M. A. Role of mammalian Rad54 in telomere length maintenance. Mol. Cell Biol. 2003, 23, 5572-5580.
- Salzano, A. ; Kochiashvili, N. ; Nergadze, S. G. ; Khoriauli, L. ; Smirnova, A. ; Ruiz-Herrera, A. ; Mondello, C. ; Giulotto, E. Enhanced gene amplification in human cells knocked down for DNA-Kcs. DNA Repair 2009, 8, 19-28.
- Ruiz-Herrera, A. ; Smirnova, A. ; Khouriauli, L. ; Nergadze, S. G. ; Mondello, C. ; Giulotto, E. Gene amplification in human cells knocked down for RAD54. Genome Integr. 2011, 2, https://doi.org/10.1186/2041-9414-2-5.
- Keeney, S. ; Giroux, C. N. ; Kleckner, N. Meiosis-specific DNA double-strand breaks are catalyzed by Spo11, a member of a widely conserved protein family. Cell 1997, 88, 375-384.
- Roeder, G. S. Meiotic chromosomes : It takes two to tango. Genes Dev. 1997, 11, 2600-2621.
- Moens, P. B. ; Kolas, N. K. ; Tarsounas, M. ; Marcon, E. ; Cohen, P. E. ; Spyropoulos, B. The time course and chromosomal localization of recombination-related proteins at meiosis in the mouse are compatible with models that can resolve the early DNA-DNA interactions without reciprocal recombination. J. Cell Sci. 2002, 115, 1611-1622.
- Baker, S. M. ; Plug, A. W. ; Prolla, T. A. ; Bronner, C. E. ; Harris, A. C. ; Yao, X. ; Christie, D. M. ; Monell, C. ; Arnheim, N. ; Bradley, A. ; et al. Involvement of mouse Mlh1 in DNA mismatch repair and meiotic crossing over. Nat. Genet. 1996, 13, 336-342.
- Turner, J. M. ; Aprelikova, O. ; Xu, X. ; Wang, R. ; Kim, S. ; Chandramouli, G. V. ; Barrett, J. C. ; Burgoyne, P. S. ; Deng, C. X. BRCA1, histone H2AX phosphorylation, and male meiotic sex chromosome inactivation. Curr. Biol. 2004, 14, 2135-2142.
- Wallace, W. H. ; Thomson, A. B. ; Kelsey, T. W. The radiosensitivity of the human oocyte. Hum. Reprod. 2003, 18, 117-121.
- Wallace, W. H. ; Thomson, A. B. ; Saran, F. ; Kelsey, T. W. Predicting age of ovarian failure after radiation to a field that includes the ovaries. Int. J. Radiat. Oncol. Biol. Phys. 2005, 62, 738-744.
- Hodgson DC : Late effects in the era of modern therapy for Hodgkin lymphoma. Hematology Am Soc Hematol Educ Program 2011, 2011 : 323-329.
- Ng AK : Review of the cardiac long-term effects of therapy for Hodgkin lymphoma. Br J Haematol 2011, 154 (1) : 23-31.
- Elkin EB, Klem ML, Gonzales AM, et al : Characteristics and outcomes of breast cancer in women with and without a history of radiation for Hodgkin’s lymphoma : a multi-institutional, matched cohort study. J Clin Oncol 2011, 29 (18) : 2466-2473.
- Baker, T. G. Comparative aspects of the effects of radiation during oogenesis. Mutat. Res. 1971, 11, 9±22.
- Donin N, Filson C, Drakaski A, et al. Risk of second primary malignancies among cancer survivors in the United States, 1992 through 2008. Cancer 2016 ; 122 : 3075-3086.
- Saletta F, Seng M and Lau L. Advances in pediatric cancer treatment. Transl Pediatr 3 (2) : 156-82. 4. Ward E, DeSantis C, Robbins A, et al. Childhood and adolescent cancer statistics, 2014. CA Cancer J Clin 2014 ; 64 : 83-103.
- Institute NC. Childhood Cancer by site incidence, survival and mortality 2019, April, https://seer.cancer.gov/csr/1975_2016/results_merged/sect_28_childhood_cancer.pdf.
- Armstrong GT, Liu Q, Yasui Y, et al. Late mortality among 5-year survivors of childhood cancer : a summary from the childhood cancer survivor study. J Clin Oncol 2009 ; 27 : 2328-2338.
- Lee JS, Dubois SG, Coccia PF, et al. Increased risk of second malignant neoplasms in adolescents and young adults with cancer. Cancer 2016 ; 122 : 116-123.
- Howlader N, Noone AM, Krapcho M, et al, eds. SEER Cancer Statistics Review, 1975-2012. Bethesda, MD : National Cancer Institute ; 2015.
- Travis LB, Gospodarowicz M, Curtis RE, et al. Lung cancer following chemotherapy and radiotherapy for Hodgkin’s disease. J Natl Cancer Inst. 2002 ; 94 : 182-192.
- Travis LB, Curtis RE, Boice JD Jr, Hankey BF, Fraumeni JF Jr. Second cancers following non-Hodgkin’s lymphoma. Cancer. 1991 ; 67 : 2002-2009.
- Curtis RE, Freedman DM, Ron E, et al. New Malignancies Among Cancer Survivors : SEER Cancer Registries, 1973-2000. Bethesda, MD : National Cancer Institute ; 2006. NIH Pub. No. 05-5302.
- Важенин А. В., Шаназаров Н. А., Шунько Е. Л. Некоторые закономерности развития радиоиндуцированных метахронных опухолей. Вестник рентгенологии и радиологии № 6, 2015. С 30-35.
- Bertin F, Deluche E, Tricard J, Piccardo A, Denes E. First case of sternum replacement with a bioceramic prosthesis after radio-induced sarcoma. Curr Oncol. 2018 Aug ; 25 (4) : e351-e353. https://doi.org/10.3747/co.25.4020. Epub 2018 Aug 14. PMID : 30111981 ; PMCID : PMC6092061.
- Majdoubi A, Serji B, Harroudi TE. Angiosarcome mammaire radio-induit : à propos d’un cas [Radiation-induced breast angiosarcoma : about a case]. Pan Afr Med J. 2020 May 21 ; 36 : 29. French. https://doi.org/10.11604/pamj.2020.36.29.21599. PMID : 32774606 ; PMCID : PMC7388625.
- Меньшиков К. В., Пушкарев А. В., Султанбаев А. В., Пушкарев В. А., Шарифгалиев И. А. Радиоиндуцированная ангиосаркома влагалища : клинический случай. Креативная хирургия и онкология. 2020 ; 10 (2) : 143-148. https://doi.org/10.24060/2076-3093-2020-10-2-143-148.
- Dores GM, Metayer C, Curtis RE, et al. Second malignant neoplasms among long-term survivors of Hodgkin’s disease : a population-based evaluation over 25 years. J Clin Oncol. 2002 ; 20 : 3484-94. https://doi.org/10.1200/JCO. 2002.09.038.
- Огнерубов Н. А., Антипова Т. С. Радиационно-индуцированная саркома мягких тканей шеи после лучевой терапии лимфомы Ходжкина. Клиническое наблюдение. Современная Онкология. 2022 ; 24 (3) : 325-330. https://doi.org/10.26442/18151434.2022.3.201904.
- van Eggermond AM, Schaapveld M, Lugtenburg PJ. Risk of multiple primary malignancies following treatment of Hodgkin lymphoma. Blood. 2014 ; 124 (3) : 319-27. https://doi.org/10.1182/blood-2013-10-532184.
- Ng AK, Mauch PM. Late effects of Hodgkin’s disease and its treatment. Cancer J. 2009 ; 15 : 164-8. https://doi.org/10.1097/PPO.0b013e31819e30d7.
- Carde P, Burgers JM, Henry-Amar M, et al. Clinical stages I and II Hodgkin’s disease : a specifically tailored therapy according to prognostic factors. J Clin Oncol. 1988 ; 6 (2) : 239-252.
- Eghbali H, Raemaekers J, Carde P ; EORTC Lymphoma Group. The EORTC strategy in the treatment of Hodgkin’s lymphoma. Eur J Haematol Suppl. 2005 ; (66) : 135-140.
- Raemaekers J, Kluin-Nelemans H, Teodorovic I, et al ; European Organisation for Research and Treatment of Cancer. The achievements of the EORTC Lymphoma Group. Eur J Cancer. 2002 ; 38 (suppl 4) : S107-S113.
- Somers R, Tubiana M, Henry-Amar M. EORTC Lymphoma Cooperative Group studies in clinical stage I-II Hodgkin’s disease 1963-1987. Recent Results Cancer Res. 1989 ; 117 : 175-181.
- Tubiana M, Henry-Amar M, Carde P, et al. Toward comprehensive management tailored to prognostic factors of patients with clinical stages I and II in Hodgkin’s disease. The EORTC Lymphoma Group controlled clinical trials : 1964-1987. Blood. 1989 ; 73 (1) : 47-56.
- van Eggermond AM, Schaapveld M, Lugtenburg PJ, Krol AD, de Boer JP, Zijlstra JM, Raemaekers JM, Kremer LC, Roesink JM, Louwman MW, Aleman BM, van Leeuwen FE. Risk of multiple primary malignancies following treatment of Hodgkin lymphoma. Blood. 2014 Jul 17 ; 124 (3) : 319-27 ; quiz 466. https://doi.org/10.1182/blood-2013-10-532184. Epub 2014 Apr 16. PMID : 24740811.
- Cahan WG, Woodard HQ, Higinbotham NL, et al. Sarcoma in irradiated bone. Report of eleven cases. Cancer. 1948 : 3-29. https://doi.org/10.1002/1097-0142(194805) 1 : 1<3 : : AID-CNCR2820010103-3.0. CO ; 2-7.
- Hall EJ, Wuu CS. Radiation-induced second cancers : the impact of 3D-CRT and IMRT. Int J Radiat Oncol Biol Phys. 2003 ; 56 : 83-8. https://doi.org/10.1016/S0360-3016 (03) 00073-7.


