Случай первично-множественной плоскоклеточной карциномы яичников и сигмовидной кишки
Автор: Виллерт Алиса Борисовна, Завьялов Александр Александрович, Коломиец Лариса Александровна, Фесик Евгения Анатольевна, Перельмутер Владимир Михайлович, Каракешишева Маргарита Борисовна, Григорьев Евгений Геннадьевич, Литвяков Николай Васильевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 6 т.15, 2016 года.
Бесплатный доступ
Плоскоклеточная карцинома яичника является редкой патологией, как и плоскоклеточная карцинома сигмовидной кишки, что обусловливает отсутствие статистических данных, а также дефицит представлений об их этиологии и патогенезе. Первично-множественная плоскоклеточная карцинома яичников и сигмовидной кишки составляет предмет дифференциальной диагностики рака сигмовидной кишки с метастатическим поражением яичников. Дана патологоанатомическая и клиническая характеристика опухолей, показаны основные факты, свидетельствующие в пользу первично-множественного характера процесса. Показана ассоциация плоскоклеточных карцином яичника и толстой кишки с вирусом папилломы человека 16-го типа.
Плоскоклеточная карцинома толстой кишки, первично-множественные опухоли, вирус папилломы человека
Короткий адрес: https://sciup.org/140254086
IDR: 140254086 | УДК: 618.11+616.349]-006.61-021.3 | DOI: 10.21294/1814-4861-2016-15-6-79-88
Текст научной статьи Случай первично-множественной плоскоклеточной карциномы яичников и сигмовидной кишки
Рак яичников занимает 9-е место по частоте встречаемости среди злокачественных новообразований у женщин и 5-е место среди причин женской смертности. Практически в 90 % случаев злокачественные опухоли яичников имеют эпителиальное происхождение. Плоскоклеточные карциномы яичников (ПКЯ) – достаточно редкая патология. Как правило, ПКЯ развивается вследствие злокачественной трансформации дермоидных кист, которая наблюдается в 0,17–1,4 % случаев, причем развитие плоскоклеточных карцином является самым частым вариантом их малигнизации (75–80 % наблюдений) и диагностируется у женщин старших возрастных групп, чаще всего достаточно поздно, при появлении симптомов сдавливания окружающих органов [1–3]. К сожалению, нет четких клинических признаков плоскоклеточных карцином, опухолевые маркеры часто могут оставаться в пределах нормы, в связи с этим диагноз ПКЯ на дооперационном этапе устанавливается крайне редко, обычно после морфологического исследования операционного материала [4].
Опухоли, ограниченные яичником, после оптимальной циторедукции имеют лучший прогноз [5]. Однако пациентки с ПКЯ III–IV стадий редко переживают пятилетний срок, несмотря на комбинированное лечение, включающее адъювантную химиотерапию и/или лучевую терапию [6]. Редкая встречаемость этого гистотипа опухолей исключает проведение крупных рандомизированных исследований, в которых изучалась бы эффективность лечения ПКЯ.
В литературе представлены клинические наблюдения плоскоклеточных карцином яичника, возникших в дермоидных кистах [3, 7–9]. Средний возраст таких больных – 55 лет, что значительно отличается от возраста диагностики зрелых тератом (37,5 лет) [6]. Выделяют также вариант плоскоклеточной карциномы яичников, ассоциированной с эндометриозом, как компонент малигнизированной опухоли Бреннера и так называемую чистую плоскоклеточную карциному, когда нет связи с такими образованиями яичников, как дермоидная киста, эндометриоз или опухоль Бреннера. Заболеваемость «чистой» первичной плоскоклеточной карциномой яичника (SCC) еще более низкая [10]. В мире зарегистрировано лишь 30 случаев чистого первичного ПКЯ [11]. Из-за редкой встречаемости «чистой» первичной плоскоклеточной карциномы яичников клинические особенности заболевания
не установлены и эффективность лечения не определена.
Ряд авторов проводят анализ серии случаев плоскоклеточных карцином яичников [3, 11–13]. По данным M.R. Pins [13], из 37 случаев ПКЯ в 19 ПКЯ были ассоциированы с дермоидными кистами, в 7 – с эндометриозом, в 11 наблюдениях ни тех, ни других изменений-предшественников выявлено не было. Средний возраст в группах равнялся 52 (21–75 лет), 49 (29–70 лет) и 56 (27–73 лет) годам соответственно. В группе больных с ПКЯ на фоне дермоида рак in situ диагностирован в 3 случаях, I стадии – в 7, II стадии – в 6, III стадии – в 3 случаях, и при этом степень дифференцировки варьировала (высокая – в 2 случаях, умеренная и низкая – по 7 наблюдений). В группе с ПКЯ на фоне эндометриоза: I стадия диагностирована у 1, II стадия – у 3, III стадия – у 1, IV стадия – у 2 больных, при этом все они имели низкую степень дифференцировки. У пациенток с «чистыми» ПКЯ I стадия наблюдалась в 1, II стадия – в 4, III стадия – в 5, IV стадии – в 1 случае, опухоли имели низкую степень дифференцировки, кроме одного наблюдения умереннодифференцированной карциномы. Больные с ПКЯ, ассоциированными с эндометриозом, характеризовались более низкой общей выживаемостью (в среднем – 5 мес). Во всех подгруппах ПКЯ стадия и степень дифференцировки коррелировали с общей выживаемостью.
В 2009 г. опубликованы результаты метаанализа, объединившего 64 исследования и включающего 277 пациенток с плоскоклеточной карциномой в зрелой тератоме яичника. Исследователями отмечено повышение концентрации SCC и СА 125 (71 %) в сыворотке крови при размерах опухоли 10 см и более, высокие показатели выживаемости при Iа стадии, а также удовлетворительные результаты лечения при проведении расширенных оперативных вмешательств и курсов полихимиотерапии с включением алкилирующих агентов [12].
В 2013 г. было опубликовано еще одно исследование, включающее 6 клинических наблюдений ПКЯ на фоне малигнизированных дермоидных кист, диагностированных в Velindre Cancer Centre, Whitchurch, Cardiff, Wales (Великобритания) за 24-летний период (1986–2010 гг.). Плохой прогноз заболевания авторы связали со значительным экс-траовариальным распространением ПКЯ (в 5 из 6 случаев были выявлены III–IV стадии) [3].
В структуре онкологической заболеваемости у женского населения России рак ободочной кишки находится на 4-м ранговом месте, среди причин смерти – на 3-м месте, составляя 9,5 %. Большинство случаев колоректального рака – аденокарциномы [14]. Такие гистотипы, как плоскоклеточные, железисто-плоскоклеточные карциномы, карциноидные опухоли, диагностируются редко. В связи с редкостью патологии изучение особенностей клинического течения, эффективности методов лечения, факторов прогноза при плоскоклеточных карциномах толстой кишки (ПКК) также затруднено [15]. В литературе с 1919 по 2006 г. описано менее 100 случаев ПКК [16, 17], однако возможность таких анализов должна полностью исключать варианты метастатического поражения прямой кишки и распространенного плоскоклеточного рака анального канала.
Показано, что ПКК встречается чаще у мужчин в возрасте старше 50 лет [18], т.е. несколько позже, чем аденокарцинома [16]. По данным канцер-регистра университета Missouri-Columbia Ellis Fischel Cancer Center, включающего анализ 4 561 случая опухолей толстой кишки, расположенных выше зубчатой линии, за период с 1940 по 1996 г. было выявлено 40 случаев плоскоклеточного рака (ПР) толстой кишки, из которых 39 наблюдений были ПР анального канала с распространением на прямую кишку и лишь один случай рака сигмовидной кишки [15]. Еще 2 случая ПКК (сигмовидной кишки и ректосигмоидного отдела) описаны исследователями из Саудовской Аравии [16], один случай рака прямой кишки – у мужчины 60 лет из Северной Индии [19]. Плоскоклеточный рак тонкой кишки – еще более редкая патология [20, 21]. При этом ПКК характеризуется отсутствием специфических клинических признаков, большей агрессивностью течения и худшим прогнозом [16]. Хирургическое вмешательство является основным методом лечения при ПКК, хотя есть данные и об эффективности химиотерапии [15, 16]. Радиотерапия может быть использована в адъювантном режиме или при рецидиве заболевания [16].
Этиология ПКК не ясна. Представляет интерес предположение, что полипы с плоскоклеточной метаплазией эпителия, плоскоклеточные карциномы, железисто-плоскоклеточный рак и мукоэпидермоидные карциномы могут возникать на фоне аденом толстой кишки с плоскоклеточной метаплазией. Случаи аденом толстой кишки с плоскоклеточной метаплазией в литературе не многочисленны. Последний из описанных случаев представлен наблюдением тубулярной аденомы с плоскоклеточной метаплазией у 44-летней женщины [22].
Железисто-плоскоклеточный рак толстой кишки, при котором в опухоли представлены и железистый и плоскоклеточный компоненты, встречается в 0,06–0,18 % случаев рака толстой и прямой кишки [11, 23–25]. Железисто-плоскоклеточные карциномы чаще наблюдаются в правой половине ободочной кишки. Прогноз железисто-плоскоклеточного рака толстой кишки, как и плоскоклеточной карциномы, хуже [24, 26].
В нашем клиническом наблюдении у пациентки Т., 53 года, с разницей в 9 мес диагностированы поражение плоскоклеточной карциномой яичников и сигмовидной кишки, что составило предмет дискуссий и дифференциальной диагностики между первично-множественным характером процесса
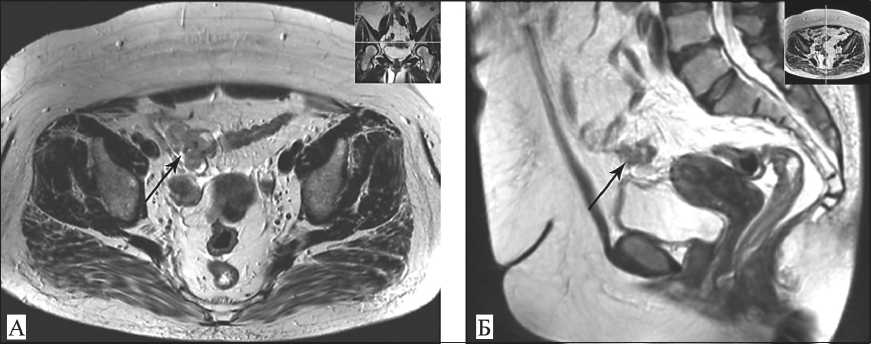
Рис. 1. Магнитно-резонансная компьютерная томография в режиме Т2: А – аксиальная плоскость, в области правого яичника определяется многоузловое образование, размером 74×43×36 мм, с наличием жидкостных включений; Б – сагиттальная плоскость, в области передней стенки сигмовидной кишки определяется аналогичное образование, размером 29×14 мм, плотно прилежащее к петлям сигмовидной кишки
и раком сигмовидной кишки с вторичным поражением яичников.
Заболевание дебютировало в перименопаузаль-ном периоде болевым синдромом и сопровождалось маточным кровотечением на фоне полипа эндометрия. Пациентке была выполнена гистероскопия, удален и гистологически подтвержден железистофиброзный полип эндометрия. При ультрасонографии в структуре правого яичника выявлено объемное образование. По данным МРТ придатки справа были представлены многоузловым образованием, размерами 74×43×36 мм, кистозно-солидной структуры с преобладанием солидного компонента (рис. 1). Видеоколоноскопия не выявила злокачественного поражения толстой кишки, эндоскопически был удален гиперпластический полип слепой кишки. Данных за поражение лимфатических узлов, наличие отдаленных метастазов получено не было. Уровень СА125 – 52,14 Ед/мл, НЕ4 – 255,4 пмоль/л, что несколько выше нормы.
В условиях Томского НИИ онкологии пациентке выполнена диагностическая лапароскопия. При ревизии правый яичник был представлен опухолью неправильной формы с кистозным компонентом, размером 40×25 мм и солидным компонентом белесого цвета неправильной формы с гладкой наружной поверхностью, размером 40×35 мм. Контралатеральный яичник до 35 мм в диаметре с единичным возвышающимся над поверхностью белесым вкраплением до 5 мм. В сальнике определялось уплотнение до 2 см в диаметре. Выполнены удаление придатков справа, биопсия контралатерального яичника и участков брюшины в рамках хирургического стадирования.
При плановом морфологическом и иммуногистохимическом исследовании в обоих яичниках наблюдалась картина низкодифференцированной плоскоклеточной карциномы с компонентом саркоматоидного типа. При светооптической микроскопии опухоль представлена умеренно полиморфными клетками с ядрами округлой формы и умеренно выраженной базофильной цитоплазмой. Опухолевые клетки располагаются дискретно и небольшими скоплениями (рис. 2а). При иммуногистохимическом исследовании выявлена экспрессия Cytokeratine AE1/AE3 (clone AE1/AE3, RTU, Dako, Дания), Cytokeratine HMW (betta clone34E12, 1:50, Dako, Дания), в части клеток CD117(c-kit) (Polyclonal, 1:500, Dako, Дания) и Vimentine (clone V9, RTU, Dako, Дания). Пролиферативная активность
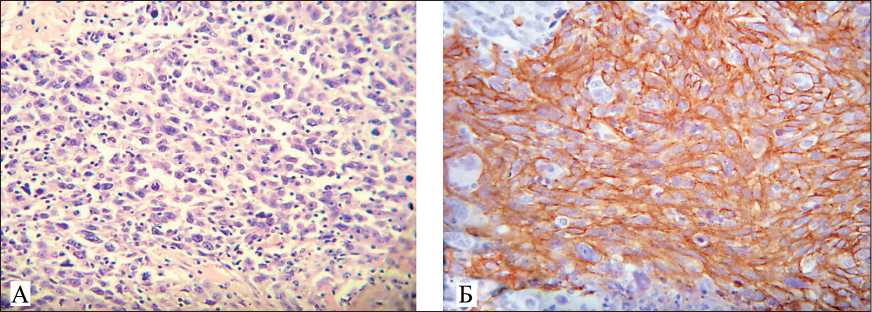
Рис. 2. Микрофото: А – светооптическая микроскопия. Опухоль в яичнике представлена полиморфными клетками с ядрами неправильной формы, окраска гематоксилином и эозином, ×200; Б – иммуно-гистохимическое исследование. Яркая экспрессия HMW (Cytokeratin, HighMolrcularWeight) (clone 34βE12, Dako), ×200
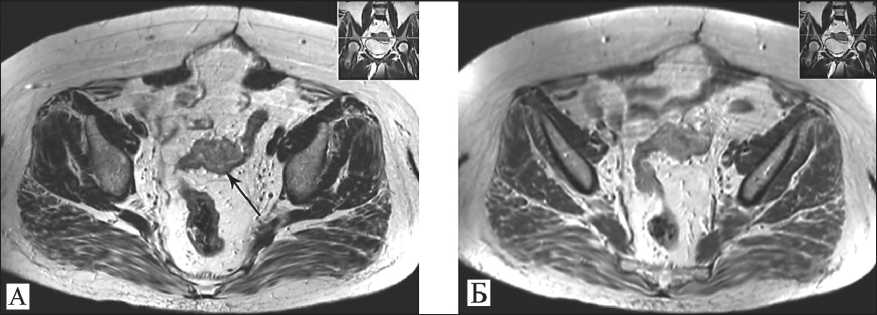
Рис. 3. Магнитно-резонансная компьютерная томография: А – Т2-взвешенное изображение в аксиальной плоскости. В сигмовидной кишке опухолевое образование, размером 47×32×34 мм (указано стрелкой), циркулярно инфильтрирующее просвет;
Б – Т1-взвешенное изображение с контрастным усилением. Диффузное накопление парамагнетика в опухоли
высокая – Кi67 76 % (clone MIB-1, RTU, Dako, Дания). Отсутствовала экспрессия СА125 (Ovarian Cancer Antigen) (clone Ov185:1, 1:100, Novocastra, Великобритания), PLAP (Placental Alkaline Phosphatase) (clone 8A9, 1:40, Dako, Дания), Human Chorionic Gonadotrophin (clone 4E12, 1:50, Novo-castra, Великобритания), α-ингибин (clone R1, 1:50, Dako, Дания), CD30 (clone BER-H2, RTU, Dako, Дания), WT1 (clone 6F-H2, RTU, DBS, Нидерланды), RE (clone 1D5, RTU, Dako, Дания), RP (clone PgR 636, RTU, Dako, Дания) (рис. 2б). Также выявлено метастатическое поражение опухолью большого сальника и брюшины левого бокового канала.
На основании клинико-морфологических данных сформулирован диагноз: Низкодифференцированная плоскоклеточная карцинома яичника IIIс стадии (Т3сNхМ0).
В последующем пациентка получила 4 курса химиотерапии (ХТ) по схеме ТР (паклитаксел в дозе 175 мг/м2 в 1-й день, цисплатин в дозе 75 мг/м2 в 1-й день). Уровень СА125 после курсов ХТ – 25 Ед/мл, НЕ-4 – 72,40 пмоль/л. Через 3 мес выполнена промежуточная циторедуктивная операция.
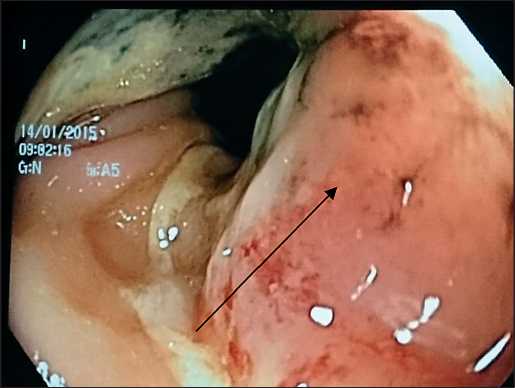
Рис. 4. Видеоколоноскопия. В области ректосигмоидного перехода определяется деформация просвета кишки за счет опухолевидного образования округлой формы, диаметром до 30 мм с некрозом в центре
При лапаротомии тело матки было без признаков поражения серозной оболочки, с единичным миоматозным узлом до 20 мм в диаметре, расположенным интрамурально, область удаленных правых придатков – без особенностей. Размер левого яичника – 25 мм. Метастаз в сальнике до 15 мм в диаметре с участками кальцинации. Отмечался канцероматоз брюшины брыжейки тонкой кишки – от 0,5 до 3 см в диаметре с признаками фиброза, один из которых был резецирован в пределах здоровых тканей.
Плановое морфологическое исследование подтвердило метастатическое поражение сальника, иммунофенотип соответствовал низкодифференцированной плоскоклеточной карциноме. В ткани брыжейки тонкой кишки при микроскопии отмечался фокус аутолиза, окруженный фиброзом, гиалинозом и очагами оссификации.
В адъювантном режиме пациентке проведено 4 курса химиотерапии по прежней схеме. Однако при контрольном обследовании через 1 мес после завершения ХТ появились боли в левой подвздошной области. При МРТ выявлено объемное образование органов малого таза с признаками инвазии ректосигмоидного отдела толстой кишки. Течение рака яичников было расценено как резистентное, была назначена монохимиотерапия гемцитабином. Увеличение размеров образования до 35 мм, появление признаков прорастания слизистой сигмовидной кишки, парааортальной лимфаденопатии после 4-го курса ХТ потребовало смены режима на ци-клофосфан с адриамицином. Однако к третьему курсу лечения наблюдалось дальнейшее увеличение опухоли (рис. 3). Уровень СА125 достиг 50,4 Ед/мл, SCC – 1,22 нг/мл.
При видеоколоноскопии в области ректосигмоидного перехода определяется деформация просвета кишки за счет опухолевидного образования округлой формы, диаметром до 30 мм с некрозом в центре. Структура ямочного рисунка разрушена. Биопсия. Осмотр проксимальных отделов толстой кишки затруднен из-за стеноза (рис. 4). Заключение: сдавление толстой кишки в области
Рис. 5. Макропрепарат. Опухоль в кишке представлена образованием до 35 мм в диаметре, блюдцеобразной формы роста ректосигмоидного перехода извне с признаками прорастания. Опухоль ректосигмоидного отдела.
Морфологическое исследование биоптата показало, что опухоль представлена полиморфными клетками с ядрами округлой и неправильной формы, в части ядер имелись ядрышки. Опухолевые клетки располагались скоплениями разной величины. Встречалось умеренное количество митозов. Определялась выраженная экспрессия Citokeratin HMW (Dako, betta clone34E12, 1:50, Дания), в части опухолевых клеток – Citokeratin AE1/AE3 (cloneAE1/AE3, Dako, RTU, Дания), Citokeratin 7 (clone OV-TL 12/30, RTU, Novocastra, Великобритания). Отсутствовала экспрессия Vimentin (clone V9, RTU, Dako, Дания), Citokeratin 20 (clone Ks 20.08, Novocastra, Великобритания), CDX2 (clone AMT22, RTU, Novocastra, Великобритания), CD34 (clone QBEnd 10, RTU, Dako, Дания), CD117 (c-kit) (Policlonal, 1:500, Dako, Дания), DOG1 (clone SP31, RTU, Spring Bioscience, Великобритания), P63 (clone 7JUL, RTU, Novocastra, Великобритания). Гисто- и иммунофенотип опухоли соответствовал карциноме низкой степени дифференцировки с экспрессией высокомолекулярных («плоскоклеточных») цитокератинов.
15.01.2015 выполнена операция релапаротомия. При ревизии опухоль определялась в виде уплотнения до 50 мм в диаметре в области дистального отдела сигмовидной кишки. Парааортально пальпировались плотно-эластические лимфатические узлы, до 2,5 см в диаметре. Выполнена дистальная резекция сигмовидной кишки, резекция имплантационных метастазов, селективная парааорталь-ная лимфаденэктомия. Макропрепарат: опухоль блюдцеобразной формы до 35 мм в диаметре, прорастает все слои стенки кишки, толщина ее стенки – 17 мм. По характеру роста напоминает первичную опухоль кишки (рис. 5). На разрезе ткань белесоватого цвета.
При морфологическом и иммуногистохимическом исследовании получены данные за плоскоклеточный рак сигмовидной кишки низкой степени дифференцировки с прорастанием до серозной оболочки и метастатическим поражением 3 лимфатических узлов из 4 исследованных. Признаков лечебного патоморфоза в опухоли не выявлено.
Гистологически опухоль представлена полиморфными клетками с ядрами вытянутой и неправильной формы, в части ядер имеются ядрышки, многочисленные патологические митозы. Опухолевые клетки расположены в виде тяжей, солидных полей с обширными участками некроза (рис. 6).
Пересмотр и сопоставление морфологических препаратов опухолей яичников и толстой кишки не позволяет с полной уверенностью высказаться в пользу единого процесса с первичным опухолевым поражением сигмовидной кишки и вторичным – яичников. Основной клинический момент, свидетельствующий в пользу полинеоплазии, – отсутствие опухоли в сигмовидной кишке на момент выявления рака яичников. На догоспитальном этапе пациентке дважды проводилась видеоколоноскопия: по месту жительства, при которой удален полип сигмовидной кишки, и повторно в НИИ онкологии, когда при удовлетворительной подготовке кишки, патологии выявлено не было.
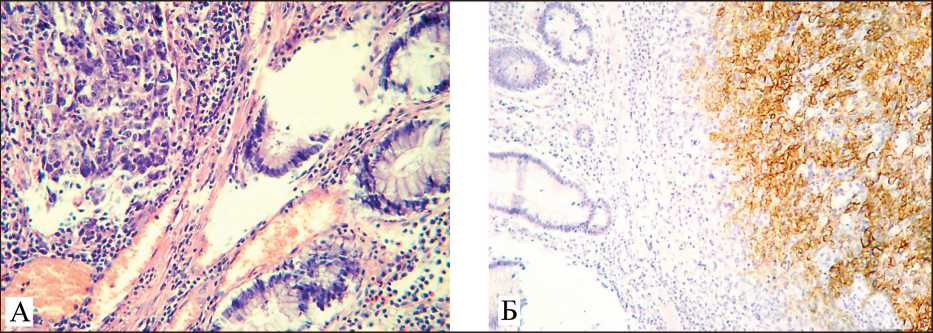
Рис. 6. Микрофото: А – светооптическая микроскопия. В слизистой кишки определяется опухоль из полиморфных клеток с ядрами вытянутой и неправильной формы в виде солидных полей, окраска гематоксилином и эозином, ×200;
Б – иммуно-гистохимическое исследование. Яркая цитоплазматическая экспрессия HMW (Cytokeratin, HighMolrcularWeight) (clone 34βE12, 1:50, Dako, Дания), ×200
Возможные варианты развития событий:
-
1. Наличие микроскопической опухоли толстой кишки, не визуализируемой при видеоколоноскопии, с высоким метастатическим потенциалом, сопровождающимся ранним гематогенным метастазированием в яичники, имплантационным метастазированием.
-
2. Наличие имплантационного или гематогенного метастаза рака яичников с прорастанием со стороны серозной оболочки в просвет кишки.
-
3. Первично-множественные синхронные опухоли яичника и толстой кишки.
Эти гипотезы могут быть окончательно подтверждены либо опровергнуты лишь данными молекулярно-генетического исследования.
Пациентке был установлен диагноз: Первичномножественные синхронные опухоли: Рак яичников IIIс стадии (T3сNхM0). Состояние после лапароскопии, овариоэктомии справа, 4 курсов неоадъювантной химиотерапии по схеме ТР, интервальной циторедукции – лапаротомии с экстирпацией матки и левых придатков, оментэк-томии. Состояние после 8 курсов адъювантной химиотерапии по схеме ТР. Синхронный рак сигмовидной кишки IIIb стадии (Т3N2M0). Состояние после резекции сигмовидной кишки.
В адъювантном режиме пациентка получила 6 курсов химиотерапии оксалиплатином. После завершения адъювантного лечения было выявлено метастатическое поражение печени. После курсов ХТ иринотеканом – стабилизация метастатического очага, при смене режима на гемцитабин с цисплатин – частичная регрессия опухолевого поражения в печени. В настоящее время пациентка направлена на эмболизацию метастатических очагов в печени. Общий период наблюдения с момента появления первых признаков заболевания составляет 50 мес.
Обсуждение
Плоскоклеточный гистотип карцином яичника и сигмовидной кишки в случае первичномножественного поражения или ПКК с вторичным поражением яичников позволяет рассматривать данное клиническое наблюдение как редкое. Присутствие убедительных данных за первичномножественный характер заболевания может лишь подчеркивать уникальность наблюдения плоскоклеточных карцином двух локализаций. Рассмотрение случая первичного плоскоклеточного рака сигмовидной кишки лишь незначительно уступает по актуальности полинеоплазиям в силу его ещё более редкой встречаемости по сравнению с ПРЯ. Так или иначе, гистогенез плоскоклеточного рака любой локализации остается окончательно не установленным. Канцерогенез злокачественных плоскоклеточных опухолей обсуждается в рамках конкуренции нескольких гипотез: в части случаев ПРЯ ассоциируют с дисэмбриогенезом или эн- дометриозом, в случае ПР толстой кишки – либо с эктопическими клетками плоского эпителия, плюрипотентными стволовыми клетками эндодермального происхождения, либо процессами плоскоклеточной метаплазии. Считается, что, как и для ПРЯ, наличие дермоидных кист или эндометриоза, язвенного колита, шистосомоза, и воздействие радиации играют роль в патогенезе данного типа карцином в кишке. Явных причин злокачественной трансформации дермоидных кист, как и других случаев ПРЯ, не выявлено. Среди зарегистрированных случаев «чистого» ПРЯ выявлены значимые ассоциации с дисплазией шейки матки [27].
Вирус папилломы человека (ВПЧ) – инфекция, которая была определена как причина рака шейки матки [28]. Папилломавирусная инфекция также обнаружена при раке вульвы, влагалища и промежности [29–31]. Прогрессирование пролиферирующих эпителиальных клеток с развитием карциномы других локализаций может также быть связано с ВПЧ-инфекцией высокого онкогенного риска [32]. Тем не менее роль ВПЧ в развитии рака верхних отделов половых путей, таких как рак эндометрия и рак яичников, менее ясна, а этиология рака яичника в целом остается до конца не изученной [33, 34].
Роль ВПЧ в развитии плоскоклеточных карцином яичников данными молекулярного анализа не подтверждена, хотя многими рассматривается как вполне логичная. В упомянутом выше исследовании у одной из пациенток с I стадией ПКЯ, ассоциированного с дермоидной кистой и высокой степенью дифференцировки, также имелась плоскоклеточная карцинома in situ шейки матки, как и в одном наблюдении из 7 случаев ПКЯ на фоне эндометриоза, где тоже сопутствовал рак шейки матки in situ. Кроме того, карцинома in situ шейки матки имелась в 3 из 11 наблюдений «чистой» ПКЯ [13].
Представляет интерес ретроспективное исследование китайских ученых, показавшее наличие ВПЧ-16 Е6 в опухоли яичника с использованием методов гибридизации in situ, свидетельствующее, что ВПЧ-инфекция может играть определенную роль в канцерогенезе яичников: 52 % архивных образцов опухолевой ткани (n=54, из них 50 случаев эпителиальных злокачественных опухолей яичников, 4 – неэпителиальных) были ВПЧ-16 Е6 положительными. В противоположность этому 6,7 % нормальной ткани яичников были ВПЧ-16 положительными. Частота ВПЧ-16-инфекции была значительно выше в ткани рака по сравнению с контрольной группой (р<0,01). Кроме того, ВПЧ-16 инфекция не выявлена ни в одном случае неэпителиального РЯ [35].
В данном клиническом наблюдении проведено ВПЧ-типирование опухолевой ткани яичников и сигмовидной кишки методом Real-time ПЦР, который показал наличие ДНК ВПЧ высокоонкогенного риска (16-й тип) во всех исследованных образцах, что может свидетельствовать в пользу вирусной природы карцином.
Таким образом, дефицит представлений об этиопатогенезе плоскоклеточных карцином определяет трудности диагностики и выбора тактики лечения данной категории больных. Редкость данной патологии исключает наличие крупных рандомизированных исследований, в которых могут быть определены эффективные
Список литературы Случай первично-множественной плоскоклеточной карциномы яичников и сигмовидной кишки
- Ayhan A., Bukulmez O., Genc C., Karamursel B.S., Ayhan A. Mature cystic teratomas of the ovary: case series from one institution over 34 years. Eur J Obstet Gynecol Reprod Biol. 2000 Feb; 88 (2): 153-7. 10.1016/ S0301-2115(99)00141-4. DOI: 10.1016/S0301-2115
- Comerci J.T. Jr., Licciardi F., Bergh P.A., Gregori C., Breen J.L. Mature cystic teratoma: a clinicopathologic evaluation of 517 cases and review of the literature. Obstet Gynecol. 1994 Jul; 84 (1): 22-8.
- Powell J.R., Haldar K. Squamous cell carcinoma arising in a mature cystic teratoma of the ovary - a case series and review of the literature. Eur Oncol Hematol. 2013; 9 (1): 17-20. DOI: 10.17925/EOH.2013.09.1.17
- Hurwitz J.L., Fenton A., McCluggage W.G., McKenna S. Squamous cell carcinoma arising in a dermoid cyst of the ovary: a case series. BJOG. 2007; 114: 1283-1287. DOI: 10.1111/j.1471-0528.2007.01478.x
- Gainford M.C., Tinker A., Carter J., Petru E., Nicklin J., Quinn M., Hammond I., Elit L., Lenhard M., Friedlander M. Malignant transformation within ovarian dermoid cysts: an audit of treatment received and patient outcomes. An Australia New Zealand gynaecological oncology group (ANZGOG) and gynaecologic cancer intergroup (GCIG) study. Int J Gynecol Cancer. 2010 Jan; 20 (1): 75-81. fccf. DOI: 10.1111/IGC.0b013e3181c7


