Случай первичной меланомы желудка
Автор: Тонеев Е. А., Чарышкин А. Л., Деньгина Н. В., Жинов А. В., Мартынов А. А., Городнов С. В., Лазаревский М. М.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Клинический случай
Статья в выпуске: 1 т.10, 2020 года.
Бесплатный доступ
Первичная меланома желудка представляет собой чрезвычайно редкое заболевание. Меланома верхних отделов желудочно-кишечного тракта диагностируется, как правило, в виде метастаза из первичного очага на коже с частотой 1 - 4 % случаев. В статье представлен клинический случай первичной меланомы желудка у пациентки, которая получила комплексное лечение в условиях ГУЗ Областной клинический онкологический диспансер г. Ульяновска.
Меланома желудка, гастрэктомия, торакоабдоминальная хирургия, диагностика меланомы
Короткий адрес: https://sciup.org/140251214
IDR: 140251214 | DOI: 10.18027/2224-5057-2020-10-35-40
Текст научной статьи Случай первичной меланомы желудка
Клиническое наблюдение
Общеклинические данные обследования больной не содержали отклонений от нормы, показатели онкомаркеров (РЭА, СА-19-9) не превышали референсных значений.
Мультидисциплинарный консилиум врачей в составе торакального хирурга, радиотерапевта и химиотерапевта принял решение начать лечение с полихимиотерапии по схеме ELF (Этопозид 200 мг в/в 1–3 дни, лейковорин 85 мг в/в 1–3 дни, 5-фторурацил 850 мг в/в 1–3 дни, повтор каждые 28 дней) ввиду распространённости процесса и наличия сопутствующей сердечно-сосудистой пато- логии; кроме того, состоялась заочная консультация пациентки в ФГБУ НМИЦ им. Н.Н. Блохина, с одобрением предложенной схемы химиотерапии. Пациентке было проведено 6 курсов химиотерапии, а также паллиативный курс гипофракционированного облучения (12 фракций по 3 Гр) на область первичной опухоли в биологически эквивалентной дозе (BED) 46,8 Гр. По данным последующего контрольного обследования через 1 месяц после окончания лечения отмечена стабилизация процесса (рис. 3, 4). Пациентка все этапы лечения перенесла удовлетворительно, нефро- и гематологической токсичности не отмечено.
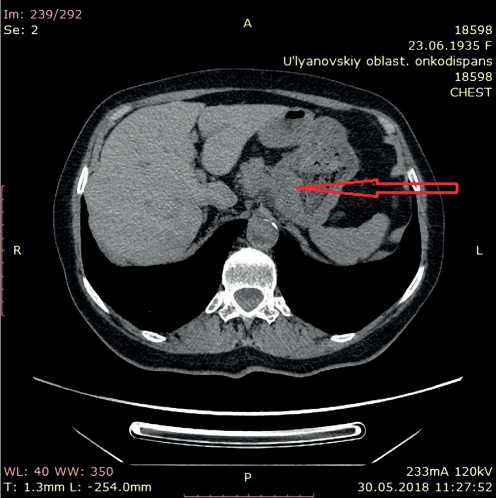
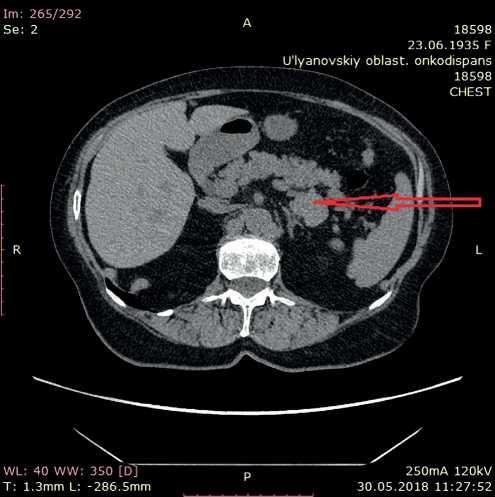
Рисунок 2. КТ брюшной полости (стрелкой отмечен увеличенный л/узел в области хвоста поджелудочной железы).
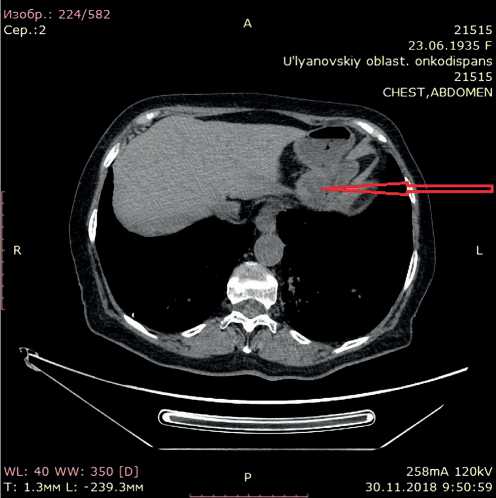
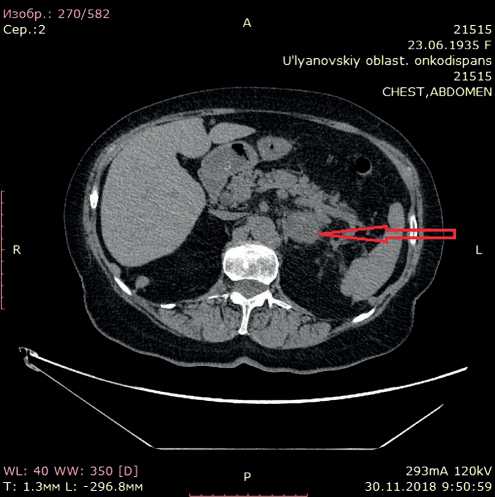
Рисунок 4. КТ брюшной полости (стрелкой указан отмечен увеличенный л/узел в области хвоста поджелудочной железы).
В процессе лечения больная регулярно наблюдалась у кардиолога с целью максимально возможной коррекции сопутствующей сердечно-сосудистой патологии.
Пациентка повторно осмотрена на консилиуме врачей, в этот раз с привлечением анестезиологов; было принято решение провести хирургическое лечение в объеме гастрэктомии с лимфодиссекцией D2 ввиду отсутствия положительной динамики процесса, а также удовлетворительных функциональных показателей больной.
Операция состоялась 12.02.2019: произведена лапаротомия, торакотомия справа, расширенно-комбинированная гастрэктомия, субтотальная резекция пищевода с пластикой толстой кишкой, лимфодиссекция уровня D2, спленэктомия, левосторонняя адреналэктомия.
Причиной субтотальной резекции пищевода стало его неудовлетворительное кровоснабжение в нижнегрудном сегменте, поэтому было принято решение о выполнении его пластики левой половиной толстой кишки. Левосторонняя адреналкэтомия произведена из-за инвазии метастатического конгломерата лимфоузлов 11 группы в левый надпочечник. Интраоперацинно отмечено интенсивное окрашивание лимфатических узлов в черный цвет.
Послеоперационный период протекал гладко, экстубация выполнена через 4 часа после операции, энтеральное питание больной начато со вторых суток.
Рентгенологический контроль на 7 и 12 сутки не выявил осложнений со стороны трансплантата (рис. 5,6).
Выписка пациентки из стационара состоялась на 21 сутки после оперативного лечения.
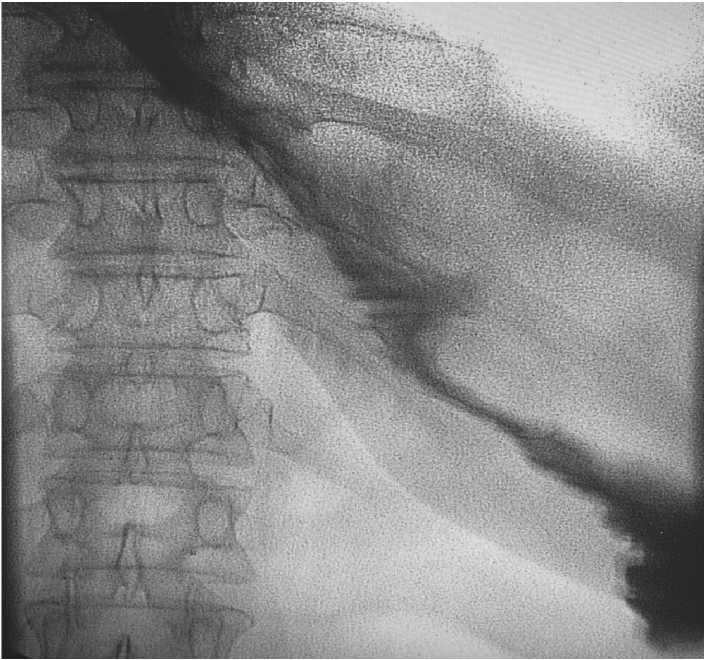
Рисунок 5. Рентгенологический контроль на 7 сутки после операции.
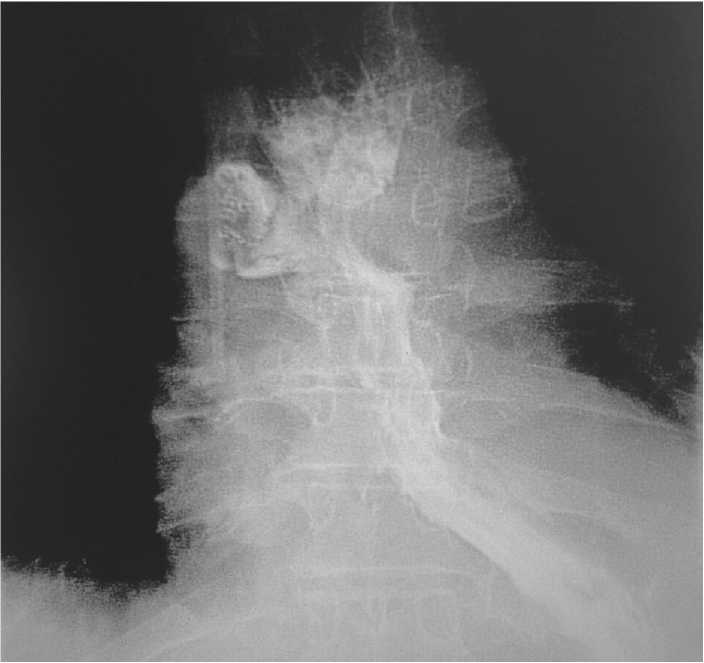
Рисунок 6. Рентгенологический контроль на 12 сутки после операции.
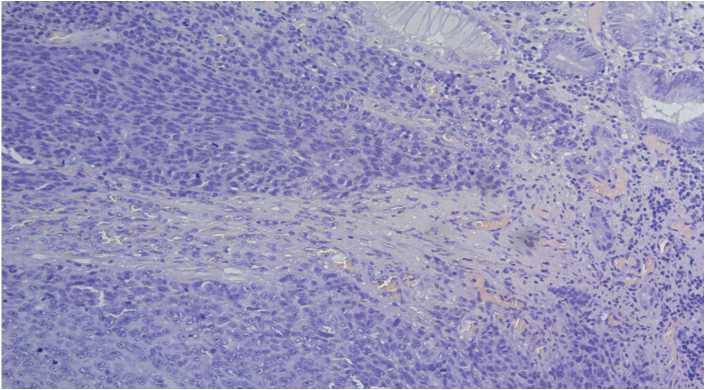
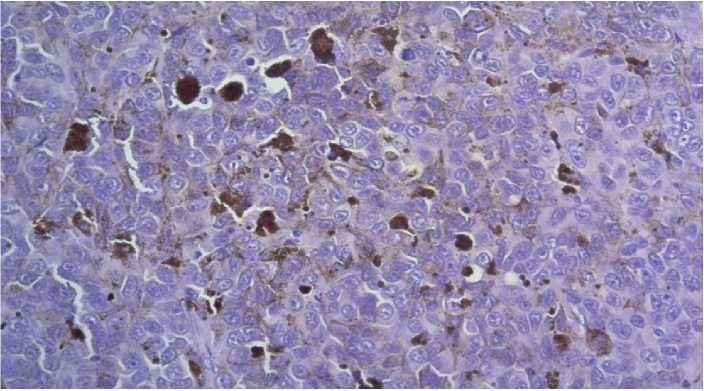
Рисунок 8. Окраска гематоксилином и эозином, ув. × 20. Очаговая пигментация в опухоли.
3 × 2 см, в подлежащей ткани опухолевый узел буровато-серого цвета с черными вкраплениями, прорастает мышечный слой без прорастания серозной оболочки.
Микроскопическое описание
Иммуногистохимическое исследование
Экспрессия опухолевыми клетками MART-1 (маркер клеток меланогенного происхождения) (рис. 9).
После полученного морфологического заключения пациентка была тщательно осмотрена онкологом для выявления патологических образований на коже и видимых слизистых и офтальмологом для исключения меланомы сетчатки. Опухолевого поражения вышеуказанных органов не отмечено. Эндоскопическое обследование кишки было произведено еще на догоспитальном этапе, и данных за поражение толстой кишки также не получено.
Для подтверждения диагноза был выполнен пересмотр гистопрепаратов в ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава РФ. Диагноз в итоге был подтвержден, а также выполнено генетическое исследование панели молекулярно-генетических онкомаркеров — мутаций в «горячих точках» генов KRAS (экзоны 2, 3 и 4), NRAS (экзоны 2, 3 и 4), BRAF (экзон 15), GNAQ (экзоны 4 и 5), GNA11 (экзоны 4 и 5) и TERT.
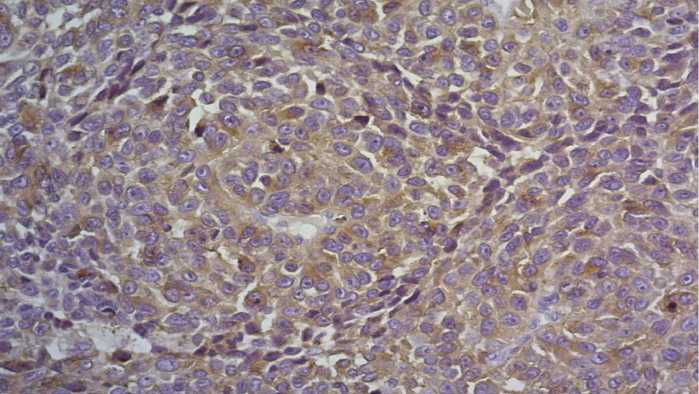
Рисунок 9. Иммуногистохимическое исследование с антителом к MART-1 — маркеру клеток меланогенного происхождения, ув. ×20. В цитоплазме опухолевых клеток отмечается диффузная выраженная экспрессия MART-1.
Результат генетического исследования
По результатам исследования методом мутационно-специфической ПЦР-РВ в соответствии с ДНК образца мутаций в «горячих точках» экзонов 2, 3 и 4 гена KRAS не обнаружено, так же как не выявлено мутаций в «горячих точках» экзонов 2, 3 и 4 гена NRAS и в «горячих точках» экзона 15 гена BRAF.
По результатам исследования методами высокочувствительной мутационно-специфической ПЦР-РВ и ПЦР с последующим секвенированием продуктов ПЦР в ДНК образца мутаций в «горячих точках» экзонов 4 и 5 гена GNAQ не обнаружено. Не было выявлено и мутаций в «горячих точках» экзонов 4 и 5 гена GNA11, и в «горячих точках» гена TERT.
Таким образом, был подтверждён диагноз меланомы, причем с большой вероятностью — внекожной локализации.
Пациентка от проведения какого-либо дальнейшего специального лечения отказалась, ссылаясь на слабость.
ОБСУЖДЕНИЕ
ВЫВОДЫ
От авторов: работа поддержана Грантом для российских исследователей ассоциации специалистов по проблемам меланомы.
Список литературы Случай первичной меланомы желудка
- Song SE, Lee CH, Kim KA, Lee HJ, Park CM. Malignant glomus tumor of the stomach with multiorgan metastases: report of a case. Surg Today. 2010;40 (7):662-667. 10.1007 / s00595-008-4113-z. DOI: 10.1007/s00595-008-4113-z
- Baur EH. Ein Fall von primarem melanom des esophagus. Arb Geb Pathol Anat Inst Tubingen. 1906;5:343-354
- Sabanathan S, Eng J, Pradhan GN. Primary malignant melanoma of the esophagus. Am J Gastroenterol. 1989;84:1475- 1481
- Scotto J, Fraumeni JF, Lee JA. Melanomas of the eye and other noncutaneous sites: epidemiologic aspects. J Natl Cancer Inst. 1976;56:489-491.
- Li H, Fan Q, Wang Z, Xu H, Li X, Zhang W, Zhang Z. Primary malignant melanoma of the duodenum without visible melanin pigment: a mimicker of lymphoma or carcinoma. Diagn Pathol. 2012;7:74. DOI: 10,1186 / 1746-1596-7-74
- Chang AE, Karnell LH, Menck HR. The National Cancer Data Base report on cutaneous and noncutaneous melanoma: a summary of 84,836 cases from the past decade. The American College of Surgeons Commission on Cancer and the American Cancer Society. Cancer. 1998;83:1664-1678. 10.1002 / (SICI) 1097-0142 (19981015) 83:83.0. CO;2-G
- DOI: 10.1002/(SICI)1097-0142(19981015)83
- Patel JK, Didolkar MS, Pickren JW, Moore RH. Metastatic pattern of malignant melanoma. A study of 216 autopsy cases. Am J Surg. 1978;135:807-810
- Aggarwal R, Dhawan S, Chopra P. Primary Gastric Melanoma: a Diagnostic Challenge. J Gastrointest Cancer. 2013 [Epub ahead of print]
- Schuchter LM, Green R, Fraker D. Primary and metastatic diseases in malignant melanoma of the gastrointestinal tract. Curr Opin Oncol. 2000;12:181-185. 10.1097 / 00001622-200003000-00014.
- DOI: 10.1097/00001622-200003000-00014
- Cheung MC, Perez EA, Molina MA, Jin X, Gutierrez JC, Franceschi D, Livingstone AS, Koniaris LG. Defining the role of surgery for primary gastrointestinal tract melanoma. J Gastrointest Surg. 2008;12:731-738. DOI: 10,1007 / s11605-007-0417-3
- Sachs DL, Lowe L, Chang AE, Carson E, Johnson TM. Do primary small intestinal melanomas exist Report of a case. J Am Acad Dermatol. 1999;41:1042-1044. 10.1016 / S0190-9622 (99) 70273-2
- DOI: 10.1016/S0190-9622(99)70273-2
- Song W, Liu F, Wang S, Shi H, He W, et al. (2014) Primary gastric malignant melanoma: Challenge in preoperative diagnosis. Int J Clin Exp Pathol 7: 6826-6831.
- Kyriakopoulos C, Zarkavelis G, Andrianopoulou A (2017) Primary pulmonary malignant melanoma: Report of an important entity and literature review. Case Rep Oncol Med 2017:8654326.
- Blecker D, Abraham S, Furth EE, Kochman ML. Melanoma in the gastrointestinal tract. Am J Gastroenterol. 1999;94:3427- 3433. 10.1111 / j. 1572-0241.1999.01604. x.
- DOI: 10.1111/j.1572-0241.1999.01604.x


