Случай развития кардиогенного шока после внутриартериального введения папаверина при измерении фракционного резерва кровотока в передней нисходящей артерии
Автор: Семухина Елена Николаевна, Семухин Михаил Витальевич, Гапон Людмила Ивановна, Зырянов Игорь Павлович
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: В помощь практическому врачу
Статья в выпуске: 4 т.32, 2017 года.
Бесплатный доступ
Инфаркт миокарда, осложнившийся кардиогенным шоком, - очень редкое, но тяжелое ятрогенное осложнение при интервенционных вмешательствах. Повреждения сосудов микроциркуляторного русла; нарушения микроциркуляции, отек перикапиллярных тканей; микроэмболизация микрокристаллами контрастного вещества и тромботическими массами; воспалительная реакция в ответ на выброс гистамина, функциональные нарушения автономной вегетативной нервной системы сердца вызвали феномены «No-reflow» и «Slow-reflow», что привело к развитию патологического состояния. При этом тактика вмешательства зависит от решения оператора и определяется индивидуально в каждом конкретном случае, однако очевидной является необходимость полной реваскуляризации миокарда.
Кардиогенный шок, внутриартериальное введение папаверина, фракционный резерв кровотока, феномен "no-reflow", феномен "slow-reflow"
Короткий адрес: https://sciup.org/149125187
IDR: 149125187 | УДК: 616-006 | DOI: 10.29001/2073-8552-2017-32-4-59-64
Текст научной статьи Случай развития кардиогенного шока после внутриартериального введения папаверина при измерении фракционного резерва кровотока в передней нисходящей артерии
Несмотря на то, что коронароангиография (КАГ) является мировым признанным стандартом при ишемической болезни сердца (ИБС) в выборе тактики ведения пациента (реваскуляризация миокарда путем проведения чрескожного коронарного вмешательства (ЧКВ) или аортокоронарного шунтирования или продолжение консервативного лечения), решение вопроса о проведении ангиопластики должно основываться на объективных доказательствах ишемии миокарда [1].
Фракционный резерв кровотока — ФРК (fractional flow reserve — FFR) используется при КАГ для измерения различия давления в стенозированной коронарной артерии с целью определения вероятности ишемии миокарда [2]. ФРК определяется отношением давления после (дистальнее) стеноза к давлению до (проксимальнее) стеноза и оценивается в виде абсолютного числа. ФРК=0,80 означает, что данный стеноз вызывает 20%-ное падение артериального давления (АД), т.е. ФРК — это максимальный поток за стенозом в сравнении с предположительным максимальным потоком в отсутствие стеноза. Особенно это важно для пациентов, у которых до проведения КАГ не проведены нагрузочные тесты с физической нагрузкой, стресс-эхокардиография ввиду противопоказаний или отсутствия возможностей, а также при контрастировании коронарных артерий выявлены стенозы 50–70%. Метод помогает уменьшить необходимость проведения как экстренной, так и плановой реваскуляризации в сравнении только с медикаментозной терапией [3], таким образом уменьшив количество ЧКВ-индуцированных осложнений, в том числе связанных с длительной двойной дезагрегационной терапией после хирургического вмешательства, и также проконтролировать оптимальную имплантацию стентов у пациентов с гемодинамически значимым поражением коронарного русла. Обязательным условием является провокация максимального расширения сосудов — гиперемия в двух отделах циркуляторного русла (эпикардиальных или проводящих артериях и микроциркуляторном русле или артериях сопротивления), иначе градиент давления в месте стеноза может быть недооценен, что ведет к неправильной оценке состояния коронарного русла. Наиболее часто в мировой практике в условиях рентгеноперационной для достижения гиперемии при измерении ФРК используется интракоронарное введение папаверина, аденозинтрифосфата или аденозина [4–8]. На фоне этого наблюдаются следующие побочные эффекты, которые были ранее описаны в литературе [4, 5, 8]: удлинение интервала QT на электрокардиограмме (ЭКГ), которое может способствовать развитию полиморфной желудочковой тахикардии и фибрилляции желудочков [9–12], преходящей атриовентрикулярной блокады, гипотонии, тахикардии, неприятным давящим болям в груди, похожим на стенокардию. В РФ чаще для достижения коронарной гиперемии используют внутрикоронарное введение папаверина, которое показало себя безопасным и эффективным. Зарегистрировано 1,2% осложнений [13–15].
В настоящее время определение ФРК является наиболее точным из инвазивных методов определения функциональной значимости пограничных стенозов коронарных артерий, но технические сложности при создании искусственной гиперемии и связанный с этим относительно высокий риск осложнений ограничивают широкое внедрение данного метода в повседневную клиническую практику [13]. Основными причинами осложнений являются: состояние гипокалиемии, прием препаратов, вызывающих удлинение интервала QT (противоаритмические препараты I и III классов). Кроме этого, интракоронарное введение папаверина строго противопоказано при использовании некоторых ионных контрастных веществ (например, гексабрикса), так как оно может вызывать кристаллизацию контрастного агента [16]. Недостатком применения препарата может служить продолжительный период полураспада, поэтому папаверин следует вводить не более 3 раз за процедуру для снижения риска возможных побочных действий и осложнений [17].
Нами представлен клинический случай развития кардиогенного шока после внутриартериального введения папаверина при измерении ФРК в передней нисходящей артерии (ПНА).
Клинический случай
Больной М., 54 года, поступил в Тюменский кардиологический научный центр с диагнозом «ИБС. Стенокардия напряжения ФК II. Артериальная гипертония, III стадия, 2-я степень, риск 4. ХСН I. ФК II (NYHA)».
Из анамнеза известно, что в течение 10 лет пациент страдает артериальной гипертонией с повышением цифр АД максимально до 150/100 мм рт. ст., клинические проявления ИБС с 2017 г., отмечает жжение за грудиной, возникающее при ходьбе около 500 м, и одышку при подъеме свыше двух лестничных пролетов, которые купируются сублингвальным приемом нитроглицерина. Регулярно принимает бисопролол, аторвастатин, ацетилсалициловую кислоту. Вредные привычки: курит много лет.
Сопутствующую патологию отрицает.
На ЭКГ: ритм синусовый с частотой сердечных сокращений 50 уд./мин.
По данным эхокардиографии (ЭхоКГ): сократительная функция левого желудочка удовлетворительная. Дилатация полости левого предсердия, атеросклероз аорты. Фракция выброса (ФВ) левого желудочка — 66%.
На тредмил-тесте: тест положительный, толерантность к физической нагрузке средняя. На пике нагрузки зарегистрирована депрессия сегмента ST до 2,0 мм в II, III, AVF, V5, V6, сопровождающаяся сжимающей болью за грудиной.
На КАГ от 07.06.2017 выявлено: ствол левой коронарной артерии (ЛКА) — неровность контуров; ПНА в проксимальном сегменте — стеноз 50%; первая диагональная ветвь (ДВ) — стеноз 50% (рис. 1); правая коронарная артерия (ПКА) — окклюзия, коллатеральный кровоток 3-й степени (рис. 2). Заключение: двухсосудистое гемодинамически значимое стенотическое и окклюзионное поражение коронарных артерий. Для определения функциональной значимости поражения необходимо проведение измерения ФРК в ПНА.
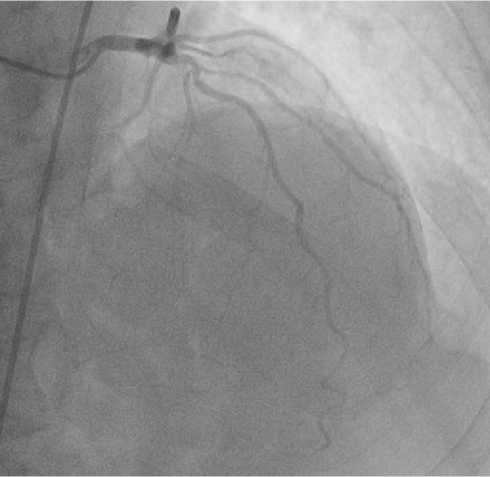
Рис. 1. КАГ левой коронарной артерии
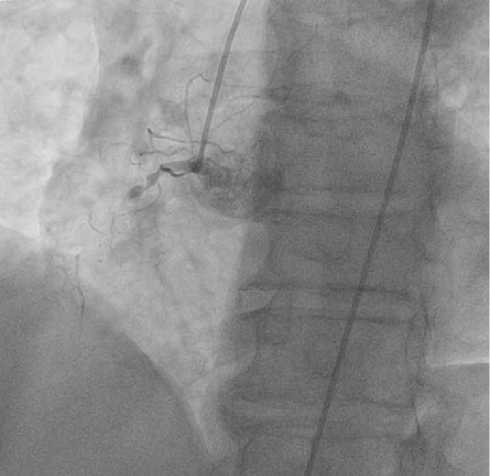
Рис. 2. КАГ правой коронарной артерии
Операция транслюминальной баллонной коронарной ангиопластики (ТБКА), ФРК ПНА от 14.06.2017: в устье ЛКА установлен гид-катетер. За место пограничного поражения ПНА заведен датчик ФРК. Внутриартериально введено 20 мг папаверина, через 10 с после введения папаверина на фоне гиперемии у больного стойкая асистолия. Реанимационные мероприятия. При контрольной КАГ — данных за диссекцию, тромбоз ПНА нет, пассаж контраста в дистальных отделах замедлен. Коллегиально в связи с низким АД решено выполнить
ТБКА ПКА. В устье ПКА установлен гид-катетер. Болюсом внутриартериально введено 7500 ЕД гепарина. Коронарный проводник проведен за место окклюзии до дистальных отделов ПКА. В место окклюзии после 3-кратной предилатации семикомплаентным баллонным катетером (2,0 x 15,0 мм, длительностью до 30 с) установлен стент с лекарственным покрытием (3,5 x 38,0 мм, давление до 12 атм, время дилатации до 30 с). Восстановлен антеградный кровоток TIMI III степени по ПКА (рис. 3); остаточного стеноза, диссекций артерии нет. Время облучения — 12,53 мин, лучевая нагрузка — 1363 мЗв, контрастное вещество — Омнипак (йогексол) 350 — 100,0 мл.
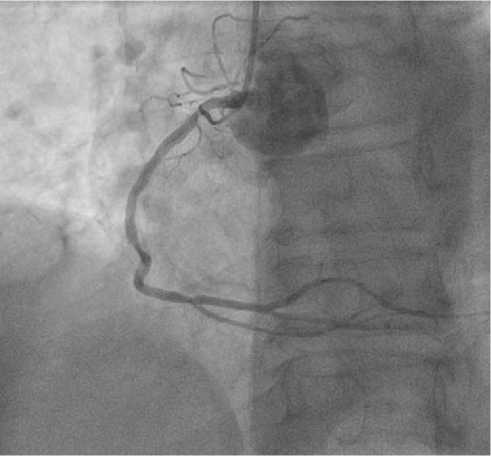
Рис. 3. Восстановление антеградного кровотока по ПКА
14.06.2017 доставлен из отделения рентгенохирургических методов диагностики и лечения № 1 (ОРХМДиЛ № 1) в группу реанимации и интенсивной терапии (ГРи-ИТ) после проведения измерения ФРК в ПНА, осложнившегося асистолией; ТБКА со стентированием ПКА. У пациента сохранялись жалобы на дискомфорт за грудиной, общую слабость, АД 90/40 мм рт. ст. По ЭхоКГ от 14.06.2017: гипокинез миокарда нижне-боковых сегментов левого желудочка, ФВ 54%, асинергия 25% (отрицательная динамика). Принято решение о проведении ревизии состояния коронарного русла. По данным КАГ от 14.06.2017: замедление пассажа контраста в дистальных отделах ПНА и ДВ (феномен «Slow-reflow»). Данных за тромбоз, диссекцию ПКА нет, кровоток антеградный. Тактика ведения консервативная. Лечение в ГРиИТ: состояние тяжелое, динамика отрицательная, на фоне продолжающейся внутривенной инфузии симпатомиметиков АД 40/20 мм рт. ст. Установлен диагноз «кардиогенный шок», проведена установка внутриартериального баллонного контрапульсатора (ВАБК) 1:2, в динамике АД 100–120/60 мм рт. ст., диурез адекватный, по ЭхоКГ наблюдается снижение ФВ до 32%, увеличение асинергии до 45%, без динамики до 19.06.2017; 16.06.2017 — сепа- рация листков перикарда до 13 мм с последующим увеличением 19.06.2017 до 23–26 мм; пароксизмы фибрилляции предсердий 16–17.06.2017; по ЭКГ от 15.06.2017 динамика нижне-бокового инфаркта миокарда без зубца Q; по рентгенограмме органов грудной полости картина застойных изменений в паренхиме легких. На фоне постоянной вазопрессорной и инотропной поддержки проводилась ВАБК 1:2, 1:3. При достижении стабильной гемодинамики 19.06.2017 ВАБК прекращена. Пациент получал антиагрегантную, антикоагулянтную терапию, статины, мочегонные препараты, нестероидные противовоспалительные препараты, вазопрессоры, инотропные препараты, антибактериальную терапию, гепатопротек-торы. 21.06.2017 отмечается положительная динамика по данным ЭхоКГ: ФВ 41%, асинергия 40%, уменьшение количества жидкости в перикарде (сепарация по заднебоковой области 17–18 мм), прекращена вазопрессорная и инотропная поддержка. Для дальнейшего лечения переводится из ГРиИТ в клиническое отделение, в динамике по ЭхоКГ от 28.06.2017 ФВ 52%, асинергия 20%. На фоне проводимой терапии АД стабильно 120/70 мм рт. ст., ЭхоКГ без динамики; выписан из стационара на дальнейшее амбулаторное лечение по месту жительства с диагнозом: «ИБС. Инфаркт миокарда задней стенки левого желудочка без зубца Q от 14.06.2017. Кардиогенный шок от 14.06.2017. ВАБК 14–19.06.2017. Перикардит. ТБКА со стентированием (стент с лекарственным покрытием) ПКА от 14.06.2017. Артериальная гипертония, III стадия, 2-я степень, риск 4. Фибрилляция предсердий, пароксизмальная форма (пароксизмы от 16–17.06.2017). ХСН II А. ФК III (NYHA)». Рекомендован постоянный прием тройной антиагрегантной терапии, ингибиторы ангио-тензинпревращающего фермента, статины, мочегонные препараты, нитраты при ангинозных болях.
Обсуждение
Мы не получили доказательств механического повреждения коронарных артерий (диссекция, тромбоз) во время выполнения КАГ и измерения ФРК в ПНА, что могло бы вызвать развитие инфаркта миокарда по передней стенке левого желудочка.
Как было указано ранее, согласно данным литературы, применение папаверина в качестве агента, вызывающего гиперемию, показало себя эффективным и безопасным, однако количество осложнений, связанных с введением папаверина, составляет 1,2% [13–15]. Факторами риска возникновения осложнений являются: состояние гипокалиемии, прием препаратов, вызывающих удлинение интервала QT (противоаритмические препараты I и III классов), а также интракоронарное введение папаверина при использовании некоторых ионных контрастных веществ (таких как гексабрикс), так как оно может вызывать кристаллизацию контрастного агента [16]. Нами не было отмечено наличия ни одного фактора риска возникновения осложнений на введение папаверина у данного пациента. Исходя из вышесказанного, можно предположить, что основной причиной ятрогенного осложне- ния — развития инфаркта миокарда, осложнившегося кардиогенным шоком, перикардитом, следует считать феномены «No-reflow» и «Slow-reflow», вызванные вну-трикоронарным введением папаверина, что, вероятнее всего, связано с эмболизацией микроциркуляторного русла микрокристаллами контрастного вещества, в данном случае Омнипака (йогексола) 350, образовавшимися в результате смешивания последнего с раствором папаверина. Кроме этого, следует отметить такое грозное осложнение, возникающее при парентеральном введении папаверина, как тромбоз, что могло в сочетании с предыдущим механизмом усугубить ситуацию или самостоятельно вызвать феномены «No-reflow» и «Slow-reflow». Микроэмболизация микроциркуляторного русла — это механизм, который нередко развивается при остром коронарном синдроме самостоятельно (естественная микроэмболизация), но может быть также обусловлен или усугублен врачебным вмешательством с целью реваскуляризации (фармакологической или механической) [18]. Также нельзя исключить наличие у данного пациента идиосинкразии к папаверину, так называемый феномен выделения гистамина — «histamine-releasing» [19]. Многие сравнительно простые молекулы могут служить выделителями гистамина. У некоторых больных применение лекарств типа кодеина, морфина, атропина, папаверина, стрихнина, апрессиолина, амфетамина и некоторых солей желчных кислот может вызвать значительное выделение гистамина, сопровождающееся развитием соответствующей реакции со стороны микроциркуляторного русла [19]. Гистамин инициирует воспаление и способствует выведению продуктов повреждения клеток, что является пусковым механизмом для повреждения миокарда и развития шока.
Повреждение сосудов микроциркуляторного русла, как структурного, так и функционального характера; нарушения микроциркуляции, обусловленные каскадом патологических процессов, сопряженных с ишемией (эндотелиальной дисфункцией в артериолах и капиллярах); отеком перикапиллярных тканей; микроэмболизацией микрокристаллами контрастного вещества и тромботическими массами; воспалительной реакцией в ответ на выброс гистамина (свободнорадикальное повреждение, активация провоспалительных медиаторов, локальная гиперкоагуляция); функциональными нарушениями автономной вегетативной нервной системы сердца (сосудистый спазм, дилатация) вызвали феномены «No-reflow» и «Slow-reflow», что привело к прекращению ретроградного коллатерального кровотока в бассейне ПКА и развитию инфаркта миокарда, осложнившегося кардиогенным шоком.
Кардиогенный шок, развившийся при инфаркте миокарда на фоне выпадения из сократительного процесса до 40–50% массы миокарда левого желудочка, приводит даже в случае своевременного оказания помощи к летальности, которая приближается к 100% [20]. С целью восстановления сократительной функции сердца нами выполнена полная реваскуляризация миокарда (вос- становление антеградного кровотока по ПКА), использовано вспомогательное кровообращение (ВАБК), что позволило справиться с развившейся ситуацией с минимальным количеством осложнений.
Заключение
Инфаркт миокарда, осложнившийся кардиогенным шоком, — очень редкое, но тяжелое ятрогенное осложнение при интервенционных вмешательствах. Острое глобальное снижение сократительной способности миокарда левого желудочка в большинстве случаев приводит к фатальному исходу. В настоящее время отсутствуют четкие рекомендации по ведению такой категории пациентов, однако очевидной является необходимость полной реваскуляризации миокарда. При этом тактика вмешательства зависит от решения оператора и определяется индивидуально в каждом конкретном случае.
Список литературы Случай развития кардиогенного шока после внутриартериального введения папаверина при измерении фракционного резерва кровотока в передней нисходящей артерии
- Erne P., Schoenenberger A.W., Burckhardt D., Zuber M., Kiowski W., Buser P.T., Dubach P., Resink T.J., Pfisterer M. Effects of percutaneous coronary interventions in silent ischaemia after myocardial infarction: the SWISSI II randomized controlled trial. JAMA. 2007;297:1985-1991. DOI: 10.1001/jama.297.18.1985
- Ассоциация сердечно-сосудистых хирургов России. Секция «Кардиология и визуализация в кардиохирургии» 20132017. www.heart-master.com
- De Bruyne B., Pijls N.H.J., Bindu M.D., For the FAME 2 Trial Investigators. N. Engl. J. Med. 2012;367:991-1001. DOI: 10.1056/NEJMoa1205361
- Di Segni E., Higano S.T., Rihal Cs. Holmes Jr. D.R., Lennon R., Lerman A. Incremental doses of intracoronary adenosine for the assessment of coronary velocity reserve for clinical decision making. Catheter Cardiovasc. Interv. 2001;54:34-40. DOI: 10.1002/ccd.1234
- Yamada H., Azuma A., Hirasaki S., Kobara M., Akagi A., Shima T., Miyazaki H., Sugihara H., Kohno Y., Asayama J., Nakagawa M. Intracoronary adenosine 5'-triphosphate as an alternative to papaverine for measuring coronary flow reserve. Am. J. Cardiol. 1994;74:940-951. DOI: 10.1016/0002-9149(94)90591-6
- Sonoda S., Takeuchi M., Nakashima Y., Kuroiwa A. Safety and optimal dose of intracoronary adenosine 5'-triphosphate for the measurement of coronary flow reserve. Am. Heart J. 1998;135:621-627.
- DOI: 10.1016/S0002-8703(98)70277-7
- Jeremias A., Filardo S.D., Whitbourn R.J., Kernoff R.S., Yeung A.C., Fitzgerald P.J., Yock P.G. Effects of intravenous and intracoronary 5'-triphosphate as compared with adenosine on coronary flow and pressure dynamics. Circulation. 2000;101:318-323.
- DOI: 10.1161/01.CIR.101.3.318
- Wilson R.F., White C.W. Intracoronary papaverine: An ideal coronary vasodilator for studies of the coronary Circulation in conscious humans. Circulation. 1986;73:444-451. 10.1161/01. CIR.73.3.444.
- DOI: 10.1161/01.CIR.73.3.444
- Inoue T., Asahi S., Takayanagi K., Morooka S.,·Takabatake Y. QT prolongation and possibility of ventricular arrhythmias after intracoronary papaverine. Cardiology. 1994;84:9-13.
- DOI: 10.1159/000176323
- Vrolix M., Piessens J., De Geest H. Torsades de pointes after intracoronary papaverine. Eur. Heart J. 1991;12:273-276.
- DOI: 10.1093/oxfordjournals.eurheartj.a059880
- Kern M.J., Deligonul U., Serota H., Gudipati C., Buckingham T. Ventricular arrhythmia due to intracoronary papaverine: Analysis of QT intervals and coronary vasodilatory reserve. Catheter Cardiovasc. Diagn. 1990;19:229-236.
- DOI: 10.1002/ccd.1810190402
- Wilson R.F., White C.W. Serious ventricular dysryhthmias after intracoronary papaverine. Am. J. Cardiol. 1988;62:1301-1302.
- DOI: 10.1016/0002-9149(88)90281-0
- Даренский Д.И., Жарова Е.А., Матчин Ю.Г. Инвазивные методы определения функциональной значимости коронарных стенозов пограничной степени выраженности. Кардиологический вестник. 2016;2:80-89.
- Миронов В.М., Меркулов Е.В., Самко А.Н. Оценка фракционного резерва коронарного кровотока. Кардиология. 2012;8:66-71
- Миронов В.М., Меркулов Е.В., Самко А.Н., Карпов Ю.А. Измерение фракционного резерва кровотока для выбора тактики лечения пациентов с многососудистым и многоуровневым поражением коронарного русла. Российский электронный журнал лучевой диагностики. 2014;4(4):3238
- De Bruyne B., Pijls N.H., Barbato E., Bartunek J., Bech J-W., Wijns W., Heyndrickx G. R. Intracoronary and intravenous adenosine 5'-triphosphate, adenosine, papaverine, and contrast medium to assess fractional flow reserve in humans. Circulation. 2003;107:1877-1883. 10.1161/01. CIR.0000061950.24940.88.
- DOI: 10.1161/01.CIR.0000061950.24940.88
- Van der Voort P.H., van Hagen E., Hendrix G., van Gelder B., Bech J.W., Pijls N. Comparison of intravenous adenosine to intracoronary papaverine for calculation of pressure-derived fractional flow reserve. Catheter Cardiovasc. Diagn. 1996;39:120-125. (199610)39:23.0.CO;2-H.
- DOI: 10.1002/(SICI)10970304
- Коваль М. Обзор: Феномен «no-reflow» -ложка дегтя в бочке меда реваскуляризации. Medicine Review. 2008;5(05):32-36
- Идиосинкразия и феномен выделения гистамина. Медицина и здоровье. Новости медицины и здравоохранения. 2015
- Литовский И.А., Гордиенко А.В. Стандарты лечения кардиогенного шока: спорные и нерешенные вопросы. Вестник Российской военно-медицинской академии. 2016;3(55):204211


