Случай успешного хирургического лечения метахронного рака фатерова соска и протоковой карциномы дистальных отделов поджелудочной железы
Автор: Афанасьев С.Г., Азовский Д.И., Ронин Я.С., Волков М.Ю., Августинович А.В., Безгодова Н.В., Черемисина О.В., Ермоленко Р.В., Фролова И.Г.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 4 т.23, 2024 года.
Бесплатный доступ
Актуальность. В настоящее время отмечается устойчивая тенденция к увеличению частоты случаев первично-множественных злокачественных опухолей (ПМЗО) как в виде синхронных, так и метахронных новообразований. Однако метахронные полинеоплазии органов панкреато-билиарной системы достаточно редко встречаются в клинической практике, случаи успешного лечения ПМЗО этой локализации носят эксклюзивный характер. Описание клинического случая. Пациент К. находился под наблюдением в абдоминальном отделении НИИ онкологии Томского НИМЦ с сентября 2014 г., когда ему была диагностирована аденокарцинома Фатерова соска Т2N0M0, стадия Ib и выполнена радикальная операция в объеме гастропанкреато-дуоденальной резекции с формированием панкреатогастроанастомоза. Послеоперационный период протекал без осложнений. При динамическом наблюдении в течение 6,5 лет признаков прогрессирования заболевания не отмечалось. При контрольном обследовании в условиях НИИ онкологии Томского НИМЦ в апреле 2021 г. выявлено объемное образование дистальных отделов культи поджелудочной железы, которое не имело клинически значимой манифестации. Диагноз ПМЗО подтвержден путем трансгастральной биопсии под контролем эндоУЗИ, гистологически и по данным иммуногистохимического исследования: недифференцированная протоковая карцинома поджелудочной железы. С учетом распространенности и локализации метахронной опухоли была выполнена экстирпация культи поджелудочной железы с резекцией задней стенки желудка и спленэктомией. Послеоперационный период протекал без осложнений, проводились заместительная терапия экзокринных нарушений и индивидуальная коррекция углеводного обмена. При дальнейшем наблюдении по месту жительства через 15 мес после операции выявлено метастатическое поражение печени, назначенная паллиативная химиотерапия оказалась неэффективной, пациент скончался через 6 мес от прогрессирования заболевания. Продолжительность жизни после первой операции составила 99 мес, после второй операции - 21 мес.
Метахронные полинеоплазии, рак фатерова соска, рак дистальных отделов поджелудочной железы, хирургическое лечение
Короткий адрес: https://sciup.org/140307086
IDR: 140307086 | УДК: 616.367+616.37]-006.6-089 | DOI: 10.21294/1814-4861-2024-23-4-194-203
Текст научной статьи Случай успешного хирургического лечения метахронного рака фатерова соска и протоковой карциномы дистальных отделов поджелудочной железы
Первично-множественные злокачественные образования (ПМЗО) определяются наличием двух или более гистологически различных злокачественных опухолей, в том числе в одном и том же органе, не связанных с рецидивом, метастазированием или местным распространением. Различают синхронные и метахронные ПМЗО в зависимости от времени диагностики первичного и последующего злокачественного новообразования (ЗНО) – в сроки менее и более 6 мес соответственно. В настоящее время повсеместно отмечается увеличение числа случаев полинеоплазий [1, 2]. В Российской Федерации в 2023 г. впервые выявлено 77 433 ПМЗО, что составило 11,5 % от всех впервые выявленных ЗНО, тогда как в 2022 г. – 68 165 и 10,9 %, в 2019 г. – 59 675 и 9,3 % соответственно. Чаще встречаются метахронные первично-множественные злокачественные новообразования; синхронные полинеплазии в 2023 г. составили 28,7 % от всех случаев ПМЗО (в 2022 г. – 26,5 %, в 2019 г. – 25,6 %) [3, 4].
Данные обстоятельства связаны как с совершенствованием методов диагностики и лечения онкологических больных, что обеспечивает улучшение отдаленных результатов и увеличение продолжительности жизни радикально пролеченных пациентов, так и с изменением условий окружающей среды, старением населения. Среди возможных этиологических факторов ПМЗО выделяют генетические изменения, вирусную инфекцию, а также перенесенные ранее комбинированные методы лечения, включая лучевую терапию и химиотерапию [5, 6].
По данным литературы, частота ПМЗО при злокачественных новообразованиях, поражающих органы билиопанкреатодуоденальной зоны, в основном оценивается для рака поджелудочной железы (РПЖ) и варьирует в широких пределах – от 1,7 до 14,4–20,1 %, что связано как с меньшей встречаемостью новообразований данной локализации, так и с неблагоприятным прогнозом при РПЖ [15, 16]. Первичный рак Фатерова соска является значительно более редкой опухолью, составляя 0,2–2 % среди всех опухолей пищеварительного тракта и примерно 6–20 % среди периампулярных ЗНО. Ежегодно в Российской Федерации выявляется 5–6 первичных случаев рака Фатерова соска на 1 млн жителей [17]. Данных о частоте ПМЗО при раке Фатерова соска нам обнаружить не удалось. В доступной литературе описаны единичные случаи метахронного РПЖ и злокачественных опухолей билиопанкреатодуоде-нальной зоны других локализаций. Сообщалось о нескольких случаях ПМЗО поджелудочной железы с предшествующим опухолевым поражением билиарного тракта, в частности с первичным раком желчного пузыря и общего желчного протока [18–20]. При этом нам встретилось только одно сообщение японских авторов о лечения больной, первично оперированной по поводу рака Фатерова соска в объеме панкреатодуоденальной резекции, с метахронным раком культи поджелудочной железы [21]. В связи с редкостью мы полагаем, что наше наблюдение больного с аналогичной клинической ситуацией представляет большой интерес.
Клинический случай
Больной К., 1949 г.р., обратился в клинику НИИ онкологии Томского НИМЦ в сентябре 2014 г. с жалобами на периодические боли в правом подреберье и эпигастрии, частую диарею, общую утомляемость, на момент обращения признаков желтухи не было. Из анамнеза: 13.08.14 по месту жительства (пациент постоянно проживает в Республике Казахстан) в порядке «скорой помощи» по поводу механической желтухи выполнена паллиативная операция в объеме наложения разгрузочного холецистоэнтероанастомоза с межкишечным анастомозом по Брауну. После купирования явлений механической желтухи для дальнейшего специального лечения пациент обратился в НИИ онкологии Томского НИМЦ.
По данным обследования клинико-лабораторные показатели на момент обращения были в пределах референсных значений. При спиральной компьютерной томографии органов брюшной области с внутривенным контрастированием (9.09.14): в области Фатерова соска определялось объемное образование, до 30 мм в диаметре, полностью перекрывающее просвет холедоха (рис. 1), вирсунгов проток дилатирован, внутрипеченочные желчные протоки не расширены, имеется соустье между дном желчного пузыря и петлей тощей кишки. Заключение: опухоль Фатерова соска, стеноз терминального отдела общего желчного протока, состояние после формирования разгрузочного
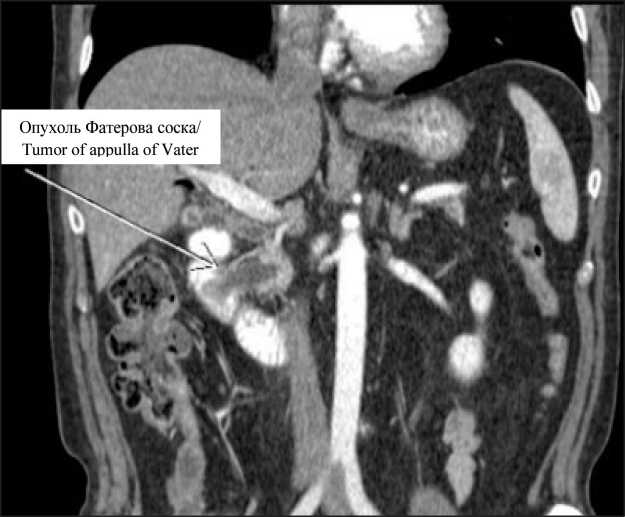
Рис. 1. КТ органов брюшной полости. В проекции Фатерова соска определяется объемное образование диаметром до 30 мм. Образование отмечено стрелкой . Примечание: сномок выполнен атворами
Fig. 1. CT scan of the abdominal organs. In the projection of Vater’s nipple a tumor with a diameter of up to 30 mm is determined. Vater’s nipple tumor is marked on arrow.
По данным гистологического исследования операционного материала (№№: № 21634–670/14,
30.09.14): высокодифференцированная аденокарцинома Фатерова соска с ростом в пределах слизистой оболочки с очаговой инвазией во внутренний мышечный слой, с инвазией в устье общего желчного протока (рис. 2). Вне опухоли стенка кишки обычного строения. Подлежащая ткань поджелудочной железы обычного строения, с неравномерной атрофией долек. Лимфатические узлы – без особенностей. С учетом результатов гистологического исследования окончательный диагноз: Рак Фатерова соска Ib стадии (рT2N0M0). С учетом распространенности процесса рекомендовано динамическое наблюдение.
Больной регулярно проходил контрольные обследования по месту жительства и 1 раз в год в условиях НИИ онкологии, при которых до 2021 г. признаков прогрессирования заболевания не выявлялось. В апреле 2021 г. при очередном контрольном обследовании в НИИ онкологии Томского НИМЦ выявлено объемное образование дистальных отделов культи поджелудочной железы, которое не имело клинически значимой манифестации. При УЗИ органов брюшной полости (6.04.21) с последующей спиральной компьютерной томографией органов брюшной области с внутривенным контрастированием (9.04.21): в проекции хвоста поджелудочной железы определялось объемное образование, размерами 35×26 мм, с нечеткими контурами, без признаков инвазии в смежные анатомические структуры.
Для верификации диагноза и исключения/под-тверждения рецидива заболевания выполнено эндо-УЗИ (14.04.21), при котором в проекции хвоста оставшейся части поджелудочной железы обнаружено гипоэхогенное образование, размера-
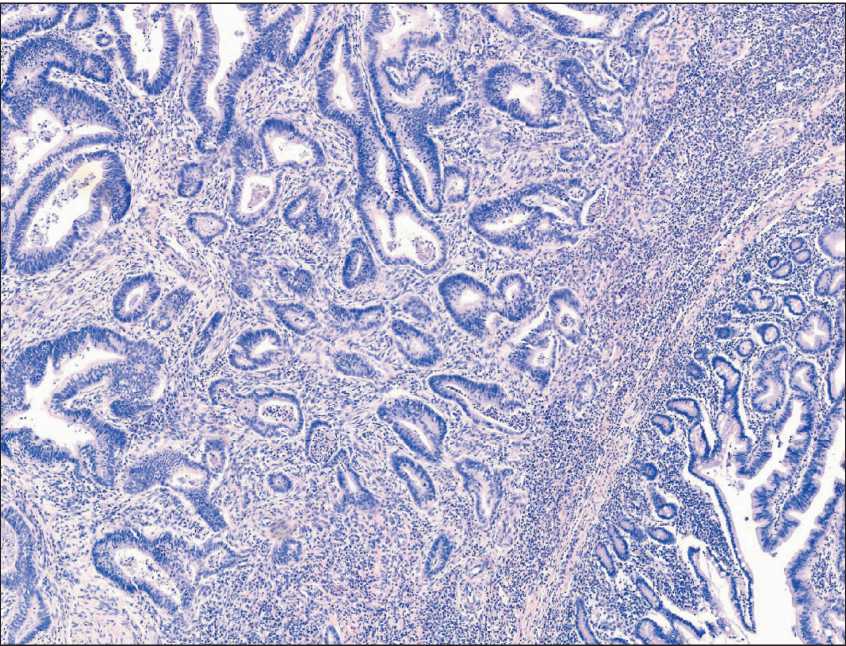
Рис. 2. Микрофото. Рак Фатерова соска. Высокодифференцированная аденокарцинома. Окраска гематоксилином и эозином, ×20.
Примечание: микрофото выполнено авторами Fig. 2. Microphoto. Carcinoma of the appulla of Vater. Well-differentiated adenocarcinoma. Hematoxylin and eosin staining, ×20. Note: created by the authors
ми 35×25 мм, с неровными нечеткими контурами, но не выходящее за пределы паренхимы органа; под контролем эндоУЗИ выполнена трансгастральная тонкоигольная биопсия опухоли. При гистологическом исследовании биопсийного материала (№№ 9141–47/21, 19.04.2021): недифференцированная протоковая карцинома поджелудочной железы. Для уточнения диагноза выполнено иммуногистохимическое исследование (№ 462/21) с использованием иммуностейнера Leica Bond Max на срезах с парафинового блока № 9144/21 и 9147/21: в опухолевых клетках отмечалось яркое диффузное окрашивание с антителом Cytokeratine 19 (клон b170, Leica), отсутствовало окрашивание с антителами CD 56 (клон 123С3, Dako), Chromogranin А (клон 5Р7, Leica), Synaptophysin (клон 27G12, Leica). Заключение: гистологическая картина и иммунофенотип опухоли соответствуют недифференцированной карциноме поджелудочной железы. С учетом полученных данных рецидивный характер данного новообразования был исключен, подтверждено наличие метахронной полинеоплазии в поджелудочной железе.
При дополнительном клинико-инструментальном обследовании признаков отдаленного метастазирования не выявлено. Установлен следующий клинический диагноз: ПМЗО. Метахронная протоковая карцинома дистальных отделов культи поджелудочной железы Ib стадии (сT2N0M0); Рак Фатерова соска Ib стадии (рT2N0M0), пилоросох-раняющая панкреатодуоденальная резекция от 23.09.14. Решением онкологического консилиума рекомендовано хирургическое лечение в объеме экстирпации культи поджелудочной железы.
Гистологическое исследование операционного материала (№ 12167–98/21, 6.05.21): инвазивная протоковая карцинома поджелудочной железы High-grade с инвазией в прилежащую клетчатку (рис. 3), с участками периневрального роста, очагами некроза. Исследованные лимфатические
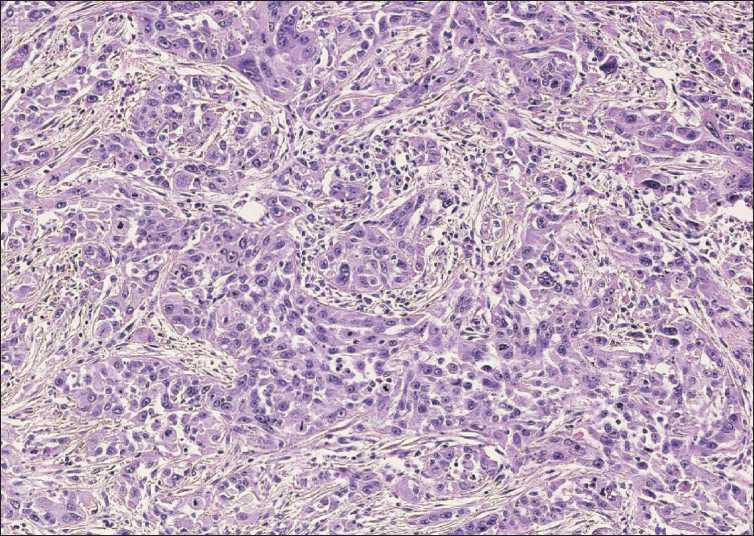
Рис. 3. Микрофото. Метахронный рак дистальных отделов культи поджелудочной железы. Недифференцированный протоковый рак поджелудчной железы. Окраска гематоксилином и эозином, ×20. Примечание: микрофото выполнено авторами Fig. 3. Microphoto. Metachronous cancer of the ductal distal parts of the remnant of the pancreas. Undifferentiated ductal carcinoma of the pancreas. Hematoxylin and eosin staining, ×20. Note: created by the authors
узлы (8 шт.) без метастатического поражения. В ткани поджелудочной железы вне опухоли – выраженный склероз, воспалительная инфильтрация. Окончательный диагноз: ПМЗО. Метахронный рак дистальных отделов культи поджелудочной железы Ib стадии (сT2N0M0); Рак Фатерова соска Ib стадии (рT2N0M0), пилоросохраняющая панкреатодуоденальная резекция от 23.09.14. Пациент выписан в удовлетворительном состоянии на 14-е сут послеоперационного периода. С учетом возраста (71 год на момент второй операции), объема выполненной операции (тотальная панкреатэкто-мия) и распространенности метахронной опухоли (рT2N0M0) решением онкологического консилиума рекомендовано динамическое наблюдение.
При дальнейшем наблюдении по месту жительства через 15 мес после тотальной панкреатэк-томии выявлено метастатическое поражение печени, верифицированное как прогрессирование протоковой карциномы поджелудочной железы. Назначенная и проводимая по месту жительста паллиативная химиотерапия оказалась неэффективной, пациент скончался через 6 мес от прогрессирования заболевания. Продолжительность жизни после первой операции составила 99 мес, после второй операции – 21 мес.
Обсуждение
В настоящее время лечение больных со злокачественными полинеоплазиями является актуальной проблемой клинической онкологии, что, с одной стороны, обусловлено неуклонным ростом уровня заболеваемости ПМЗО, с другой, – трудностями, возникающими на пути реализации радикального лечения. Сейчас случаи ПМЗО не относятся к редкой патологии, поскольку они встречаются более чем у 10 % онкологических больных, чаще всего в виде метахронных процессов [3, 4, 18, 20]. Считается, что вероятность выявления вторых и последующих опухолей у пациентов, получивших радикальное лечение, примерно в 1,3–5 раз выше, чем у лиц, которые ранее не попадали в поле зрения онкологов [15]. Определенные трудности возникают при необходимости оперативного лечения второй опухоли в ранее оперированном органе, поскольку после радикальной резекции любого объема неизбежно возникает функциональная недостаточность, иногда лимитирующая выполнение повторного хирургического вмешательства. Кроме того, при развитии ПМЗО в культе резецированного органа в отдаленные сроки после радикальной операции возникает закономерный вопрос о природе второй опухоли – рецидив или самостоятельное новообразование, – который не всегда удается решить даже с использованием современных патоморфологических методов [22].
Все вышеизложенное более чем актуально для ПМЗО, поражающих органы билиопанкреа-тодуоденальной зоны (БПДЗ). Данное сочетание злокачественных новообразований достаточно редко встречается в клинической практике, в литературе описаны единичные наблюдения, которые в основном представлены мультицентрич-ными опухолями самой поджелудочной железы. Максимальные серии успешного лечения данной категории больных не превышают 12 случаев [22, 23]. Это связано и с относительно редкой встречаемостью ЗНО данной локализации, в Российской Федерации в 2023 г. первичный рак поджелудочной железы, самая распространенная опухоль органов БПДЗ, составил 3 % от всех первичных случаев злокачественных новообразований у мужчин (10-е ранговое место) и 2,8 % – у женщин (13-е ранговое место) [3]. Опухоли других локализаций в БПДЗ встречаются гораздо реже, в связи с этим не все они включаются в национальные статистические отчеты. Кроме того, многие первичные опухоли БПДЗ, прежде всего рак поджелудочной железы, отличаются агрессивным течением и неблагоприятным прогнозом. При нерезектабельном РПЖ средняя продолжительность жизни составляет ~6–7 мес, после радикального хирургического лечения показатели общей 5-летней выживаемости колеблются в пределах от 0 до 30 %, следует отметить, что опухоли поджелудочной железы, поражающие дистальные отделы органа, обладают худшими прогнозом [24]. Напротив, первичный рак Фатерова соска отличается достаточно благоприятным прогнозом, что обусловлено как биологическими особенностями опухоли, так и достаточно ранней клинической манифестацией, вызванной стенозом терминального отдела холедоха, даже при небольшом объеме опухоли [25], что наглядно демонстрирует представленное наблюдение. В итоге, небольшой объем клинических данных пока не позволяет сформулировать клинические рекомендации по лечению больных со злокачественными полинеоплазиями, поражающими органы БПДЗ, решение в каждом конкретном случае приходится принимать индивидуально, исходя из создавшейся клинической ситуации.
Уникальность представленного наблюдения обусловлена сочетанием первичной аденокарциномы Фатерова соска с протоковой карциномой дистальных отделов поджелудочной железы, развившейся через 6,5 лет в культе оперированного органа. В доступной литературе мы встретили только одно подобное наблюдение японских авторов, в котором метахронный РПЖ (гистологически – внутрипротоковая папиллярно-муцинозная аденокарцинома) возник у 72-летней женщины через 3,5 года после пилоросохраняющей панкреатодуоденальной резекции, выполненной по поводу рака Фатерова соска, развившегося на фоне муцинозной аденомы [21]. Так же, как и в нашем клиническом наблюдении, данные морфологического исследования позволили подтвердить ПМЗО, поскольку у обеих опухолей был различный гистотип. Однако Y.
Gotoh et al. (2019) [22] считают, что в ряде случаев бывает трудно определить, является ли второе поражение поджелудочной железы метахронным мультифокальным процессом или представляет собой местный рецидив. Авторы провели мутационный и иммуногистохимический анализ 4 основных генов ( KRAS, TP53, CDKN2A, SMAD4 ) у 12 пациентов, перенесших панкреатэктомию по поводу второй опухоли в культе поджелудочной железы, ранее резецированной по поводу ЗНО. В итоге, у 4 больных, включенных в исследование, мутационный профиль в обоих новообразованиях совпал, что позволило говорить о рецидиве заболевания, у 8 больных – различался, что свидетельствовало о наличии ПМЗО.
Обсуждая возможности радикального лечения ПМЗО с метахронным поражением поджелудочной железы, следует обратить внимание на следующий аспект данной проблемы – панкреатодуоденальная резекция (ПДР) относится к категории наиболее сложных радикальных операций, послеоперационный период при которых сопряжен с высоким риском тяжелых постхирургических осложнений. Современные хирургические технологии и методики периоперационного сопровождения позволили существенно снизить уровень послеоперационных осложнений до 15–30 % и хирургической летальности до 1–5 % [27]. Однако у многих больных, успешно перенесших ПДР, в отдаленные сроки после операции наблюдаются значимые функциональные нарушения, связанные с обширным объемом резекции и обусловленные дефицитом как эндокринной, так и экзокринной функции поджелудочной железы, что усиливает коморбид-ность. Однако при метахронном процессе в культе оперированной поджелудочной железы приходится пренебрегать риском прогрессирования функциональной недостаточности, поскольку в этом случае радикальная операция подразумевает тотальную панкреатэктомию (ТПЭ) с полной утратой экзо- и эндокринной функции органа [28, 29].
До недавнего времени экстирпация культи поджелудочной железы была достаточно редкой операцией, сопровождалась высоким уровнем послеоперационных осложнений и летальности и в основном выполнялась как «операция спасения» по поводу тяжелых осложнений, возникших после ПДР, таких как недостаточность панкреа-тодигестического анастомоза и/или аррозивных панкреатогенных кровотечений, либо по причинам,
Список литературы Случай успешного хирургического лечения метахронного рака фатерова соска и протоковой карциномы дистальных отделов поджелудочной железы
- Skoropad V.Yu., Berdov B.A., Rukhadze G.O. Polineoplazii u bol'nykh rakom zheludka: zakonomernosti razvitiya, rezul'taty lecheniya. Voprosy onkologii. 2012; 58(6): 754-761.
- Sung H., Ferlay J., Siegel R.L., Laversanne M., Soerjomataram I., Jemal A., Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021; 71(3): 209-49. https://doi.org/10.3322/caac.21660.
- Zlokachestvennye novoobrazovaniya v Rossii v 2023 godu (zabolevaemost' i smertnost'). Pod red. A.D. Kaprina, V.V. Starinskogo, A.O. Shakhzadovoi. M., 2024. 276 s.
- Zlokachestvennye novoobrazovaniya v Rossii v 2019 godu (zabolevaemost' i smertnost'). Pod red. A.D. Kaprina, V.V. Starinskogo, A.O. Shakhzadovoi. M., 2020. 252 s.
- Skoropad V.Yu., Berdov B.A., Kozlov I.G. Metakhronnye zlokachestvennye opukholi u bol'nykh, radikal'no operirovannykh po povodu raka zheludka. Sibirskii onkologicheskii zhurnal. 2010; (6): 5-11.
- Amer M.H. Multiple neoplasms, single primaries, and patient survival. Cancer Manag Res. 2014; 5(6): 119-134. https://doi.org/10.2147/CMAR. S57378.
- Ikeda Y., Saku M., Kawanaka H., Nonaka M., Yoshida K. Features of second primary cancer in patients with gastric cancer. Oncology. 2003; 65(13): 13-117.
- Ikeguchi M., Ohfuji S., Oka A., Tsujitani S., Maeda M., Kaibara N. Synchronous and metachronous primary malignancies in organs other than the stomach in patients with early gastric cancer. Hepatogastroenterology. 1995; 42: 672-676.
- Ławniczak M., Gawin A., Jaroszewicz-Heigelmann H., Rogoza-Mateja W., Raszeja-Wyszomirska J., Białek A., Karpińska-Kaczmarczyk K., Starzyńska T. Synchronous and metachronous neoplasms in gastric cancer patients: a 23-year study. World J Gastroenterol. 2014 Jun 21; 20(23): 7480-7. https://doi.org/10.3748/wjg.v20.i23.7480.
- Cheremisina O.V., Men'shikov K.Yu., Afanas'ev S.G., Vusik M.V. Predopukholevye izmeneniya i sinkhronnyi rak zheludka u bol'nykh so zlokachestvennymi novoobrazovaniyami legkikh i LOR-organov. Sibirskii onkologicheskii zhurnal. 2015; (2): 76-80.
- Donin N., Filson C., Drakaki A., Tan H.J., Castillo A., Kwan L., Litwin Mark., Chamie K. Risk of second primary malignancies among cancer survivors in the United States, 1992 through 2008. Cancer. 2016; 122(19): 3075-86. https://doi.org/10.1002/cncr.30164.
- Moores D., Mane P. Pathology of Primary Tracheobronchial Malignancies Other than Adenoid Cystic Carcinomas.Thorac Surg Clin. 2018 May; 28(2): 149-154. https://doi.org/10.1016/j.thorsurg.2018.01.003.
- Nyqvist J., Parris T.Z., Helou K., Sarenmalm E.K., Einbeigi Z., Karlsson P., Nasic S., Kovács A. Previously diagnosed multiple primary malignancies in patients with breast carcinoma in Western Sweden between 2007 and 2018. Breast Cancer Res Treat. 2020; 184(1): 221-228. https://doi.org/10.1007/s10549-020-05822-z.
- Alhamadh M.S., Alanazi R.B., Algarni S.T., Alhuntushi A.A.R., Alshehri M.Q., Chachar Y.S., Alkaiyat M., Sabatin F. A Descriptive Study of the Types and Survival Patterns of Saudi Patients with Multiple Primary Solid Malignancies: A 30-Year Tertiary Care Center Experience. Curr Oncol. 2022; 29(7): 4941-55. https://doi.org/10.3390/curroncol29070393.
- Kit O.I., Kolesnikov E.N., Trifanov V.S., Lapteva T.O., Voloshin M.V., Meshcheryakova M.Yu. Metakhronnyi pervichno-mnozhestvennyi rak golovki podzheludochnoi zhelezy i pecheni: sluchai razvitiya gepatotsellyulyarnoi kartsinomy 10 let spustya posle pankreatoduodenal'noi rezektsii. Eksperimental'naya i klinicheskaya gastroenterologiya. 2021; 195(11): 79-83. https://doi.org/10.31146/1682-8658-ecg-195-11-79-83
- Ikematsu Y., Tamura H., Nakata Y., Hayashi T., Kanai T., Hirayama K., Mori H., Ozawa T., Hasegawa S., Okawada T., Kageyama S., Sugimura H., Nishiwaki Y. Metachronous multiple adenocarcinomas of the pancreas. Int J Clin Oncol. 2011 Dec; 16(6): 726-31. https://doi.org/10.1007/s10147-011-0206-6.
- Patyutko Yu.I., Kotel'nikov A.G., Kudashkin N.E., Polyakov A.N., Moroz E.A., Yastrebova E.V. Rak bol'shogo sosochka dvenadtsatiperstnoi kishki: lechenie i prognoz. Annaly khirurgicheskoi gepatologii. 2016; 21(4): 84-92.
- Kim J.H., Kang C.D., Lee K., Lim K.H. Metachronous squamous cell carcinoma of pancreas and stomach in an elderly female patient: A case report. World J Clin Cases. 2021 Nov 6; 9(31): 9680-9685. https://doi.org/10.12998/wjcc.v9.i31.9680.
- Kato H., Asano Y., Ito M., Arakawa S., Shimura M., Koike D., Kamio K., Kawai T., Urano M., Horiguchi A. A case of metachronous intraductal tubulopapillary carcinoma of the pancreas after surgery for gallbladder cancer-accompanied pancreaticobiliary maljunction. Clin J Gastroenterol. 2022 Oct; 15(5): 1018-1025. https://doi.org/10.1007/s12328-022-01677-7.
- Minami Y., Hasuike Y., Takeda Y., Tsujinaka T. Metachronous double cancer of the gallbladder and pancreas associated with pancreaticobiliary maljunction. J Hepatobiliary Pancreat Surg. 2008; 15(3): 330-3. https://doi.org/10.1007/s00534-007-1208-7.
- Ishida M., Egawa S., Sakata N., Mikami Y., Motoi F., Abe T., Fukuyama S., Sunamura M., Furukawa T., Unno M. Intraductal papillary-mucinous adenocarcinoma in the remnant pancreas after pancreatoduodenectomy for cancer of Vater’s papilla associated with intraductal papillary-mucinous adenoma. J Hepatobiliary Pancreat Surg. 2007; 14(5): 522-5. https://doi.org/10.1007/s00534-006-1199-9. Epub 2007 Sep 28.
- Gotoh Y., Ohtsuka T., Nakamura S., Shindo K., Ohuchida K., Miyasaka Y., Mori Y., Mochidome N., Oda Y., Nakamura M. Genetic assessment of recurrent pancreatic high-risk lesions in the remnant pancreas: Metachronous multifocal lesion or local recurrence? Surgery. 2019 Apr; 165(4): 767-774. https://doi.org/10.1016/j.surg.2018.10.025.
- Eriguchi N., Aoyagi S., Hara M., Okuda K., Tamae T., Fukuda S., Hashino K., Sato S., Fujiki K., Furukawa S., Jimi A. Synchronous or metachronous double cancers of the pancreas and other organs: report on 12 cases. Surg Today. 2000; 30(8): 718-21. https://doi.org/10.1007/s005950070083.
- Gurmikov B.N., Bolokov M.S., Gurmikova N.L. Otdalennye rezul'taty khirurgicheskogo lecheniya raka podzheludochnoi zhelezy. Obzor literatury. Kubanskii nauchnyi meditsinskii vestnik. 2017; 1(2): 142-147. https://doi.org/10.25207/1608-6228-2017-2-142-147
- Yastrebova E.V., Kotel'nikov A.G., Patyutko Yu.I., Polikarpova S.B., Moroz E.A., Bazin I.S., Kudashkin N.E. Rezul'taty lecheniya bol'nykh rakom bol'shogo duodenal'nogo sosochka. Meditsinskii alfavit. 2018; 2(29): 32-37.
- Kaminskii M.N., Kachalov S.N., Ivanov D.V., Rakhimova S.N. Gastrostaz posle pankreatoduodenal'noi rezektsii: voprosy terminologii i profilaktiki. Annaly khirurgicheskoi gepatologii. 2022; 27 (3): 100-107. https://doi.org/10.16931/1995-5464.2022-3-100-107.
- Oleksenko V.V., Zakharov V.A., Aliev K.A., Bondarev A.V., Al'-Nsour Dzh.M. Total'naya pankreatektomiya pri metakhronnom pervichno-mnozhestvennom rake podzheludochnoi zhelezy. Tavricheskii mediko-biologicheskii vestnik. 2022; 25(2): 158-64. https://doi.org/10.37279/2070-8092-2022-25-2-158-164
- Shabunin A.V., Bedin V.V., Tavobilov M.M., Karpov A.A., Lantsynova A.V., Abramov K.A. Total'naya duodenopankreatektomiya s sokhraneniem zheludka, selezenki, zheludochnykh i selezenochnykh sosudov. Khirurgiya. Zhurnal im. N.I. Pirogova. 2023; 5: 5-12. https://doi.org/10.17116/hirurgia20230515.
- Szempruch K.R., Walter K., Ebert N., Bridgens K., Desai C.S. Pharmacological management of patients undergoing total pancreatectomy with auto-islet transplantation. Pancreatology. 2022 Jun; 22(5): 656-664. https://doi.org/10.1016/j.pan.2022.04.009.
- Kubyshkin V.A., Kriger A.G., Vishnevskii V.A., Karmazanovskii G.G., Kochatkov A.V., Lebedeva A.N., Gorin D.S., Berelavichus S.V., Zagagov S.O., Filippova E.M. Pankreatektomiya pri opukholyakh podzheludochnoi zhelezy. Khirurgiya. Zhurnal im. N.I. Pirogova. 2013; 3: 11- 16.
- Ametov A.S., Shabunin A.V., Pashkova E.Yu., Amikishieva K.A., Golodnikov I.I., Tavobilov M.M., Vlasenko A.V., Lukin A.Yu. Vedenie patsienta s sakharnym diabetom v iskhode total'noi pankreatektomii. Klinicheskoe nablyudenie. Terapevticheskii arkhiv. 2022; 94(10): 1177- 1181. https://doi.org/10.2 6442/00403660.2022.10.201882.


