Случай успешного лечения пациента с высокой легочной гипертензией путем имплантации окклюдера в дефект межпредсердной перегородки
Автор: Корж Д.А., Самко А.Н., Горбунов М.Г., Ларионов А.А., Гапонов Д.П., Агафонов Д.В., Тарасов Д.Г.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 4 т.33, 2018 года.
Бесплатный доступ
Цель: продемонстрировать безопасность и эффективность рентген-эндоваскулярного метода лечения при длительно существующих и запущенных таких достаточно распространенных врожденных пороках сердца, как дефект межпредсердной перегородки с высокой легочной гипертензией.Материал и методы. Клинический случай успешного рентген-эндоваскулярного лечения пациентки 48 лет с высокой легочной гипертензией с диагнозом: врожденный порок сердца, дефект межпредсердной перегородки. Клиническое и инструментальное обследование: стандартная электрокардиограмма покоя, эхокардиографическое исследование сердца; зондирование правых отделов сердца и легочной артерии. Хирургическое лечение: рентген-эндоваскулярная имплантация окклюдера ASD (atrium septum defect) 40 мм трансфеморальным доступом. Послеоперационное динамическое наблюдение составило 15 мес.Результаты. Эхокардиографическое исследование сердца (до операции): конечный диастолический объем левого желудочка — 53 мл; врожденный порок сердца: дефект межпредсердной перегородки вторичный центральный 2,5 см, сброс переменный. Систолическое давление в легочной артерии — 120 мм рт. ст. Зондирование правых отделов сердца и легочной артерии: обьемный кровоток с наличием лево-правого сброса, равным Qp/Qs=2,0/1. Рентген-эндоваскулярная окклюзия дефекта межпредсердной перегородки проводилась в условиях рентген-операционной стандартным трансфеморальным доступом. Операция: рентген-эндоваскулярная окклюзия дефекта межпредсердной перегородки с имплантацией окклюдера ASD 40 мм (диаметр перешейка окклюдера). Интраоперационное эхокардиографическое исследование сердца: окклюдер установлен корректно, признаков остаточного сброса крови не выявлено. Контрольное эхокардиографическое исследование сердца через трое суток: состояние после имплантации окклюдера при дефекте межпредсердной перегородки. Дефект закрыт герметично. Систолическое давление в легочной артерии 83 мм рт. ст. Госпитализация: трое суток. Эхокардиографическое исследование сердца через 15 мес.: состояние после имплантации окклюдера при дефекте межпредсердной перегородки. Дефект закрыт герметично. Систолическое давление в легочной артерии — 46 мм рт. ст.Выводы. Сегодня существуют два вида лечения дефекта межпредсердной перегородки: открытая операция — ушивание или пластика с искусственным кровообращением и рентген-эндоваскулярная окклюзия дефекта межпредсердной перегородки путем имплантации специального устройства. Рентген-эндоваскулярное лечение дефекта межпредсердной перегородки путем имплантации окклюзирующего устройства является высокоэффективной и безопасной процедурой. Основные преимущества данной методики состоят в том, что операция выполняется без наркоза, разреза и искусственного кровообращения, и всегда есть возможность реимплантации, репозиционирования устройства.
Врожденный порок сердца, дефект межпредсердной перегородки, имплантация окклюзирующих устройств, легочная гипертензия, эндоваскулярное лечение
Короткий адрес: https://sciup.org/149125248
IDR: 149125248 | DOI: 10.29001/2073-8552-2018-33-4-136-142
Текст научной статьи Случай успешного лечения пациента с высокой легочной гипертензией путем имплантации окклюдера в дефект межпредсердной перегородки
Дефект межпредсердной перегородки (ДМПП) является одним из наиболее частых врожденных пороков сердца (ВПС) [1]. Как отмечают Feldt R. H. и соавт., ДМПП составляет около 7% от всех врожденных аномалий сердца, у женщин встречается чаще, чем у мужчин (2:1). Nakamura F. F. и соавт. считают, что ДМПП встречается чаще — около 10%, из которых 60–70% — вторичные дефекты [2].
У 80–100% больных, у которых порок диагностирован в возрасте до 3 мес., дефект от 3–8 мм спонтанно закрывается к 1–1,5 года жизни [3–5]. При диаметре более 8 мм спонтанное закрытие не происходит [4, 5]. У большинства пациентов в детском возрасте отсутствуют симптомы, у младенцев могут быть признаки сердечной недостаточности, хорошо поддающиеся медикаментозной терапии. На 2–3-й декаде жизни появляются признаки легочной гипертензии и сердечной недостаточности [2]. Выраженная кардиомегалия является типичным признаком «старого» ДМПП. Она сопровождается развитием недостаточности митрального и трехстворчатого клапанов. После 40 лет, особенно у лиц женского пола, в клинической картине порока превалируют явления застойной сердечной недостаточности. Вне зависимости от операции у взрослых могут возникнуть предсердная экстрасистолия, трепетание или мерцание предсердий. Предсердные аритмии возникают у 15% 40-летних и у 60% 60-летних пациентов. Трепетание предсердий и мерцательная аритмия в возрасте до 40 лет встречаются лишь у 1% больных. Предсердным аритмиям способствует растяжение правого (ПП), а затем и левого предсердия (ЛП). В редких случаях наблюдается парадоксальная эмболия системных сосудов, в том числе сосудов головного мозга.
При некорригированном небольшом ДМПП пациенты обычно доживают до зрелого возраста, но продолжительность их жизни снижена. Однако при больших ДМПП с высокой легочной гипертензией четверть пациентов умирают до 27 лет, половина не доживает до своего 36-летия, три четверти — до 50 лет и 90% — до 60 лет. Основной причиной смерти является сердечная недостаточность.
Следует отметить, что при некорригированном ДМПП длительное время удается избежать высокой легочной гипертензии, так как правому желудочку (ПЖ) не требуется развивать высокое давление для изгнания крови в легочную артерию. ПЖ компенсирует длительное время возникающие гемодинамические проблемы, что сопровождается постепенным развитием его гипертрофии и ухудшением растяжимости [6]. Как правило, склеротические изменения в легочных сосудах возникают не ранее 2–3-го десятилетия жизни [7]. По мере снижения общего легочного сопротивления (ОЛС) и развития большого артериовенозного сброса с гиперволемией малого круга кровообращения (МКК) может прогрессировать сердечная недостаточность с одышкой и тахикардией.
До 90-х годов XX века основным методом хирургического лечения ДМПП являлась пластика или ушивание дефекта на открытом сердце с применением искусственного кровообращения. Основным показанием для хирургической коррекции ДМПП является наличие умеренного или значительного лево-правого шунта (при коэффициенте легочно-системного кровотока, равном или большем соотношения 1,5) с целью предотвращения возможности развития легочной гипертензии, застойной сердечной недостаточности и предсердной аритмии [1, 2]. Также встречаются бессимптомные или малосим-птомные пациенты с ДМПП [7].
В настоящее время несмотря на то, что хирургическая коррекция ДМПП на открытом сердце безопасна, она широко применяется и имеет низкую летальность (менее 1%), могут возникать интра- и послеоперационные осложнения как в раннем, так и в отдаленном периодах [8].
С 1976 г. как альтернатива хирургическому методу коррекции ДМПП на открытом сердце разрабатывается технология нового, менее травматичного метода — эндоваскулярного закрытия ДМПП. Первые эндоваскулярные операции выполнили King и Mills (1976).
Целью настоящей публикации является обсуждение случая успешного эндоваскулярного лечения пациентки с высокой легочной гипертензией высокого хирургического риска с длительно существующим большим ДМПП.
Материал и методы
В Федеральном центре сердечно-сосудистой хирургии (ФЦ ССХ) была обследована и пролечена пациентка с высокой легочной гипертензией, возникшей за счет длительно существующего ВПС — ДМПП.
Клиническое и инструментальное обследование включало стандартную электрокардиограмму покоя, эхокардиографическое исследование сердца (ЭхоКГ); зондирование правого отдела сердца (ПОС) и легочной артерии (ЛА).
Хирургическое лечение включало рентген-эндоваску-лярную имплантацию окклюдера ASD 40 мм трансфеморальным доступом. Послеоперационное динамическое наблюдение составило 15 мес.
Клиническое наблюдение и обсуждение. Пациентка И., 48 лет, поступила в ФЦ ССХ с жалобами на одышку, слабость, неритмичный пульс, цианоз губ. Из анамнеза: ВПС с детства, от оперативного лечения воздерживались родители. Самостоятельно родила 3 детей (две девочки и один мальчик, без ВПС). За последние 7 мес. состояние ухудшилось.
Данные эхокардиоскопии (ЭхоКС) при поступлении:
Левый желудочек (ЛЖ): КДОлж — 53 мл; ИКДО — 31,5 мл/м2; КCОлж — 13 мл; ИКCО — 7,7 мл/м2; КДР — 4,2 см; КCР — 2,8 см; ФВsimpson — 70%. ПЖ: Базальный отдел — 5,4 см. Левое предсердие: ЛП — 4,2 см; ЛПдл — 6,5 см; ЛПшир — 4,2 см; Vлп — 65 мл; ИVлп — 38,7 мл/м2. Правое предсердие: ППдл — 5,6 см; ППшир — 5,4 см. ВПС: ДМПП вторичный центральный 2,5 см, сброс переменный, аортальный край 0,9 см, нижний край 1,5 см, верхний край 1,5 см, длина МПП 5,3 см (рис. 1, 2). Дилатация ФК, ствола и ветвей ЛА. Регургитация на клапане ЛА 2-й степени. Дилатация правых камер сердца. Дилатация ЛП. Гипертрофия межжелудочковой перегородки. Глобальная сократительная способность миокарда в норме. Нарушений локальной сократимости ЛЖ не выявлено. Диастолическая функция ЛЖ нарушена по 1-му типу. Регургитация на митральном клапане 1-й степени. Регургитация на трикуспидальном клапане 2-й степени. Систолическое давление в ЛА 120 мм рт. ст. (IV ст.), НПВ 2,5 см. Перикард без особенностей.
В связи с наличием переменного сброса и оценки степени легочной гипертензии пациентке выполнено зондирование полостей сердца для решения вопроса о возможности (операбельности) лечения. Зондирова-
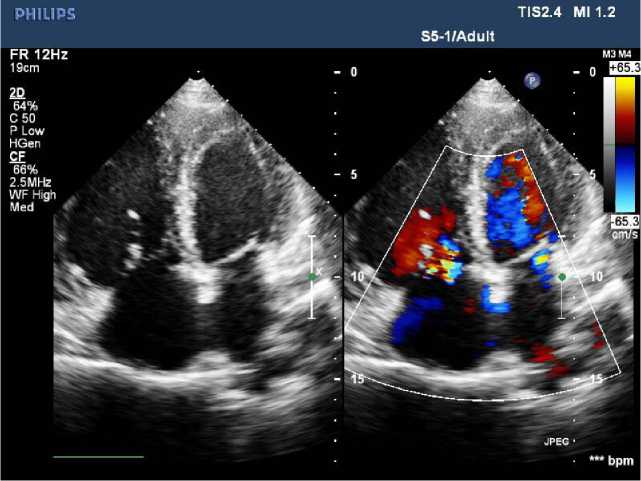
Рис. 1. ЭхоКС до имплантации окклюдера. ДМПП вторичный центральный 2,5 см, сброс переменный, аортальный край 0,9 см, нижний край 1,5 см, верхний край 1,5 см, длина МПП 5,3 см. ПП: ППдл — 5,6 см; ППшир — 5,4 см
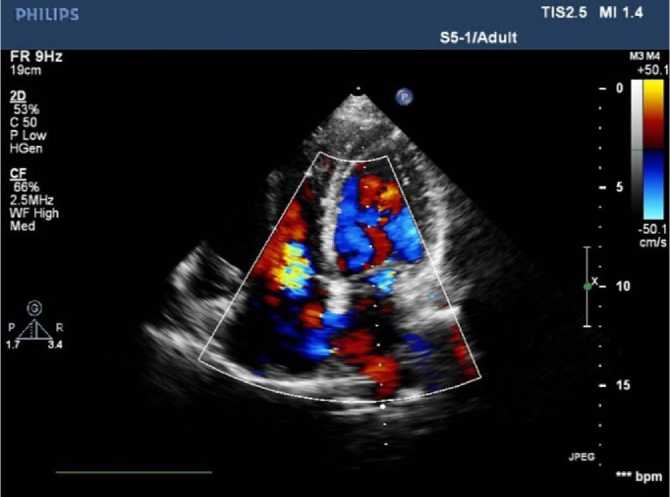
Рис. 2. ЭхоКС, 4-камерная позиция.
ДМПП вторичный центральный 2,5 см ние ПОС и ЛА (манометрия, оксиметрия, ангиопульмо-нография).
Стандартным способом было проведено зондирование ПОС и ЛА со взятием проб крови из следующих отделов: верхняя полая вена, нижняя полая вена, легочная артерия, аорта, легочные вены. Согласно проведенному зондированию, был выявлен объемный кровоток с наличием лево-правого сброса, равного Qp/Qs=2,0/1. Давление в ЛА составило 59% от системного артериального давления (АД) (табл. 1). При этом снижения давления в ЛА при проведении последовательной пробы на подачу 100% кислорода и в/в эуфиллина не определялось (табл. 2). Учитывая, что давление в ЛА составило 59% от системного АД (ниже 70% от системного), тест-окклюзия баллоном ДМПП не проводилась ввиду нецелесообразности.
Таблица 1
Исходные показатели гемодинамики при катетеризации правых отделов сердца (мм рт. ст.)
|
ЛА |
АО |
Sat |
ЧCC |
|
97/35 (57) |
164/99 (125) |
96 |
73 |
|
97/33 (56) |
163/98 (122) |
94 |
70 |
|
98/33 (56) |
157/92 (120) |
95 |
75 |
Примечание: давление в ЛА и АО, Sat — сатурация, ЧСС — частота сердечных сокращений.
Таблица 2
Проба «100% кислород + эуфиллин внутривенно»
|
ЛА |
АО |
Sat |
ЧCC |
|
|
1 мин |
96/33/57 |
161/94/120 |
100 |
93 |
|
2 мин |
97/33/57 |
166/99/125 |
100 |
76 |
|
3 мин |
95/33/55 |
170/105/134 |
100 |
80 |
|
5 мин |
95/33/56 |
159/98/122 |
100 |
82 |
Также существуют разгрузочные девайсы — устройства, которые имеют вид окклюдера, но с наличием центрального отверстия для остаточного сброса крови слева направо. В данном случае также решено было отказаться от имплантации разгрузочного девайса ввиду наличия давления в ЛА ниже 70% от системного АД.
Учитывая данные инвазивного и неинвазивного методов исследования, пациентке решено было выполнить рентген-эндоваскулярное закрытие ДМПП путем имплантации классического 2-дискового окклюдера (РЭО ДМПП) [9].
РЭО ДМПП проводилась в условиях рентген-операци-онной стандартным трансфеморальным доступом.
В ДМПП имплантирован окклюдер ASD 40 мм (диаметр перешейка окклюдера). По данным интраоперационного ЭхоКГ: окклюдер установлен корректно, признаков остаточного сброса крови не выявлено (рис. 3).
Состояние после хирургического лечения было стабильное, переведена в отделение сразу из рентген-опе-рационной. Через трое суток после РЭО ДМПП было выполнено контрольное ЭхоКГ. Состояние после имплантации окклюдера при ДМПП. Дефект закрыт герметично. КДОлж — 45 мл; ФВsimpson — 60%. Дилатация правых камер сердца. Неопределенное движение МЖП. Регургитация на трикуспидальном клапане 1,5-й степени. Систолическое давление в легочной артерии 83 мм рт. ст. Перикард без особенностей. Пациентка была выписана из стационара через трое суток в удовлетворительном состоянии. Спустя 15 мес. пациентке было выполнено плановое контрольное ЭхоКГ (рис. 4, 5). ЛЖ: КДОлж — 76 мл; ИКДО — 45,2 мл/м2; КCОлж — 25 мл; ИКCО — 14,9 мл/м2; КДР — 4,1 см; КCР — 2,7 см; ФВsimpson — 68 %. ПЖ: Базальный отдел — 4,3 см; Средний отдел — 3,4 см. ЛП: ЛП — 4,6 см; ЛПдл — 4,6 см; ЛПшир — 4,4 см. ПП: ППдл — 5,3 см; ППшир — 3,4 см. Состояние после имплантации окклю-дера при ДМПП. Дефект закрыт герметично. Дилатация
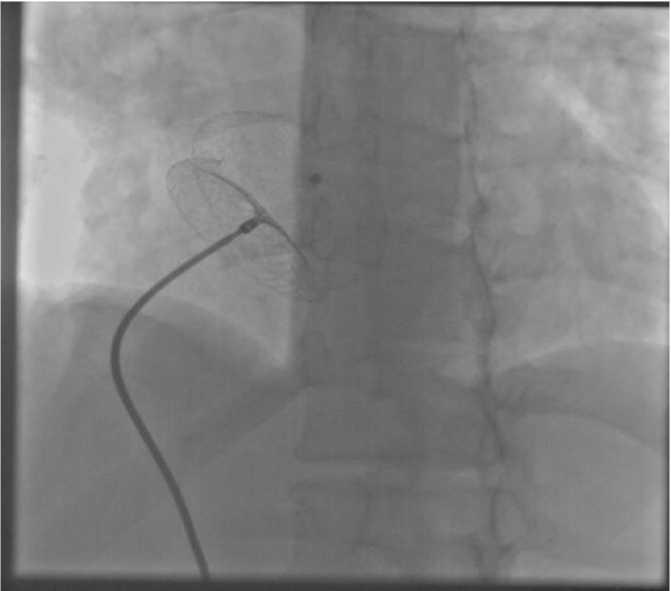
Рис. 3. РЭО ДМПП с имплантацией окклюдера 40 мм.
Окклюдер ASD имплантирован в ДМПП. Доставляющее устройство — 14 Fr.
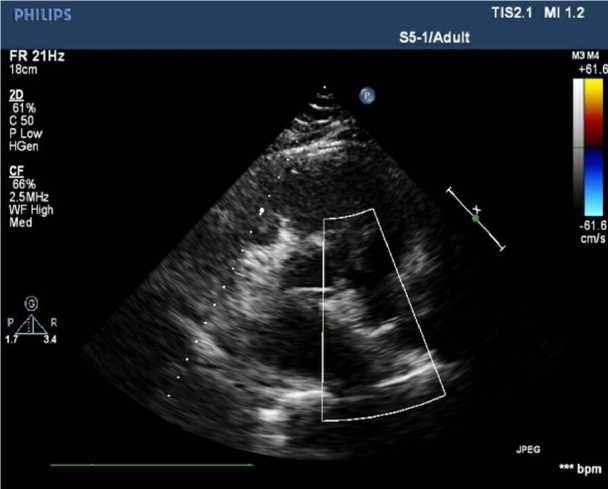
Рис. 4. ЭхоКС после РЭО, ДМПП (короткая ось)
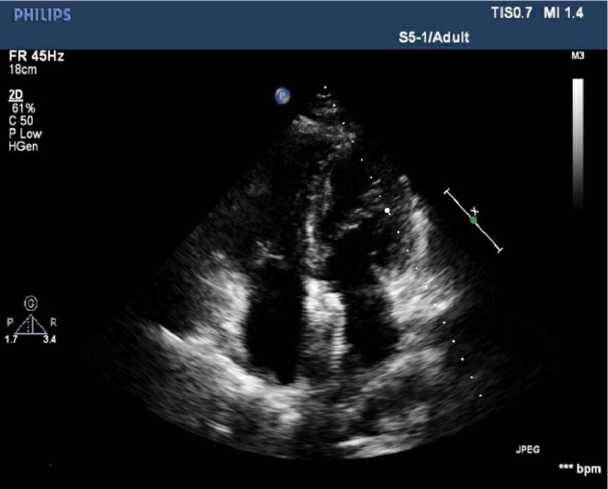
Рис. 5. ЭхоКС (4-камерная позиция)
ПП. Дилатация ФК, ствола и ветвей ЛА. Регургитация на клапане ЛА 1–2-й степени. Глобальная сократительная способность миокарда в норме. Нарушений локальной сократимости ЛЖ не выявлено. Диастолическая функция ЛЖ нарушена по 1-му типу. Аортальный клапан 3-створчатый. Градиент на перешейке нисходящей аорты 4,0 мм рт. ст. Регургитация на митральном клапане 1-й степени. Регургитация на трикуспидальном клапане 1-й степени. Систолическое давление в ЛА 46 мм рт. ст. Перикард без особенностей.
Спустя 15 мес. состояние после имплантации окклю-дера при ДМПП. Дефект закрыт герметично. Систолическое давление в ЛА 46 мм рт. ст. Регургитация на трикуспидальном клапане 1-й степени.
ДМПП является простым ВПС и на сегодня не представляет трудностей для кардиохирурга. В более старшем возрасте в клинической симптоматике начинают преобладать признаки веноартериального сброса, в том числе и у взрослых. Но существуют запущенные ВПС, грозным осложнением которых является высокая легочная гипертензия. Безусловно, ПЖ длительное время в состоянии компенсировать возникшие гемодинамические проблемы, что сопровождается возрастанием его работы и постепенным развитием гипертрофии. Кардиохирургическое вмешательство при ВПС, осложненные высокой легочной гипертензией, часто требует тщательного отбора пациентов и их грамотного послеоперационного ведения. Высокий риск кардиохирургического вмешательства у пациентов с высокой легочной гипертензией часто осложнен также за счет сопутствующей патологии, что делает практически невозможным вариант открытой операции.
Заключение
Легочная гипертензия как осложнение длительно существующего изолированного ДМПП является се- рьезной проблемой, для устранения которой необходимо тщательное обследование и подготовка. Данные ЭхоКС, несмотря на сверхточную аппаратуру и навыки операторов, не могут дать достоверных данных о запущенности ДМПП и его последствиях. В первую очередь необходимо выполнить зондирование ПОС и ЛА с определением объемного кровотока и типа сброса крови. Именно прямая манометрия ПОС и ЛА позволяет точно дать оценку операбельности ДМПП с высокой легочной гипертензией.
Сегодня существуют два вида лечения: открытая операция — ушивание или пластика с искусственным кровообращением и рентген-эндоваскулярная окклюзия ДМПП путем имплантации специального устройства.
При ДМПП с высокой легочной гипертензией, больше 70% от системного давления, также существует метод эндоваскулярной имплантации «разгрузочных» окклюде-ров. Это так называемый окклюдер с отверстием внутри устройства. В дальнейшем центральное отверстие также закрывается другим окклюдером.
При легочной гипертензии ниже 70% от системного давления при подходящей анатомии ДМПП рекомендована имплантация классического двухдискового устройства.
Данный клинический случай показывает хороший результат лечения у пациентов с ДМПП с высокой легочной гипертензией, что доказывают немногочисленные литературные данные [10].
Рентген-эндоваскулярное лечение ДМПП у пациентов с высокой легочной гипертензией путем имплантации окклюзирующего устройства является высокоэффективной и безопасной процедурой [10]. Основные преимущества данной методики состоят в том, что операция выполняется без наркоза, разреза и искусственного кровообращения и всегда есть возможность реимплантации, репозиционирования устройства [11].
Список литературы Случай успешного лечения пациента с высокой легочной гипертензией путем имплантации окклюдера в дефект межпредсердной перегородки
- Бураковский В. И., Бокерия Л. A. Руководство по сердечно-сосудистой хирургии. 2-е изд. М.: Медицина; 1996: 768.
- Nakamura F. F., Hauck A. J., Nadas A. S. Atrial septal defects in infants. Pediatrics. 1964; 34: 101-106.
- Шарыкин А. С. Врожденные пороки сердца. Руководство для педиатров, кардиологов, неонатологов. М.: Изд-во «Теремок»; 2005: 384.
- Wang S. Y., Welch T. D., Elfenbein A., Kaplan A. V. Spontaneous Closure of a Secundum Atrial Septal Defect. Methodist Debakey Cardiovasc. J. 2018 Jan-Mar; 14(1): 60-62. DOI: 10.14797/mdcj-14-1-60
- Ghisla R. P., Hannon D. W., Meyer R. A., Kaplan S. Spontaneous closure of isolated secundum atrial septal defects in infants: an echocardiographic study. Am. Heart J. 1985 Jun; 109(6): 1327-1333.
- Ishii M., Eto G., Tei C., Tsutsumi T., Hashino K., Sugahara Y., Himeno W., Muta H., Furui J., Akagi T., Fukiyama R., Toyoda O., Kato H. Quantitation of the global right ventricular function in children with normal heart and congenital heart disease; a right ventricular myocardial performance index. Pediatr. Cardiol. 2000; 21: 416-421.
- Brochu M.-C., Baril J.-F., Dore A., Juneau M., De Guise P., Mercier L. A. Improvement in exercise capacity in asymptomatic and midly symptomatic adults after atrial septal defect percutaneous closure. Circulation. 2002; 106: 1821-1826.
- Murphy J. G., Gersh B. J., McGoon M. D., Mair D. D., Porter C. J., Ilstrup D. M., McGoon D. C., Puga F. J., Kirklin J. W., Danielson G. K. Long-term outcome after surgical repaire of isolated atrial septal defect. Follow-up at 27 to 32 years. N. Engl. J. Med. 1990; 323: 1645-1650.
- Sideris E. B., Sideris S. E., Thanopoulos B. D., Ehly R. L., Fowlkes J. P. Transvenous atrial septal defect occlusion by the buttoned device. Am. J. Cardiol. 1990; 66(20): 1524-1526.
- Zwijnenburg R. D., Baggen V. J. M., Geenen L. W., Voigt K. R., Roos-Hesselink J. W., van den Bosch A. E. The prevalence of pulmonary arterial hypertension before and atrial septal defect closure at adult age: A systematic review. Am. Heart J. 2018 Jul; 201: 63-71. Epub 2018 Apr 6.
- DOI: 10.1016/j.ahj.2018.03.020
- Sideris E. B., Leung M., Yoon J. H., Chen C. R., Lochan R., Worms A. M., Rey C., Meier B. Occlusion of large atrial septal defects with a centering buttoned device: early clinical experience. Am. Heart J. 1996 Feb; 131(2): 356-359.


