Смена парадигмы при операциях на дуге аорты - «теплая голова - холодное тело»
Автор: Россейкин Е.В., Евдокимов М.Е., Базылев В.В., Батраков Павел Александрович, Кобзев Е.Е., Гебгарт Т.В.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Хирургия дуги аорты
Статья в выпуске: 4 т.20, 2016 года.
Бесплатный доступ
Цель Представить непосредственные результаты применения новой технологии протезирования дуги аорты и ее ветвей. Методы С января 2014 г. по июль 2016 г. 56 пациентам выполнили протезирование дуги аорты по новой технологии. Средний возраст составил от 23 до 73 лет (медиана 57,5). Показанием к протезированию дуги аорты являлись аневризма дуги аорты (32 пациента, 57%), острое (8 пациентов, 14%) и хроническое расслоение (16 пациентов, 29%) аорты 1-го и 2-го типов по Дебейки. Технология протезирования дуги аорты и ее ветвей включала 4 взаимосвязанных компонента: 1) тотальную индивидуальную антеградную перфузию головного мозга в нормотермическом режиме; 2) систему двух независимых контуров аппарата искусственного кровообращения; 3) технику первоначального протезирования ветвей дуги аорты в обратном порядке (Opposite Branch First Technique); 4) Пензенскую технику канюляции аорты (Penza Cannulation). Результаты Госпитальная летальность - 0. У 2 пациентов в ближайшем послеоперационном периоде возник неврологический дефицит, связанный с фибрилляцией предсердий. Время искусственного кровообращения составило 177,5 (92-312) мин, время антеградной перфузии головного мозга - 145 (78-220) мин, интраоперационная кровопотеря - 626,5 (300-3 200) мл. Пациенты экстубированы через 8,9 (3,6-106,8) ч после операции, а в отделении реанимации провели 3 (2-23) дня. Заключение Предложенная технология протезирования дуги аорты и ее ветвей является радикальной, универсальной и индивидуальной, имеет положительные клинические результаты без госпитальной летальности. Только она позволяет использовать технику «открытого дистального анастомоза» одновременно с нормотермической перфузией головного мозга.
Аневризма аорты, расслоение аорты, тотальная реконструкция дуги аорты, селективная антеградная перфузия головного мозга, нормотермическая перфузия
Короткий адрес: https://sciup.org/142140766
IDR: 142140766 | DOI: 10.21688-1681-3472-2016-4-26-33
Текст научной статьи Смена парадигмы при операциях на дуге аорты - «теплая голова - холодное тело»
Стремительное развитие сердечно-сосудистой хирургии и внедрение достижений научно-технического прогресса позволяет излечивать большинство врожденных и приобретенных пороков сердца и сосудов. И тем не менее в лечении некоторых заболеваний даже опытным специалистам хирургических клиник трудно достигнуть оптимальных результатов. К таким заболеваниям, несомненно, относятся аневризмы грудной аорты, в частности ее дуги. В настоящее время растет число оперативных вмешательств по поводу аневризм грудной аорты [1, 2]. Это объясняется как улучшением диагностических возможностей, так и большей осведомленностью и связанной с этим настороженностью врачей многих специальностей. Все больше появляется публикаций по поводу дегенеративных повреждений стенки аорты в связи с наследственными и врожденными заболеваниями. Среди аневризм грудной аорты особое место занимают аневризмы на фоне врожденной патологии дуги и нисходящей аорты.
Врожденная деформация дуги аорты (ВДДА) — это врожденный порок аорты, который характеризуется удлинением, извитостью и перегибами дуги аорты при патологическом строении ее стенки. Описание аневризмы дистального отдела дуги и/или нисходящей грудной аорты на фоне ее многочисленных изгибов, извитости встречается в работах многих иностранных и отечественных авторов [3–8]. Единичные наблюдения не позволяли авторам делать какие-либо заключения относительно закономерностей развития, характерных клинических проявлений и вариантов хирургического лечения врожденной деформации дуги и нисходящей аорты. Единичные публикации говорят о неблагоприятном прогнозе для пациентов без оперативного лечения в отдаленные сроки наблюдения [9].
Статья доступна по лицензии Creative Commons Attribution 4.0.
Располагаясь в дистальном отделе дуги аорты или начальном отделе нисходящей аорты, ВДДА часто вызывает необходимость пережатия ветвей дуги аорты при хирургическом вмешательстве. Это диктует особое отношение к профилактике неврологических осложнений. Высокая толерантность головного мозга к пережатию сонной артерии при ультразвуковой допплерографической пробе не всегда означает интраоперационную безопасность пациента, особенно в молодом возрасте, когда ткани чувствительны к ишемии [7, 8].
Также остается открытым вопрос о тактике хирургического лечения аневризм грудной аорты у пациентов с врожденными аномалиями дуги аорты (ВАДА) — с аномальным отхождением брахиоцефальных артерий или аномальным положением самой дуги. Самым частым вариантом аномалий дуги при аневризмах грудной аорты является аберрантное отхождение подключичных артерий при правой или левой дуге аорты.
Правая дуга аорты (ПДА) — редкая аномалия сердечнососудистой системы, частота которой, по данным разных авторов, составляет 0,05–0,1% в общей популяции [10, 11].
Среди большого количества вариантов правой дуги аорты наиболее частыми являются ПДА с зеркальным положением брахиоцефальных сосудов и ПДА с аберрантной левой подключичной артерией. В зарубежной литературе представлены публикации, посвященные хирургическому лечению сосудистых колец при правой дуге или сочетанию правой дуги аорты с коарктациями [12–14]. Значительно реже в литературе встречаются сообщения, посвященные хирургическому лечению аневризм грудной аорты различной этиологии и локализации при правой дуге аорты. Среди них преобладают описания аневризм аортального дивертикула при правой дуге аорты с аберрантной левой подключичной артерией, который наблюдается у трети пациентов с данной анатомией порока [15, 16]. Меньше публикаций посвящено хирургическому лечению расслаивающих, травматических, ложных послеоперационных аневризм при правой дуге аорты.
Наиболее частой аномалией левой дуги аорты является аберрантное отхождение правой подключичной артерии. По данным ряда крупных аутопсийных исследований, частота аномалии варьирует от 0,2 до 2,5% [17]. Аномалия нередко протекает асимптомно и является второстепенной находкой при аутопсии, но имеет большое клиническое значение при необходимости коррекции аневризм грудной аорты [18, 19].
В 1936 г. Kommerell B.F. описал аортальный дивертикул, представляющий собой рудиментарный остаток правой дуги, от которого отходит аберрантная правая подключичная артерия [20]. Дивертикул Коммерелля встречается у 60% пациентов с аберрантным отхождением правой подключичной артерии. Аневризмы дивертикула наблюдаются у 3–8% пациентов с аберрантной подключичной артерией [21].
Наиболее частым симптомом при аневризмах данной локализации является дисфагия вследствие компрессии пищевода [22]. Наряду с этим в литературе описаны и значительно более редкие случаи: изолированные симптомы компрессии трахеи и главных бронхов или легочной артерии [23].
Следует отметить, что зачастую дивертикул Коммерелля определяют как аневризму проксимального сегмента нисходящей грудной аорты, дистального отдела дуги аорты или же устья аберрантной правой подключичной артерии, а в ряде случаев как комбинацию аневризм артерии lusoria и грудной аорты. Эти вариации наряду с редкостью патологии препятствуют определению показаний и тактики хирургического лечения данного контингента пациентов.
Методы
В основу работы положен анализ 34 клинических наблюдений пациентов с аневризмами грудной аорты на фоне врожденной деформации дуги аорты или в сочетании с аномалиями дуги аорты и брахиоцефальных артерий, оперированных в отделении хирургии артериальной патологии ФГБУ «НЦССХ им. А.Н. Бакулева» Минздрава России
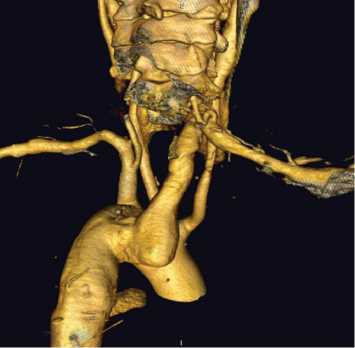
Рис. 1. СКТ-АГ, 3D-реконструкция: аневризма аберрантной правой подключичной артерии (вид сзади)
Fig. 1. MSCT-AG, 3D-reconstruction: aneurysm of aberrant right subclavian artery (rear view)
с 2000 по 2016 г. Аневризмы аорты диагностированы у 22 пациентов с врожденными деформациями дуги аорты и у 12 пациентов с аномальным положением дуги и/или брахиоцефальных артерий. Средний возраст больных составил 20,8±13,2 года, более 70% больных возрастом до 30 лет. Соотношение женщин и мужчин 1 : 1.
Основными инструментальными методами диагностики являлись рентгеноконтрастная ангиография и в последние годы компьютерная ангиография с контрастированием и построением 3D-реконструкций (рис. 1).
Среди пациентов с врожденными деформациями аорты кинкинг и аневризма наиболее часто локализовались дистальнее отхождения левой общей сонной артерии с вовлечением в процесс перешейка аорты с отходящей от нее левой подключичной артерией (50%), локальное поражение аорты между левой общей сонной и подключичной артериями выявлено у 32% пациентов, поражение аорты дистальнее левой подключичной артерии диагностировано у 18% пациентов (рис. 2).
В группе пациентов с врожденными аномалиями дуги аорты аневризмы сочетались с аберрантным отхождением правой подключичной артерии у 58,3% пациентов, у 4 пациентов диагностированы правая дуга аорты и отхождение последним стволом левой подключичной артерии (33,4%), в одном случае аневризма грудной аорты диагностирована при двойной дуге (8,3%). У 6 пациентов аневризмы имели истинный характер с признаками атеросклеротического поражения аорты на фоне врожденной патологии. В трех случаях
B
D
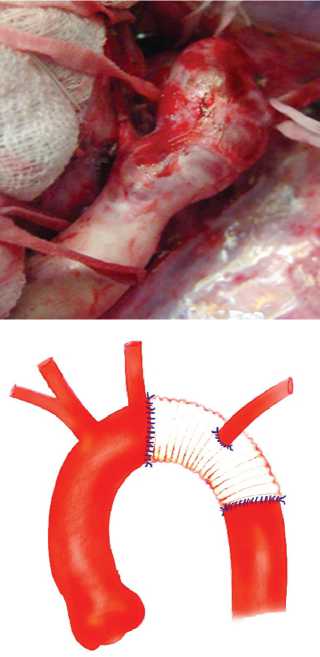
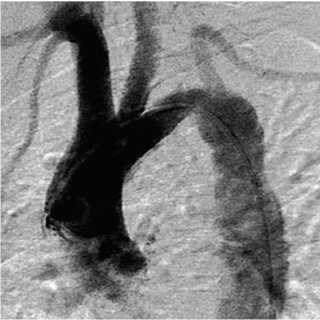
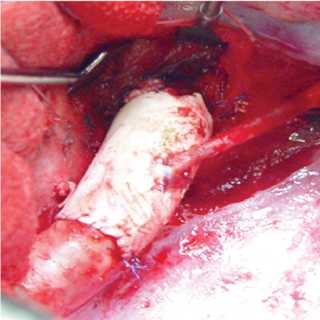
Рис. 2. Реконструкция дистального отдела дуги аорты при врожденной деформации дуги аорты: A — аортограмма; B , C — интраоперационные фотографии этапов операции; D — схема вмешательства
Fig. 2. Reconstruction of a distal part of the aortic arch (congenital deformation of the aortic arch): (A) aortogram; (B, C) intraoperative photos of surgery stages; (D) intervention scheme
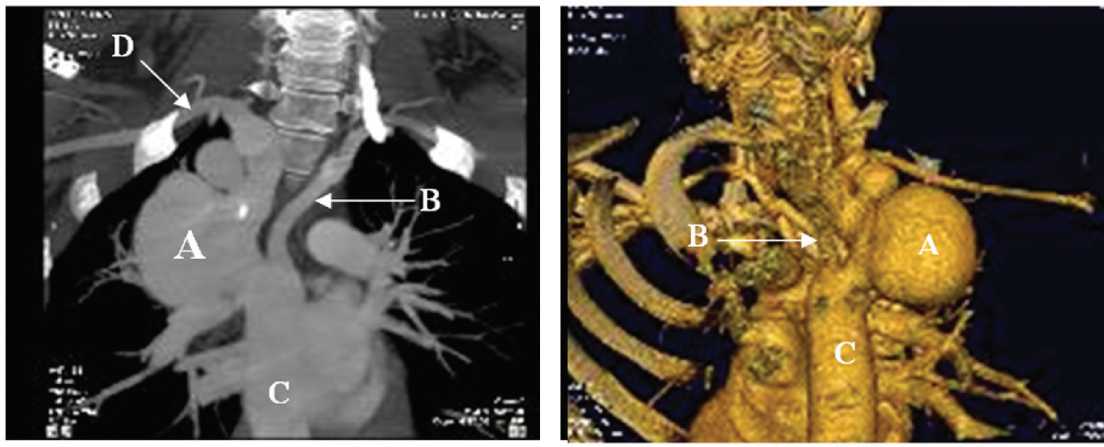
Рис. 3.1. Мультиспиральная компьютерная томография, вид спереди: А — аневризма перешейка аорты; В — аберрантная левая подключичная артерия; C — нисходящая грудная аорта; D — правая подключичная артерия
Fig. 3.1. Multislice computer tomography, front view: (A) aortic isthmus; (B) aberrant left subclavian artery; (C) descending thoracic aorta; (D) right subclavian artery
Рис. 3.2. Мультиспиральная компьютерная томография, 3D-реконструкция, вид сзади: А — аневризма перешейка аорты; В — аберрантная левая подключичная артерия;
С — нисходящая грудная аорта
Fig. 3.2. Multislice computer tomography, rear view: (A) aortic isthmus; (B) aberrant left subclavian artery; (C) descending thoracic aorta выявлены расслаивающие аневризмы аорты. У двух пациентов диагностированы ложные аневризмы, развившиеся после истмопластики зоны коарктации аорты синтетической заплатой. В одном наблюдении отмечена посттравматическая аневризма перешейка грудной аорты.
Ниже приведены результаты диагностики (рис. 3.1, 3.2) и схема операции (рис. 4) пациента с правой дугой и послеоперационной аневризмой в зоне пластики коарктации аорты.
Нарушение пульсации артерий левой верхней конечности (ослабление или отсутствие) среди пациентов с ВДДА
A
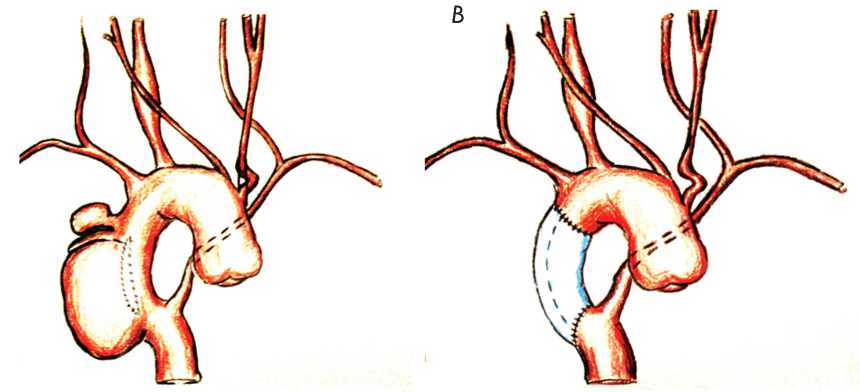
Рис. 4. Схемы патологии ( А ) и операции ( В ) у пациента с правой дугой и послеоперационной аневризмой в зоне пластики коарктации аорты
Fig. 4. Schemes of pathology (A) and surgery (B) in patient with the right arch and postoperative aneurysm located in the plasty zone of aortic coarctation
отмечено у 12 больных: каждый второй пациент имеет нарушение кровотока в бассейне левой подключичной артерии. Нарушение кровотока по правой подключичной артерии не является характерным для врожденной деформации дуги аорты с нормальной анатомией брахиоцефальных артерий, а свидетельствует об аберрантном отхождении правой подключичной артерии.
Из сопутствующих пороков выявлены: коарктация аорты — 5 случаев, ДМЖП — 1 случай, подклапанный стеноз аорты — 1 случай.
Всех пациентов оперировали. С использованием метода вспомогательного искусственного кровообращения прооперировано 54,5% больных с ВДДА (левожелудочковый обход, дистальная аортальная перфузия, при необходимости в сочетании с селективной перфузией левой общей сонной и подключичной артерий). Аорта проксимальнее левой общей сонной артерии пережималась у 27% пациентов с врожденной деформацией дуги аорты.
У 50% пациентов отмечена врожденная деформация дистального отдела дуги аорты с переходом на нисходящую грудную аорту, поэтому в процесс устья вовлекалась левая подключичная артерия, требовавшая реконструкции. Пациентам выполнена резекция начального сегмента подключичной артерии с ее протезированием и реимплантацией протеза подключичной артерии «конец-в-бок» непосредственно в грудную аорту либо протез. У ряда пациентов после резекции измененного участка подключичной артерии удалось без натяжения реимплантировать артерию в бок протеза грудной аорты. Одномоментное протезирование общей сонной и подключичной артерий бифуркационным протезом выполнено у 1 пациента как следствие прорезывания швов в области проксимального анастомоза, потребовавшее перекладывания анастомоза сразу дистальнее брахиоцефального ствола (операция в условиях гипотермии, острого нарушения мозгового кровообращения не отмечено). Одномоментная реконструкция 2 подключичных артерий при а.luzoria, отходившей на границе измененной и нормальной грудной аорты, выполнена в 1 случае в условиях искусственного кровообращения и селективной перфузии обеих артерий (рис. 5).
Учитывая высокий риск пережатия аорты проксимальнее брахиоцефального ствола, возможность прорезывания швов на измененной стенке аорты и высокую вероятность продления разреза аорты на восходящий отдел у больного с врожденной деформацией нисходящей грудной аорты и сопутствующей атрезией дистальной части дуги, начинающейся сразу от левой общей сонной артерии, в 1 случае применялся гипотермический циркуляторный арест. Использовали двунаправленную перфузию восходящей аорты и бедренной артерии с раздельной канюляцией полых вен. Кровообращение остановлено при 18 °C, время ареста 48 мин. Послеоперационный период протекал без осложнений, церебральных и спинальных нарушений не отмечено.
Пациенты с аневризмами грудной аорты на фоне врожденных аномалий дуги и брахиоцефальных артерий в связи с отсутствием у них коарктационного синдрома оперированы
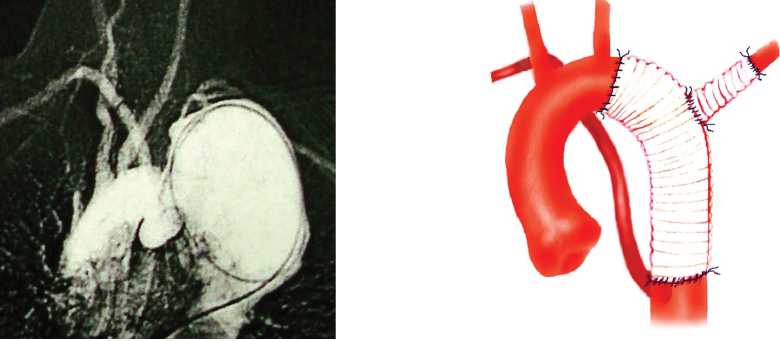
Рис. 5. Данные аортографии и схема вмешательства у пациента с аневризмой дистального отдела дуги аорты на фоне врожденной деформации дуги аорты и а.luzoria
Fig. 5. Aortography data and intervention plan in patient with aneurism of aortic arch distal section against the background of congenital aortic arch and a.luzoria deformation
в условиях искусственного кровообращения в 100% случаев. Тактику хирургического лечения в этой группе мы условно разделили на одноэтапную, когда вмешательство ограничивается интраторакальным этапом, и двухэтапную — с превентивным вмешательством на экстраторакальных отделах брахиоцефальных артерий.
Среди 12 пациентов с аномалиями дуги аорты в 6 случаях выполнены одноэтапные операции. В 6 наблюдениях хирургическая тактика включала первоэтапную имплантацию аберрантной подключичной артерии в общую сонную артерию с последующей реконструкцией грудной аорты через торакотомию. В двух случаях операции выполнены через правостороннюю торакотомию.
Результаты и обсуждение
Редко встречающаяся патология сердечно-сосудистой системы, в частности врожденные пороки развития, вызывает повышенное внимание специалистов в определении тактики лечения, особенностей операционного пособия. Эти аспекты, как правило, индивидуальны и основаны на оценке результатов доступных методов исследования и совокупного опыта медицинского учреждения в лечении сложных видов патологии сердечно-сосудистой системы. У пациентов с ВДДА важно оценить расположение ветвей дуги аорты по отношению к ее кинкингу, необходимость пережатия сонной артерии, вероятность интраоперационных осложнений и перехода на полную гипотермическую остановку кровообращения. Планирование защиты головного мозга должно учитывать фактор артериальной гипертензии на этапе пережатия аорты, необходимость пережатия ветвей дуги, возможность деклампинг-гипотензии.
Гипотермия в хирургии аорты имеет длительную историю и основана на изменении интенсивности обмена веществ в ответ на снижение температуры тела. С каждым градусом потребность и энергии снижается на 6-7%, и поэтому даже умеренная гипотермия достаточно защищает почки и внутренние органы при пережатии аорты. Однако со стороны головного мозга минимальный безопасный временной уровень пережатия ветвей дуги аорты определить не всегда возможно. Гипотермия также снижает вероятность повреждения нейронов, но гарантировать достаточный уровень обмена веществ не может. Вспомогательное искусственное кровообращение позволяет проводить адекватную перфузию ветвей дуги аорты, предупреждая ишемию клеток головного мозга [24].
Из 22 пациентов с аневризмами на фоне врожденной деформации дуги аорты 6 больным потребовалось пережатие аорты между брахиоцефальным стволом и левой об- щей сонной артерией (в каждом третьем случае). Среднее время пережатия левой общей сонной артерии составило 30,53±9,15 мин (от 12 до 70). Острое нарушение мозгового кровообращения отмечено у 2 больных, оперированных без искусственного кровообращения (9%). При этом оба пациента имели отрицательную пробу с пережатием по данным ультразвуковой допплерографии. Интраоперационно особенностей основного этапа операции не было, время пережатия аорты проксимальнее сонной артерии составило 55 и 25 мин, кровопотеря при операциях умеренная (300 и 500 мл).
В 4 случаях применялась селективная перфузия левой общей сонной и подключичной артерий при операциях с вспомогательным искусственным кровообращением. У данной группы пациентов неврологических осложнений не отмечено. Отсутствие временного фактора на этапе наложения анастомозов, несомненно, способствует качеству их выполнения.
Таким образом, вспомогательное искусственное кровообращение позволяет выполнять оперативное лечение этой сложной группы больных с высокой степенью защиты от ишемического повреждения головного мозга. Возможность селективной перфузии левой общей сонной и подключичной артерий позволяет пережимать дугу аорты проксимальнее этих ветвей и накладывать анастомозы в удобных условиях без временного прессинга. Тщательное соблюдение протокола операции как уменьшает вероятность тяжелых неврологических осложнений в раннем послеоперационном периоде, так и позволяет предупредить фатальные осложнения в отдаленные сроки.
При выборе тактики хирургического лечения пациентов с аневризмами аорты на фоне врожденных аномалий дуги аорты и брахиоцефальных артерий перед специалистами встает несколько вопросов: выбор хирургического доступа, методов защиты головного, спинного мозга и внутренних органов от ишемии, что актуально при одномоментном пережатии обеих подключичных артерий, а также необходимость превентивного вмешательства на аберрантных подключичных артериях.
Широко распространен двухэтапный метод хирургического лечения при аневризматически измененной аберрантной правой подключичной артерии — перемещение правой подключичной артерии в правую общую сонную артерию через надключичный доступ справа с последующей резекцией аневризмы через левостороннюю торакотомию. Kieffer E. с соавт. в 1994 г. описали различные методы хирургического лечения 33 пациентов с аберрантными подключичными артериями, в том числе при их сочетании с аневризмами грудной аорты. При необходимости протезирования грудной аорты авторы предлагают этапное хирургическое лечение через два доступа — надключичный (для имплантации подключичной артерии в общую сонную) и заднелатеральную торакотомию. Имплантацию аберрантной подключичной артерии в ипсилатеральную общую сонную артерию авторы считают показанием во всех случаях для предотвращения ишемических осложнений в вертебробазиллярном бассейне или бассейне верхних конечностей. Второй этап операции на грудной аорте авторы проводят в условиях сердечно-легочного обхода [25].
Kamiya H. с соавт., приводя опыт лечения 8 пациентов с компрессией трахеи и пищевода аневризматически измененной аберрантной правой подключичной артерии, демонстрируют три варианта хирургического вмешательства. Четыре пациента подверглись двухэтапному хирургическому вмешательству: первым этапом через надключичный доступ справа выполнена реваскуляризация правой подключичной артерии, после чего вторым этапом через левосторонний то-ракотомный доступ произведена резекция аневризмы подключичной артерии. Двум пациентам не проводили реваскуляризацию правой подключичной артерии (в этой группе впоследствии наблюдался синдром позвоночно-подключичного обкрадывания). Пациентам третьей группы выполняли реваскуляризацию подключичной артерии с оставлением аневризмы в виде слепого мешка [26].
Ряд авторов предполагают, что реваскуляризацию правой подключичной артерии посредством имплантации ее в правую общую сонную артерию следует проводить вторым этапом после резекции аневризмы аберрантной правой подключичной артерии через левостороннюю торакотомию только в случаях клинически выраженной ишемии правой верхней конечности после первого этапа хирургического лечения.
В некоторых работах представлен дифференцированный подход к вопросу транслокации подключичной артерии при резекции аневризмы аберрантной подключичной артерии и аневризмы нисходящей грудной аорты. Превентивное сонно-подключичное шунтирование показано только пациентам, у которых невозможна адекватная резекция аневризмы подключичной артерии через торакотомный доступ. В остальных случаях авторы выполняют резекцию аневризмы аберрантной артерии с протезированием от нисходящей грудной аорты или непосредственно имплантацию подключичной артерии (при ее интактности) в протез грудной аорты через левостороннюю торакотомию [27].
Известны единичные случаи одноэтапного хирургического лечения при аневризме аберрантной подключичной артерии с использованием сердечно-легочного обхода и циркуляторного ареста доступом через срединную стернотомию с расширением ее в надключичную область. В этих наблюдениях выполняли трансаортальную пластику устья аневризматически измененной подключичной артерии синтетической заплатой с последующей имплантацией ее в восходящую аорту или правую общую сонную артерию, а при необходимости — протезированием правой подключичной артерии от восходящей аорты. К преимуществам такой хирургической тактики относят полную визуализацию аневризмы, отсутствие необходимости трудного, а в ряде случаев опасного (при кальцинозе аорты и собственно аневризмы) пережатия аорты и, как следствие, меньшую вероятность травматизации левого возвратного гортанного нерва, который проходит в области устья аберрантной подключичной артерии [28–30].
Помимо вышеперечисленных методик в литературе описаны случаи успешной трансаортальной пластики заплатой устья аберрантной правой подключичной артерии без вмешательства на дивертикуле или аберрантной правой подключичной артерии. Однако такой подход можно считать целесообразным в случае отсутствия симптомов компрессии трахеи или пищевода и нерасширенного дивертикула.
В представленной серии наблюдений показаниями к одномоментному хирургическому лечению (50% случаев) считали отсутствие сдавления трахеи и пищевода ретроэзофаге-альным компонентом, распространение расширения грудной аорты на аберрантные подключичные артерии или отхождение обеих подключичных артерий от интактной зоны грудной аорты, когда радикальное выполнение операции осуществимо из одноплеврального торакотомного доступа. Подобная техника хирургического вмешательства в ряде случаев может быть сопряжена с одновременным пережатием обеих подключичных артерий, поэтому условием выполнения данных операций у 2 пациентов являлась селективная перфузия головного мозга через подключичные артерии.
При аневризмах аберрантных подключичных артерий, необходимости контроля анатомических структур в обеих половинах грудной клетки, сдавлении пищевода и трахеи ретроэзофагеальным компонентом мы применяли двухэтапный подход (50% случаев), включающий первоэтапную имплантацию аберрантной подключичной артерии в общую сонную артерию своей стороны с последующим основным интраторакальным этапом. Превентивное переключение аберрантной подключичной артерии позволяет работать в условиях «сухого» операционного поля на основном этапе операции — без ретроградного кровотока из полости аневризмы, радикально устранить ретроэзофагеальный компонент, а также является методом профилактики ишемических осложнений со стороны спинного и головного мозга без громоздких перфузионных методов защиты. Кроме того, подобная методика позволяет уменьшить объем реконструкции во время основного этапа операции, является профилак- тикой ишемии верхних конечностей и синдрома позвоночно-подключичного обкрадывания головного мозга.
Таким образом, аномалии дуги аорты и брахиоцефальных артерий меняют течение заболевания и лечение пациентов с аневризмами грудной аорты. Чаще чем при аневризмах грудной аорты с нормальной анатомией магистральных сосудов встречаются симптомы компрессии трахеи и пищевода — одышка, стридор, дисфагия, что связано с ретроэзофагеальным прохождением аберрантной подключичной артерии. Следовательно, в ряде случаев во время операции устраняют ретроэ-зофагеальный сосудистый компонент. Аномальное положение дуги аорты влияет на выбор хирургического доступа к аорте, в частности на выбор стороны торакотомии. Одновременное пережатие обеих подключичных артерий увеличивает риск спинальных осложнений, а следовательно, диктует необходимость применять специальные методы защиты головного и спинного мозга от ишемии или проводить этапные операции.
Превентивная транслокация подключичной артерии в ипсилатеральную общую сонную артерию помимо профилактики вертебробазилярной недостаточности создает предпосылки для адекватной санации аневризматического мешка и удаления тромботической чаши в условиях «сухого» операционного поля при отсутствии ретроградного кровотока из подключичной артерии. Такой подход также исключает одновременное прекращение кровотока по обеим подключичным артериям. Этапная методика в случаях аневризм грудной аорты, распространяющихся на дивертикул Коммерелля и артерию lusoria, в 100% случаев ликвидирует симптомы компрессии трахеи и пищевода за счет полного устранения рет-роэзофагеального сосудистого компонента.
Заключение
Выбор хирургического подхода при аневризмах, ассоциированных с врожденными аномалиями или деформациями дуги аорты, зависит от совокупности факторов: индивидуальных анатомических особенностей патологии; распространения аневризматического процесса на дугу аорты, аберрантную подключичную артерию или нисходящую грудную аорту; экстренности операции и опыта хирурга.
Представленный опыт свидетельствует о том, что при оптимальной стратегии хирургического лечения, основанной на точной дооперационной диагностике и анализе индивидуальных особенностей анатомии порока и факторов риска, хирургическая коррекция может быть эффективной и безопасной даже при редких и сложных патологических состояниях.
Финансирование
Исследование не имело спонсорской поддержки.
Список литературы Смена парадигмы при операциях на дуге аорты - «теплая голова - холодное тело»
- Cooley D., DeBakey M., Morris G. Jr. Controlled extracorporeal circulation in surgical treatment of aortic aneurysm//Annals of Surgery. 1957. Vol. 146. No. 3. P. 473-485.
- Harrington D., Fragomeni F., Bonser R. Cerebral perfusion//Ann. Thorac. Surg. 2007. Vol. 83. No. 2. P. S799-804. http://dx.doi. org/10.1016/j.athoracsur.2006.11.018
- De Paulis R., Czerny M., Weltert L., Bavaria J., Borger M.A., Carrel T.P., Etz C.D., Grimm M., Loubani M., Pacini D., Resch T., Urbanski P.P., Weigang E., EACTS Vascular Domain Group. Current trends in cannulation and neuroprotection during surgery of the aortic arch in Europe//Eur. J. Cardiothorac. Surg. 2015. Vol. 47. No. 5. P. 917-923. http://dx.doi.o DOI: rg/10.1093/ejcts/ezu284
- Urbanski P., Luehr M., Di Bartolomeo R., Diegeler A., De Paulis R., Esposito G., Bonser R.S., Etz C.D., Kallenbach K., Rylski B., Shrestha M.L., Tsagakis K., Zacher M., Zierer A. Multicentre analysis of current strategies and outcomes in open aortic arch surgery: heterogeneity is still an issue//Eur. J. Cardiothorac. Surg. 2016. Vol. 50. No. 2. P. 249-255. http://dx.doi.oezw055 DOI: rg/10.1093/ejcts/
- Чернявский А.М., Альсов С.А., Ляшенко М.М., Сирота Д.А., Хван Д.С., Виноградова Т.Е., Ломиворотов В.В., Захаров С.Л. Анализ неврологических осложнений после хирургической реконструкции дуги аорты у пациентов с проксимальным расслоением//Патология кровообращения и кардиохирургия. 2013. Т. 17. № 2. С. 35-40.
- Аксельрод Б.А., Гуськов Д.А., Чарчян Э.Р., Федулова С.В., Ойстрах А.С., Еременко А.А., Локшин Л.С., Хачатрян З.Р., Медведева Л.А., Трекова Н.А. Анестезиологическое обеспечение реконструктивных операций на дуге аорты: нюансы органопротекции//Анестезиология и реаниматология. 2015. Т. 60. № 5. С. 26-31.
- Griepp R., Stinson E., Hollingsworth J., Buehler D. Prosthetic replacement of the aortic arch//J. Thorac. Cardiovasc. Surg. 1975. Vol. 70. No. 6. P. 1051-1063.
- Griepp R., Ergin M., McCullough J., Nguyen K.H., Juvonen T., Chang N., Griepp E.B. Use of hypothermic circulatory arrest for cerebral protection during aortic surgery//J. Cardiovasc. Surg. 1997. Vol. 12. Suppl. 2. P. 312-321.
- Di Eusanio M., Schepens M., Morshuis W., Dossche K.M., Di Bartolomeo R., Pacini D., Pierangeli A., Kazui T., Ohkura K., Washiyama N. Brain protection using antegrade selective cerebral perfusion: a multicenter study//Ann. Thorac. Surg. 2003. Vol. 76. No. 4. P. 1181-1188.
- Kamiya H., Hagl C., Kropivnitskaya I., Böthig D., Kallenbach K., Khaladj N., Martens A., Haverich A., Karck M. The safety of moderate hypothermic lower body circulatory arrest with selective cerebral perfusion: a propensity score analysis//J. Thorac. Cardiovasc. Surg. 2007. Vol. 133. No. 2. P. 501-509. http://dx.doi. org/10.1016/j.jtcvs.2006.09.045
- Pacini D., Leone A., Di Marco L., Marsilli D., Sobaih F., Turci S., Masieri V., Di Bartolomeo R. Antegrade selective cerebral perfusion in thoracic aorta surgery: safety of moderate hypothermia//Eur. J. Cardiothorac. Surg. 2007. Vol. 31. No. 4. P. 618-622. http://dx.doi. org/10.1016/j.ejcts.2006.12.032
- Bechtel J.F.M., Eleftheriadis S., Sievers H.-H. Surgical strategies for neuroprotection during ascending aortic and arch surgery//Applied Cardiopulmonary Pathophysiology. 2009. Vol. 13. P. 219223.
- Россейкин Е.В., Евдокимов М.Е., Базылев В.В, Вачев С.А. Способ определения объемной скорости регионарного кровотока для проведения селективной антеградной перфузии//Бюллетень «Изобретения. Полезные модели». 2016. № 24. Патент RU 2596059 C2.
- Takano H., Sakakibara T., Matsuwaka R., Hori T., Sakagoshi N, Shinohara N. The safety and usefulness of cool head-warm body perfusion in aortic surgery//European Journal of Cardio-thoracic Surgery. 2000. Vol. 18. No. 3. P. 262-269.
- Fernandes P., Mayer R., Adams C., Chu M.W.A. Simultaneous individually controlled upper and lower body perfusion for valve-sparing root and total aortic arch replacement: a case study//JECT. 2011. Vol. 43. No. 4. P. 245-251.
- Croughwell N.D., Frasco P., Blumenthal J.A., Leone B.J., White W.D., Reves J.G. Warming during cardiopulmonary bypass is associated with jugular bulb desaturation//Ann. Thorac. Surg. 1992. Vol. 53. No. 5. P. 827-832.
- Murkin J.M., Adams S.J., Novick R.J., Quantz M., Bainbridge D., Iglesias I., Cleland A., Schaefer B., Irwin B., Fox S. Monitoring brain oxygen saturation during coronary bypass surgery: a randomized, prospective study//Anesthesia & Analgesia. 2007. Vol. 104. No. 1. P. 51-58. http://dx.doi.o DOI: rg/10.1213/01.ane.0000246814.29362.f4
- Touati G., Roux N., Carmi D., Degandt A., Benamar A., Marticho P., Nzomvuama A., Poulain H.J. Totally normothermic aortic arch replacement without circulatory arrest//Ann. Thorac. Surg. 2003. Vol. 76. No. 6. P. 2115-2117. http://dx.doi.o DOI: rg/10.1016/S0003-4975(03)00739-2


