Смена среды культивирования положительно влияет на развитие и качество эмбрионов крупного рогатого скота in vitro
Автор: Сингина Г.Н.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Вспомогательные репродуктивные технологии, эмбриогенез
Статья в выпуске: 6 т.57, 2022 года.
Бесплатный доступ
Несмотря на то, что число эмбрионов крупного рогатого скота (КРС), получаемых in vitro (in vitro embryo production, IVP), в мире ежегодно возрастает, их качество все еще уступает качеству эмбрионов, получаемых in vivo, а условия, в которых происходит развитие IVP эмбрионов, до сих пор требуют детализации. В связи с этим в представленной работе была изучена зависимость развития IVP эмбрионов и их качества от условий обновления среды in vitro культивирования (in vitro culture, IVC) и ее объема. Post mortem ооциты коров культивировали в среде созревания, оплодотворяли in vitro заморожено-оттаянной спермой и переносили в среду BO-IVC («IVF Bioscience», Великобритания) объемом 500 или 100 мкл для эмбрионального развития. Сравнивали три варианта инкубации: без смены среды (БСС), с полной сменой среды (ПСС) и с частичной сменой среды (ЧСС). В первом случае эмбрионы развивались в течение всего периода (8 сут) без обновления среды культивирования, во втором - через 3 сут IVC эмбрионы были перенесены для дальнейшего развития в капли свежей среды, в варианте ЧСС через 3 сут инкубации половина изначального объема среды удалялась и заменялась эквивалентным объемом свежей среды. Во всех вариантах на 8-е сут культивирования оценивали число эмбрионов, развившихся до стадии бластоцисты (Бл), и их качество (на основе определения общего числа ядер и ядер с признаками апоптоза в Бл при цитологическом анализе). Также исследовали развитие 8-суточных бластоцист через 2 сут дополнительного культивирования до стадии вылупившейся Бл (ВБл). Результаты показали, что по сравнению с непрерывным культивированием ПСС обеспечивала значительное повышение частоты образования бластоцист (с 23,0±1,5 и 25,8±0,8 до 45,7±4,8 и 52,1±4,9 %, p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
In vitro эмбриональное развитие, среда культивирования, ivp, ivс, крупный рогатый скот
Короткий адрес: https://sciup.org/142237384
IDR: 142237384 | УДК: 636.2:591.39 | DOI: 10.15389/agrobiology.2022.6.1197rus
Текст научной статьи Смена среды культивирования положительно влияет на развитие и качество эмбрионов крупного рогатого скота in vitro
Развитие и практическое применение вспомогательных репродуктивных технологий по получению эмбрионов in vitro (in vitro embryo production, IVP) и их трансплантации животным-реципиентам позволяет увеличить темпы генетического прогресса в селекции коммерческих пород и повысить эффективность программ сохранения малочисленных и гено-фондных пород (1). In vitro эмбрионы, пригодные для трансплантации, развиваются из ооцитов, созревших и оплодотворенных в искусственных условиях. Получить ооциты можно как прижизненно (чаще всего методом трасвагинальной пункции фолликулов) (2), так и post mortem (3). В обоих
∗ Работа по получению IVP эмбрионов выполнена при финансовой поддержке Минобрнауки России (тема 0445-2021-0004), работы по анализу их качества — при финансовой поддержке Российского научного фонда (проект ¹ 19-16-00115-П).
случаях целью является получение большего числа потомков от лучших и уникальных матерей.
Использование эмбрионов in vitro с каждым годом становится все более распространенной мировой практикой, однако по качеству IVP эмбрионы пока что уступают эмбрионам in vivo (1, 4). IVP эмбрионы менее устойчивы к замораживанию (4), и их жизнеспособность после трансплантации реципиентам ниже, чем у полученных in vivo (3, 5).
Важный этап IVP технологии, от которого зависит полноценность эмбрионов, — культивирование ооцитов после оплодотворения до доим-плантационных стадий развития. У крупного рогатого скота (КРС) продолжительность культивирования оплодотворенных ооцитов составляет примерно 7 сут, после чего те, которые достигли стадии бластоцисты (Бл), либо подвергают замораживанию, либо пересаживают животным-реципиентам. От условий, в которых происходит эмбриональное развитие, критически зависят как количественные (доля эмбрионов на стадии Бл), так и качественные (полноценность Бл) показатели эффективности IVP метода (3).
Для развития эмбрионов in vitro у КРС чаше всего используются самостоятельно приготовленные в условиях лаборатории простые по составу питательные среды (6). К ним в первую очередь следует отнести среду SOF (7), которая представляет собой синтетический аналог жидкости яйцевода, а также среду CR1aa (8). При этом к обоим растворам с целью улучшения эмбрионального развития, наряду с бычьим сывороточным альбумином (БСА), на завершающем этапе культивирования рекомендуется добавлять фетальную бычью сыворотку (ФБС), так как присутствие последней способствует преодолению эмбрионами блока на стадии морулы, а также увеличивает выход Бл и повышает их качество (9, 10).
С ростом наблюдаемой в последнее десятилетие коммерциализации IVP технологии возникла необходимость в разработке готовых коммерческих сред для культивирования эмбрионов in vitro (IVC среда, in vitro culture). Особенность этих сред заключается в том, что они обеспечивают высокий выход качественных эмбрионов доимплантационных стадий развития в отсутствие ФБС, которая может быть источником патогенов и осложнять возможность обмена эмбриональным материалом. Кроме того, применение таких сред упрощает процедуру получения эмбрионов и позволяет стандартизировать условия их культивирования (1, 6).
В литературе имеется множество свидетельств того, что среды, в которых культивируются эмбрионы, в конечном счете определяют их потенциал к развитию и качество (11-13). Однако режимы инкубации, при которых происходит культивирование, в частности условия обновления среды, могут корректировать этот эффект. Замена IVC среды считается обычной практикой во время процедуры IVC и положительно влияет на развитие эмбрионов, так как позволяет обеспечивать их необходимыми питательными веществами и удалять токсичные метаболиты, например, аммиак и свободные радикалы кислорода, накопленные в культуральной среде (1416). В то же время в период культивирования in vitro эмбрионы секретируют в среду паракринные факторы, такие как эпидермальный фактор роста, фактор активации тромбоцитов, инсулиноподобный фактор роста, а также матричные РНК и микроРНК, которые играют важную роль в регуляции эмбрионального развития (17-19). Эти молекулы, как показывают результаты последних исследований, упакованы во внеклеточные везикулы (ВВ), которые могут секретироваться или поглощаться эмбрионами (20, 21). Замена питательной среды во время процедуры IVC эмбрионов приводит к удалению этих важных панкриатических факторов, а также ВВ, что может снизить потенциал эмбрионального развития in vitro.
У КРС замену IVC среды обычно проводят каждые 2-3 сут культивирования (3, 15, 22). Однако есть немало сообщений о сомнительной необходимости такой процедуры и возможности получения высоких показателей развития и качества IVP эмбрионов без смены или с частичной сменой среды (16, 23, 24). Два последних подхода стали особенно популярны в связи с переходом к культивированию в инкубаторах с атмосферой, содержащей низкую концентрацию кислорода (25). То есть на этапе созревания и оплодотворения ооциты культивируются при естественном уровне О 2 (20 %), а со стадии предполагаемой зиготы — при более низкой концентрации О 2 , в результате чего в клетках уменьшается образование активных форм кислорода и окислительный стресс. Существует мнение, что, несмотря на многолетний опыт и рутинность работ по получению IVP эмбрионов, оптимальный режим смены IVC среды при их культивировании как для КРС (16), так и для других животных (26) до сих пор не определен. Особенно это касается появившихся недавно новых коммерческих растворов, по использованию которых информация либо лимитирована, либо отсутствует.
В выполненной нами работе эмбриональное развитие созревших и оплодотворенных in vitro ооцитов происходило в коммерческой среде BO-IVC («IVF Bioscience», Великобритания), выбор которой был основан на данных о ее высокой эффективности при получении IVP эмбрионов у КРС (27, 28). В настоящем сообщении в целом впервые охарактеризовано влияние исследуемых условий на развитие оплодотворенных in vitro ооцитов КРС до стадии бластоцисты и оценено их качество с точки зрения числа ядер, частоты апоптоза и жизнеспособности.
Цель исследования заключалась в изучении влияния условий смены BO-IVC на количественные и качественные характеристики эмбрионов при их развитии in vitro. Также оценивалась возможная зависимость такого влияния от объема среды культивирования.
Методика . Во всех экспериментах, кроме отдельно указанных случаев, использовались реагенты фирмы «Sigma-Aldrich» (США).
Для получения эмбрионов выделенные post mortem яичники коров доставляли в лабораторию, освобождали от прилегающих тканей и многократно отмывали в стерильном физиологическом растворе, содержащем пенициллин (100 МЕ/мл) и стрептомицин (50 мкг/мл) («БиоФармГарант», Россия). Для извлечения ооцит-кумулюсных комплексов (ОКК) из яичников лезвием рассекали стенки фолликулов и промывали 3 раза в среде ТС-199, содержащей HEPES (25 мМ), Na-пируват (0,5 мМ), ФБС (5 %), гепарин (10 мкг/мл) и гентамицин (50 мкг/мл). Одновременно с промывкой проводили морфологическую оценку извлеченных ОКК, отбирая для дальнейшего культивирования ооциты согласно общепринятым критериям (29).
Для созревания отобранные ОКК инкубировали в течение 24 ч в среде ТС-199, содержащей HEPES (25 мМ), Na-пируват (0,5 мМ), фолликулостимулирующий и лютеоинизирующий гормоны (по 10 мкг/мл), эпидермальный фактор роста (10 нг/мл) («Thermo Fisher Scientific», США), а также ФБС (10 %) и гентамицин (50 мкг/мл).
После созревания ОКК подвергали in vitro оплодотворению (in vitro fertilization, IVF). Для этого их однократно промывали в среде BO-IVF («IVF Bioscience», Великобритания) и помещали в капли той же среды за 30 мин до контакта со сперматозоидами. Ооциты оплодотворяли с использованием фракции активных сперматозоидов, полученных методом swim-up (30). Соломинку с замороженной спермой размораживали, содержимое соломинки переносили на дно пробирок, содержащей 1 мл среды Sperm-TALP (31), и помещали в инкубатор (MCO-18AIC, «Sanyo», Япония) на 50 мин. После инкубации из пробирки отбирали верхний слой объемом 750 мкл, переносили его в другую пробирку содержащую среду Sperm-TALP и центрифугировали (центрифуга 3-30KS, «Sigma», Германия) при 300 g в течение 7 мин. Полученный осадок, содержащий подвижные спермии, вносили в среду BO-IVF («IVF Bioscience», Великобритания) с предварительно перенесенными туда созревшими ОКК (конечная концентрация сперматозоидов в среде составляла 1,5½106/мл). Половые клетки совместно культивировали в течение 15-16 ч, после чего ооциты осторожно освобождали в среде Fert-TALP от клеток кумулюса и налипших сперматозоидов и помещали в среду для эмбрионального развития.
Эмбрионы культивировали в 4-луночных планшетах («Nunc», Дания) в каплях среды BO-IVC («IVF Bioscience», Великобритания) объемом 500 или 100 мкл под слоем минерального масла в инкубаторе (MCO-MCO-50M-PE, «Sanyo», Япония) при температуре 38,5 ° С и газовой атмосфере, содержащей 6 % СО 2 , 5 % О 2 и 89 % N 2 . Сравнивали три варианта инкубации: без смены среды (БСС), с полной сменой среды (ПСС) и с частичной сменой среды (ЧСС). В первом случае эмбрионы развивались в течение всего периода (8 сут) без обновления среды культивирования, во втором — через 3 сут IVC эмбрионы переносили для дальнейшего развития в капли свежей среды, в третьем — через 3 сут инкубации половину изначального объема (500 или 100 мкл) среды удаляли и заменяли эквивалентным объемом свежей среды. Во всех вариантах через 3 сут IVC проводили морфологическую оценку доли раздробившихся зигот, на 8-е сут культивирования подсчитывали число эмбрионов, развившихся до стадии Бл, а также определяли их жизнеспособность и качество.
Для анализа качества одну часть 8-суточных Бл фиксировали 60 мин 4 % раствором параформальдегида. После фиксации эмбрионы пермеаби-лизировали 30 мин в 0,1 % растворе цитрата натрия, содержащем 0,5 % Тритона Х-100, и использовали для детекции апоптотических ядер методом TUNEL с помощью набора In Situ Cell Death Detection Kit, fluorescein («Roche Diagnostics», Швейцария). Затем ядерный материал эмбрионов окрашивали 20 мин в растворе DAPI (1 мкг/мл), переносили на предметное стекло с адгезивным покрытием Superfrost Plus («Thermo Fisher Scientific», США) и заключали в среду Vectashield («Vector Laboratories», Великобритания). Цитологические препараты просматривали и фотографировали под флуоресцентным микроскопом Axio Imager M2, оснащенным фильтром для TUNEL (возбуждение при 445-470 нм) и DAPI (возбуждение при 365 нм), с использованием цифровой камеры Axiocam 506 и программы ZEN 2 pro («Carl Zeiss», Германия). Определяли общее число ядер в эмбрионах и число TUNEL-позитивных ядер.
Для оценки жизнеспособности вторую часть полученных 8-суточных Бл культивировали 2 сут в среде BO-IVC, содержащей 5 % ФБС, до стадии вылупления. Учитывали число вылупившихся Бл (ВБл) на начало и в конце культивирования.
Статистическую обработку данных проводили методом ANOVA с использованием программы SigmaStat («Systat Software, Inc.», США). Результаты экспериментов представлены в виде средних значений ( М ) и их стандартных ошибок (±SEM). Для оценки достоверности различий между сравниваемыми средними значениями использовали критерий Тьюки.
Результаты. Используемые для получения эмбрионов созревшие in vitro ооциты имели равноценную компетенцию для дальнейшего развития. При двух использованных вариантах культивирования результаты дробления на 3-и сут после оплодотворения in vitro существенно не различались, и доля раздробившихся после оплодотворения ооцитов колебалась от 67,6 до 74,0 % (табл. 1).
-
1. Развитие оплодотворенных in vitro ооцитов коров до стадии бластоцисты в зависимости от режима смены IVC (in vitro culture) среды ( n = 6, M ±SEM, 8-е сут культивирования)
-
2. Результаты цитологического анализа бластоцист, полученных в результате культивирования эмбрионов (8-е сут) при разных режимах смены IVC (in vitro culture) среды
|
Вариант культивирования |
Число ооцитов |
Доля ооцитов, раздробившихся после оплодотворения, % |
Развитие до стадии бластоцисты, % |
|
|
от общего числа ооцитов |
от числа раздробившихся ооцитов |
|||
|
Капли ср еды объемом 500 мкл |
||||
|
Без смены среды |
148 |
67,6±1,9 |
23,0±1,5 |
34,1±2,4 |
|
Полная смена среды |
166 |
69,9±2,6 |
45,7±4,8** |
65,1±4,8*** |
|
Частичная смена среды |
138 |
74,0±2,9 |
44,9±0,7** |
58,5±1,6** |
|
Капли ср еды объемом 100 мкл |
||||
|
Без смены среды |
68 |
68,4±3,4 |
25,8±0,8 |
37,9±2,8 |
|
Полная смена среды |
88 |
72,5±4,5 |
52,1±4,9** |
71,5±2,3*** |
|
Частичная смена среды |
94 |
72,2±2,3 |
44,1±5,0* |
60,9±5,7** |
*, **, *** Различия по сравнению с культивированием без смены среды статистически значимы соответ- ственно при p < 0,05; p < 0,01 и p < 0,001.
Эксперимент выявил влияние условий смены IVC среды на развитие оплодотворенных in vitro ооцитов до стадии Бл (рис. 1, А-В, табл. 1). В случае культивирования эмбрионов в каплях BO-IVC объемом 500 мкл в течение 8 сут без смены среды выход Бл был наименьшим и составил 23,0±1,5 %. Частичная или полная смена среды через 3 сут культивирования эмбрионов в равной степени повышала показатель в 1,9 (р < 0,01). С уменьшением объема капли среды BO-IVC до 100 мкл характер влияния условий смены среды на развитие зигот до стадии Бл не изменялся. Описанные эффекты сохранялись и в случае, когда процент развития до Бл рассчитывали от числа раздробившихся зигот, то есть от общего числа полученных после оплодотворения эмбрионов.
|
Вариант культивирования |
Число экспериментов |
Общее число бластоцист |
Число ядер в бластоцисте, M ±SEM |
|
|
всего |
с признаками апоптоза, % |
|||
|
Капли ср еды объемом 500 мкл |
||||
|
Без смены среды |
3 |
17 |
216,9±9,8 |
6,53±0,88 |
|
Полная смена среды |
3 |
38 |
180,4±9,2a |
3,60±0,12* |
|
Частичная смена |
||||
|
среды |
3 |
31 |
198,3±15,4 |
4,30±0,46 |
|
Капли среды объемом 100 мкл |
||||
|
Без смены среды |
3 |
9 |
175,8±13,5 |
6,47±0,66 |
|
Полная смена среды |
3 |
23 |
224,3±6,7*b |
3,50±0,29** |
|
Частичная смена |
||||
|
среды |
3 |
21 |
230,4±8,4* |
3,10±0,17** |
*, ** Различия по сравнению с культивированием без смены среды статистически значимы соответственно при p < 0,05 и p < 0,01.
ab Различия между средними значениями для одного варианта смены среды, помеченными разными буквами, статистически значимы при p < 0,05.
Данные цитологического анализа свидетельствовали о достаточно высоком качестве эмбрионов, развившихся in vitro при сравниваемых условиях обновления IVC среды (табл. 2). При высоком среднем числе ядер в 8-суточных Бл (см. рис. 1, Г-Е) между вариантами смены среды не было выявлено существенных различий, если эмбрионы развивались в каплях объемом 500 мкл. Напротив, с уменьшением объема среды до 100 мкл ПСС приводила к повышению анализируемого показателя по сравнению с культивированием в варианте БСС (р < 0,05), а также по сравнению с ПСС, когда объем капель составлял 500 мкл (р < 0,05).
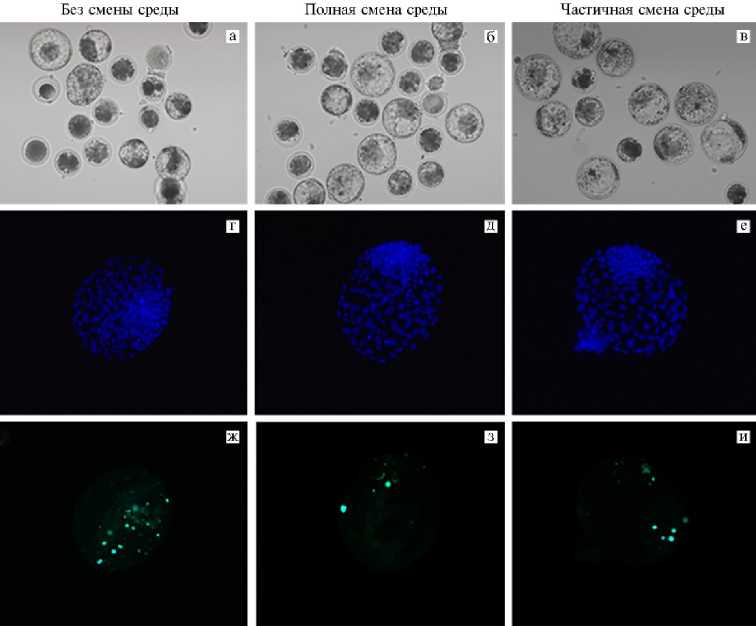
Рис. 1. Микрофотографии эмбрионов крупного рогатого скота ( Bos taurus ) через 8 сут культивирования in vitro при разных режимах смены IVC (in vitro culture) среды: а-в — эмбрионы, развившиеся до стадии бластоцисты (увеличение 100½, микроскоп Eclipse Ti-U, «Nikon», Япония); г-е — окрашивание ядер в бластоцисте с помощью DAPI (синий цвет; цитологический препарат), ж-и — окрашивание апоптотических ядер в бластоцисте методом TUNEL (зеленый цвет; цитологический препарат) (увеличение ½400, микроскоп Axio Imager M2, «Carl Zeiss», Германия).
Также было обнаружено влияние тестируемых условий на частоту апоптитической дегенерации в Бл. Культивирование эмбрионов в варианте БСС в среде объемом 100 мкл негативно влияло на долю апоптоти-ческих ядер в Бл (см. рис. 1, Ж), существенно повышая этот показатель по сравнению как с вариантом ПСС (см. рис. 1, З), так и ЧСС (см. рис. 1, И) (p < 0,01). С увеличением объема IVC среды эффект становился менее выраженным. При ПСС анализируемый показатель уменьшался по сравнению с БСС (p < 0,05), но не ЧСС (при частичной смене среды достоверных различий мы не обнаружили, хотя в эмбрионах отмечалась тенденция к снижению доли ядер с признаками апоптоза).
Показано, что доля IVF ооцитов, достигших стадии ВБл на 10-е сут IVC, что служит критерием жизнеспособности IVP эмбрионов, была выше в группах ПСС и ЧСС, чем в группе БСС (рис. 2, А). В последнем случае этот показатель для объемов среды 500 и 100 мкл не различался и составил соответственно 14,9±1,5 и 11,6±3,3 %. Культивирование, предполагающее полную или частичную смену среды при объеме 500 мкл, повышало долю IVF ооцитов, достигших стадии ВБл, до 25,2±3,9 и 26,2±3,2 (p < 0,05), при объеме 100 мкл — соответственно до 40,8±3,2 (p < 0,001) и 27,7±1,4 (p < 0,05). То есть в условиях ПСС уменьшение объема IVC среды с 500 до 100 мкл повышало показатель жизнеспособности эмбрионов (p < 0,05), величина которого была при этом самой высокой среди тестируемых вариантов культивирования. Следует отметить, что когда долю IVF ооцитов, достигших стадии ВБл, оценивали на 8-е сут IVC, положительное эффект при ПСС и ЧСС в сравнении с БСС проявлялся только в каплях объемом 100 мкл (p < 0,05), кроме того, в условиях ПСС показатель жизнеспособности, как и на 10-е сут, был выше по сравнению с таковым при 500 мкл (p < 0,05).
Жизнеспособность эмбрионов дополнительно оценивали по доле ВБл к общему числу бластоцист (см. рис. 2, Б). В случае культивирования эмбрионов в течение 10 сут в среде объемом 500 мкл доля ВБл существенно не различалась между вариантами смены среды и составила для групп БСС, ПСС и ЧСС соответственно 65,6±8,7; 54,6±2,9 и 58,5±7,1 %. Напротив, с уменьшением объема среды этот показатель был больше в группе ПСС, чем БСС (78,7±2,4 против 44,4±11,1 %, p < 0,01), и существенно превышал значения в аналогичной группе при объеме 500 мкл (p < 0,05). Когда долю ВБл от общего числа бластоцист оценивали на 8-е сут культивирования эмбрионов, в каплях большего объема в группе БСС она была выше, чем при ПСС и ЧСС — соответственно 53,3±3,3 против 16,2±2,0 % (p < 0,01) и 29,4±6,3 % (p < 0,05), в то время как в каплях меньшего объема ее значения были самыми низкими среди сравниваемых вариантов (22,2±11,1; 42,6±4,9 и 35,0±5,0 % соответственно для БСС, ПСС и ЧСС).
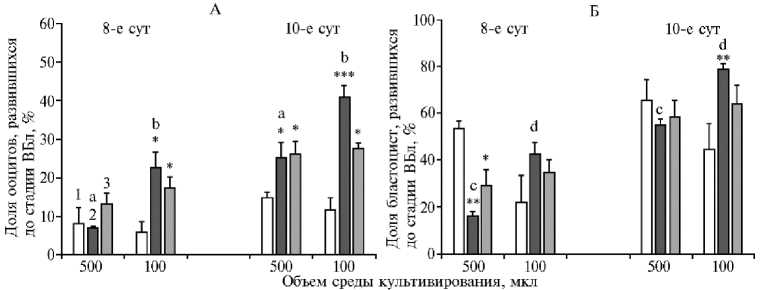
Рис. 2. Оценка жизнеспособности бластоцист, полученных в результате культивирования эмбрионов (8-е и 10-е сут) при разных режимах смены IVC (in vitro culture) среды ( n = 3, M ±SEM).
*, **, *** Различия по сравнению с культивированием без смены среды статистически значимы соответственно при p < 0,05; p < 0,01 и p < 0,001.
ab, cd Различия между средними значениями для одного варианта смены среды на 8-е и 10-е сут культивирования, помеченными разными буквами, статистически значимы соответственно приp < 0,05 и p < 0,01.
В настоящее время IVC среды, используемые в рамках IVP технологии, способны обеспечивать высокий выход эмбрионов, пригодных для замораживания и трансплантации животным-реципиентам. Тем не менее условия in vitro, в которых происходит развитие эмбрионов, до сих пор требуют детализации (3, 6). В частности, остается неясным, существует ли необходимость в процедуре обновления IVC среды, которую рекомендуется проводить каждые 48-72 ч в течение культивирования эмбрионов. С одной стороны, замена среды обеспечивает эмбрионы питательными веществами и удаляет вредные метаболиты (14-16), с другой данная — процедура приводит к стрессовому изменению микроокружения эмбрионов и удалению необходимых для их развития эмбриотропных факторов (15, 16).
В представленной работе культивирование эмбрионов происходило в коммерческой среде BO-IVC в каплях объемом 500 и 100 мкл и предполагало их развитие до стадии бластоцисты либо без смены среды культивирования, либо с полной или частичной (50 %) сменой среды. Результаты показали, что по сравнению с непрерывным культивированием полная смена среды через 3 сут IVC обеспечивала значительное увеличение выхода Бл (см. табл. 1), снижение частоты апоптоза в эмбрионах (см. табл. 2), а также повышение их жизнеспособности, определяемой по доле ВБл от общего числа оплодотворенных ооцитов (см. рис. 1, А), вне зависимости от объема IVC среды, в котором происходило развитие эмбрионов, и, кроме того, увеличивало число ядер в Бл (см. табл. 2) при объеме среды 100 мкл. Культивирование, предполагающее частичную смену среды, также было по ряду показателей эффективней, чем таковое без смены среды. Наблюдалось сходное с вариантом ПСС повышение частоты образования бластоцист (см. табл. 1) и их жизнеспособности (см. рис. 1, А), а в случае культивирования в среде объемом 100 мкл — увеличение числа ядер и снижение доли апопто-тических ядер в Бл (см. табл. 2). Значимых различий между ПСС и ЧСС по всему спектру исследуемых показателей мы не обнаружили, тем не менее в случае ПСС и культивирования в среде объемом 100 мкл наблюдались самые высокие показатели развития Бл и ВБл. В целом описанные выше результаты свидетельствуют о негативном влиянии непрерывного культивирования на развитие и качество IVP эмбрионов.
Полученные нами данные частично согласуются с недавним исследованием на кроликах, в котором ЧСС была эффективнее с точки зрения развития Бл и их качества (числа ядер), чем культивирование без смены среды. Кроме того, ЧСС и ПСС сходным образом снижали частоту апоптоза в эмбрионах (26). В работе этих авторов, как и в нашем исследовании, смена среды проводилась однократно через 3 сут культивирования. Тем не менее в опытах на КРС, которых не так много, наоборот, показано, что ПСС в сравнении с культивированием БСС приводит к снижению образования Бл и ВБл (23), а также к ухудшению качества и жизнеспособности эмбрионов (16). Также есть сообщения об отсутствии различий между такими вариантами культивирования (24). Учитывая тот факт, что в обсуждаемых выше работах культивирование эмбрионов КРС происходило в среде SOF со сменой среды через каждые 48 ч IVC, и принимая во внимание результаты наших собственных исследований, можно предположить, что, во-первых, столь частая смена среды как раз и могла быть причиной стресса и негативного эффекта ПСС, оказываемого на развитие и качество эмбрионов (32), и, во-вторых, параметры обновления среды SOF, возможно, требуют детализации.
Таким образом, по сравнению с культивированием без смены среды (БСС) полная (ПСС) и частичная (ЧСС) смена среды культивирования положительно влияют на развитие и качество эмбрионов крупного рогатого скота, получаемых in vitro (IVP). ПСС обеспечивала значительное увеличение частоты образования бластоцист (с 23,0±1,5 и 25,8±0,8 до 45,7±4,8 и 52,1±4,9 %, p < 0,01), снижение частоты апоптоза в эмбрионах (с 6,53±0,88 и 6,47±0,66 до 3,60±0,12 и 3,50±0,29 %, p < 0,05 и p < 0,01) и повышение выхода вылупившихся бластоцист от общего числа оплодотворенных ооцитов (с 14,9±1,5 и 11,6±3,3 до 25,2±3,9 и 40,8±3,2 %, p < 0,05 и p < 0,001) независимо от объема среды (данные представлены соответственно для 500 и 100 мкл); при объеме среды 100 мкл также увеличивалось число ядер в бластоцисте (с 175,8±13,5 до 224,3±6,7, p < 0,05). При ЧСС частота образования бластоцист повышалась (до 44,9±0,7 и 44,1±5,0 %, p < 0,01 и p < 0,05) и доля бластоцист, развившихся до стадии вылупления, увеличивалась (до 26,2±3,2 и 27,7±1,4 %, p < 0,05), а при объеме среды 100 мкл увеличивалось число ядер в бластоцисте (до 230,4±8,4, p < 0,05) и уменьшалась доля апоптотических ядер (до 3,10±0,17, p < 0,01). Также очевидно, что наблюдаемый эффект зависит от объема IVC (in vitro culture) среды: при культивировании эмбрионов в среде BO-IVC («IVF Bioscience», Великобритания) объемом 500 мкл эффективны оба способа обновления среды, а при 100 мкл лучшие показатели достигаются при ПСС. При ПСС и культивировании в среде объемом 100 мкл показатели развития Бл и ВБл оказались самыми высокими. В целом коммерческая среда BO-IVC при условии обновления через 3 сут может быть рекомендована для получения IVP эмбрионов у крупного рогатого скота.
Список литературы Смена среды культивирования положительно влияет на развитие и качество эмбрионов крупного рогатого скота in vitro
- Ferré L.B., Kjelland M.E., Strøbech L.B., Hyttel P., Mermillod P., Ross P.J. Review: Recent advances in bovine in vitro embryo production: reproductive biotechnology history and methods. Animal, 2020, 14(5): 991-1004 (doi: 10.1017/S1751731119002775).
- Sanches B.V., Zangirolamo A.F., Seneda M.M. Intensive use of IVF by large-scale dairy pro-grams. Animal Reproduction, 2019, 16(3): 394-401 (doi: 10.21451/1984-3143-AR2019-0058).
- Ferré L.B., Kjelland M.E., Taiyeb A.M., Campos-Chillon F., Ross P.J. Recent progress in bovine in vitro-derived embryo cryotolerance: impact of in vitro culture systems, advances in cryopres-ervation and future considerations. Reproduction in Domestic Animals, 2020, 55(6): 659-676 (doi: 10.1111/rda.13667).
- Marsico T.V., de Camargo J., Valente R.S., Sudano M.J. Embryo competence and cryosurvival: Molecular and cellular features. Animal Reproduction, 2019, 16(3): 423-439 (doi: 10.21451/1984-3143-AR2019-0072).
- Pontes J.H., Nonato-Junior I., Sanches B.V., Ereno-Junior J.C., Uvo S., Barreiros T.R., Oliveira J.A., Hasler J.F., Seneda M.M. Comparison of embryo yield and pregnancy rate between in vivo and in vitro methods in the same Nelore (Bos indicus) donor cows. Theriogenology, 2009, 71(4): 690-697 (doi: 10.1016/j.theriogenology.2008.09.031).
- Stroebech L., Mazzoni G., Pedersen H.S., Freude K.K., Kadarmideen H.N., Callesen H., Hyt-tel P. In vitro production of bovine embryos: revisiting oocyte development and application of systems biology. Animal Reproduction, 2015, 12(3): 465-472.
- Carvalho A.V., Canon E., Jouneau L., Archilla C., Laffont L., Moroldo M., Ruffini S., Corbin E., Mermillod P., Duranthon V. Different co-culture systems have the same impact on bovine em-bryo transcriptome. Reproduction, 2017, 154(5): 695-710 (doi: 10.1530/REP-17-0449).
- Rosenkrans C.F. Jr., First N.L. Effect of free amino acids and vitamins on cleavage and devel-opmental rate of bovine zygotes in vitro. Journal of Аnimal Science, 1994, 72(2): 434-437 (doi: 10.2527/1994.722434x).
- Thompson J.G., Allen N.W., McGowan L.T., Bell A.C., Lambert M.G., Tervit H.R. Effect of delayed supplementation of fetal calf serum to culture medium on bovine embryo development in vitro and following transfer. Theriogenology, 1998, 49(6): 1239-1249 (doi: 10.1016/s0093-691x(98)00071-5).
- Thompson J.G., Peterson A.J. Bovine embryo culture in vitro: new developments and post-trans-fer consequences. Human Reproduction, 2000, 15(5): 59-67 (doi: 10.1093/humrep/15.suppl_5.59).
- Xiong X.R., Wang L.J., Wang Y.S., Hua S., Zi X.D., Zhang Y. Different preferences of IVF and SCNT bovine embryos for culture media. Zygote, 2014, 22(1): 1-9 (doi: 10.1017/S0967199412000184).
- Soto-Moreno E.J., Balboula A., Spinka C., Rivera R.M. Serum supplementation during bovine embryo culture affects their development and proliferation through macroautophagy and endo-plasmic reticulum stress regulation. PLoS ONE, 2021, 16(12): e0260123 (doi: 10.1371/jour-nal.pone.0260123).
- Amaral T.F., de Grazia J.G.V., Martinhao LAG., De Col F., Siqueira L.G.B., Viana J.H.M., Hansen P.J. Actions of CSF2 and DKK1 on bovine embryo development and pregnancy out-comes are affected by composition of embryo culture medium. Scientific Reports, 2022, 12(1): 7503 (doi: 10.1038/s41598-022-11447-7).
- Takahashi M., Keicho K., Takahashi H., Ogawa H., Schultz R.M., Okano A. Effect of oxidative stress on development and DNA damage in in-vitro cultured bovine embryos by comet assay. Theriogenology, 2000, 54(1): 137-145 (doi: 10.1016/s0093-691x(00)00332-0).
- Cagnone G., Sirard M.A. The embryonic stress response to in vitro culture: insight from genomic analysis. Reproduction, 2016, 52(6): 247-261 (doi: 10.1530/REP-16-0391).
- Qu P., Qing S., Liu R., Qin H., Wang W., Qiao F., Ge H., Liu J., Zhang Y., Cui W., Wang Y. Effects of embryo-derived exosomes on the development of bovine cloned embryos. PLoS ONE, 2017, 12(3): e0174535 (doi: 10.1371/journal.pone.0174535).
- Wydooghe E., Vandaele L., Heras S., De Sutter P., Deforce D., Peelman L., De Schauwer C., Van Soom A. Autocrine embryotropins revisited: how do embryos communicate with each other in vitro when cultured in groups? Biological Reviews of the Cambridge Philosophical Society, 2017, 92(1): 505-520 (doi: 10.1111/brv.12241).
- Lopera-Vásquez R., Hamdi M., Fernandez-Fuertes B., Maillo V., Beltrán-Breña P., Calle A., Redruello A., López-Martín S., Gutierrez-Adán A., Yañez-Mó M., Ramirez M.Á., Rizos D. Ex-tracellular vesicles from BOEC in in vitro embryo development and quality. PLoS ONE, 2016, 11(2): e0148083 (doi: 10.1371/journal.pone.0148083).
- Lin X., Beckers E., Mc Cafferty S., Gansemans Y., Szymańska K.J., Pavani K.C., Catani J.P., Van Nieuwerburgh F., Deforce D., De Sutter P., Van Soom A., Peelman L. Bovine EMBRYO-SECRETED MICroRNA-30c is a potential non-invasive biomarker for hampered preimplantation developmental competence. Frontiers in Genetics, 2019, 10: 315 (doi: 10.3389/fgene.2019.00315).
- Bobrie A., Colombo M., Raposo G., Théry C. Exosome secretion: molecular mechanisms and roles in immune responses. Traffic, 2011, 12(12): 1659-1668 (doi: 10.1111/j.1600-0854.2011.01225.x).
- Saadeldin I.M., Oh H.J., Lee B.C. Embryonic-maternal cross-talk via exosomes: potential impli-cations. Stem Cells and Cloning, 2015, 8: 103-107 (doi: 10.2147/SCCAA.S84991).
- Wang Y.S., Tang S., An Z.X., Li W.Z., Liu J., Quan F.S., Hua S., Zhang Y. Effect of mSOF and G1.1/G2.2 media on the developmental competence of SCNT-derived bovine embryos. Re-production in Domestic Animals, 2011, 46(3): 404-409 (doi: 10.1111/j.1439-0531.2010.01679.x).
- Fukui Y., Lee E.S., Araki N. Effect of medium renewal during culture in two different culture systems on development to blastocysts from in vitro produced early bovine embryos. Journal of Animal Science, 1996, 74(11): 2752-2758 (doi: 10.2527/1996.74112752x).
- Ikeda K., Takahashi Y., Katagiri S. Effect of medium change on the development of in vitro matured and fertilized bovine oocytes cultured in medium containing amino acids. The Journal of Veterinary Medical Science, 2000, 62(1): 121-123 (doi: 10.1292/jvms.62.121).
- Sciorio R., Smith G.D. Embryo culture at a reduced oxygen concentration of 5 %: a mini review. Zygote, 2019, 27(6): 355-361 (doi: 10.1017/S0967199419000522).
- Wang H., Cao W., Hu H., Zhou C., Wang Z., Alam N., Qu P., Liu E. Effects of changing culture medium on preimplantation embryo development in rabbit. Zygote, 2022, 30(3): 338-343 (doi: 10.1017/S0967199421000721).
- Nielsen J.M.K., Wrenzycki C., Hyttel P., Poppicht F., Stroebech L. New culture media affects blastocyst development and gene expression levels in in vitro-produced bovine embryos. Repro-duction, Fertility, Development, 2014, 27(1): 206-207 (doi: 10.1071/RDv27n1Ab234).
- Gutierrez-Castillo E., Ming H., Foster B., Gatenby L., Mak C.K., Pinto C., Bondioli K., Jiang Z. Effect of vitrification on global gene expression dynamics of bovine elongating embryos. Repro-duction, Fertility, Development, 2021, 33(5): 338-348 (doi: 10.1071/RD20285).
- Singina G.N., Shedova E.N. Final maturation of bovine oocytes in a FERT-TALP medium in-creased their quality and competence to in vitro embryo development. Sel'skokhozyaistvennaya Bi-ologiya [Agricultural Biology], 2019, 54(6): 1206-1213 (doi: 10.15389/agrobiology.2019.6.1206eng).
- Parrish J.J. Bovine in vitro fertilization: in vitro oocyte maturation and sperm capacitation with heparin. Theriogenology, 2014, 81(1): 67-73 (doi: 10.1016/j.theriogenology.2013.08.005).
- Singina G.N., Shedova E.N., Lopukhov A.V., Mityashova O.S., Lebedeva I.Y. Delaying effects of prolactin and growth hormone on aging processes in bovine oocytes matured in vitro. Pharma-ceuticals (Basel), 2021, 14(7): 684 (doi: 10.3390/ph14070684).
- Dagilgan S., Dundar-Yenilmez E., Tuli A., Urunsak I.F., Erdogan S. Evaluation of intracellular pH regulation and alkalosis defense mechanisms in preimplantation embryos. Theriogenology, 2015, 83(6): 1075-1084 (doi: 10.1016/j.theriogenology.2014.12.011).


