Снижение периоперационного риска при вертебрологических операциях у пациентов с наследственными заболеваниями соединительной ткани
Автор: Рябых Сергей Олегович, Шушарина Вера Леонидовна, Очирова Полина Вячеславовна, Третьякова Анастасия Николаевна, Рябых Татьяна Викторовна
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 4, 2015 года.
Бесплатный доступ
Дизайн исследования. Ретроспективный анализ серии клинических случаев. Цель. Оценка функционального состояния внутренних органов при наследственных заболеваниях соединительной ткани и снижение периоперационного риска для достижения максимальной результативности вертебрологической коррекции. Объект. Анализ 22 пациентов в возрасте от 9 месяцев до 24 лет за период 2011 - 2014 гг. с наследственными заболеваниями соединительной ткани, оперированных по поводу декомпенсированных деформаций позвоночника. Методы. Выполнен анализ функционального статуса по основным выделенным синдромам: синдром неврологических нарушений; астенический синдром; клапанный синдром; торакодиафрагмальный синдром; аритмический синдром; бронхолегочный синдром; висцеральный синдром; синдром патологии органа зрения; синдром гипермобильности суставов; вертеброгенный синдром; косметический синдром. Применялись клинический, функциональный и статистический методы. Предметом анализа явились наличие аномалий развития и функциональные нарушения со стороны сердца, органов дыхания, ЖКТ, гомеостаза и почек. Результаты. Выделены основные патологические состояния, характеризующие изменения различных органов и систем при наследственных заболеваниях соединительной ткани и определяющие как риск оперативной коррекции и анестезиологического пособия, так и течение послеоперационного периода. Обоснован план многопрофильного обследования пациентов и хирургическая тактика коррекции системной деформации позвоночника. Обсуждение. Отразить прямую связь функционального статуса с риском анестезиологического пособия и оперативного лечения. Заключение. Анализ индивидуального профиля соматической патологии в каждой нозологической группе позволяет объективизировать риск с учетом соматического, неврологического статуса и объема вмешательства.
Дисплазия, соединительная ткань, наследственные синдромы, деформация позвоночника, риск, спинальная хирургия
Короткий адрес: https://sciup.org/142121861
IDR: 142121861 | УДК: 612.751.3-007.17:616.711-007.24-056.7-089 | DOI: 10.18019/1028-4427-2015-4-48-52
Текст научной статьи Снижение периоперационного риска при вертебрологических операциях у пациентов с наследственными заболеваниями соединительной ткани
Соединительная ткань составляет 50 % от массы тела человека и является основным структурным компонентом костной ткани, паренхиматозных органов, органа зрения, нейроглии, гладкой мускулатуры, крови, лимфы. Именно полисистемность поражения заставляет вертебролога, анестезиолога, невролога, педиатра быть настороженными в плане возникновения нарушений со стороны «уязвимых органов и систем» при вертебрологических операциях.
Общие признаки поражения внутренних органов и систем при наследственных заболеваниях соединительной ткани широко описаны [13, 16, 20]. Так, патология сердечнососудистой системы представлена врожденными пороками сердца, малыми аномалиями сердца, нарушениями сердечного ритма; дыхательной системы: дисплазиями легочной ткани, врожденными аномалиями развития, бронхоэктазами, фиброателектазами;
центральной нервной системы: аномалиями развития головного мозга, эпилепсией, аномалиями ликворной системы, задержкой этапов психомоторного развития; вегетативной системы: вегетопатиями различных типов; мочевыделительной системы: аномалией развития, пиелоэктазией, кистами почек, органов пищеварения: врожденными аномалиями развития, дисфункцией желез внутренней секреции. Особенности патологии позвоночника при системных поражениях определяют атипичность локализации дуги и выраженность деформации позвоночника, бурное прогрессирование, негативный прогноз естественного течения патологии, непрогнозируемые особенности течения с присоединением миелопатии, нарушением функции внутренних органов и опорности скелета [2, 7, 10, 15, 17, 19]. Это определяет высокий риск лечения и сомнительный прогноз конечного результата [1, 3,4, 5, 6, 7, 8].
Ш Рябых С.О., Шушарина В.Л., Очирова П.В., Третьякова А.Н., Рябых Т.В. Снижение периоперационного риска при вертебрологических операциях у пациентов с наследственными заболеваниями соединительной ткани // Гений ортопедии. 2015. № 4. С. 48-52.
Целью работы является оценка функционального состояния внутренних органов при наследственных заболеваниях соединительной ткани и сни-
МАТЕРИАЛ
В исследуемой нами группе за 2011-2014 гг. состояло 22 пациента в возрасте от 9 месяцев до 24 лет с наследственными заболеваниями соединительной ткани, оперированных по поводу декомпенсированных деформаций позвоночника.
Нозологический профиль пациентов представлен в таблице 1.
Часть вышеуказанных генетических синдромов, безусловно, не относится к наследственным заболеваниям соединительной ткани, но наличие во всех случаях патологии позвоночника у данных пациентов побудило нас рассматривать их в одном ряду с пациентами, страдающими наследственными заболеваниями соединительной ткани.
Анализ функционального статуса выполнялся по жение периоперационного риска для достижения максимальной результативности вертебрологиче-ской коррекции.
И МЕТОДЫ основным выделенным синдромам: синдром неврологических нарушений; астенический синдром; клапанный синдром; торакодиафрагмальный синдром; аритмический синдром; бронхолегочный синдром; висцеральный синдром; синдром патологии органа зрения; синдром гипермобильности суставов; верте-брогенный синдром; косметический синдром.
Применялись клинический, функциональный и статистический методы.
Предметом анализа явилось наличие врожденных аномалий, особенности функции внутренних органов и состояние гемостаза, а также степень их компенсации. Указанное отражало как состояние синдромаль-ного соматического статуса, так и явилось критерием риска оперативного лечения.
Таблица 1
Нозологический профиль пациентов
|
Нозология |
Количество |
|
|
1. |
Нейрофиброматоз I типа |
5 |
|
2. |
Синдром Ларсена |
1 |
|
3. |
Синдром Гольденхара |
1 |
|
4. |
Мукополисахаридоз I типа |
1 |
|
5. |
Мукополисахаридоз IV типа |
1 |
|
6. |
Мукополисахаридоз VI типа |
1 |
|
7. |
Болезнь Дауна в сочетании с врожденной аномалией развития шейного отдела позвоночника |
1 |
|
8. |
Синдром Поланда |
1 |
|
9. |
Синдром Клиппеля-Фейля |
1 |
|
10. |
Синдром VACTERL |
1 |
|
11. |
Синдром Марфана |
2 |
|
12. |
Ахондроплазия |
2 |
|
13. |
Спондилоэпифизарная дисплазия |
1 |
|
14. |
Синдром Эскобара |
1 |
|
15. |
Cистемная платиспондилия |
1 |
|
16. |
Недифференцированный тип дисплазии соединительной ткани |
1 |
РЕЗУЛЬТАТЫ
Общая характеристика поражений основных систем представлена на рис. 1.
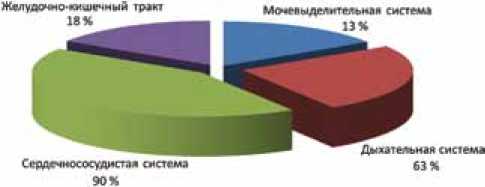
Рис. 1. Процентное соотношение функциональных нарушений у больных с деформациями позвоночника «высокого риска» на фоне наследственных заболеваний соединительной ткани
Нозологический профиль патологии сердечнососудистой системы у пациентов в исследуемой группе приведен в таблице 1. Следует отметить, что в 50 % случаев выявлено сочетанное поражение сердечнососудистой системы. Считается, что одной из причин столь частого поражения сердца при врожденных дисплазиях соеди- нительной ткани является недостаток магния, необходимого для синтеза коллагена – структурного компонента соединительной ткани [11, 18, 9, 12, 14].
Таблица 2
Частота встречаемости поражений сердечнососудистой системы (процентное соотношение)
|
Врожденные пороки сердца |
|
|
Врожденные пороки сердца Малые аномалии развития |
13,6 % 27,2 % |
|
Вегетативные дисфункции |
|
|
ВСД по ваготоническому типу ВСД по симпатикотоническому типу Гипертоническая болезнь I степени |
22,7 % 18,6 % 9 % |
|
Нарушение сердечного ритма |
|
|
Экстрасистолия (наджелудочковая, желудочковая) Синусовая тахикардия Синусовая брадикардия |
18 % 9 % 4,5 % |
|
Нарушение внутрижелудочковой проводимости |
|
|
Синоаурикулярная блокада II степени Неполные блокады ножек пучка Гисса |
9 % 9 % |
Основным проявлением поражения органов дыхания была дыхательная недостаточность (ДН), которая, по данным исследования функций внешнего дыхания, была выявлена в 41 % случаев. Клинически она не всегда была выражена из-за ограниченной подвижности пациентов в исследуемой нами группе. Распределение дыхательной недостаточности с учетом ФЖЕЛ и ОФВ1 по степени тяжести: ДН I степени встретилась в 34 %, II степени – в 22 %, III степени – в 44 %. При анализе типов выявленных вентиляционных нарушений у пациентов с дыхательной недостаточностью (по данным ФВД) смешанный тип встретился в 56 %, обструктивный – в 33 %, рестриктивный – в 11 %.
Морфологические изменения со стороны органов дыхания изучались на основе данных компьютерной томографии легких в дооперационном периоде. Отсутствовали патологические изменения легких в 36 %. Врожденная сегментарная эмфизема выявлена у пациентов с мукополисахаридозом и ахондроплазией в 9 %; фиброателектазы при ахондроплазии и болезни Дауна в 9 %; стеноз гортани при мукополисахаридозе – в 4 %; стеноз трахеи в нижней трети (мукополисахаридоз, VACTERL-синдром) – в 9 %; трахеомаляция при синдроме Ларсена – в 4 %.
Из нарушений внутреннего гомеостаза в доопера-ционном периоде отметим гипопротеинемию – 13 %, анемический синдром – 20 %, недифференцированный умеренный дефицит факторов свертывания – 9 %, значимые отклонения международного нормализованного отношения (МНО) у одного пациента, получавшего фенилин – 4 %. Наличие гомеостатических изменений не было связано с сопутствующими заболеваниями, и не выявлено корреляции с валидностью индекса массы тела. Это можно объяснить общностью онтогенетического происхождения форменных элементов крови, факторов свертывания из мезенхимы.
Другая сопутствующая патология выявлена у 8 пациентов. В ее структуре выделим миопию в 4 %; гиперметропию – в 9 %; гидроцефалию – в 9 %; бронхиальную астму вне обострения – в 4 %; хронический вторичный обструктивный пиелонефрит – в 9 %.
ОБСУЖДЕНИЕ
Полученные данные в группе пациентов в целом соответствуют данным как российских, так и зарубежных коллег [13, 16, 20], а профиль выявленной патологии в доопераци-онном периоде подтверждает полисистемность поражения при врожденной соединительнотканной дисплазии.
Основными, угрожаемыми по своим осложнениям, патологическими синдромами, выявленными при анализе соматического статуса, явились:
-
1. Синдром дыхательной недостаточности.
-
2. Вегетативная дисфункция преимущественно с нарушением сердечного ритма.
-
3. Выраженный дефицит массы тела.
-
4. Декомпенсация хронических заболеваний.
-
5. Врожденные аномалии дыхательных путей.
Пациенты в исследуемой нами группе поступали в отделение нейрохирургии и вертебрологии в большинстве случаев лишь с данными клинических и биохимических исследований. Актуальность выявленной патологии очевидна. В случае отсутствия полученной информации в дооперационном периоде вероятность осложнений со стороны указанных систем велика.
Прогнозировались и профилактировались следующие критические ситуации: со стороны дыхательной системы – трудная интубация вплоть до невозможности её выполнения ввиду стеноза гортани, аномалий трахеи; риск гипоателектазов, рестриктивно-обструктивных изменений 2-3 степени; риск поствентиляционных пневмоний; риск бронхообструктивного синдрома без предоперационной медикаментозной подготовки. Со стороны сердечно-сосудистой системы: без соответствующей медикаментозной коррекции была велика вероятность возникновения бра-дитахиаритмий на фоне вертебрологических операций 3-4 категории сложности, вплоть до остановки сердечной деятельности, возникновения пароксизмальной тахикардии. Грозным возможным осложнением являются послеоперационные гипоателектазы, вероятность которых высока на фоне миатонического синдрома и рестриктивно-обструктивных нарушений, усугубляющихся выраженным болевым синдромом. Риск поствентиляционной пневмонии, обострение хронических заболеваний (хронический пиелонефрит на фоне нарушения функций тазовых органов) лишь усугубили бы тяжесть послеоперационного периода.
Недооценка выявленного выраженного дефицита массы тела могла бы спровоцировать несоответствия массы тела, ОЦК, степени кровопотери, своевременности и составляющих инфузионной терапии, своевременности проведения гемотрансфузии.
На основании критериев синдромальной оценки соматического статуса пациентов исследуемой группы в отделении вертебрологии и нейрохирургии РНЦ «ВТО» им. Г.А. Илизарова выработан алгоритм предоперационной подготовки, который включает в себя девять позиций:
-
1. Оценку индекса массы тела.
-
2. Клиническое обследование пациента.
-
3. Мониторинг АД, ЧСС, ЧД в дооперационном периоде.
-
4. Оценку внутреннего гомеостаза с помощью клинико-биохимического и бактериологического исследований.
-
5. Оценку данных лучевой диагностики (УЗИ, МРТ, КТ).
-
6. Оценку данных функциональных методов исследования (холтеровское мониторирование, ЭКГ, ФВД, пульсоксиметрия).
-
7. Выявление ведущих патологических синдромов, представляющих периоперационный риск.
-
8. Соответствие выявленных отклонений тяжести предстоящего оперативного вмешательства, что определяет анестезиологический и хирургический риск.
-
9. Медикаментозную коррекцию.
По двум последним позициям решение принимал мультидисциплинарный консилиум. Результатом консилиума должно быть не только декларативное заключение о возможности проведения вмешательства в настоящее время, а поиск факторов риска и путей их минимизации.
Неблагоприятные фоновые факторы могут быть причиной осложненного течения пери- и послеоперационных периодов вплоть до летального исхода, несмотря на технически корректное выполненное оперативное пособие. Все перечисленное должно быть учтено при обследовании и его оценке различными специалистами с последующим принятием коллегиального решения.
При анализе периоперационного риска мы выделяем дооперационную составляющую, интраоперационный риск и прогнозируемый послеоперационный риск. У всех пациентов риск оперативного вмешательства, анестезиологического пособия оценивался как крайне высокий, что предполагало детальное предоперационное обследование.
Основными патологическими синдромами, которые выявлены в дооперационном периоде и определяли периоперационный риск, явились вегетопатии с нарушением сердечного ритма, проводимости; синдром артериальной гипертензии; анемический синдром; дыхательная недостаточность; синдром белково-энергетической недостаточности (гипопротеинемия, снижение мышечной массы, астения); хроническая интоксикация при неполной ремиссия хронического пиелонефрита.
Одним из фоновых состояний у большинства пациентов является чрезвычайно низкая масса тела, что определяет низкий уровень ОЦК.
Потенциальные трудности анестезиологического обеспечения у пациентов с деформацией шейного отдела позвоночника включали трудную интубацию, вследствие ограничения разгибания шеи, деформации и аномалии развития трахеи, особенности катетеризации магистральных вен. Это определяет необходимость использования оборудования, позволяющего визуализировать трахею при интубации (видеоларингоскоп, фибробронхоскоп), а также сонографии, облегчающей катетеризацию магистральных вен. При деформации грудного отдела позвоночника часто выявляются деформации ребер, грудной клетки, ателектазы, дистелектазы, гипогенезии, агенезии долей легких и снижение показателей функции внешнего дыхания, поэтому важным методом диагностики являются спирометрия и КТ грудной клетки и легких.
Деформации поясничного отдела позвоночника наиболее часто сопровождаются нарушением функции тазовых органов и вторичной инфекцией мочевыводящих путей.
Анализ функционального статуса на дооперацион-ном этапе позволил спрогнозировать основные факторы послеоперационного риска: синдром дыхательных расстройств на фоне аномалий развития легких, фиброателектазов и рестрективно-обструктивных нарушений с угрозой развития поствентиляционной пневмонии; вегетопатии с нарушением АД, сердечного ритма; обострение хронических заболеваний; постгеморрагическая анемия на отягощенном соматическом фоне, ацетонемический синдром.
Для минимизации и контроля интраоперационного риска крайне важными компонентами подготовки к хирургическому лечению являются медикаментозная коррекция патологических синдромов, валидность объема и характера оперативного лечения. Предложен «ступенчатый» протокол операции с соматическим и нейрофизиологическим контролем состояния пациента в течение оперативной сессии после каждого хирургического этапа. При наличии признаков соматической или неврологической нестабильности целесообразна тактика «разорванной во времени» этапной коррекции и стабилизации.
На основании основных патологических синдромов, определяющих периоперационный риск, выделены принципы их медикаментозной коррекции:
-
1. Нутритивная поддержка (диета, обогащенная белком, препараты энтерального питания, при необходимости парентеральное питание, расчет физиологических и патологических потерь с определением пути введения, коррекция ионного равновесия, КЩР, гипопротеинемии).
-
2. Коррекция анемии с учётом этиологического фактора (препараты железа, по показаниям гемотрансфузия).
-
3. Коррекция вегетопатий в зависимости от типа (адаптогены, бетта-1 адреноблокаторы, кардиометоболи-ческая терапия).
-
4. Лечение синдрома дыхательной недостаточности (бетта-2 адреномиметики, м- холиноблокаторы, топические кортикостероиды, системные стероиды, ме-тилксантины по показаниям).
-
5. Профилактика стресс-язвы с применением ингибиторов ионной помпы и др.
-
6. Санация мочевыделительной системы с учётом бактериологического обследования в дооперационном периоде, с продолжением антибактериальной терапии после операции; исключение неоправданно длительной катетеризации мочевого пузыря, коррекция уроди-намических нарушений.
-
7. Дыхательная гимнастика, ЛФК.
Соблюдение стандартов медикаментозной коррекции позволило достичь стабильных показателей гомеостаза у всех пациентов.
ВЫВОДЫ
-
1. Комплексное многопрофильное обследование c оценкой периоперационного риска позволяет улучшить результаты при хирургической коррекции патологии позвоночника.
-
2. Анализ индивидуального профиля соматической патологии в каждой нозологической группе позволяет объективизировать риск с учетом соматического, неврологического статуса и объема вмешательства.
-
3. Разработанный алгоритм предоперационной подготовки и медикаментозная коррекция выделенных патологических синдромов достоверно уменьшает пери-операционный риск.
-
4. Важным компонентом является планирование предполагаемого оперативного вмешательства. Для минимизации и контроля интраоперационного риска целесообразно применять «ступенчатый» протокол операции с соматическим и нейрофизиологическим контролем состояния пациента в течение оперативной сессии после каждого хирургического этапа. При наличии признаков соматической или неврологической нестабильности целесообразна тактика этапной коррекции и стабилизации. Соблюдение этой схемы позволяет расширить границы курабельности детей с деформациями позвоночника «высокого риска».
Список литературы Снижение периоперационного риска при вертебрологических операциях у пациентов с наследственными заболеваниями соединительной ткани
- Айзенберг В.Л., Уколов К.Ю., Диордиев А.В. Методы анестезии при оперативном лечении сколиоза у детей//Анестезиология и реаниматология. 2010. № 1. C. 57-60.
- Дисплазия соединительной ткани: пульмонологические аспекты/Г.И. Нечаева, И.А. Викторова, И.В. Друк, М.В. Вершинина//Пульмонология. 2004. № 2. С. 116-120.
- Земцовский Э.В. Диспластические синдромы и фенотипы. Диспластическое сердце. СПб., 2007. 80 с.
- Коррекция и стабилизация деформаций позвоночника у больных с системными заболеваниями скелета/С.В. Колесов, И.А. Шавырин, И.И. Мельников, С.А. Кудряков//Хирургия позвоночника. 2009. № 1. С. 8-16.
- Колесов С.В., Снетков А.И., Шавырин И.А. Хирургическое лечение деформаций позвоночника у больных системными наследственными заболеваниями скелета//Вестн. РАМН. 2008. № 8. C. 48-52.
- Коррекция и стабилизация позвоночника при его вторичных деформациях/С.В. Колесов, И.И. Мельников, И.А. Шавырин, С.А. Кудряков//Хирургия позвоночника. 2009. № 3. C. 38-45.
- Михайловский М.В. Сколиоз при синдроме Марфана//Хирургия позвоночника. 2009. № 4. С. 31-37.
- Поздникин Ю.И. Хирургическая коррекция деформаций позвоночника при системных заболеваниях//Вестн. травматологии и ортопедии им. Н.Н. Приорова. 1996. № 4. С. 7-11.
- Оценка эффективности терапии препаратом «Магнерот» у лиц молодого возраста с признаками дисплазии соединительной ткани/А.Р. Пшепий, Э.Г. Малев, С.В. Реева, И.А. Панкова//Артериальная гипертензия. 2008. № 2 (Прил. 1). С. 78.
- Синдром дисплазии соединительной ткани сердца/А.И. Мартынов, О.Б. Степура, О.Д. Остроумова, О.О. Мельник//Междунар. мед. журн. 1998. № 1. С. 17-22.
- Результаты применения магниевой соли оротовой кислоты «Магнерот» при лечении больных с идиопатическим пролапсом митрального клапана/А.Б. Шехтер, А.И. Мартынов, О.Б. Степура, Л.С. Пак, О.О. Мельник//Рос. мед. вести. 1999. № 2. С. 64-69.
- Школьникова М.А. Метаболизм магния и терапевтическое значение его препаратов. М.: ИД Медпрактика, 2002. 28 с.
- Терминология, определенная с позиции клиники, классификация врожденной дисплазии соединительной ткани/В.М. Яковлев, Г.И. Нечаева, И.А. Викторова //Врожденные дисплазии соединительной ткани: тез. симп. Омск, 1990. С. 3-5.
- Idiopathic magnesium deficiency in mitral valve prolapse/L. Cohen, H. Bitterman, E. Grenadier, A. Laor, N. Lahat, A. Palant//Am. J. Cardiol. 1986. Vol. 57, No 6. P. 486-487.
- Erkula G., Sponseller P., Dormans J.P. Surgery for spinal deformity in Marfan syndrome. In: 36th Annual SRS Meeting. Cleveland, Ohio, 2001. P. 118.
- Inherited Metabolic Disease/eds. G.F. Hoffman, W.L. Nyhan, J. Zschocke, S.G. Kahler, E. Mayatepek. Philadelphia, USA: Lippincott & Wilkins, 2002. 435 p.
- Lawrence E.J. The clinical presentation of Ehlers-Danlos syndrome//Adv. Neonatal Care. 2005. Vol. 5, No 6. P. 301-314.
- Clinical symptoms of mitral valve prolapse are related to hypomagnesemia and attenuated by magnesium supplementation/B. Lichodziejewska, J. Kłoś, J. Rezler, K. Grudzka, M. Dłuzniewska, A. Budaj, L. Ceremuzyński//Am. J. Cardiol. 1997. Vol. 79, No 6. P. 768-772.
- McKusick V.A. The cardiovascular aspects of Marfan’s syndrome: a heritable disorder of connective tissue//Circulation. 1955. Vol. 11, No 3. P. 321-342.
- A clinical and cardiovascular survey of Ehlers-Danlos syndrome patients with complete deficiency of tenascin-X/A.C. Peeters, M. Kucharekova, J. Timmermans, F.W. van den Berkmortel, G.H. Boers, I.R. Nováková, D. Egging, M. den Heijer, J. Schalkwijk//Neth. J. Med. 2004. Vol. 62, No 5. P. 160-162.


