Содержание диеновых конъюгатов и оснований шиффа в мицелии гриба Neonothopanus nambi при разных уровнях его свечения в условиях стресса
Автор: Тюлькова Н.А., Бондарь В.С.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Агрономия
Статья в выпуске: 3, 2019 года.
Бесплатный доступ
Исследовано соотношение интенсивности световой эмиссии мицелия Neonothopanus nambi в условиях стресса и содержания в био- массе гриба первичных и конечных продуктов перекисного окисления липидов (ПОЛ) - диено- вых конъюгатов (ДК) и оснований Шиффа (ОШ). С этой целью образцы механически по- врежденного мицелия инкубировали в пита- тельной картофельно-сахарозной среде без каких-либо добавок (контроль) и в условиях воздействия дополнительных стрессовых факторов (опыт): добавка в среду ингибитора грибного свечения (салициловая кислота (СК) в концентрации 0,5 мМ), закисления среды до рН 5,0 и 4,0 добавками уксусной кислоты. Со- держание изучаемых продуктов ПОЛ оценива- ли в биомассе контрольных и опытных образ- цов мицелия через 4 ч инкубации (регистри- руемый максимум интенсивности грибного свечения). ДК из биомассы мицелия экстраги- ровали смесью растворителей гептан- изопропанол с последующим разделением фаз. Содержание ДК в фазе гептана и фазе изопро- панола, отражающее интенсивность перекис- ного окисления в грибе нейтральных липидов и фосфолипидов соответственно, определяли спектрофотометрически по величине опти- ческой плотности образцов при длине волны 232 нм...
Светящиеся грибы, диеновые конъюгаты, основания шиффа, активные формы кислорода
Короткий адрес: https://sciup.org/140243399
IDR: 140243399 | УДК: 577.334
Текст научной статьи Содержание диеновых конъюгатов и оснований шиффа в мицелии гриба Neonothopanus nambi при разных уровнях его свечения в условиях стресса
Введение. Исследования светоизлучающих высших грибов Neonothopanus nambi и Armillaria borealis позволили нам составить представление о защитной функции грибного свечения от негативного воздействия активных форм кислорода (АФК) [1–7]. Известно, что в биологических объектах постоянно происходят жизненно важные реакции свободнорадикального окисления (СРО), скорость которых поддерживается на определенном уровне. Строгая регламентация реакций СРО в биообъектах обеспечивается согласованным функционированием ферментативных и неферментативных механизмов, контролирующих уровень АФК, свободных радикалов и молекулярных продуктов окисления с их участием [8–11]. Так как одним из основных видов свободнорадикальных процессов, происходящих в живых объектах, является перекисное окисление липидов (ПОЛ), в недавних работах мы исследовали некоторые аспекты взаимосвязи ПОЛ с интенсивностью грибного свечения [6, 7]. В этих работах в условиях острого эксперимента нами было установлено, что у механически поврежденного мицелия N. nambi наблюдается значительное (на 2 порядка и более) увеличение уровня световой эмиссии. В то же время было показано, что концентрация конечного продукта ПОЛ – малонового диальдегида повышалась в мицелии только в первые часы после его механической травмы и снижалась в период максимального свечения [6]. При этом возрастание интенсивности световой эмиссии мицелия отмечалось на фоне значительного снижения в нем активности СОД и общей пероксидазной активности при незначительном повышении активности каталазы. Совокупность этих данных позволила высказать предположение, что свечение высших грибов, по-видимому, является дополнительным механизмом их защиты от повреждающего действия активных радикалов кислорода. Вероятно, в ходе реакции светоизлучения нейтрализуется избыток АФК, пул которых в грибе может значительно возрастать в условиях стресса, особенно на начальных стадиях его развития, например сразу после механического повреждения мицелия. В этих условиях нейтрализация избытка АФК за счет реакции светоизлучения будет препятствовать развитию ПОЛ или снижать вероятность его возникновения [6].
Хорошо известно, что ПОЛ – это сложный многостадийный процесс, в котором происходит образование и деградация липидных радикалов, что сопровождается формированием целого ряда молекулярных соединений: спирты, кетоны, альдегиды, эфиры и т. д. Среди продуктов ПОЛ выделяют первичные (диеновые конъюгаты), промежуточные (кетоны, альдегиды) и конечные (диальдегиды), которые образуют флуоресцирующие конъюгаты типа оснований Шиффа, различающиеся устойчивостью и биологической активностью. Исходя из предположения о защитной роли свечения грибов от повреждающего действия активных радикалов, важным являлось изучение содержания первичных и конечных продуктов ПОЛ в грибном мицелии в сравнении с уровнем его световой эмиссии в стрессовых условиях.
Цель исследования : изучение содержания диеновых конъюгатов и оснований Шиффа при разных уровнях свечения мицелия гриба Neonothopanus nambi в условиях стресса.
Материалы и методы исследования. В исследовании использовали образцы мицелия гриба N. nambi IBSO 3293 из Коллекции микроорганизмов (CCIBSO 836) ИБФ СО РАН, выращенные на жидкой питательной картофельно-сахарозной среде по разработанной нами ранее технологии [1]. Для экспериментов из полученного пленочного мицелия высекали диски диаметром 12 мм, которые помещали в свежую питательную картофельно-сахарозную среду (рН 6,2). Контрольные образцы мицелия инкубировали в питательной среде без каких-либо добавок. В качестве дополнительного стрессового фактора, который мог влиять на уровень световой эмиссии поврежденного мицелия, использовали закисление инкубационной среды. Для этого в питательную среду добавляли уксусную кислоту (до рН 5,0 и 4,0), после чего в нее помещали опытные образцы мицелия. В параллельных экспериментах в качестве эффектора, ингибирующего свечение, в питательную среду с образцами мицелия добавляли нейтрализованный до нейтрального значения рН раствор салициловой кислоты (СК) в конечной концентрации 0,5 мМ. Ранее нами было показано, что СК в такой концентрации подавляет свечение поврежденного мицелия N. nambi на порядок и более [7]. Контрольные и опытные образцы мицелия инкубировали при комнатной температуре, через каждые 30 мин оценивая интенсивность их свечения на люминометре Glomax 20/20 (Promega, USA). Уровень световой эмиссии выражали в относительных люминесцентных единицах (RLU), регистрируемых со скоростью 1 измерение в 1 с. При достижении максимального уровня свечения диски мицелия извлекали из питательной среды, замораживали, лиофилизовали и определяли вес сухой биомассы каждого образца. Содержание диеновых конъюгатов (ДК) в биомассе оценивали после экстракции из нее липидных компонентов смесью растворителей гептан-изопропанол с последующим разделением фаз [12]. Согласно методу, уровень ДК в фазах гептана и изопропанола может свидетельствовать об интенсивности перекисного окисления в биообразце нейтральных липидов и фосфолипидов соответственно. Содержание ДК в фазах определяли спектрофотометрически (UV-1800, Shimadzu, Japan) по величине их оптической плотности (OD) при длине волны 232 нм и выражали в единицах OD на 1 г сухой биомассы. Для количественной оценки содержания оснований Шиффа (ОШ) экстракцию липидных компонентов из биомассы проводили по методу [13], используя смесь растворителей хлороформ-метанол. Содержание ОШ в экстрактах определяли по величине их флуоресценции (Varian Cary Eclipse, USA), регистрируемой в диапазоне длин волн 400–600 нм, после возбуждения образцов облучением при длине волны 360 нм и выражали в относительных единицах максимальной световой эмиссии на 1 г сухой биомассы. Для сравнительной оценки содержание ДК и ОШ определяли также в образцах мицелия, которые не инкубировали. В этом случае диски после высечения из пленочного мицелия и оценки уровня их свечения сразу замораживали, лиофилизовали и проводили последующую экстракцию ДК и ОШ из сухой биомассы таким же образом, как это изложено выше.
Результаты исследования и их обсуждение. Как показали эксперименты (рис. 1), закисление питательной среды до значений рН 5,0 и 4,0 добавкой уксусной кислоты сопровождается значительным подавлением световой эмиссии поврежденного мицелия N. nambi в ходе его инкубации. Из представленных данных видно, что через 4 ч инкубации (максимальный уровень свечения образцов мицелия) при рН 5,0 наблюдается снижение интенсивности световой эмиссии гриба более чем на порядок (в 13.5 раз), по сравнению с контролем. При рН 4,0 свечение мицелия подавляется практически полностью – уровень регистрируемой световой эмиссии гриба через 4 ч инкубации составляет около 800 RLU (рис. 1). Для сравнения следует сказать, что уровень фонового шума измерительной системы (люмино-метр Glomax 20/20) составляет порядка 100 RLU. Точный механизм такого действия уксусной кислоты пока непонятен и требует дальнейшего изучения. С одной стороны, этот эффект, вероятно, мог бы объясняться неоптимальным значением рН среды для активности ферментов, обеспечивающих свечение гриба. Ранее было установлено [14], что оптимум функционирования ферментов люминесцентной системы, выделенной из гриба N. nambi, наблюдается при pH 7,4–7,6, а смещение pH среды в кислую или щелочную области приводит к снижению их активности. Однако можно пред- положить, что ингибирующий эффект уксусной кислоты связан с ее денатурирующим воздействием на белковые компоненты гриба. Известно, что данная кислота обладает липофильными свойствами и является более сильным денатурирующим агентом, например, в сравнении с минеральными кислотами при одинаковой концентрации ионов водорода [15]. В пользу этой версии свидетельствует тот факт, что в ходе инкубации контрольные образцы поврежденного мицелия N. nambi сохраняли жизнеспособность – через сутки гриб восстанавливал свою целостность и продолжал рост. В то же время закисление питательной среды добавкой уксусной кислоты до рН 4,0 приводило не только к практически полному ингибированию свечения образцов мицелия (см. рис. 1), но и полному подавлению их роста. В дополнение следует сказать, что добавка 0,5 мМ СК (раствор реагента нейтрализован до нейтрального рН) в питательную среду с образцами мицелия N. nambi также приводила к существенному подавлению их свечения (в 11,5 раз) (данные не приведены), что полностью согласуется с результатами наших предыдущих исследований [7].
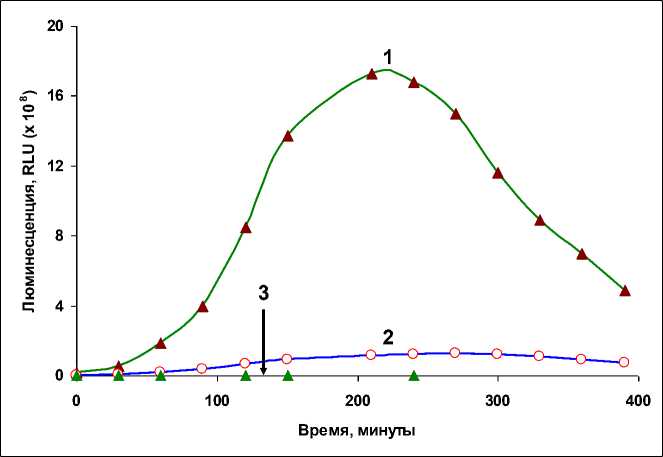
Рис. 1. Динамика и интенсивность свечения механически поврежденного мицелия N. nambi в ходе его инкубации в питательной среде: 1 – контроль (рН 6,2); 2, 3 – закисление питательной среды добавками уксусной кислоты до рН 5,0 и 4,0 соответственно
Поскольку у контрольных и опытных образцов мицелия максимальная интенсивность свечения регистрировалась через 4 ч инкубации
(см. рис. 1), содержание ДК и ОШ в их биомассе оценивали в это время. Совокупность полученных данных позволила выявить общую законо- мерность (рис. 2). При высоком уровне световой эмиссии образцов инкубируемого мицелия по сравнению с исходным уровнем их свечения (сразу после высечения дисков) в экстрактах из биомассы гриба регистрируется снижение уровня ДК как в фазе гептана, так и в фазе изопропанола. В то же время при практически полном подавлении свечения мицелия при рН 4,0, вызванном добавлением уксусной кислоты, наблюдается гораздо меньшее снижение содержания ДК в фазе изопропанола и некоторое повышение их содержания в фазе гептана. По- скольку более выраженные изменения в содержании ДК были выявлены в фазе изопропанола, можно предположить, что в поврежденном мицелии N. nambi перекисное окисление фосфолипидов идет интенсивнее, чем перекисное окисление нейтральных липидов (рис. 2). В целом результаты этого раздела работы позволяют говорить о том, что грибное свечение оказывает протекторный эффект при повреждающем воздействии активных радикалов на гриб в условиях стресса и препятствует развитию ПОЛ.
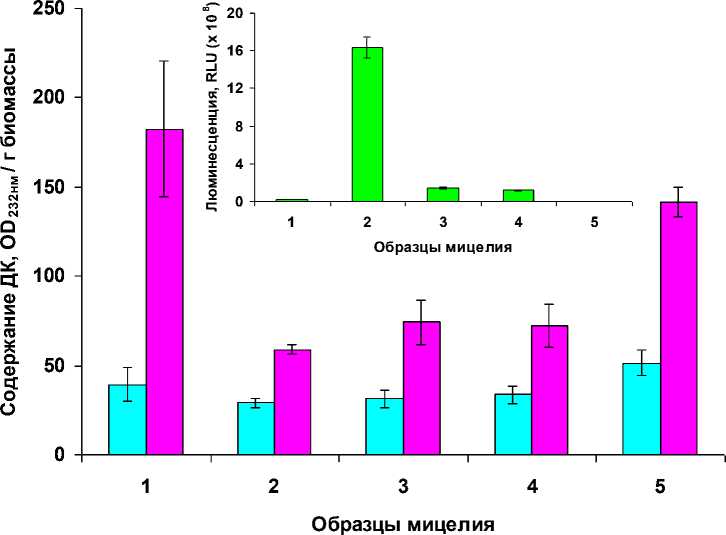
Рис. 2. Содержание ДК в экстрактах из биомассы мицелия N. nambi: фракция гептана (голубые столбцы), фракция изопропанола (малиновые столбцы). Образцы мицелия: 1 – без инкубации; 2–5 – после инкубации в течение 4 часов – контроль (питательная среда, рН 6,2), питательная среда с добавкой 0,5 мМ СК, закисление питательной среды до рН 5,0 и 4,0 добавкой уксусной кислоты (на вставке представлена интенсивность свечения указанных образцов мицелия)
В экспериментах было показано, что изменения содержания ОШ в образцах поврежденного мицелия N. nambi при их инкубации имеют такую же направленность, как и изменения содержания ДК (см. выше). Это следует из данных уровней флуоресценции хлороформ-метанольных экстрактов из образцов грибной биомассы (рис. 3). Видно, что в контрольных образцах мицелия, обладающих максимальным свечением через 4 ч инкубации, регистрируется значительно мень- шее содержание ОШ по сравнению с их содержанием в исходном поврежденном мицелии, имеющем невысокий уровень световой эмиссии. В образцах мицелия, проинкубированных 4 ч в присутствии СК (0,5 мМ) и уксусной кислоты (закисление среды до рН 5,0) и обладающих гораздо меньшим уровнем световой эмиссии по отношению к контролю (рис. 2, вставка), отмечается большее содержание ОШ. И, наконец, при практически полном подавлении свечения после закисления питательной среды до рН 4,0 добавкой уксусной кислоты в биомассе мицелия через 4 ч инкубации отмечается самый высокий уровень содержания ОШ среди исследованных опытных образцов мицелия (см. рис. 3). Совокупность данных этого раздела исследований также свидетельствует в пользу защитной роли грибного свечения, нейтрализующего в ходе реакции излучения избыточный пул активных радикалов кислорода, которые могут значительно возрастать в грибе в стрессовых условиях и тем самым препятствовать дальнейшему развитию ПОЛ [6].
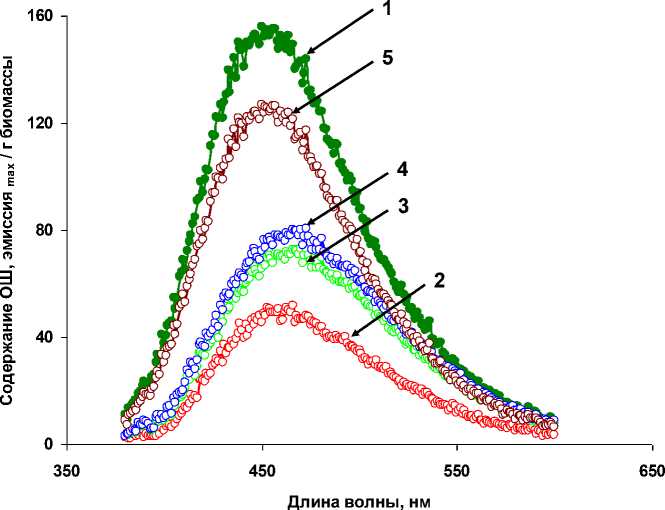
Рис. 3. Интенсивность флуоресценции хлороформ-метанольных экстрактов из образцов мицелия N. nambi, отражающая содержание ОШ в грибной биомассе. Для экстракции использованы образцы мицелия: 1 – без инкубации; 2–5 – после инкубации в течение 4 ч – контроль (питательная среда, рН 6,2), питательная среда с добавкой 0,5 мМ СК, закисление питательной среды до рН 5,0 и 4,0 добавкой уксусной кислоты
Заключение . Таким образом, проведенная оценка интенсивностей световой эмиссии образов механически поврежденного мицелия гриба N. nambi при разных условиях их инкубации в сопоставлении с полученными данными содержания в грибной биомассе первичных (ДК) и конечных (ОШ) продуктов ПОЛ указывает на взаимосвязь процессов свечения и свободнорадикального окисления. Исследованием установлено, что в условиях стресса (механическое повреждение, инкубация в присутствии ингибитора свечения (СК) и при закислении среды добавлением уксусной кислоты) повышение уровня световой эмиссии мицелия сопровождается снижением содержания в биомассе гриба первичных и конечных продуктов ПОЛ.
Совокупность этих данных свидетельствует в пользу высказанной нами ранее гипотезы о защитной функции свечения высших грибов от негативного воздействия активных радикалов кислорода, пул которых может значительно возрастать в грибе при стрессе.
Нейтрализация избытка кислородных радикалов в ходе реакции светоизлучения будет оказывать протекторный эффект и препятствовать развитию в грибной биомассе процессов свободнорадикального окисления, в частности развитию ПОЛ. Пока неясен точный механизм наблюдаемого в экспериментах снижения содержания ДК и ОШ в инкубируемых контрольных и опытных образцах мицелия по сравнению с их содержанием в исходном поврежденном мице- лии. Полученные результаты не позволяют также объяснить, могут ли данные продукты ПОЛ утилизироваться (прямо или опосредованно) в процессе грибного свечения или вовлекаться в метаболические циклы гриба. Выяснение этих вопросов требует дальнейшего изучения.
Список литературы Содержание диеновых конъюгатов и оснований шиффа в мицелии гриба Neonothopanus nambi при разных уровнях его свечения в условиях стресса
- Бондарь В.С., Пузырь А.П., Пуртов К.В. и др. О люминесцентной системе светящегося гриба Neonothopanus nambi//ДАН. -2011. -Т. 438. -№ 5. -С. 705-707.
- Bondar V.S., Shimomura O., Gitelson J.I. Luminescence of higher mushrooms//J. Sib. Fed. Univ. Biol. -2012. -V. 5. -№. 4. -P. 331-351
- Бондарь В.С., Родичева Э.К., Медведева С.Е. и др. О механизме свечения гриба Neonothopanus nambi//ДАН. -2013. -Т. 449. -№ 2. -С. 223-227
- Могильная О.А., Ронжин Н.О., Медведева С.Е. и др. Общая пероксидазная и каталазная активности светящихся базидиомицетов Armillaria borealis и Neonothopanus nambi в сравнении с уровнем световой эмиссии//Прикладная биохимия и микробиология. -2015. -Т. 51. -№ 4. -С. 395-401
- Mogilnaya O.A., Ronzhin N.O., Bondar V.S. Comparative evaluation of total peroxidase and catalase activities during light emission of luminous fungus Neonothopanus nambi//Mycosphere. -2016. -V. 7. -№ 4. -P. 499-510
- Тюлькова Н.А., Медведева С.Е., Бондарь В.С. Сравнительная оценка интенсивностей перекисного окисления липидов и свечения гриба Neonothopanus nambi//Вестн. Крас-ГАУ. -2016. -№ 1. -С. 21-28.
- Тюлькова Н.А., Бондарь В.С. Активность ферментов метаболизма активных форм кислорода и уровень световой эмиссии мицелия гриба Neonothopanus nambi при действии салициловой кислоты//Вестн. Крас-ГАУ. -2017. -№ 2. -С. 155-165.
- Владимиров Ю.А., Арчаков А.И. Перекисное окисление липидов в биологических мембранах. -М.: Наука, 1972. -252 c.
- Феофилова Е.П., Бурлакова Е.Б., Кузнецова Л.С. Значение реакций свободнорадикального окисления в регуляции роста и липидообразования эукариотных и прокариотных организмов//Прикл. биохимия и микробиология. -1987. -Т. 23. -Вып. 1. -С. 3-13.
- Колупаев Ю.Е. Активные формы кислорода в растениях при действии стрессоров: образование и возможные функции//Вестн. Харьковского национального аграр. ун-та. Сер. Биология. -2007. -Вып. 3 (12). -С. 6-26.
- Загоскина Н.В., Назаренко Л.В. Активные формы кислорода и антиоксидантная система растений//Вестн. Москов. городского пед. ун-та. Сер. Естественные науки. -2016. -№ 2 (22). -C. 9-23.
- Хышиктуев Б.С., Хышиктуева Н.А., Иванов В.Н. Методы определения продуктов перекисного окисления липидов в конденсате выдыхаемого воздуха и их клиническое значение//Клиническая лабораторная диагностика. -1996. -№ 3. -С.13-15.
- Fletcher B.L., Dillard C.L., Tappel A.L. Fluorescent products of lipid peroxidation of mitohondria and microsomes//Analyt. Biochem. -1973. -№ 52 (1). -P. 1-9.
- Бондарь В.С., Пузырь А.П., Пуртов К.В. и др. Выделение люминесцентной системы из светящегося гриба Neonothopanus nambi//ДАН. -2014. -Т. 455. -№ 3. -С. 346-348
- Reynolds A.E. The mode of action of acetic acid on bacteria//Diss. Abstr. -1975. -№ 35. -P. 4935-4936


