Сохранение и рациональное использование генетических ресурсов яка (Bos mutus)
Автор: Багиров В.А., Гладырь Е.А., Эрнст Л.К., Кленовицкий П.М., Зиновьева Н.А., Насибов Ш.Н.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Научная школа академика Л.К. Эрнста: исследования и перспективы (к 80-летию ученого)
Статья в выпуске: 2 т.44, 2009 года.
Бесплатный доступ
Предложена оригинальная технология криоконсервации эпидидимальных и тестикулярных сперматозоидов яка, с использованием которой создан криобанк семени кабардино-балкарской, памирской и алтайской популяций яков. Получены гибридные животные для выведения новых селекционных форм. Дана цитогенетическая и молекулярно-генетическая характеристика яков из разных региональных популяций.
Гибриды, криобанк семени, криоконсервация, молекулярно-генетический, популяция, цитогенетический, эпидидимальные сперматозоиды, яки
Короткий адрес: https://sciup.org/142133236
IDR: 142133236 | УДК: 636.293.3:636.082:636.082.4.53
Текст научной статьи Сохранение и рациональное использование генетических ресурсов яка (Bos mutus)
Традиционные приемы воспроизводства не обеспечивают эффективную реализацию генетического потенциала малочисленных и исчезающих видов. Сохранять и рационально использовать эти генетические ресурсы, восстанавливать малочисленные виды, породы, создавать новые селекционные формы посредством отдаленной гибридизации животных позволяют современные биотехнологические методы (3, 4).
В 1947 году В.К. Милованов, И.И. Соколовская и И.В. Смирнов открыли возможность длительно сохранять семя животных в состоянии глубокого охлаждения, что стало основой для создания криобанка генетических ресурсов высокопродуктивных, редких, уникальных и исчезающих видов животных (5), а в 1970-е годы Б.Н. Вепринцев стал инициатором создания генетических криобанков и использования методов биологии развития для сохранения редких и исчезающих видов животных.
Нашей целью была разработка технологии криоконсервации сперматозоидов яка и проведение молекулярно- и цитогенетических исследований образцов для создания криобанка семени животных из региональных популяций.
Методика . Исследования выполняли в 2002-2007 годах в экспери-
Работа выполнена при поддержке РФФИ (проект ¹ 08-04-13701).
ментальном хозяйстве Всероссийского НИИ животноводства (ВНИИЖ) «Кленово-Чегодаево», в с. Бизинги (Черекский р-н, Кабардино-Балкарская Республика), Горно-Бадахшанской автономной области (Республика Таджикистан), пос. Кош-агач (Республика Алтай). Опыты по сохранению генофонда проводили на яках памирской, кабардино-балкарской и алтайской популяций. Для молекулярно-генетического анализа генотипа изучали образцы ДНК у 37 животных из монгольской (Я-М, n = 31), алтайской (Я-А, n = 2), памирской (Я-П, n = 2) и кабардино-балкарской (Я-К, n = 2) популяций. Для сравнения частоты встречаемости микросателлитных маркеров и оценки вариабельности в исследуемых популяциях использовали ДНК яков из Бутана (исследования в рамках проекта Institut National de la Recherche Agronomique — INRA CaDBase) (Я-Б, n = 39).
ДНК выделяли из образцов ткани (ушные выщипы). Использовали колонки NexttecTM (Германия) и набор реагентов DIAtomTM DNA Prep100 (ООО «Биоком», Россия) в соответствии с рекомендациями фирм-изготовителей. Анализ ДНК и постановку полимеразной цепной реакции (ПЦР) выполняли согласно описанию (6). Выбор микросателлитных локусов осуществляли в соответствии с рекомендациями Международного общества генетики животных ( ISAG). Электрофоретическое разделение фрагментов ДНК методом капиллярного электрофореза проводили на приборе ABI 3130xl Genetic Analyzer («Applied Biosystems», США). Для идентификации аллелей исследованных микросателлитных локусов использовали программу ABI GeneMapper v. 4.0. Данные о выявленных у каждого животного аллелях суммировали в электронной таблице Microsoft Excel. Полученная матрица генотипов служила основой для статистической обработки результатов.
Цитогенетические исследования выполняли в культуре периферических лимфоцитов яка, крупного рогатого скота и их гибридов при стимуляции клеток конконавалином А. Препараты хромосом получали по общепринятой методике (7) с оригинальными модификациями (8). Для документирования данных и последующего изучения кариотипа применяли цифровую видеокамеру КС-583С с пакетом программ, совместимых с Windows. Обработку изображений проводили по описанной нами методике (9).
При подготовке эпидидимальных сперматозоидов животных использовали фракционное выделение спермы (оригинальный метод, предложенный нами ранее) (10). Процедура получения и криоконсервации семени включала: отбор семенников; препарирование эпидидимиса, извлечение содержимого эпидидимиса, разделение сперматозоидов на фракции, разбавление образцов семени криопротективной средой, эквилибрацию семени и собственно криоконсервацию. Пробирки с разбавленным семенем, которые находились в поролоновом теплоизолирующем штативе, помещали на 4 ч в холодильник (+4 ° С), затем в воду со льдом (0 ° С). Семя замораживали на охлажденной в жидком азоте фторопластовой пластине (11).
Качественные и количественные показатели семени определяли по общепринятой методике (5). После оттаивания визуально оценивали подвижность и жизнеспособность сперматозоидов (при +37 ° С каждые 2 ч до полной гибели), используя микроскоп с нагревательным столиком Пакена-са. Морфологическую сохранность акросом контролировали с помощью видеокамеры и компьютерной программы Image Scope (ООО «Системы для микроскопии и анализа», Россия) (3).
Статистическую обработку данных проводили по стандартным методикам (12-14), применяя программное обеспечение MS Excel, MSA_WIN v. 2.65, GenAlEx 6.0, Phylip.
Результаты. В экспедициях в Кабардино-Балкарию, на Памир и Ал- тай было выделено биологически полноценное эпидидимальное семя от 11 яков и выполнена его криоконсервация. Подвижность сперматозоидов после замораживания—оттаивания составила 35 %. Отметим, что первые попытки получения спермы от яков были предприняты во второй половине ХХ века (исследования, выполненные В.В. Ельчаниновым в Киргизии в 1962 году), однако тогда эпидидимальные сперматозоиды не подвергались криоконсервации, а опыты Е. Загдсурена (1980) по получению спермы от яков на искусственную вагину с последующей криоконсервацией и использованием при осеменении коров не дали результата.
Выделенные нами сперматозоиды яка имели следующие морфометрические характеристики: длина общая — 72,90±0,24, длина головки — 8,71±0,06, ширина головки — 4,67±0,04 мкм, площадь головки — 33,70±1,68 мкм2, коэффициент округлости головки — 1,220±0,001. При цитологическом исследовании площадь ядра сперматозоидов составила 107,2; средняя яркость — 67,2; средняя плотность — 187,8; количество ДНК — 20,1 усл. ед.


Рис. 1. Гибридное потомство, полученное при осеменении коров черно-пестрой породы эпидиди-

мальным семенем яка после криоконсервации.
Замороженное эпидидимальное семя яков сохраняло биологиче- скую полноценность и оказалось пригодным для плодотворного искусст- венного осеменения: от коров черно-пестрой породы с использованием такого семени получили восемь гибридных потомков — шесть телочек и двух бычков (рис. 1).
0 Illi ^ ДО ДО 11Я
1 2 3 4 56
fill М fill fid fid DA
7 8 9 10 1112
Afi flfl flfl flfl flflM
13 14 15 16 1718
Л 6 0 0 л6 i* 0 r * 6 a
19 20 21 22 2324
Oft ftfl dd Aft OA
25 26 27 28 29XY
Рис. 2. Кариотип самца яка ( Bos mutus ). Предварительная обработка 5 ′ -бром-дезоксиуридином и бромистым этидием. Окраска по Романовскому-Гимза, увеличение ½100.
Изучение воспроизводительной функции у яков разного возраста, получение и криоконсервация семени, создание его банка — один из надежных способов сохранения генетических ресурсов вида. Это необходимо для улучшения племенных качеств одомашненных яков и их использования для отдаленной гибридизации, позволяющей обогащать генотип материнских пород комплексом генов, контролирующих присущие якам желательные свойства. Для решения этих задач требуется углубленное изучение биологических (биотехнологических, физиологических, генетических) особенностей исходных видов и их гибридов.
Цитогенетический анализ показал, что по числу и морфологии хромосом кариотипы яка и крупного рогатого скота Bos taurus идентичны: в них имеется по 29 пар акроцентрических аутосом, а X- и Y-хромосомы по морфологии и размеру сходны (рис. 2). Существенных морфологических раз-
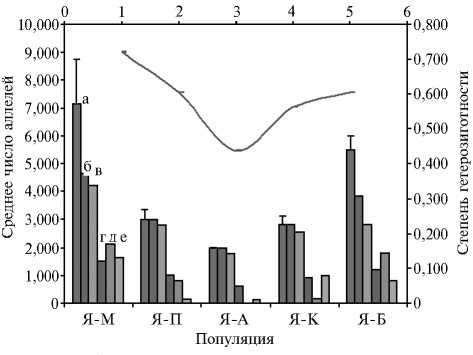
Рис. 3. Характеристика аллелофонда изучаемых популяций яка по среднему числу аллелей шести микросателлитных маркерных локусов (BM1824, ETH10, ETH225, TGLA122, TGLA126 и TGLA227) крупного рогатого скота (диаграмма) и степени гетерозиготности популяции (график): а, б, в, г, д, е — соответственно среднее число аллелей, среднее число аллелей с частотой более 5 %, число эффективных аллелей, информационный индекс, число приватных аллелей, число общих аллелей с частотой до 50 %. Описание популяций ЯМ, Я-П, Я-А, Я-К, Я-Б см. в разделе «Методика».
личий между хромосомами крупного рогатого скота, яка и их гибридов не обнаружили. Сравнение характера дифференциального окрашивания гомео-логичных хромосом выявило высокую степень их сходства. В то же время следует отметить, что идеальных методик хромосомного анализа не существует, поэтому утверждать, что у разных видов рода Bos хромосомы полностью идентичны, преждевременно, тем более что у сельскохозяйственных видов животных макро- и микроструктура таких сложных объектов, как хромосомы, мало изучена.
Среднее число аллелей на локус и степень гетерозиготности в исследованных популяциях яков
|
Популяция Показатель BM1824 |
ETH10 |
ETH225 |
TGLA122 TGLA126 TGLA227 |
Среднее |
||||
|
Я-М |
N |
31 |
31 |
31 |
31 |
31 |
31 |
|
|
Na |
6 |
6 |
5 |
14 |
9 |
3 |
7,167 |
|
|
Ho |
0,419 |
0,484 |
0,645 |
0,742 |
0,581 |
0,710 |
0,597 |
|
|
He |
0,709 |
0,684 |
0,639 |
0,881 |
0,804 |
0,609 |
0,721 |
|
|
F |
0,408 |
0,292 |
- 0,010 |
0,158 |
0,278 |
- 0,165 |
0,160 |
|
|
Я-П |
N |
2 |
2 |
2 |
2 |
2 |
2 |
|
|
Na |
4 |
2 |
3 |
3 |
2 |
4 |
3,000 |
|
|
Ho |
1,000 |
0,500 |
0,500 |
1,000 |
1,000 |
1,000 |
0,833 |
|
|
He |
0,750 |
0,375 |
0,625 |
0,625 |
0,500 |
0,750 |
0,604 |
|
|
F |
- 0,333 |
- 0,333 |
0,200 |
- 0,600 |
- 1,000 |
- 0,333 |
- 0,400 |
|
|
Я-А |
N |
2 |
2 |
2 |
2 |
2 |
2 |
|
|
Na |
2 |
2 |
2 |
2 |
2 |
2 |
12,000 |
|
|
Ho |
1,000 |
0,500 |
0,500 |
1,000 |
1,000 |
0,500 |
0,750 |
|
|
He |
0,500 |
0,375 |
0,375 |
0,500 |
0,500 |
0,375 |
0,438 |
|
|
F |
- 1,000 |
- 0,333 |
- 0,333 |
- 1,000 |
- 1,000 |
- 0,333 |
- 0,667 |
|
|
Я-К |
N |
2 |
2 |
2 |
2 |
2 |
2 |
|
|
Na |
2 |
3 |
3 |
4 |
2 |
3 |
2,833 |
|
|
Ho |
0,500 |
0,500 |
1,000 |
1,000 |
0,500 |
0,500 |
0,667 |
|
|
He |
0,375 |
0,625 |
0,625 |
0,750 |
0,375 |
0,625 |
0,563 |
|
|
F |
- 0,333 |
0,200 |
- 0,600 |
- 0,333 |
- 0,333 |
0,200 |
- 0,200 |
|
|
Я-Б |
N |
39 |
39 |
39 |
39 |
39 |
39 |
|
|
Na |
5 |
5 |
5 |
8 |
5 |
5 |
5,5 |
|
|
Ho |
0,590 |
0,436 |
0,615 |
0,487 |
0,590 |
0,385 |
0,517 |
|
|
He |
0,524 |
0,451 |
0,705 |
0,801 |
0,643 |
0,493 |
0,603 |
|
|
F |
- 0,125 |
0,034 |
0,127 |
0,392 |
0,082 |
0,221 |
0,122 |
|
П р и м е ч а н и е. Описание популяций см. в разделе «Методика». N, Na, Ho, He и F — соответственно среднее число исследованных животных, среднее число аллелей в популяции по маркеру, наблюдаемый уровень гетерозиготности, ожидаемый уровень гетерозиготности и индекс фиксации.
В результате молекулярно-генетического исследования полиморфизма по шести микросателлитным маркерам крупного рогатого скота в разных популяциях яков были обнаружены существенные различия по степени гетерозиготности, которая варьировала от 43,8 % у животных из алтайской популяции до 72,1 % у особей из Монголии, а в кабардино-балкарской популяции составляла 56,3 %. Яки на Памире и в Бутане характеризовались сходной степенью гетерозиготности (соответственно 60,4 и
60,3 %) (рис. 3). Максимальное число аллелей, равное 44, диагностировали в монгольской популяции. Отметим, что степень информативности маркеров варьировала (от 2 аллелей на локус в малых выборках до 14 для локуса TGLA122 в популяции яков в Монголии).
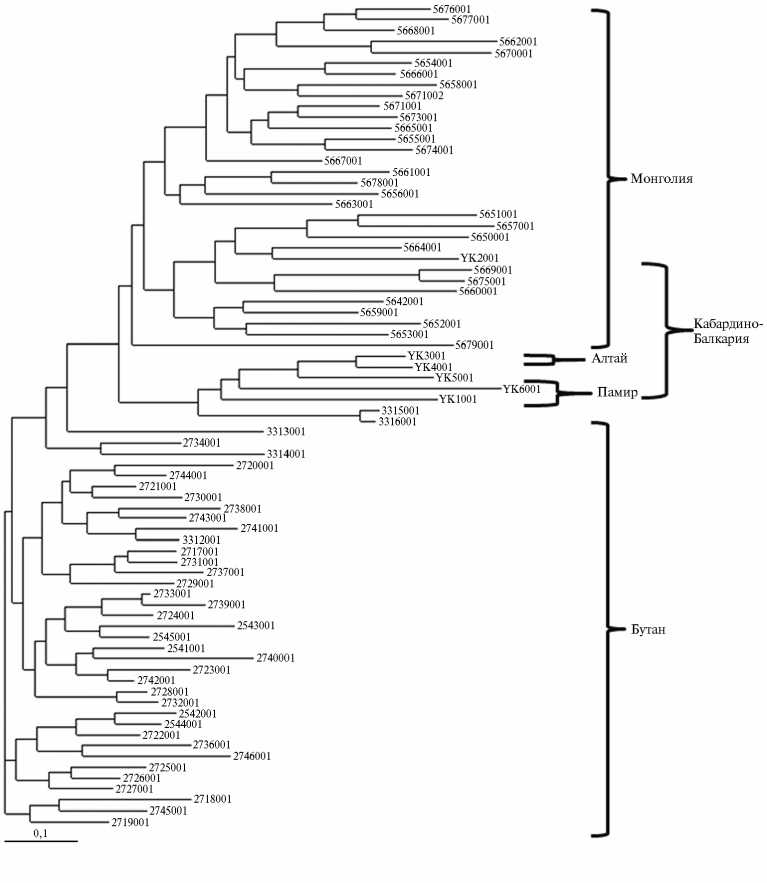
Рис. 4. Дендрограмма, характеризующая филогенетические различия изучаемых популяций яков из разных регионов (Бутан, Монголия, Памир, Алтай, Кабардино-Балкария) .
Проведенный анализ выявил приватные аллели, свойственные только одной из популяций яков. Максимальное число приватных аллелей — 6, 5 и 4 (соответственно для микросателлитных локусов TGLA122, TGLA126 и ETH225) обнаружили у яков из Монголии и Бутана, 2 приватных аллеля (290 – ETH10 и 113 – TGLA126) встречались с частотой соответственно 50,0 и 53,8 %. Этот факт свидетельствует о маркерной роли перечисленных аллелей в идентификации ареальной и популяционной принадлежности животных.
Мы установили, что только в двух популяциях (монгольской и бутанской) ожидаемый уровень гетерозиготности оказался выше фактического; в остальных наблюдаемая степень гетерозиготности существенно превосходила расчетные значения.
Кластерный анализ показал, что животные, которых разводят в Монголии и Бутане, образуют хорошо выраженные обособленные генетические группы. Изучение филогенетических связей яков в исследованных ареалах также подтвердило достаточную генетическую консолидированность особей алтайской и памирской популяций, в то время как животные, обитающие в Кабардино-Балкарии, не попали в свою группу (рис. 4). По всей видимости, это стало следствием их вторичной интродукции в регион из Алтайского края и Средней Азии.
Таким образом, разработана технология криоконсервации эпидидимальных и тестикулярных сперматозоидов, с использованием которой создан криобанк семени яков кабардино-балкарской, памирской и алтайской популяций. Получение спермы, ее криоконсервация и создание банка семени наряду с изучением генетических характеристик открывает новые перспективы в сохранении и рациональном использовании генофонда яков для создания новых селекционных форм на основе отдаленной гибридизации.
Л И Т Е Р А Т У Р А
-
1. W h i t e W.T. e.a. Yaks and yak hybrids in Alaska. J. Hered., 1946, 12: 355-358.
-
2. Э р н с т Л.К. Научные основы гибридизации. Животноводство, 1980, 9: 28-30.
-
3. Б а г и р о в В.А. Биотехнологические аспекты сохранения генетических ресурсов животных. Автореф. докт. дис. Дубровицы, 2004.
-
4. Э р н с т Л.К. Проблемы селекции и биотехнологии сельскохозяйственных животных. М., 1995.
-
5. М и л о в а н о в В.К. Биология воспроизведения и искусственное осеменение животных. М., 1962.
-
6. З и н о в ь е в а Н.А., П о п о в А.П., Э р н с т Л.К. и др. Методические рекомендации по использованию метода полимеразной цепной реакции в животноводстве. Дубро-вицы, 1998.
-
7. Г р а ф о д а т с к и й А.С., Р а д ж а б л и С.И. Хромосомы сельскохозяйственных и лабораторных животных. Атлас. Новосибирск, 1988.
-
8. К л е н о в и ц к и й П.М., Н и к и ш о в А.А., И о л ч и е в Б.С. и др. Хромосомы одомашненных животных и родственных им видов. Дубровицы, 2002.
-
9. К л е н о в и ц к и й П.М., Б а г и р о в В.А., З и н о в ь е в а Н.А. и др. Цитогенетика животных. М., 2007.
-
10. Б а г и р о в В.А., Э р н с т Л.К., К л е н о в и ц к и й П.М. и др. Сохранение генетических ресурсов редких, исчезающих и уникальных видов животных. Цитология, 2004, 46(9): 767-768.
-
11. Ю щ е н к о Н.П., С е м а к о в В.Г., Л е в и н К.Л. Замораживание спермы быков в гранулах без применения сухого льда. Молочное и мясное скотоводство, 1968, 5: 36-37.
-
12. М е р к у р ь е в а Е.К. Биометрия в селекции и генетике сельскохозяйственных животных. М., 1979.
-
13. Ж и в о т о в с к и й Л.А. Популяционная биометрия. М., 1991.
-
14. В е й р Б. Анализ генетических данных. Пер. с англ. Д.В. Зайкина, А.И. Пудовкина, А.Н. Татаренкова. М., 1995.
ГНУ Всероссийский НИИ животноводства Россельхозакадемии ,


