Сохранность лейкоцитов в условиях криоанабиоза
Автор: Сведенцов Е.П., Щеглова О.О., Туманова Т.В., Соломина О.н
Журнал: Журнал стресс-физиологии и биохимии @jspb
Рубрика: Original article
Статья в выпуске: 1 т.2, 2006 года.
Бесплатный доступ
Для реализации потребности в лейкоцитах перед клиницистами остро встает проблема сохранения данных клеток длительное время в функционально полноценном состоянии, что возможно в условиях глубокого криоанабиоза (-196°С). Данный способ консервирования по ряду причин не доступен для широкого применения. Поэтому целью работы явилась разработка эффективного, доступного и экономичного способа сохранения лейкоцитов при умеренно-низкой температуре -40°С. Показано, что применение данного способа позволяет сохранять ядерные клетки крови в функционально полноценном состоянии до 30 суток
Лейкоциты, экспоненциальная программа замораживания, криоанабиоз, криоконсервант
Короткий адрес: https://sciup.org/14323450
IDR: 14323450
Текст обзорной статьи Сохранность лейкоцитов в условиях криоанабиоза
Для реализации потребности в лейкоцитах перед клиницистами остро встает проблема сохранения данных клеток длительное время в функционально полноценном состоянии, что возможно в условиях глубокого криоанабиоза (-1960С). Данный способ консервирования по ряду причин не доступен для широкого применения. Поэтому целью работы явилась разработка эффективного, доступного и экономичного способа сохранения лейкоцитов при умеренно-низкой температуре -400С. Показано, что применение данного способа позволяет сохранять ядерные клетки крови в функционально полноценном состоянии до 30 суток.
В настоящее время в связи с расширением показаний к применению концентратов лейкоцитов (лейкопения, гипо- и апластические состояния кроветворения, тяжелый сепсис и др.) возникла проблема создания их запасов. На протяжении многих лет ряд ученых (Пушкарь Н.С. и др., 1978; Аграненко В.А. и др., 1982) ведет поиск оптимальных методов замораживания и длительного хранения лейкоцитов. Немногочисленные данные литературы (Махатадзе И.К. и др., 1975; Гордиенко Е.А., Пушкарь Н.С., 1994) свидетельствуют о том, что в настоящее время единственным эффективным методом долгосрочного хранения гранулоцитов является их замораживание при ультранизкой ( –1960С) температуре.
Сохранение жизнеспособности лейкоцитов крови при положительных температурах встречает значительные трудности в связи с быстрым затуханием энергетического обмена, что в свою очередь связано с более сложной внутренней структурой клеток. Так, например, мембраны гранул лейкоцитов весьма чувствительны к любого рода воздействиям (изменению рН, температуры среды и т.д.) и при нарушении их целостности, содержащиеся в гранулах гидролитические ферменты (фагоцитин, лизоцин), выходят в цитоплазму клетки, вызывая ее гибель.
Накопленный опыт по хранению ядерных клеток крови свидетельствует о том, что продлить жизнеспособность лейкоцитов в условиях положительных температур, т.е. при +40С возможно до 24 часов (Заривчатский М.Ф., 1995), при температуре от 0 до –40С в течение 48 часов (Белоус А.М., Грищенко В.И., 1994), при низкой температуре (-800С) - 12 месяцев (Утемов С.В. и др., 1999; Сведенцов Е.П. и др., 2001), при ультранизкой (–1960С) - в среднем до 20 месяцев (Аграненко В.А. и др., 1982). Следует отметить, что существующие методы замораживания до -196°С и хранения при данной температуре требуют применения дорогостоящего оборудования, жидкого азота и обслуживания высококвалифицированного персонала, что делает технологию криоконсервирования сложной, громоздкой и экономически неэффективной и не позволяет вводить ее в широкую практику. Поэтому весьма актуальным является создание простого, эффективного и экономичного метода криоконсервирования лейкоцитов, но без использования жидкоазотной технологии. Приоритетность данной темы исследования обусловлена особенно тем, что в доступной отечественной и зарубежной литературе сведений о методах, позволяющих сохранить функцию лейкоцитов, в том числе гранулоцитов, при умеренно-низкой (-400 С) температуре не имеется. На основании выше указанного была сформулирована следующая цель исследования: разработать эффективный, доступный и экономичный способ сохранения лейкоцитов при умеренно-низкой температуре (400С).
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования служил концентрат лейкоцитов (ЛК), выделенный из цельной донорской крови при цитаферезе. Полученное количество ЛК в среднем составляло 21,27±5,3 мл. Смешивание ЛК с криоконсервантом, включающим в себя криопротектор гексаметиленбистетраоксиэтилмочевину (ГМБТОЭМ), антигипоксант фумарат натрия и лимонную кислоту (Патент на изобретение №2184449), производили в соотношении 1:1 и эквилибрировали при комнатной температуре в течение 20 минут. После этого клеточная взвесь подвергалась замораживанию по экспоненциальной программе до –400С. Для этого подготовленный биообъект погружали в заполненную хладоносителем (96% этиловым спиртом) 4-литровую ванну камеры электроморозильника «Криостат», охлажденную до -28оС. После 18 минут экспозиции в данной камере биоматериал переносили в электроморозильник с температурой -400С для дальнейшего замораживания и хранения.
Регистрацию температуры замораживания осуществляли с помощью прибора ГСП – 04, датчик которого был установлен в одном из контейнеров с имитатором – криоконсервантом с конечной концентрацией его ингредиентов, как при смешивании с ЛК. При температуре –400С биообъект с предложенным криоконсервантом хранили 1 и 30 суток. Быстрое размораживание ЛК производили в 20-литровой водяной ванне при температуре +380С в течение 45-60 сек (в зависимости от объема ЛК) при интенсивном покачивании контейнера (3-4 раза в секунду) для предотвращения процессов рекристаллизации до температуры биообъекта +20С++40С.
Изучение функциональных свойств лейкоцитов осуществляли до введения в холодовой анабиоз и после выхода из него по общепринятым лабораторным методикам: определение эозинорезистентности лейкоцитов (Shreck R., 1936), изучение фагоцитарной активности нейтрофилов (Потапова С.Г. и др., 1977), проведение оценки окислительновосстановительного метаболизма нейтрофилов по НСТ-тесту (Гольдберг Е.Д. и др., 1992), изучение функционального состояния нейтрофилов с помощью лизосомально-катионного теста (Славинский А.А., Никитина Г.В., 1999), оценка содержания Т- и В-лимфоцитов в ЛК с помощью моноклональных антител в непрямом иммунофлуоресцентном тесте (Кондратьева И.А., Ярилин А.А., 2004).
Результаты исследования (всего 456 наблюдений), обработаны методами параметрической статистики; результаты выражали в виде М±о, а различия оценивали по критерию Стьюдента (Гланц С., 1998); их считали достоверными при p<0,05.
РЕЗУЛЬТАТЫ
Определение эозинорезистентности лейкоцитов показало, что после размораживания через 1 и 30 суток холодового анабиоза наблюдалось достоверное (р<0,05) снижение уровня клеток с сохраненным свойством избирательной проницаемости мембраны. Относительные данные свидетельствуют о том, что после 30 суточного хранения количество жизнеспособных лейкоцитов было достоверно (р<0,05) ниже – 70,1±14,9%, чем после хранения в течение 1 суток – 84,3±6,6%.
Изучение фагоцитарной активности нейтрофилов (процентное отношение фагоцитирующих клеток к общему числу сосчитанных) показало (табл.1, рис.1, 2), что образование фагосом, содержащих поглощенные частицы латекса, наблюдалось в течение 1 и 30 суток хранения биообъекта в условиях холодового анабиоза (–400С) без достоверного отличия как от исходного уровня, так и указанных сроков хранения. Однако прослеживалась тенденция к снижению фагоцитарной активности к 30 суткам.
Процент активированных нейтрофилов, т.е. содержащих диформазан, достоверно (p<0,05) увеличивался после размораживания (табл.1), что, согласно данным литературы (Granfeldt D. et al., 2002; Зинкин В.Ю., Годков М.А., 2004), отражает проявление респираторного взрыва нейтрофилов. Спустя сутки хранения этот показатель возрастал в 3,1 раза, после 30 суток хранения рост этого показателя был более выраженным (p<0,05) – 4,3 раза.
Определение содержания соединений, обеспечивающих микробицидность нейтрофилов без участия кислорода с помощью лизосомально-катионного теста показало (табл.1), что средний цитохимический коэффициент (СЦК) достоверно (p<0,05) снижался после размораживания через все сроки хранения. Кроме того, данный показатель после 30 суточного хранения в условиях холодового стресса оказался достоверно (p<0,05) ниже в отличие от хранения в течение 1 суток.
При умеренно-низкой температуре -40оС после размораживания исследуемой биосреды через одни сутки наблюдалось достоверное (p<0,05) увеличение в ней численности Т-лимфоцитов и снижение В-лимфоцитов (табл.2) в сравнении с исходным (до замораживания) уровнем.
Таблица 1 Функциональное состояние нейтрофилов, перенесших холодовой анабиоз (-40оС) разной длительности
|
Сроки Хранения (сутки) |
Количество фагацитарно активных НФ |
Количество диформазанположительн ых НФ |
СЦК по ЛКТ |
|||||
|
до замор. |
после размор. |
до замор. |
после размор. |
до замор. |
после размор. |
|||
|
в % к общему числу НФ |
в % к общему числу НФ |
в % к исх. уровню |
в % к общему числу НФ |
в % к общему числу НФ |
В у.е. |
В у.е. |
в % к исх. уровню |
|
|
1 |
41,9±4,7 |
39,8±3,6 |
95,9±4,5 |
21,75±3,9 |
67,33±6,4* |
2,3±0,5 |
1,6±0,3* |
81,8±12,4 |
|
30 |
46,7±5,2 |
43,0±6,8 |
92,2±6,4 |
22,33±1,9 |
96,80±7,2*# |
1,1±0,1# |
1,1±0,2# |
102,0±9,1# |
Примечание: НФ – нейтрофилы, ЛКТ – лизосомально-катионный тест, СЦК – средний цитохимический коэффициент; * - различие с исходным уровнем (до замораживания) достоверно (p<0,05); # -различие с данными через 1 сутки достоверно (p<0,05).
Таблица 2 Содержание Т и В-лимфоцитов в лейкоконцентратах, подвергнутых холодовому воздействию (-40оС) разной длительности
|
Состояние ЛК (n=5) |
Т-лимфоциты, % |
В-лимфоциты, % |
|
|
ЛК, смешанный с криоконсервантом 1:1 |
до замораживания |
82,80±1,92 |
9,25±3,86 |
|
после размораживания |
88,33±2,08 * |
2,67±0,58 * |
|
Примечание : ЛК- лейкоцитный концентрат; * - различие с исходным уровнем (до замораживания) достоверно (p<0,05).
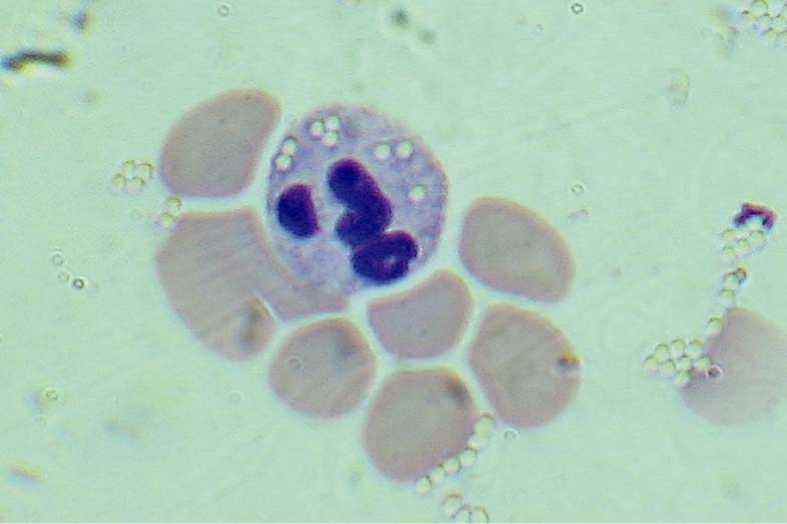
Рис. 1. Нейтрофил, фагоцитировавший частицы латекса до замораживания (увеличение в 1500 раз)
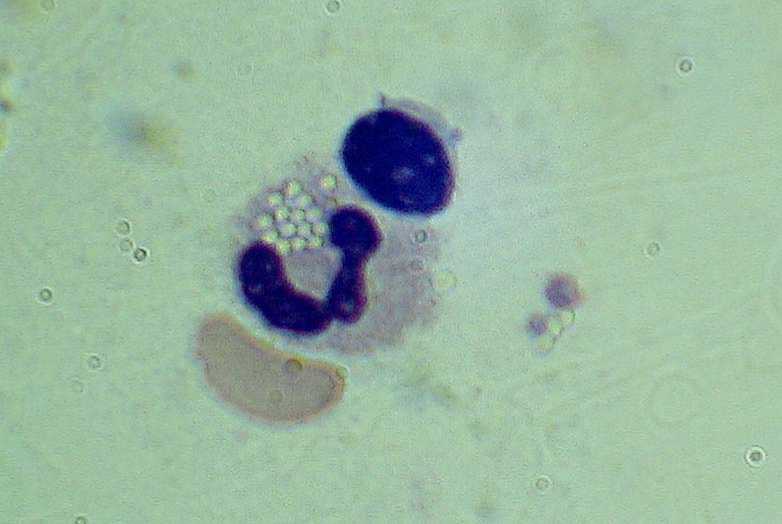
Рис. 2. Нейтрофил, фагоцитировавший частицы латекса после оттаивания (увеличение в 1500 раз)
ОБСУЖДЕНИЕ
Несмотря на большое количество работ, посвященных изучению механизмов криоповреждения и криозащиты ядерных клеток крови (Иткин Ю.А. и др., 1983; Белоус А.М., Грищенко В.И., 1994; Svedentsov E.P. et al., 1998; Halle P. et al., 2001), проблема сохранения этих объектов еще далека от своего окончательного разрешения.
Степень криоповреждения в первую очередь определяется глубиной анабиотического состояния клетки. Во избежание механического разрушения мембран клетки и ее органелл образующимися кристаллами при фазовом переходе вода-лед и денатурации клеточных белков при повышении концентрации солей в межкристаллических пространствах нами был использован отечественный криопротектор смешанного действия ГМБТОЭМ (Сведенцов Е.П. и др., 1997), который стабилизирует как фракции внеклеточной воды, так и внутриклеточной. Показано (Осташко В.Ф., Осташко Ф.И., 2004), что температурный шок смягчается или вообще не проявляется при медленном экспоненциальном снижении температуры клеточной суспензии. Использование данной программы позволяет избежать процессов рекристаллизации в процессе замораживания биообъекта. Кроме того, экспоненциальная программа замораживания не требует применения дорогостоящей жидкоазотной технологии и является весьма экономичной. Вероятно, используемый нами криопротектор, позволяющий избежать глубоких фазовых изменений и нарушения барьерных свойств мембран лейкоцитов, а также примененная экспоненциальная программа замораживания позволили нам сохранить большой процент (70,1±14,9%) жизнеспособных клеток после их размораживания.
Лейкоциты в отличие от других клеток крови обладают повышенным обменом веществ, который при умеренно-низкой температуре (-40оС) замедляется, но продолжается, так как в клетках в незамерзшем состоянии остаются часть связанной и вся фракция фиксированной воды; поэтому энергетические запасы лейкоцитов продолжают расходоваться (Сведенцов Е.П., 2004). Для поддержания метаболизма лейкоцитов в состав хладоограждающего раствора нами был включен антигипоксант биоэнергетической направленности фумарат натрия, который необходим для нормализации цикла Кребса в клетках как во время воздействия холодового стресса, так и после него. Нами было установлено, что после нахождения нейтрофилов в состоянии холодового анабиоза при -40°С количество НСТ-положительных клеток существенно увеличивалось и после 30 суток хранения резервные функции системы, генерирующей активные формы кислорода, были использованы почти полностью. Таким образом, применение данной ограждающей среды и экспоненциальной программы замораживания позволяет поддерживать метаболизм нейтрофилов, подвергнутых холодовому стрессу (-40°С) до 30 суток.
Образование кислородных радикалов является подготовительным этапом фагоцитоза (Герасимов И.Г., 2004). Полученные нами данные в НСТ-тесте коррелируют с результатами определения способности нейтрофилов к фагоцитозу. Нами установлено, что через 30 суток холодового анабиоза 92,2±6,4% нейтрофилов сохраняют способность к образованию фагосом с инертными частицами латекса.
Данные литературы свидетельствуют (Обозная Э.И. и др., 1981; Славинский А.А., Никитина Г.В., 1999), что лизосомально-катионные белки локализуются как в первичных пероксидазопозитивных (азурофильных), так и во вторичных пероксидазонегативных
(специфических) гранулах нейтрофилов.
Согласно результатам лизосомально-катионного теста наблюдается достоверное (p<0,05) снижение СЦК к 30 суткам. Мы предполагаем, что это может быть связано с повреждением первичных и вторичных гранул нейтрофилов в процессе длительного холодового воздействия.
Среди лейкоцитов лимфоциты являются наиболее устойчивыми к действию холода клетками, кроме того, устойчивость В-лимфоцитов к замораживанию до -196°С выше, чем Т-лимфоцитов (Белоус А.М., Грищенко В.И., 1994). Нами установлено, что при умереннонизкой температуре -40оС наиболее чувствительными к холодовому стрессу оказались В-лимфоциты. Таким образом, при различных температурных воздействиях популяции лимфоцитов ведут себя неоднозначно, что может быть использовано в практике для обогащения трансфузионной среды необходимой фракцией лимфоцитов.
Таким образом, предложен эффективный, доступный и экономичный способ сохранения лейкоцитов при умеренно-низкой температуре -40°С в функционально полноценном в течение 30 суток. Данный способ может быть рекомендован к использованию в научных учреждениях медицинского и биологического профиля.
Таким образом, патогенные для человека бактерии способны проникать в ткани растительного организма и колонизировать их, не вызывая при этом четко выраженных симптомов заражения, но сохраняя свою вирулентность. Это указывает на возможный риск заболевания при употреблении зараженных овощей и фруктов. .
Список литературы Сохранность лейкоцитов в условиях криоанабиоза
- Аграненко В.А., Файнштейн Ф.Э., Ермолович С.В. (1982) Биологические свойства криоконсервированных лейкоцитов и их клиническоеприменение.Пробл. гематологии и переливания крови, 4, 6-10.
- Белоус A.M., Грищенко В.И. (1994) Никитина Н.Н. Криобиология, Наукова Думка, Киев.
- Герасимов И.Г. (2004) Неоднородность нейтрофиловвфагоцитозеи респираторном взрыве. Клиническая лаб. диагностика, 6, 34-36.
- Гланц С. (1998) Медико-биологическая статистика, Практика, Москва.
- Гольдберг Е.Д., Дыгай A.M., Шахов В.П. (1992) Методы культуры ткани в гематологии, Изд-во Томского гос. ун-та, Томск.
- Гордиенко Е.А., Пушкарь Н.С. (1994) Никитина Н.Н.Физическиеосновы низкотемпературногоконсервирования клеточных суспензий, Наукова Думка, Киев.
- Зинкин В.Ю., Годков М.А. (2004) Способ количественнойоценки кислородзависимогометаболизма нейтрофильных гранулоцитов человека. Клиническая лаб. диагностика, 8, 26-29.
- Иткин Ю.А., Бронштейн В.Л., Гордиенко Е.А., Марценюк В.Ф. (1983) Консервирование клеточных суспензий, Замораживание: факторы, механизмы и гипотезы криоповреждения биологический суспензий. Наукова Думка, Киев, С. 26-34.
- Махатадзе И.К., Каличава Л.Х., Мгебришвили Н.Н., Кахиани Ш.В. (1975) Корреляция скоростей охлаждения с ограждающей средой в поиске оптимальных режимов замораживания гранулоцитов. Пробл. гематологии и переливания крови, 9, 25-27'.
- Обозная Э.И., Пушкарь Н.С., Маркова О.П.,Панков Е.Я.(1981) Цитохимия замороженной клетки, Локализация и функциональное значение ферментов и веществ в клетках костного мозга и крови. Наукова Думка, Киев, С. 38-43.
- Основы трансфузиологии (1995) Заривчацкий М.Ф., Изд-во Пермского ун-та, Пермь.
- Осташко В.Ф., Осташко Ф.И. (2004) Температурный шок клеток как гидравлический удар в резонансной системе. Цитология, 46, 831-833.
- Потапова С.Г., Хрустиков B.C., Демидова Н.В.,Козинец Г.И.(1977) Изучение поглотительной способности нейтрофилов крови с использованием инертных частиц латекса. Пробл. гематологии и переливания крови, 9, 58-59.
- Практикум по иммунологии (2004) Кондратьева Н.А., Ярилин А.А., Исследование клеточного иммунитета в клинике, Академия, Москва, С. 182-184.
- Пушкарь Н.С., Лобынцева Г.С., Полякова А.И. и др. (1978) Разработка оптимальных режимов программного замораживания лейкоцитов. Пробл. гематологии и переливания крови, 8, 8-13.
- Сведенцов Е.П. (2004) К классификации разных уровней отрицательных температур, используемых для консервирования биообъектов. Материалы научной сессии НИИ и ВУЗов, Изд-во Кировского областного Бюро медицинской статистики и информатики, Киров, С. 117-120.
- Сведенцов Е.П., Архиреев В.П., Утемов С.В. (1997)Физико-химические и токсико-фармакологическиехарактеристики жидкой формы криопротектора А-378. Актуальные вопросы трансфузионной и клинической медицины: Мат-лы науч. конф, Киров, С. 34.
- Сведенцов Е.П., Туманова Т.В., Семенов А.Н..Хомякова С.А., Костяев А.А., Утемов С.В.Патент на изобретение № 2184449. Криозащитный раствор для замораживания лейкоцитовприумеренно-низкой температуре. Опубл. 10.07.2002, Бюл.19.
- Сведенцов Е.П., Утемов С.В., Костяев А.А.,Туманова Т.В. (2001) Функциональная активность лейкоцитов, подвергнутых холодовому(-80°С)анабиозу. Восемнадцатый съезд физиологического общества им. И.П. Павлова, Казань, С. 421-422.
- Славинский А.А., Никитина Г.В. (1999) Цитохимическое выявление катионных белков в гранулоцитах крови амидо черным 10Б для визуальной оценки и компьютерного анализа изображения. Клиническая лаб. диагностика, 2, 35-37.
- Утемов С.В., Сведенцов Е.П., Костяев А.А.,НовосадовВ.М.(1999) Криоконсервирование лейкоцитов с новым ограждающим раствором. Вопросы трансфузионной и клинической медицины (Мат-лы 6-й научной конференции молодых ученых), Киров, С. 28.
- Granfeldt D., Samuelsson M., Karlsson A. (2002) Capacitative Ca2+ influx and activation of the neutrophils respiratory burst. Different regulation of plasma membrane-and granule-localized NADPH-oxidase. J. of Leukocyte Biol, 71, 611-617.
- Halle P., Tournilhac O., Knopinska-Posluszny W. (2001) Uncontrolled -rate freezing and storage at -80°C, with only 3,5 -percent DMSO in cryoprotective solution for 109 autologous peripheral blood progenitor cell transplantation. Transfusion, 41, 667-673.
- Scheck R. (1936) A method for counting the viable cells in normal and malignant cell suspension. Ann. J. Cancer, 28, 389-391.
- Svedentsov E.P., Archireyev V.P., Utyomov S.V. (1998)Low temperature leukocyte concentrate conserving. Vox Sanguineous. 25th Congress JSBT, Oslo, Norway, Abstract 1254.


