Соотношение возбудительных и тормозных синаптических процессов в кортико-нигральных проекциях на модели болезни Паркинсона с протекцией меланином
Автор: Погосян М.В., Саркисян Р.Ш., Андриасян А.А., Хачатрян Л.М., Аветисян С.В., Минасян А.Л., Степанян А.Ю., Саркисян В.Р., Манукян А.М., Саркисян Д.С.
Журнал: Психология. Психофизиология @jpps-susu
Рубрика: Психофизиология
Статья в выпуске: 1 т.17, 2024 года.
Бесплатный доступ
Обоснование. Болезнь Паркинсона - медленно прогрессирующее хроническое нейродегенеративное заболевание. В основе патологии лежит гибель дофаминергических нейронов компактной части черной субстанции. В последнее время обнаружены также нарушения во многих других отделах мозга, в частности в двигательных областях коры. Поскольку болезнь является неизлечимой, остается актуальность поиска новых терапевтических подходов.
Болезнь паркинсона, эксперимент, кортико-нигральные проекции, меланин, частота потенциалов действия
Короткий адрес: https://sciup.org/147243286
IDR: 147243286 | УДК: 612.821 | DOI: 10.14529/jpps240110
Текст научной статьи Соотношение возбудительных и тормозных синаптических процессов в кортико-нигральных проекциях на модели болезни Паркинсона с протекцией меланином
Когнитивные нарушения при болезни Паркинсона (БП) варьируются от субъективных когнитивных симптомов до умеренных когнитивных нарушений с объективным когнитивным дефицитом и, в конечном счете, до болезни Паркинсона с деменцией и прогрессирующим дефицитом, достаточно серьезным, чтобы ухудшать повседневную жизнь [1]. Когнитивные нарушения влияют на важные аспекты жизни, такие как профессия и вождение автомобиля, даже на ранних стадиях БП и становятся ключевым предиктором помещения в дом престарелых и смерти на более поздних стадиях [2]. Черная субстанция (Substatia nigra – SN) – важная нейрональная структура, осуществляющая регуляцию базальных ганглиев (БГ) через нигро-стриатный путь. Антеро-латеральная зона SN – pars reticulate (SNr) – состоит из ГАМКергических нейронов, воспринимающих афференты от стриатума и субталамического ядра, и, в свою очередь, проецируется к вентральному переднему таламическому ядру [3]. SN, осуществляя регуляцию БГ [4], вовлекается в различные нейрологические и нейропсихиатрические болезни, в частности, болезнь Паркинсона (БП) [5], шизофрению [6], патологические склонности и пагубные пристрастия [7]. Полагается, что понимание регуляции ДА среднего мозга необходимо для составления представления о системе вознаграждения и ненормальностях при этих болезнях [4]. Согласно данным на родентах, SNr – большая выходная инстанция БГ, воспринимающая информацию от мозговой коры через три главных пути, прямой тормозный транс-стриатный, непрямой возбудительный транс-стриатный, который вовлекает паллидум и субталамус и прямой возбудительный транс-субталамическй [8]. Недавно доказано существование кортико-нигральной проекции у людей. Менке с соавт. [9], применив вероятностную диффузионную тензорную магнитно-резонансную томографию (diffusion-tensor magnetic resonance imaging – DTMRI) с целью дифференциации взаимоотношений SNc и SNr с мозговой корой посредством таламуса, показали высочайший профиль связи SNc с префронтальной корой (ПФК). При этом SNr оказался больше связанным с моторной и премоторной корой [9]. Наконец, Квон и Янг [10] описали связь SN с различными стуктурами мозга (мозолистое тело, первичная сенсорная кора, премоторная кора, хвостатое ядро, скорлупа, nucleus accumbens, височно-затылочные доли, pontine basis, передняя доля мозжечка, наружная капсула). Согласно ранним работам, одностороннее удаление фронтальной коры сопровождается значительной редукцией глутаминовой кислоты в ипсилатеральной SN при неизменном содержании ГАМК, что свидетельствует о глутамате в качестве передатчика в кортико-нигральном тракте [11]. Несмотря на относительный недостаток коркового входа к клеткам среднего мозга у приматов, они оказались богатыми глутаматными рецепторами [12]. Основанный на изучениях родентов, корковый контроль среднего мозга – один из важных механизмов, которым глутаматергический вход прямо или непрямо может управлять или модулировать допаминергические (ДА) клетки [13]. Недавно проведена оценка корковых связей SN in vivo у человека [14]. Обнаружено, что связи SN с мозговой корой вовлекают ПФК, пре- и постцентральную извилины и верхнюю париетальную долю.
Эти результаты могут быть релевантными для понимания патофизиологии отдельных нейрологических болезней, вовлекающих SN, таких как БП, шизофрения, патологическое пристрастие (зависимость). Тем самым подкреплена гипотеза, что SN не только часть сети подкорковых БГ, но также связана с корой посредством дополнительного параллельного круга и представлена трактографическими находками наличия кортико-нигрального пути у людей, что подтверждает выводы, основанные на резул ьтатах исследований, проведенных на животных [14]. В заключение, применением DTMRI и CSD (constrained spherical deconvolution) трактографии, продемонстрировано наличие прямой анатомической кортико-нигральной связи, уже широко описанной у кошек, родентов и приматов, но лишь предполагаемой у людей. Наконец, представляет несомненный интерес MelaninConcentrating Hormone (MCH), который вовлечен в большинство мозговых функций и поведения, существенных для выживания животных [15].
Предметом настоящего изучения явилось исследование в норме и на модели БП выраженности кортико-нигральных связей в микроэлектрофизио-логическом исследовании на примере соотношения возбудительных и тормозных процессов в нейронах SN, при активации первичной моторной коры (М1). Это может содействовать новому пониманию механизмов контроля моторики и когнитивных функций мозга на стволовом уровне, в условиях изменения его пластичности при нейроде-генеративных болезнях и протекции под влиянием меланина – мощного антиоксиданта липидной пероксидации.
Материал и методы
Проводили электрофизиологические исследования на 28 крысах-самцах линии Альбино (230 ± 30 г.) в трех сериях экспериментов: интактных (n = 9), на модели БП, индуцированной унилатеральным введением ротенона на 4-й неделе выдерживания (n = 14), и в условиях протекции меланином (n = 5). Введение ротенона осуществляли в условиях нембуталового наркоза (40 мг/кг, в/б) из расчета 12 μг в 0,5 μл Димексида (со скоростью 1 μл/мин) в medial forebrain bundle по координатам стереотаксического атласа [16] (AP + 0,2; L ± 1,8; DV + 8 мм). Меланин в дозе 170 мг/кг вводили через день (14 инъекций). Исследование проводилось в соответствии с принципами Базельской декларации и рекомендациями руководства ARRIVE [17]. В стереотаксическом аппарате производили трепанацию черепа от брегмы до лямбды и вскрывали твердую мозговую оболочку. После краниотомии раздражающий электрод вживляли в ипсилатеральную М1 по стереотаксическим координатам (АР + 2,1; L ± 2,6; DV + 1,6 мм), а cтеклянные микроэлектроды с диаметром кончика 1–2 µM, заполненные 2M NaCl, вводили в SNс (AP – 5,0; L ± 2,0; DV + 8,1 мм) и SNr (АР – 5,1; L ± 2,0, DV+8,6 мм) для экстраклеточной регистрации спайковой активности одиночных нейронов. Осуществляли высокочастотную стимуляцию МI посредством прямоугольных толчков тока (длитель- ностью 0,05 мс, амплитудой 0,12–0,18 мВ, силой тока 0,32 мА и частотой 100 Гц в течение 1 секунды).
Операции осуществляли на наркотизированных уретаном животных (urethane 1,5 г/кг и/п) в следующей очередной последовательности: фиксация черепа в стереотаксическом аппарате, краниотомия с удалением костей от брегмы до лямбды и отсепаровкой твердой мозговой оболочки. Предварительно животные обездвиживались 1%-ным дитилином (Dithylin - Suxamethonium iodide , 25 мг/кг в/б) и переводились на искусственное дыхание.
Регистрацию нейрональной активности проводили с использованием компьютерной программы, позволяющей осуществлять селекцию спайков амплитудной дискриминацией, построением суммарной гистограммы и графиков текущих частот спайковых разрядов. Рассчитывались также средние частоты спайковых разрядов до, во время и после ВЧС M1. Для оценки характера изменения нейрональной активности во время ВЧС М1 определялась относительная степень выраженности частоты разрядов до и во время ВЧС М1. Вместе с тем строились дисковые диаграммы для сопоставления значений средних частот нейронов для различных серий экспериментов.
Была зарегистрирована активность 599 нейронов. Их активность проявлялась в виде тетанической потенциации (ТП) или тетанической депрессии (ТД) во время ВЧС М1, а также посттетанической потенциацией (ПТП) или посттетанической депрессией (ПТД) после ВЧС М1. Достоверность отличия данных, полученных для различных этапов экспериментов, оценивали с использованием t-критерия Стьюдента при уровне значимости р < 0,05.
Результаты
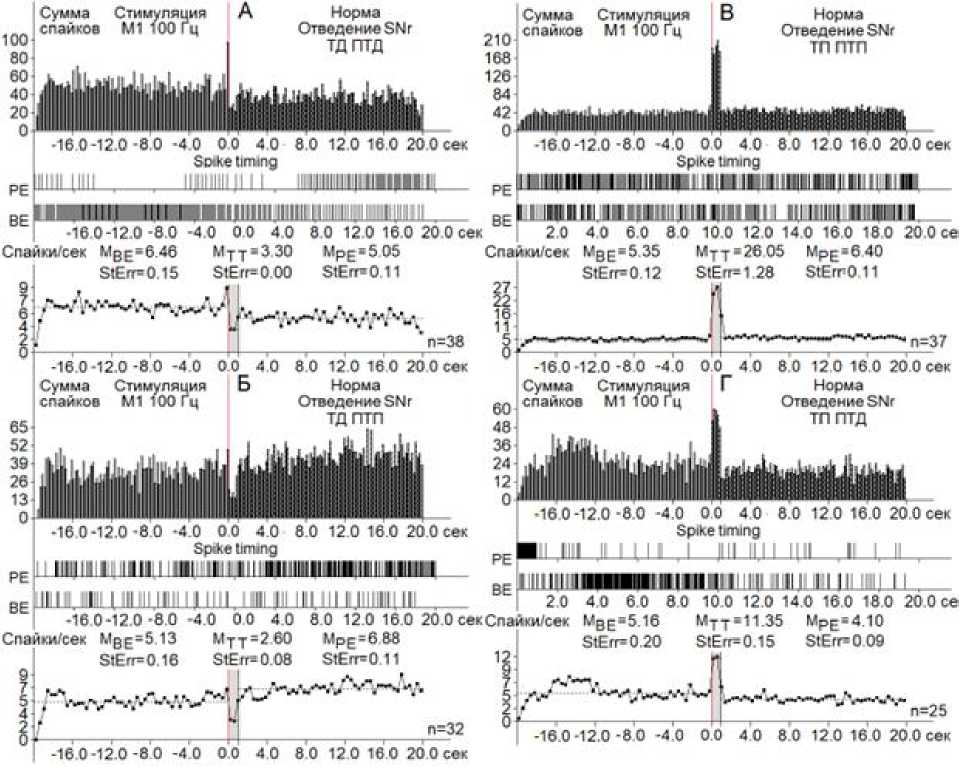
Проведен cравнительный анализ импульсной активности одиночных нейронов SNc (107 нейронов, n = 4) и SNr (135 нейронов, n = 7) при ВЧС M1 в норме, на ротеноновой модели БП (105 нейронов SNc , n = 5) и (184 нейрона, SNr n = 7) и на ротеноновой модели БП в условиях протекции меланином (50 нейронов SNc, n = 3) и (41 нейронов SNr, n = 2).
В нейронах SNc при ВЧС М1 в норме значения занижения (ТД) и завышения (ТП) прести-мульной активности в одно- и разнонаправленных постстимульных последовательностях исчислялись в следующих пределах. В депрессорной последовательности ТД достигало 1,55-кратного cнижения престимульной активности, в депрессорно-возбудительной – 1,5-кратного cнижения (рис. 1 А, Б; рис. 7 А, Б); в возбудительной последовательности повышение ТП выявлялась в пределах 2,05-кратного, а в возбудительно-депрессорной – 1,58-кратного (рис. 1 В, Г; рис. 7 В, Г).
На ротеноновой модели БП в нейронах SNc депрессорные эффекты полностью отсутствовали. В возбудительной постстимульной активности ТП в двух последовательностях достигала 3,31- и 3,05-кратности превышения престимульной активности (рис. 2 А, Б; рис. 7 В, Г). Очевидна эк-сайтотоксичность SNc нейронов в условиях патологии, свидетельствующая об их нейродегенера-тивном поражении.
В нейронах SNc в условиях использования меланина депрессорные эффекты были восстановлены. ТД в депрессорных эффектах достигала 2,43- и 6,40-кратного снижения престимульной активности. ТП в возбудительных эффектах показал 1,20- и 1,46-кратнов превышение (рис. 3 А-Г; рис. 7 А-Г).
Иными словами, с использованием меланина имело место восстановление депрессорных постстимульных эффектов в нейронах SNc, уровни которых даже превысили уровни нормы (1,56- и 4,26-кратно), и резкое снижение уровней возбудительных эффектов (2,76- и 2,11-кратно).
В нейронах SNr при ВЧС М1 в норме значения cнижения (ТД) и превышения (ТП) прести-мульной активности в одно- и разнонаправленных постстимульных последовательностях исчислялись в следующих пределах. В депрессорной последовательности ТД достигало 2,05-кратного занижения, в депрессорно-возбудительной – 2,07-кратного (рис. 4 А, Б; рис. 8 А, Б). В возбудительной последовательности ТП исчислялась в пределах 5,07-кратного завышения, а в возбудительнодепрессорной – 2,20-кратного (рис. 4 В, Г; рис. 8 В, Г). Иными словами, ТП в нейронах SNr оказалась выше ТД, преимущественно в однонаправленной последовательности.
На ротеноновой модели БП в нейронах SNr ТД в обеих последовательностях достигала лишь 1,21- и 1,23-кратного снижения прести-мульной активности (рис. 5 А, Б; рис. 8 А, Б). Однако ТП в обеих последовательностях также исчислялись в небольших пределах – порядка 1,40- и 1,60-кратного превышения (рис. 5 В, Г; рис. 8 В, Г). Итак, в нейронах SNr на модели БП уровни как депрессорной, так и возбудительной постстимульной активности оказались ниже нормы.
В условиях использования меланина ТД в депрессорных постстимульных последовательностях определялась в пределах 2,10- и 2,15-кратного занижения активности, а ТП в таковых возбудительных – порядка 1,71- и 1,26-кратного завышения (рис. 6 А–Г; рис. 8 А–Г). Таким образом, имело место очевидное повышение депрессорных постстимульных эффектов (1,73- и 1,75кратно) в нейронах SNr с выравниванием с нормой, а возбудительные – не претерпели ощутимых изменений.
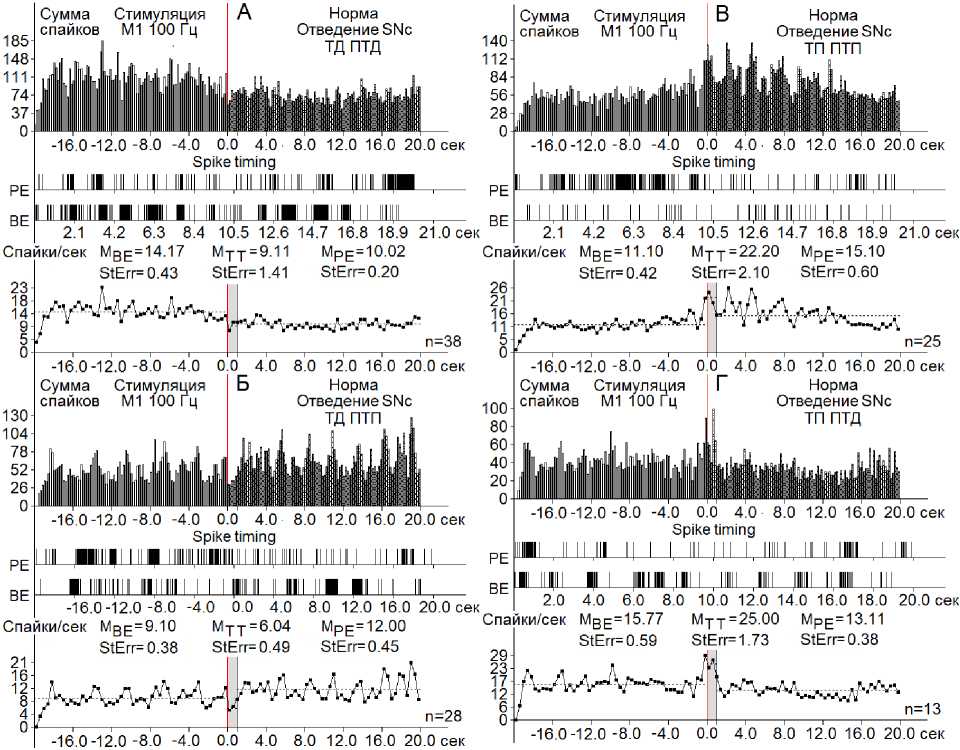
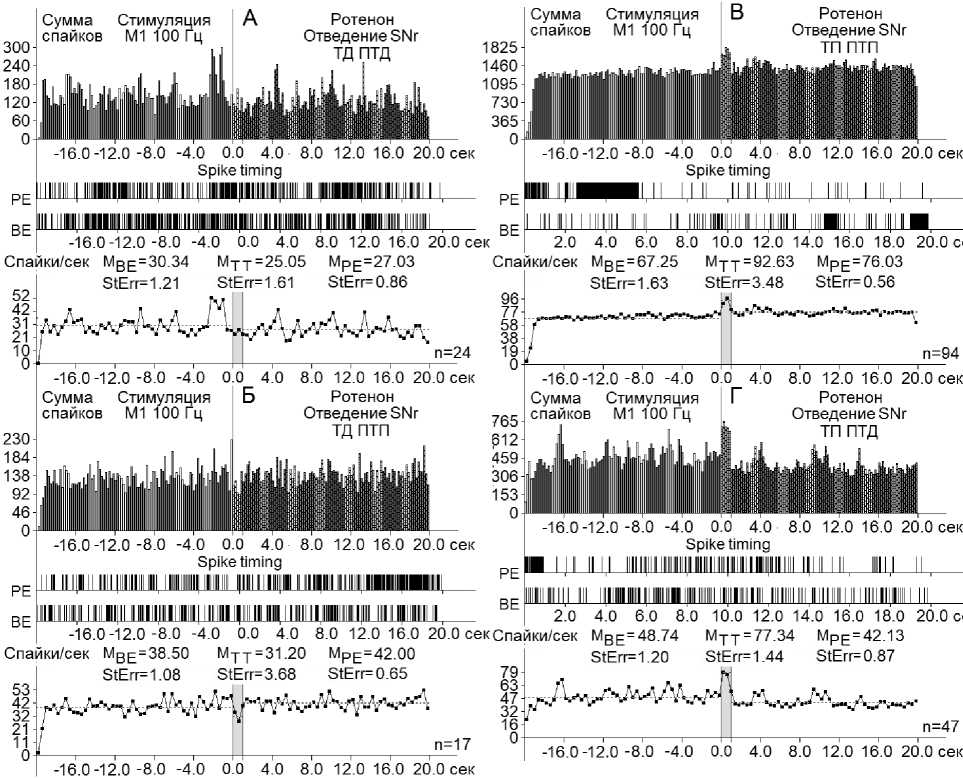
Рис. 1. А–Г – суммарные гистограммы спайков депрессорных проявлений активности – ТД ПТД (А), депрессорно-возбудительных – ТД ПТП (Б), возбудительных – ТП ПТП (В) и возбудительно-депрессорных – ТП ПТД (Г) нейронов SNc, вызванных ВЧС М1 в норме.
Здесь и на остальных рисунках: ВЕ – до стимуляции, РЕ – после стимуляции, усредненная частота нейронов SNc М BE – для временных отрезков до стимуляции, М TT – на время тетанизации и М РЕ – после стимуляции. StErr – стандартная ошибка средней частоты нейронов в соответствующих временных интервалах. Справа от диаграмм – количество испытаний (n)
Fig. 1. А–Г – histograms of the sum of spikes of inhibitory manifestations – ТД ПТД (А), inhibitory-excitatory – ТД ПТП (Б), excitatory – ТП ПТП (В), and excitatory-inhibitory – ТП ПТД (Г) SNc neurons evoked by high– frequency stimulation of the primary motor cortex in the normal condition.
The diagrams display the following time intervals: BE – before stimulation, PE – after stimulation, the average frequency of SNc neurons M BE – time periods before stimulation, M TT – for the time of tetanization, and M PE – after stimulation. StErr represents the standard error of the average frequency of neurons in the corresponding time intervals. The number of trials (n) is indicated to the right of each diagram
Сумма Стимуляция спайков М1 100 Гц
A
Ротенон Отведение SNc ТП ПТП
-16.0-12.0 -8.0 -4.0 0.0 4.0 8.0 12.0 16.0 20.0 сек Spike timing
PE
BE
-16.0-12.0 -8.0 -4.0 0.0 4.0
Спайки/сек Мдр = 25.40
StErr=0.53
0-
MTT = 84.30
StErr=1.53
8.0 12.0 16.0 20.0 сек
Mpp = 27.78
StErr=0.61
-16.0-12.0-8.0 -4.0 0.0
Сумма Стимуляция [ спайков М1 100 Гц
Б
n=71
4'0 8'0 12.0 16.0 20.0 сек
Ротенон Отведение SNc
ТП ПТД
297-
-16.0-12.0 -8.0 -4.0 0.0 4.0 8.0 12.0 16.0 20.0 сек Spike timing
PE
BE
-16.0-12.0 -8.0 -4.0 0.0 4.0
8.0 12.0 16.0 20.0 сек
Mpp = 21.70
StErr=0.65
MTT=72.27
StErr=0.63
Спайки/сек МВЕ = 23.70
StErr=0.50

-16.0-12.0-8.0 -4.0 0.0
4'0 8'0 12.0 16.0 20.0 сек
Рис. 2. А, Б – суммарные гистограммы спайков возбудительных проявлений активности – ТП ПТП (А) и возбудительно-депрессивных – ТП ПТД (Б) нейронов SNc, вызванных ВЧС М1 на ротеноновой модели БП. Справа от диаграмм – количество испытаний (n)
Fig. 2. А, Б – histograms of the sum of spikes of excitatory manifestations – ТП ПТП (A) and excitatory-inhibitory – ТП ПТД (Б) of SNc neurons evoked by high-frequency stimulation of the primary motor cortex on the rotenone-induced model of PD. The number of trials (n) is indicated to the right of each diagram
Меланин Отведение SNc ТДПТД
Сумма Стимуляция спайков Ml 100 Гц
О
РЕ
Spike timing ii iiiiii, iiiiiiiiiiw iiiiiiiiiiiiiiiiiiniiiiiii
Сумма Стимуляция спайков Ml 100 Гц
В
Меланин Отведение SNc ТП ПТП
РЕ
BE
I |l Hill III , lllll , I pi|Wll -16.0-12.0 -8.0 -4.0 0.0 4.0 8.0 12.0 16.0 20.0 сек
Spike timing mil i___________, i , i mi in Him mill i mi,iiniii11hiii_________
BE
Illi Illi 11 | ll 11 III Will IIM ll | llllllllllll|lllllllllllll ___________
2.0 4.0 6.0 8.0 10.0 12.0 14.0 16.0 18.0 20.0 сек
MTT=2.41
StErr=0.19
Mgp-5.87
StErr=0.48
MPE-3.35
St.ErR0.12
Б
РЕ
14.0 16.0 18.0 20.0 сек
MpE=3.65
StErr=0.40
Spike timing
, 11111111 | 1111111111111111111111111|11111111111Я II I,
8.0 10.0 12.0
Мтт = 0.21
StErr=0.21
-16.0-12.0-8.0 -4.0 0 0
Сумма Стимуляция спайков Ml 100 Гц
4.0 8.0 12.0 16.0 20.0 сек Меланин
Отведение SNc
ТД ПТП
Спайки/сек Мрр = 1.34
StErR0 22
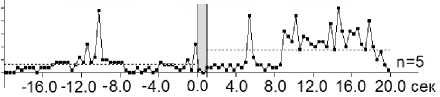
Рис. 3. А–Г – суммарные гистограммы спайков депрессорных проявлений активности – ТД ПТД (А), депрессорно-возбудительных – ТД ПТП (Б), возбудительных – ТП ПТП (В) и возбудительно-депрессорных – ТП ПТД (Г) нейронов SNc, вызванных ВЧС М1 на ротеноновой модели БП в условиях использования меланина. Справа от диаграмм – количество испытаний (n)
Fig. 3. А–Г – histograms of the sum of spikes of inhibitory manifestations – ТД ПТД (А), inhibitory – excitatory – ТД ПТП (Б), excitatory ТП ПТП (В) and excitatory-inhibitory ТП ПТД (Г) of SNc neurons evoked by high-frequency stimulation of the primary motor cortex in a rotenone–induced model of PD under the use of Melanin. The number of trials (n) is indicated to the right of each diagram
2.0 Спайки/сек
4.0 6.0
Мрр= 1.05
StErr=0.27
8.0 10.0 12.0
М-р -р = 1.25
StErr=1.25
। 14.0 16.0 18.0 20.0 сек
। МРЕ=3.23
■ StErr=0.51
-16.0-12.0-8.0 -4.0 0 0
Сумма Стимуляция [ спайков 100 Гц
4.0
8.0 12.0 16.0 20.0 сек
Меланин Отведение SNc тп птд
-16.0-12.0 -8.0 -4.0 0.0 4.0 8.0 12.0 16.0 20.0 сек
111111111111111111111111111111 | 111111111|11111« 1111111111|11111111111 1111 | 11111111111111111111 ___________
BE
2.1 4.2 6.3 8.4 10.5 12.6 14.7 16.8 18.9 21.0 сек
Спайки/сек Мрр=8.00
StErr=0.94
Мтт = 11.67 МРЕ=5.12
S1Err=2.50 StErr=0.39
...........- I i I . IIII^IIIIII1I■I^H|II
•16 0-12.0-8.0-4.0 0 0 4 0 8 0 12 0 16.0 20 0 сек
• - . , I I,, , ,
I -16 0-12.0 -8 0 -4 0 0 0 4 0 8 0 12 0 16 0 20 0 сек
PE I. lllllllLlllllilll-lllLl.IlllllUllIUlllllllimum
UIIIIUUI
ЮПИ 111 111 JJIj ИЦ Щ II
StErr=0.2O n=25
n=32
-16 0-12.0-8 0 -4 0 0 0 4 0 8 0 12 0 16 0 20 0 сек
-16 0-12.0-8 0 -4 0 0 0 4 0 8 0 12 0 16 0 20Осек
100806040-У
MpE»5O5 StErr-011
MTT = 260
StErr=OOB
MpE = 688
StErr=O 11
Норма Отведение SNr ТППТД
РЕ|1Ш1ЩШ
Норма Отведение SNr ТППТП
Норма Отведение SNr ТДГГТД
•16 0-12.0-8.0-4 0 0 0 4 0 8.0 12.0 16.0 20.0 сек Spike timing
•16 0-12.0-8 0-4.0 0 0 4 0 8 0 12 0 16 0 20 0 сек Spike timing
Сумма Стимуляция слайков М1 100 Гц
-16 0-12.0-8 0 -4 0 0 0 4 0 8.0 12 0 16 0 20 0 сек Sp«ke timing
Спайки/сек MgE=5.13
SlErr=0.16
-16 0-12.0 - 8.0 -4.0 0 0 4.0 8.0 12 0 16 0 20 0 сек Spike timing
« II■1И1М—|ИИ 1»Ш1 RIM IW M IWIIIWI!»ГII ни
Мтт»11.35 МрЕ=4 10
StErr=015 StErr»0 09
2.0 Спайки/сек
Сумма Стимуляция слайков М1100ГЦ
StErr=1 28 StErrO.11
=pl I llllllll III1I1II1JIIIIIUI1J IILIIIIIII ОПИШИ
1 * * * 10 0 12 0 14.0 16.0 18 0 20 0 се
Мтт»26 05 МРЕ»6 40
Сумма Стимуляция ^слайкое М1100ГЦ 48
36 IlM,. , , I 24 • (LmMLLIl^I^i 12 ii 11 Nil iih ii 11
40 6.0 80
Mbe=5.35
StEfr^O 12
Спайки/сек MBE=6 46 M-[-y»3 30
StErr=0 15 StErr=0 00
>■■■-,—. i.....,......,...._.— ,.. ,.^.,, ./...-f., , 2.0 40 60 80 100 120 140 160 180 200ce
-16 0-12.0 -8 0 -4 0 00 4 0 8.0 12.0 16.0 20 0секСпайки/сек M0E=5.16
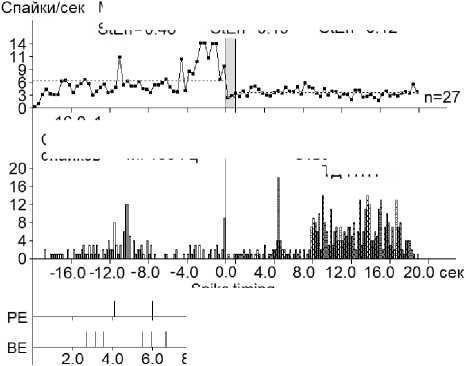
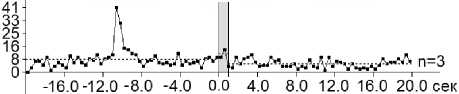
Рис. 4. А–Г – суммарные гистограммы спайков депрессорных проявлений активности – ТД ПТД (А), депрессорно-возбудительных – ТД ПТП (Б), возбудительных – ТП ПТП (В) и возбудительно-депрессорных – ТП ПТД (Г) нейронов SNr, вызванных ВЧС М1 в норме . Справа от диаграмм – количество испытаний (n)
Fig. 4. А–Г – histograms of the sum of spikes of inhibitory manifestations – ТД ПТД (А), inhibitory-excitatory – ТД ПТП (Б), excitatory – ТП ПТП (В), and excitatory – inhibitory – ТП ПТД (Г), of SNr neurons evoked by high-frequency stimulation of the primary motor cortex in the normal condition. The number of trials (n) is indicated to the right of each diagram
4 0 8.0 12 0 16 0 20 0 сек Норма Отведение SNr
ТДПТП
^*?^
-16.0-12.0 -8.0 -4.0 0.0 4.0 8.0 12.0 16.0 20
n=24
4'0 8'0 12.0 16.0 20.0 сек
StErr=1.20
^/^Д^^^
xAV1--'^^
-16.0-12.0-8^0 -4^0
-16.0-12.0-8.0 -4.0 0.0
60 О
Сумма спайков
365 О
765 ₽12 459 306 153 О
Стимуляция М1 100 Гц
8.0 12.0 16.0 20.0 сек
МрЕ=27.03
StErr=0.86
Ротенон Отведение SNr ТД ПТП
Ротенон Отведение SNr ТП ПТП
Ротенон Отведение SNr ТДПТД
Ротенон Отведение SNr ТП ПТД
2.0 4.0 6.0 8.0
4.0 6.0 8.0 Мве=67.25 StErr=1.63
-16.0-12.0 -8.0 -4.0 0.0 4.0 8.0 12.0 16.0 20.0 сек Spike timing
Сумма Стимуляция спайков М1 100 Гц
Сумма Стимуляция спайков М1 100 Гц
Сумма Стимуляция спайков М1 100 Гц
-16.0-12.0 -8.0 -4.0 0.0 4.0 8.0 12.0 16.0 20.0 сек Spike timing n=47
0.0 4.0 8.0 12.0 16.0 20.0 сек
10.0 12.0 14.0 16.0 18.0 20.0 c
Мтт = 92.63 MpE=76.03
StErr=3.48 StErr=0.56
10.0 12.0 14.0 16.0 18.0 20.0 c
MTT = 77.34 MPE = 42.13
StErr=1.44 StErr=0.87
-16.0-12.0 -8.0 -4.0 0.0 4.0 8.0 12.0 16.0 20.0 секСпайки/сек MBE = 48.74
2.0 Спайки/сек n=17
4'0 8'0 12.0 16.0 20.0 сек
Спайки/сек МВЕ=38.50 M-p-p = 31.20 МрЕ=42.00
StErr=1.08 StErr=3.68 StErr=0.65
-16.0-12.0 -8.0 -4.0 0.0 4.0
Спайки/сек MBE=30.34 Мтт = 25.05
StErr=1.21 StErr=1.61
... n=9 4
-16.0-12.0 -8.0 -4.0 0.0 4.0 8.0 12.0 16.0 20.0 сек
-16.0-12.0 -8.0 -4.0 0.0 4.0 8.0 12.0 16.0 20.0 сек Spike timing llllllll IIJII^^I, I II II II III lllllll I Hill, I II, I,_______
-16.0-12.0 -8.0 -4.0 0.0 4.0 8.0 12.0 16.0 20.0 сек
■ ill mi iiiiiii i iiiiiiiiiiiiiiiiii^ mill ii, ______
Mil IlliIII III llllllllllllllll l lllllllllllllllllll hi, __________
Рис. 5. А–Г – суммарные гистограммы спайков депрессорных проявлений активности – ТД ПТД (А), депрессорно-возбудительных – ТД ПТП (Б), возбудительных – ТП ПТП (В) и возбудительно-депрессорных – ТП ПТД (Г) нейронов SNr, вызванных ВЧС М1 на ротеноновой модели БП. Справа от диаграмм – количество испытаний (n)
Fig. 5. А–Г – histograms of the sum of spikes of inhibitory manifestations – ТД ПТД (А), inhibitory-excitatory ТД ПТП (Б), excitatory – ТП ПТП (В), and excitatory-inhibitory – ТП ПТД (Г) of SNr neurons evoked by high-frequency stimulation of the primary motor cortex in a rotenone-induced model of PD. The number of trials (n) is indicated to the right of each diagram
Сумма Стимуляция спайков Ml 100 Гц
A
Меланин Отведение SNr ТДПТД
Сумма Стимуляция спайков Ml 100 Гц
В
PE
BE
-16.0-12.0 -8.0 -4.0 0.0 4.0 8.0 12.0 16.0 20.0 сек Spike timing
0-
РЕ
III llllllllllllllllllllllllllllllllllllllllllllllllli ,
2.0 Спайки/сек
4.0 6.0 8.0 10.0 12.0
14.0 16.0 18.0 20.0 сек
MpE= 11.56 StErr=0.40
BE
Меланин Отведение SNr ТП ПТП
-16.0-12.0 -8.0 -4.0 0.0 4.0 8.0 12.0 16.0 20.0 сек Spike timing
2.0 4.0 6.0 8.0
Спайки/сек MgE = 9.30
StErr=0.52
MTT = 8 01
StErr=0.23
Mg E-16.05 StErr=0.68
4Д аЪ 12.0 16.0 20.0 сек Меланин
Отведение SNr
। ТД ПТП
-16.0-12.0-8.0 -4.0
Сумма Стимуляция спайков Ml 100 Гц
5 0
10.0 12.0 14.0 16.0 18.0 20.0 се
Мтт = 16.04 МРЕ=11.41
StErr=3.44 StErr=0.55
дД^^фЦ^^
п=4
-16.0-12.0 -8.0 -4.0 0.0 4.0 8.0 12.0 16.0 20.0 сек Spike timing
4^0 8^0 12.0 16.0 20.0 сек
Меланин Отведение SNr ТП птд
-16.0-12.0-8.0 -4.0 0 0
Сумма Стимуляция [ спайков 100 Гц
-16.0-12.0-8.0 -4.0
4.0 8.0 12.0 16.0 20.0 сек
PE
BE
2.0
4.0 6.0 8.0 10.0 12.0
Спайки/сек MBE = 15.25
StErr=1.18
MTT = 7.08
StErr=0.42
14.0 16.0 18.0 20.0 сек
MpE=17.14
StErr=1.57
I I I I T I I I I г
-16.0-12.0 -8.0 -4.0 0.0 4.0 8.0 12.0 16.0 20.0 сек
РЕ
BE
Spike timing
I l | НИ ll | III IIIIIIIIII III I lllllllllllllllllllllllll!llllllllll
2.0 4.0 6.0 8.0 10.0 12.0 14.0 16.0 18.0 20.0 се
Спайки/сек МЕЕ=14.24 Мтт = 18.04 МрЕ=10.07
StErr=0.95 StErr=1.25 StErr=0.43
-16.0-12.0-8.0 -4.0 0.0
4Д 8Д 12.0 16.0 20.0 сек
Рис. 6. А–Г – суммарные гистограммы спайков депрессорных проявлений активности – ТД ПТД (А), депрессорно-возбудительных – ТД ПТП (Б), возбудительных – ТП ПТП (В) и возбудительно-депрессорных – ТП ПТД (Г) нейронов SNr, вызванных ВЧС М1 в на модели ротеноновой БП в условиях использования меланина. Справа от диаграмм – количество испытаний (n)
Fig. 6. А–Г – histograms of the sum of spikes of inhibitory manifestations – ТД ПТД (А), inhibitory-excitatory – ТД ПТП (Б), excitatory ТП ПТП (В) and excitatory-inhibitory ТП ПТД (Г) of SNr neurons evoked by high-frequency stimulation of the primary motor cortex in a rotenone-induced model of PD under the use of Melanin. The number of trials (n) is indicated to the right of each diagram
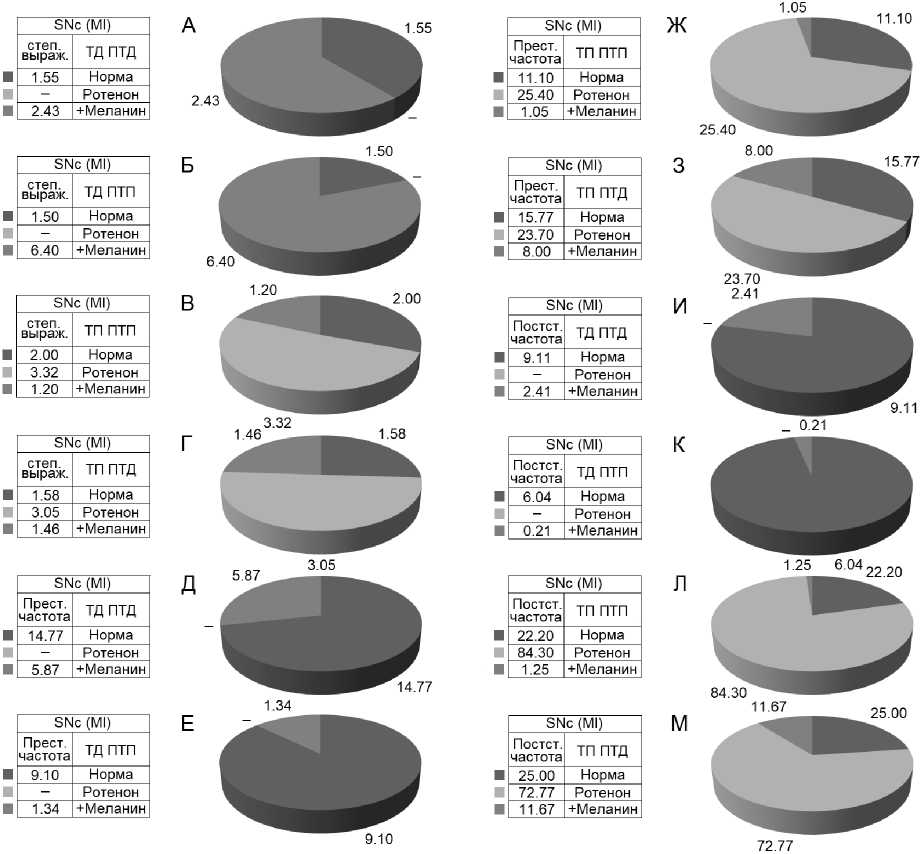
Рис. 7. А, Б – относительная кратность частоты спайковых разрядов депрессорных нейронов SNc до и во время ВЧС М1. В, Г – относительная кратность частоты спайковых разрядов депрессорновозбудительных нейронов SNc во время и до ВЧС М1. Д–З – престимульная частота нейрональных разрядов в различных экспериментальных сериях. И–М – постстимульная частота нейрональных разрядов SNc в различных экспериментальных сериях. Прочерк – указывает на отсутствие соответствующей группы нейронов в серии экспериментов с использованием ротенона. Обозначения: «степ. выраж.» – степень выраженности, «престим» – престимульный, «постстим» – постстимульный
Fig. 7. А, Б – relative multiplicity of the frequency of spike discharges of SNc inhibitory neurons before and during high-frequency stimulation of the primary motor cortex. В, Г – relative multiplicity of the frequency of spike discharges of SNc inhibitory-excitatory neurons before and during high-frequency stimulation of the primary motor cortex. Д–З – prestimulus frequency of neuronal discharges in various experimental series. И–М – post-stimulus frequency of SNc neuronal discharges in various experimental series. A dash indicates the absence of the corresponding group of neurons in a series of experiments with rotenone. Legend: “step. express.” – degree of expression, “prestim” – prestimulus, “poststim” – post-stimulus
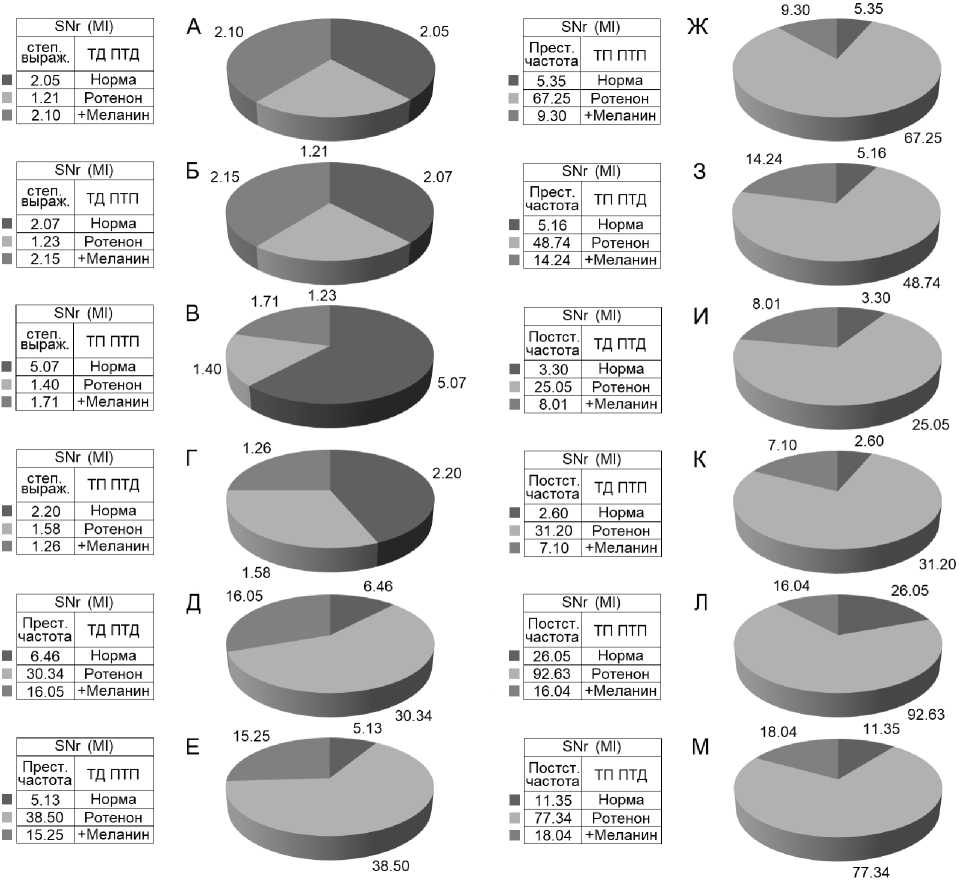
Рис. 8. А, Б – относительная кратность частоты спайковых разрядов депрессорных нейронов SNr до и во время ВЧС М1. В, Г – относительная кратность частоты спайковых разрядов депрессорновозбудительных нейронов SNr во время и до ВЧС М1. Д–З – престимульная частота нейрональных разрядов в различных экспериментальных сериях. И–М – постстимульная частота нейрональных разрядов SNr в различных экспериментальных сериях. Обозначения: «степ выраж» – степень выраженности, «престим» – престимульный, «постстим» – постстимульный
Fig. 8. А, Б – relative multiplicity of the frequency of spike discharges of SNr inhibitory neurons before and during high-frequency stimulation of the primary motor cortex. В, Г – relative multiplicity of the frequency of spike discharges of inhibitory-excitatory neurons SNr before and during high-frequency stimulation of the primary motor cortex. Д–З – prestimulus frequency of neuronal discharges in various experimental series. И–М – post-stimulus frequency of neuronal discharges SNr in various experimental series. Legend: “step express” – degree of expression, “prestim” – prestimulus, “poststim” – post-stimulus
Обсуждение
Согласно современным представлениям, эк-сайтотоксичность при нейродегенеративных болезнях является результатом сверхактивации глутаматных NMDA- и AMPA-рецепторов, содействующей серьезному повреждению нейронов [18], с их гибелью [19, 20]. Возникает она в результате неизбежного развития целого ряда отрицательных явлений, включающих нарушение кальциевой буферизации, генерацию свободных радикалов, активацию митохондриальной проницаемости и вторичной эксайтотоксичности [21].
С целью их предотвращения необходимо восстановление и углубление депрессорных эффектов протекторного назначения и снижения чрезмерных возбудительных [22]. В настоящих экспериментах проведен cравнительный анализ импульсной активности одиночных нейронов SNc (244 нейрона, n = 14) и SNr (355 нейронов, n = 14) при ВЧС M1 в норме, на модели БП и с протекцией меланином. В нейронах SNr при активации М1 коры мозга в целом как депрессорные, так и возбудительные постстимульные реакции оказались резко превалирующими над таковыми в нейронах SNc (2,05; 2,07; 4,87;, 2,21 против 1,55; 1,5; 2,0; 1,58), что свидетельствует о большей выраженности корковой проекции к SNr в сравнении с SNc. Более того, в условиях БП выявлена большая ранимость депрессорных постстимульных проявлений активности нейронов SNc в сравнении с SNr с формированием тяжелой эксайтотоксичности. На модели БП в сравнении с нормой при полном отсутствии
депрессорных постстимульных эффектов и более выраженных возбудительных в нейронах SNc (3,05, 3,32 против 2,0, 1,58) нейроны SNr сохраняют депрессорные постстимульные реакции, хотя и сниженные, но снижены и возбудительные (1,21; 1,23; 1,38; 1,6 в патологии против 2,05; 2,07; 4,87; 2,21 в норме), что свидетельcтвует также о меньшей подверженности нейронов SNr эксайтоток-сичности в сравнении с таковыми SNc.
С использованием меланина в нейронах SNс имело место восстановление депрессорных постстимульных эффектов даже выше нормы (1,56- и 4,26-кратно) и резкое снижение таковых возбудительных (2,76- и 2,11-кратно). В нейронах SNr показано повышение депрессорных постстимульных эффектов (1,73- и 1,75-кратно) с выравниванием с нормой, хотя возбудительные – не претерпели ощутимых изменений, что следовало ожидать из-за меньшей подверженности SNr БП. Восстановление депрессорных проявлений активности позволяет считать очевидным протекторный эффект меланина, направленный против эксайтотоксичности.
Заключение
Сравнительный анализ пре- и постстимульной частоты активности нейронов SNc и SNr при ВЧС МI на модели БП в условиях протекции меланином привел к заключению о неизбежной эксайто-токсичности, сопровождающей нейродегенератив-ное повреждение, которое успешно исключалось протекторным воздействием меланина.
Список литературы Соотношение возбудительных и тормозных синаптических процессов в кортико-нигральных проекциях на модели болезни Паркинсона с протекцией меланином
- Goldman J.G., Sieg E. Cognitive impairment and dementia in Parkinson disease. Clinics in Ge-riatric Medicine. 2020;36(2):365–77. DOI: 10.1016/j.cger.2020.01.001
- Uc E.Y., Rizzo M., O’Shea A.M.J. et al. Longitudinal decline of driving safety in Parkinson dis-ease. Neurology. 2017;89(19):1951–1958. DOI: 10.1212/WNL.0000000000004629
- Zhou F.M., Lee C.R. Intrinsic and integrative properties of substantia nigra pars reticulata neu-rons. Neuroscience. 2011;198:69–94. DOI: 10.1016/j.neuroscience.2011.07.061.
- Guatteo E., Cucchiaroni M.L., Mercuri N.BJ. Substantia nigra control of basal ganglia nuclei. Journal of Neural Transmission. Supplementa. 2009;73: 91–101. DOI: 10.1007/978-3-211-92660-4_7.
- Carman J.B. Anatomic basis of surgical treatment of Parkinson's disease. The New England Journal of Medicine. 1968;17:919–930. DOI: 10.1056/NEJM196810242791706
- Weinberger D.R. Implications of the normal brain development for the pathogenesis of schizophrenia. Archives Of General Psychiatry. 1987;44:660–669. DOI: 10.1001/archpsyc.1987.01800190080012.
- Wise R.A. Roles for nigrostriatal-not just mesocorticolimbic-dopamine in reward and addiction. Trends in Neurosciences. 2009;32:517–524. DOI: 10.1016/j.tins.2009.06.004
- Kolomiets B.P., Deniau J.M., Glowinski J., Thierry A.M. Basal ganglia and processing of cortic-al information: functional interactions between trans-striatal and trans-subthalamic circuits in the subs-tantia nigra pars reticulata. Neuroscience. 2003;117(4):931–938. DOI: 10.1016/s0306-4522(02)00824-2
- Menke R.A., Jbabdi S., Miller K.L., Matthews P.M., Zarei M. Connectivity-based segmentation of the substantia nigra in human and its implications in Parkinsons disease. Neuroimage. 2010;52:1175–1180. DOI: 10.1016/j.neuroimage.2010.05.086
- Kwon H.G., Jang S.H. Differences in neural connectivity between the substantia nigra and ven-tral tegmental area in the human brain. Frontiers in Human Neuroscience. 2014.8:41. DOI: 10.3389/fnhum.2014.00041
- Kornhuber J. The cortico-nigral projection: reduced glutamate content in the substantia nigra following frontal cortex ablation in the rat. Brain Research.1984;322(1):124–126. DOI: 10.1016/0006-8993(84)91189-2
- Frankle W.G., Laruelle M., Haber S.N. Stable and unstable activation of the prefrontal cortex with dopaminergic modulation. Neuropsychopharmacology. 2006;31:1627–1636.
- Sesack S.R, Carr D.B. Selective prefrontal cortex inputs to dopamine cells: implications for schizophrenia. Physiology and Behavior. 2002;77:513–517. DOI: 10.1016/s0031-9384(02)00931-9
- Cacciola A., Milardi D., Quartarone A. Role of cortico-pallidal connectivity in the pathophysi-ology of dystonia. Brain. 2016;139(9):e48. DOI: 10.1093/brain/aww102
- Gao X.B. Peptides Electrophysiological effects of MCH on neurons in the hypothalamus. 2009;30(11):2025–2030. DOI: 10.1016/j.peptides.2009.05.006.
- Paxinos G., Watson C. The rat brain in stereotaxic coordinates. Elsevier, Academic Press. 5th ed. 2005:367.
- Kilkenny C., Browne W., Cuthill I.C., Emerson M., Altman D.G. Animal research: Reporting in vivo experiments: The ARRIVE guidelines. British Journal of Pharmacology. 2010;160(7):1577–1579. DOI: 10.1111/j.1476-5381.2010.00872.x
- Matthew R.H., Heather L.S., Peter R.D. Glutamate-mediated excitotoxicity and neurodegenera-tion in Alzheimer’s disease. Comprehensive Cancer Information. 2004;45(5):583–595. DOI: 10.1016/j.neuint.2004.03.007.
- Lucas D.R., Newhouse J.P. The toxic effect of sodium L-glutamate on the inner layers of the re-tina. Archives of ophthalmology 1957;58(2):193–201. DOI: 10.1001/archopht.1957.00940010205006.
- Olney J.W. Brain lesions, obesity, and other disturbances in mice treated with monosodium glu-tamate. Science. 1969;164(3880):719–721. DOI: 10.1126/science.164.3880.719.
- Dong X.X., Wang Y. Qin Z.H. Molecular mechanisms of excitotoxicity and their relevance to pathogenesis of neurodegenerative diseases. Acta Pharmacologica Sinica. 2009;30(4):379–387. DOI: 10.1038/aps.2009.24
- Назначение депрессорных синаптических процессов в условиях специфической нейроде-генеративной патологии и протекции / Дж.С. Саркисян, М.В. Погосян, М.А. Даниелян, А.Ю. Степанян, А.В. Варданян. LAP LAMBERT Academic Publishing RU. 2018. 252 с. Sarkissian J.S., Poghosyan M.V., Danielyan M.A., Stepanyan H.Y., Vardanyan A.V. The assign of depressor synaptic processes in condition of specific neurodegenerative pathology and protection. LAP LAMBERT Academic Publishing RU 2018:252 (in Russ.).


