Состав и метаболический потенциал микробиома кишечника бройлеров Gallus gallus L. Под влиянием кормовых добавок при экспериментальном Т-2 токсикозе
Автор: Йылдырым Е.А., Грозина А.А., Вертипрахов В.Г., Ильина Л.А., Филиппова В.А., Лаптев Г.Ю., Пономарева Е.С., Дубровин А.В., Калиткина К.А., Молотков В.В., Ахматчин Д.А., Бражник Е.А., Новикова Н.И., Тюрина Д.Г.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Экспериментальные микотоксикозы
Статья в выпуске: 4 т.57, 2022 года.
Бесплатный доступ
Микотоксины негативно влияют на состав и функции кишечной микробиоты у сельскохозяйственной птицы и, как следствие, на ее здоровье. Одной из стратегий восстановления микробиома и борьбы с микотоксикозами стало введение добавок в загрязненные корма. В настоящей работе впервые показано, что кормовая добавка Заслон 2+ эффективно улучшает структуру и метаболический потенциал кишечного микробиома у цыплят-бройлеров при экспериментальном Т-2 микотоксикозе. Нашей целью было выявление изменений микробиоты химуса и ее функциональная аннотация после 14-суточного воздействия Т-2 токсина, искусственно внесенного с кормами, и под влиянием кормовой добавки Заслон 2+, применяемой отдельно и в сочетании с протеолитическим препаратом Axtra Pro на фоне экспериментального микотоксикоза. Опыты проводили в 2021 году в виварии Всероссийского научно-исследовательского и технологического института птицеводства на цыплятах-бройлерах кросса Смена 8 (с 33- до 47-суточного возраста). Корм контаминировали Т-2 токсином механическим способом. Птицу разделили на четыре группы по 5 гол. в каждой: I группа (контроль) получала основной рацион (ОР) без введения Т-2 токсина, II группа - ОР с добавлением Т-2 токсина (200 мкг/кг, 2-кратное превышение ПДК), III - ОР с добавлением Т-2 токсина (200 мкг/кг) и кормовую добавку Заслон 2+, состоящую из сорбирующего материала диатомита, двух культур бактерий Bacillus spp., смеси натуральных эфирных масел эвкалипта, чабреца, чеснока и лимона (ООО «БИОТРОФ», Россия) (1 г/кг корма), IV - ОР с добавлением Т-2 токсина (200 мкг/кг), кормовую добавку Заслон 2+ (1 г/кг корма) и ферментный препарат с протеолитической активностью Axtra Pro («DuPont de Nemours, Inc.», США) (100 мг/кг корма). Потребление корма бройлерами составляло в среднем 150 г/сут, то есть птицы опытных групп ежесуточно получали Т-2 токсин с кормом в количестве 30 мкг. В конце эксперимента проводили отбор проб химуса слепых отростков кишечника от трех птиц из каждой группы. Тотальную ДНК из исследуемых образцов выделяли с использованием набора «Genomic DNA Purification Kit» («Fermentas, Inc.», Литва). Бактериальное сообщество слепой кишки оценивали методом NGS-секвенирования на платформе MiSeq («Illumina, Inc.», США) с применением праймеров для V3-V4 региона гена 16S рРНК. Биоинформатический анализ данных выполняли с помощью программного обеспечения QIIME2 ver. 2020.8 (https://docs.qiime2.org/2020.8/). Реконструкцию и прогнозирование функционального содержания метагенома, семейств генов, ферментов осуществляли при помощи программного комплекса PICRUSt2 (v.2.3.0) (https://github.com/picrust/picrust2). Для анализа метаболических путей и ферментов пользовались базой данных MetaCyc (https://metacyc.org/). При проведении NGS-секвенирования микробиома было показано, что в кишечнике у бройлеров из II группы происходили сдвиги в биоразнообразии и составе микробиома уже на уровне филумов: обилие бактерий суперфилума Actinobacteriota и филума Proteobacteria возрастало соответственно в 1,8 и 3,5 раза (р ≤ 0,05), суперфилума Desulfobacterota - напротив, снижалось в 2,2 раза (р ≤ 0,05). У птицы из IV группы с введением в рацион комплекса, включающего кормовую добавку Заслон 2+ и фермент, количество бактерий суперфилума Actinobacteriota и филума Proteobacteria также возрастало по сравнению с I группой (р ≤ 0,05), тогда как в III группе подобных изменений не отмечали. Представители суперфилума Verrucomicrobiota полностью исчезали во II и IV группах, но в I группе присутствовали в значительном количестве - 14,1±0,8 %. У птицы из III группы по сравнению с I группой повышалась численность бактерий рода Lactobacillus (с 15,9±1,32 до 30,7±1,84 %, p ≤ 0,01). Доля микроорганизмов рода Akkermansia , которые были представлены единственным видом A. muciniphila , резко уменьшалась (p ≤ 0,001) во всех группах, получавших Т-2 токсин, вплоть до полного отсутствия во II и IV группах. При загрязнении корма Т-2 токсином во II группе появлялись отсутствовавшие в контроле патогенные микроорганизмы - Enterococcus cecorum , Campylobacter concisus , Campylobacter gracilis , Streptococcus gordonii , Flavonifractor spp. В III и IV группах эти патогены либо отсутствовали, либо были представлены в значительно меньшем количестве, чем во II группе (р ≤ 0,05). Функциональная аннотация микробных сообществ показала, что экспериментальные группы различались (р ≤ 0,05) по 163 прогнозируемым метаболическим путям. При воздействии Т-2 токсина отмечалось усиление (p ≤ 0,05) метаболических путей деградации ароматических соединений (включая ксенобиотики) и аминокислот, а также синтеза коферментов и кофакторов, образования биопленок, клеточных стенок, спор и протекторных веществ в клетках. Применение кормовой добавки Заслон 2+ способствовало модуляции функционального потенциала кишечной микробиоты до уровня контрольной группы, при сочетании кормовой добавки и протеазы положительного эффекта не отмечали.
Микотоксины, т-2 токсин, бройлеры, микробиом кишечника, экспрессия генов, сельскохозяйственная птица
Короткий адрес: https://sciup.org/142236373
IDR: 142236373 | УДК: 636.52/.58:616-099:636.087.7:579 | DOI: 10.15389/agrobiology.2022.4.743rus
Текст научной статьи Состав и метаболический потенциал микробиома кишечника бройлеров Gallus gallus L. Под влиянием кормовых добавок при экспериментальном Т-2 токсикозе
Микотоксины — это группа соединений, которые образуются в результате вторичного метаболизма плесневых грибов и обладают высокой токсичностью для животных, птиц и человека (1). За их продукцию ответственны микромицеты родов Aspergillus , Fusarium , Penicillium , Alternaria , Phomopsis , Emericella , Cephalosporium , Myrothecium , Trichoderma , Trichothecium , Ne-opetromyces , Byssochlamys , Neotyphodium и Claviceps . В среднем 25 % мировой сельскохозяйственной продукции и кормов в той или иной степени загрязнены микотоксинами (2), что вызывает массовые отравления как людей, так и сельскохозяйственных животных во многих странах (1).
Т-2 токсин — один из наиболее опасных микотоксинов (3). Он относится к трихотеценам (4), вырабатываемым микромицетами родов Fusarium , Myrothecium и Stachybotrys . T-2 токсин часто встречается в зерне пшеницы, кукурузы, ячменя, риса, соевых бобов, овсе (5), продуктах его переработки и комбикормах, включая комбикорма для птиц (6).
К основным симптомам Т-2 токсикозов у домашней птицы относятся геморрагическое некротическое язвенное воспаление пищеварительного тракта с утолщением слизистой оболочки, шаткая походка и отказ от корма (7). Было отмечено (8), что острая интоксикация цыплят-бройлеров проявляется симптомами внутреннего кровоизлияния, поражений полости рта и кожи (некрогеморрагический дерматит), ухудшения качества перьев и нарушений со стороны нервной системы. При низких дозах наблюдалось значительное снижение количества гемоглобина в крови у цыплят-бройлеров (8). Кроме того, при воздействии низких доз Т-2 отмечали снижение содержания общего белка и холестерина и повышение — мочевой кислоты и лактатдегидрогеназы в сыворотке (9, 10), что убедительно доказывает токсическое воздействие Т-2 токсина даже в низких дозировках. Патологоанатомические исследования обычно выявляют жировую дистрофию и выраженную гранулярную дегенерацию в печени, почках и редко — в сердце (11).
Исполнение роли селективного проницаемого барьера помещает эпителий слизистой оболочки кишечника в центр взаимодействий между иммунной системой слизистой и химусом, который включает нормофлору, патогены и пищевые токсиканты (12). Известно, что микотоксины могут тем или иным образом модулировать состав микробиоты кишечника, что оказывает пагубное влияние на здоровье хозяина (13). При воздействии токсинов нарушается целостность кишечного эпителия, в результате чего патогенные микроорганизмы проникают в макроорганизм (14). В то же время микробиота кишечника может метаболизировать микотоксины, тем самым превращая их в иные химические структуры с большей или меньшей токсичностью, чем первоначальные соединения (13). По всей видимости, кишечный микробиом обладает не только прямым потенциалом метаболизма в отношении ксенобиотиков, но и оказывает влияние на экспрессию генов и активность ферментов хозяина. Так, W. Meinl с соавт. (15) продемонстрировали, что кишечная микробиота воздействует на экспрессию генов GSTs, GPX2, EPHXs и NNAT 1, связанных с детоксикацией ксенобиотиков, в тканях толстого кишечника и печени хозяина. Исследования, касающиеся изучения состава микробиома животных и птиц под влиянием микотоксинов крайне ограничены (16, 17). Анализ изменений прогнозируемого функционального потенциала микробиома животных, птиц и человека с применением биоинформатических программных комплексов, таких как PICRUSt2 и ему подобных, ранее не проводился. Также не изучалось влияние Т-2 токсина на состав и функциональный потенциал микробиома кишечника у птиц.
Для профилактики микотоксикозов используются сорбенты, которые избирательно связывают токсины в процессе пищеварения, предотвращая их всасывание из желудочно-кишечного тракта и, следовательно, уменьшая токсическое действие. Известно, что обогащение кормов пробиотиками, аминокислотами, липидами, ферментами оказывает позитивное влияние и снижает проявление симптомов Т-2-токсикоза (3). Например, включение бактериальных культур Lactobacillus spp. в рацион цыплят-бройлеров уменьшало токсические эффекты от афлатоксина B 1 , зеараленона (18) и ДОН (19). H. Tozaki с соавт. (20) продемонстрировали, что перспективным приемом деградации ксенобиотиков может быть использование ферментов, в частности протеаз.
В настоящей работе мы впервые установили изменения состава микробиома бройлеров под влиянием кормовой добавки Заслон 2+ и протеолитического фермента Axtra Pro на фоне искусственного загрязнения кормов Т-2 токсином.
Нашей целью был комплексный анализ влияния 14-суточного воздействия Т-2 токсина, искусственно внесенного в корма, а также кормовой добавки Заслон 2+ и протеолитического фермента Axtra Pro на состав микробиома химуса цыплят-бройлеров кросса Смена 8 и его функциональный потенциал.
Методика. Эксперименты проводили в 2021 году в виварии Всероссийского научно-исследовательского и технологического института птицеводства на цыплятах-бройлерах ( Gallus gallus L.) кросса Смена 8 с 33- до 47-суточного возраста согласно требованиям Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях (ETS ¹ 123, Страсбург, 1986) (21). Условия кормления и содержания соответствовали требованиям для кросса бройлеров (22). Для кормления применяли комбикорм ПК-6 (Россия) для бройлеров в виде россыпи. Кормление и поение птицы не ограничивали. Продолжительность эксперимента составила 14 сут.
Была выполнена экспериментальная контаминация корма Т-2 токсином (2-кратное превышение ПДК) механическим способом с соблюдением требований безопасности персонала. Для работы применяли сертифицированный калибровочный стандарт «Т-2 токсин» в виде порошка с массовой долей основного вещества 99,7±0,3 % («Romer Labs», Австрия; cat. ¹ 10000310, LOT #S17052T). До и после проведения контаминации комбикорм исследовали на наличие микотоксинов методом высокоэффективной жидкостной хроматографии с тандемной масс-спектрометрией (ВЭЖХ-МС/МС, хроматографическая система Agilent 1260 Infinity LC, «Agilent Technologies», США; масс-спектрометр AB SCIEX Triple Quad TM
5500, «AB Sciex», США; колонка для обращенно-фазового разделения Gemini® С18 110А 5 µ m 150½4,6 mm, «Phenomenex», США). Для построения калибровочных графиков и в качестве внутренних стандартов использовали стандартный раствор Т-2 токсина. Кроме указанного, рацион бройлеров практически не содержал фоновых количеств микотоксинов. Для определения фонового содержания микотоксинов в кормах применяли систему ВЭЖХ-МС/МС. При построении калибровочных графиков и в качестве внутренних стандартов использовали стандартные растворы микотоксинов («Romer Labs», Австрия). В используемых для заражения кормах не было обнаружено афлатоксинов (B 1 , G 1 ), фумонизинов (B 1 , B 2 , B 3 ), дезоксини-валенола, Т-2 токсина, зеараленона и охратоксина А.
Птиц разделили на четыре группы по 5 гол. в каждой: I группа (контрольная) получала основной рацион (ОР) без введения Т-2 токсина, II группа — ОР с добавлением Т-2 токсина (200 мкг/кг), III опытная — ОР с добавлением Т-2 токсина (200 мкг/кг) и кормовой добавки Заслон 2+, состоящей из сорбирующего материала диатомита, двух культур бактерий Bacillus spp., смеси натуральных эфирных масел эвкалипта, чабреца, чеснока и лимона (ООО «БИОТРОФ», Россия) (1 г/кг корма), IV опытная — ОР с добавлением Т-2 токсина (200 мкг/кг), кормовой добавки Заслон 2+ (1 г/кг корма) и ферментного препарата с протеолитической активностью Axtra Pro («DuPont de Nemours, Inc.», США) (100 мг/кг корма). Потребление корма бройлерами составляло в среднем 150 г/сут, то есть птица опытных групп ежесуточно получала Т-2 токсин с кормом в количестве 30 мкг.
В конце эксперимента птицу декапитировали и проводили вскрытие. Вручную отбирали пробы химуса из слепых отростков кишечника от трех птиц из каждой группы (30-50 г) с максимально возможным соблюдением условий асептики. Отобранные образцы немедленно помещали в центрифужные стерильные пластиковые пробирки. Все образцы замораживали при - 20 ° C и транспортировали в сухом льду для последующего выделения ДНК.
Тотальную ДНК выделяли с использованием набора Genomic DNA Purification Kit («Fermentas, Inc.», Литва) согласно прилагаемой инструкции. Метод основан на селективном детергентно-опосредованном осаждении ДНК из субстрата с применением растворов 1,2 М хлорида натрия и хлороформа для лизиса клеточных стенок и осаждения ДНК.
Бактериальное сообщество слепой кишки оценивали методом NGS-секвенирования на платформе MiSeq («Illumina, Inc.», США) с праймерами для V3-V4 региона гена 16S рРНК. Прямой праймер: 5´-TCGTCGGCAG-CGTCAGATGTGTATAAGAGACAGCCTACGGGNGGCWGCAG-3´; обратный праймер: 5´-GTCTCGTGGGCTCGGAGATGTGTATAAGAGACAGG-ACTACHVGGGTATCTAATCC-3´.
ПЦР проводили при следующих условиях: 3 мин при 95 ° С; 30 с при 95 ° С, 30 с при 55 ° С, 30 с при 72 ° С (необходимо для удлинения последовательности) (25 циклов); 5 мин при 72 ° С (окончательная элонгация). Секвенирование осуществляли с реагентами для подготовки библиотек Nextera® XT IndexKit («Illumina, Inc.», США), для очистки ПЦР-продуктов Agencourt AMPure XP («Beckman Coulter Inc.», США) и для проведения секвенирования MiSeq® ReagentKit v2 (500 cycle) («Illumina, Inc.», США). Максимальная длина полученных последовательностей составила 2½250 п.н.
Биоинформатический анализ данных выполняли с помощью программного обеспечения QIIME2 ver. 2020.8 . После импорта последовательностей в формате .fastq из секвенирующего прибора и создания необходимых для работы файлов сопоставления, содержащих метаданные изучаемых файлов, парные строки прочтений были выровнены. Далее последовательности фильтровали по качеству с использованием параметров настроек по умолчанию. Фильтрацию шумовых последовательностей проводили с помощью вcтроенного в пакет QIIME2 метода DADA2, включающего информацию о качестве в свою модель ошибок, что делает алгоритм устойчивым к последовательности более низкого качества, при этом использовали максимальную длину последовательности обрезки, равную 250 п.н. . Для построения филогении de novo выполнили множественное выравнивание последовательностей, применяя программный пакет MAFFT , далее проводили маскированное выравнивание последовательностей, чтобы удалить позиции, которые значительно различались. Для анализа таксономии использовали справочную базу данных Silva 138.1 .
На основании полученной таблицы оперативно-таксономических единиц (ОТЕ, оperational taxonomic unit — OTU) с использованием плагинов программного пакета QIIME2 были рассчитаны индексы биоразнообразия, а также построен график зависимости числа ОТЕ от числа прочтений. При статистическом анализе индексов разнообразия их дополнительное преобразование не проводили.
Реконструкцию и прогнозирование функционального содержания метагенома, семейств генов, ферментов осуществляли при помощи программного комплекса PICRUSt2 (v.2.3.0) (23). С программой работали согласно рекомендованному сценарию действий, все настройки использовали по умолчанию. ОТЕ каждого образца расположили в соответствии с его содержанием, от большего к меньшему, значения преобразовали с помощью логарифмического преобразования Log2. Для анализа метаболических путей и ферментов пользовались базой данных MetaCyc . Прогнозируемые профили метаболических путей MetaCyc оценивали по обилию ASV (Amplicon Sequence Variants) (24). Визуализацию данных и подсчет статистических показатели проводили с помощью веб-приложения Phantasus v1.11.0 , в котором, помимо основных методов визуализации и фильтрации, поддерживаются методы на основе R, такие как кластеризация k-средних, анализ основных компонентов или анализ дифференциальных выражений с пакетом limma.
Математическую и статистическую обработку результатов осуществляли методом многофакторного дисперсионного анализа (multifactor ANalysis Of VAriance, ANOVA) в программах Microsoft Excel XP/2003, R-Studio (Version 1.1.453) . Результаты представлены как средние значения (M) и стандартные ошибки средних (±SEM). Достоверность различий устанавливали по t-критерию Стьюдента, различия считали статистически значимыми при p ≤ 0,05. Средние значения сравнивали с использованием теста достоверно значимой разницы Тьюки (HSD) и функции TukeyHSD в пакете R Stats Package.
Результаты. При проведении NGS-секвенирования микробиома было сгенерировано в общей сложности 85,121 секвенированных последовательностей гена 16S рРНК (с медианой считываний 7,253, min = 3,330, max = 10,859). Число ОТЕ статистически значимо не различалось (р > 0,05) между опытными группами (рис. 1).
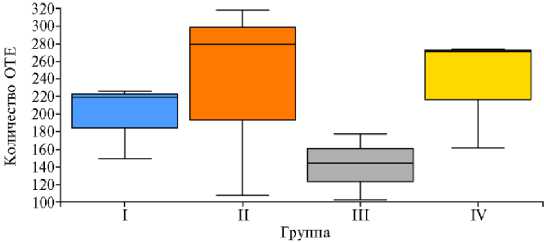
Рис. 1. Число оперативных таксономических единиц (ОТЕ) по результатам NGS-секвенирования микробиома кишечника цыплят-бройлеров ( Gallus gallus L.) кросса Смена 8 при скармливании Т-2 токсина, кормовой добавки Заслон 2+ (ООО «БИОТРОФ», Россия) и ферментного препарата с протеолитической активностью Axtra Pro («DuPont de Nemours, Inc.», США) (опыт в виварии ФНЦ ВНИТИП РАН, 2021 год) . Описание групп см. в разделе «Методика».
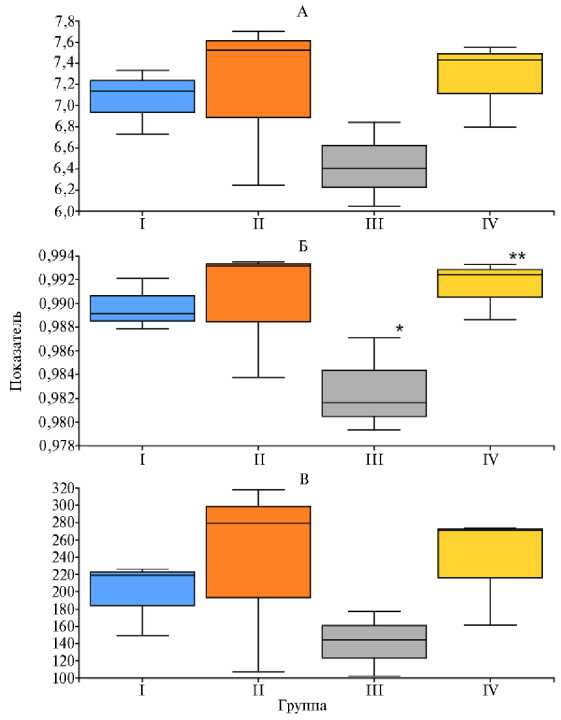
Рис. 2. Абсолютные значения индексов биоразнообразия Шеннона (А) , Симпсона (Б) и Chao1 (В) для микробиома кишечника цыплят-бройлеров ( Gallus gallus L.) кросса Смена 8 при скармливании Т-2 токсина, кормовой добавки Заслон 2+ (ООО «БИОТРОФ», Россия) и ферментного препарата с протеолитической активностью Axtra Pro («DuPont de Nemours, Inc.», США) (опыт в виварии ФНЦ ВНИТИП РАН, 2021 год) . Рассчитано с использованием плагинов программного пакета QIIME2 ver. 2020.8. Описание групп см. в разделе «Методика».
*, ** Различия статистически значимы при р ≤ 0,05 при сравнении соответственно с I и III группой.
При сопоставлении по индексу Симпсона оказалось, что в III группе биоразнообразие снижалось (р ≤ 0,05) по сравнению с контрольной I груп-
пой (рис. 2). Мы предполагаем, что снижение биоразнообразия связано со стабилизацией микробиома под влиянием кормовой добавки Заслон 2+. По мнению J. Knol с соавт. (25), это может иметь положительный эффект, поскольку большое число взаимодействующих видов нередко имеет тенденцию оказывать дестабилизирующее воздействие на микробиом. Ранее показано, что пребиотики, подавляя рост потенциально патогенных Clostridium spp. и Salmonella spp., способствовали формированию более стабильных микробных сообществ кишечника с низким биоразнообразием (26). В IV группе наблюдалось повышение (р ≤ 0,05) биоразнообразия в кишечнике по сравнению с III группой (см. рис. 2), что, вероятно, связано с введением протеолитического фермента. В работе J.M. Lourenco с соавт. (27) сообщалось, что добавление в рацион бройлеров протеазы оказало влияние как на богатство, так и на разнообразие микробных популяций: при введении фермента увеличилось количество ОТЕ (р = 0,04) и значение индекса Chao1 (р = 0,09).
Относительная частота, %
Ф Firmicutes ф Bacleroidota Ф Verrucomicrobiota Actinobacteriota Proteobacteria Cyanobacteria
Ф Desulfobacterota
Ф Fusobactenota
О Pateseibacterta
Campilobacterota
Ф Sptrochaetota WPS-2
Ф Synergistota
Elusimicrobiota
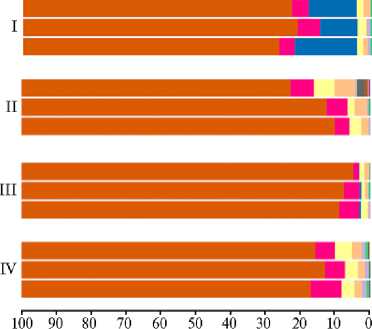
Рис. 3. Состав кишечного микробиома у цыплят-бройлеров ( Gallus gallus L.) кросса Смена 8 на уровне бактериальных филумов (по данным NGS-секвенирования ампликонов гена 16S рРНК) при скармливании Т-2 токсина, кормовой добавки Заслон 2+ (ООО «БИОТРОФ», Россия) и ферментного препарата с протеолитической активностью Axtra Pro («DuPont de Nemours, Inc.», США) (опыт в виварии ФНЦ ВНИТИП РАН, 2021 год) . Описание групп см. в разделе «Методика».
В составе микробиома кишечника у птицы из всех групп присутствовало 15 бактериальных филумов и суперфилумов (рис. 3). Среди них доминировали Firmicutes , Verrucomicrobiota , Proteobacteria , Actinobacteriota , Bac-teroidota , при этом самым многочисленным оказался филум Firmicutes (от 71,1±3,9 до 94,8±5,7 %). Преобладание бактерий филума Firmicutes в составе кишечного микробиома сельскохозяйственной птицы было показано и ранее (28, 29). Важная функция Firmicutes — это способность разлагать сложные полисахариды с последующим образованием короткоцепочечных жирных кислот (30). Короткоцепочечные жирные кислоты играют важную роль в энергетическом метаболизме хозяина, способствуя росту и нормальному функционированию клеток кишечника (31).
В кишечнике птицы из II группы при введении Т-2 токсина в корм содержание бактерий суперфилума Actinobacteriota и филума Proteobacteria возрастало соответственно в 1,8 и 3,5 раза (р ≤ 0,05), бактерий суперфилума Desulfobacterota — снижалось в 2,2 раза (р ≤ 0,05). В кишечнике бройлеров из IV группы количество бактерий суперфилума Actinobacteriota и филума Proteobacteria также возрастало по сравнению с I группой (р ≤ 0,05), тогда как в III группе (использование кормовой добавки Заслон 2+) подобных изменений не отмечали.
Интересно, что в составе микробиома во II и IV группах появлялись новые суперфилумы — Fusobacteriota и Spirochaetota (среди представителей указанных таксонов нередко встречаются патогены) (32, 33). В III группе, получавшей кормовую добавку Заслон 2+, эти филумы мы не выявили. Обращает на себя особое внимание тот факт, что представители суперфилума Verrucomicrobiota полностью исчезали во II и IV группах, тогда как в I группе присутствовали в значительном количестве (14,1±0,8 %). В III группе с введением кормовой добавки Заслон 2+ на фоне Т-2 токсина их содержание было очень низким (0,39±0,03 %) по сравнению с I группой (р ≤ 0,001). Вероятно, бактерии суперфилума Verrucomicrobiota проявляют наибольшую чувствительность к воздействию Т-2 токсина по сравнению с другой кишечной микробиотой. Известно (34), что Verrucomicrobiota синтезируют множество гликозидгидролаз, предназначенных для деградации стабильных полисахаридов. Поэтому резкое снижение их содержания в кишечнике птицы при воздействии Т-2 токсина могло быть связано с угнетением процессов переваривания клетчатки.
Наиболее обильно представленными микроорганизмами среди фи-лума Firmicutes были бактерии рода Lactobacillus spp. семейства Lactobacil-laceae (от 11,1±0,72 до 30,7±1,84 % в зависимости от экспериментальной группы) и Clostridia_UCG-014 семейства Clostridia_UCG-014 (от 17,6±0,91 до 25,5±1,34 %). В I группе также были широко представлены микроорганизмы филума Verrucomicrobiota — бактерии рода Akkermansia семейства Ak-kermansiaceae (14,1±0,82 %) (рис. 4, 5). Для бактерий Lactobacillus spp. ранее также было показано, что они составляют одну из преобладающих групп в желудочно-кишечном тракте сельскохозяйственных птиц (35, 36).
Увеличение содержания бактерий рода Lactobacillus в кишечнике птицы из III группы при использовании кормовой добавки Заслон 2+ по сравнению с I группой с 15,9±1,32 до 30,7±1,84 % (p ≤ 0,01), вероятно, имело позитивный характер. Эти микроорганизмы способны вырабатывать значительное количество молочной и уксусной кислот, снижающих значения рН в желудочно-кишечном тракте (37), конкурировать с патогенами за питательные вещества и участки эпителия для адгезии (38).
Точная роль представителей рода Clostridia_UCG-014 до конца не ясна в связи с отсутствием способности расти на лабораторных средах. По мнению С. Yang с соавт. (39), Clostridia_UCG-014 играют положительную роль для макроорганизма. Авторами показано, что в кишечнике человека на фоне заболевания язвенным колитом и применения препарата декстрансульфата натрия происходило нарушение состава микробиома, в частности снижение численности Clostridia_UCG-014. Использование полисахарида куркумы приводило к восстановлению состава микробиоты и увеличению содержания этих микроорганизмов. В нашем эксперименте на фоне введения в рацион Т-2 токсина (II группа) наблюдалось возрастание численности Clostridia_UCG-014 по сравнению с контролем, что может указывать на их участие в инициации дисбиотических нарушений на фоне введения токсина. В то же время Clostridia_UCG-014 могут быть более устойчивыми к Т-2 токсину, чем другие представители микробиоты, вследствие способности к спорообразованию, повышенной толерантности к кислотам и другим агрессивным веществам (40, 41) и играть роль в процессе детоксикации токсина.
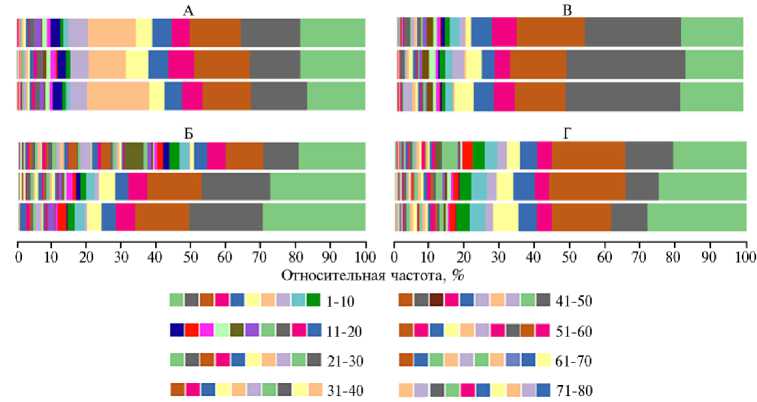
Рис. 4. Состав кишечного микробиома у цыплят-бройлеров ( Gallus gallus L.) кросса Смена 8 на уровне бактериальных семейств (по данным NGS-секвенирования ампликонов гена 16S рРНК) при скармливании Т-2 токсина, кормовой добавки Заслон 2+ (ООО «БИОТРОФ», Россия) и ферментного препарата с протеолитической активностью Axtra Pro («DuPont de Nemours, Inc.», США) : 1-10 — Clostridia_UCG-014, Lactobacillaceae , Ruminococcaceae , Lachnospiraceae , Oscillo-spiraceae , Rikenellaceae , Akkermansiaceae , Eubacterium coprostanoligenes group, Christensenellaceae , RF39; 11-20 — Erysipelatoclostridiaceae, Bifidobacteriaceae, Anaerovoracaceae, Butyricicoccaceae, Clostridia vadinBB60 group, Enterobacteriaceae , Clostridiaceae , Coriobacteriales , Gastranaerophilales , Peptococcaceae ; 21-30 — Monoglobaceae , Erysipelotrichaceae , Veillonellaceae , Peptostreptococcaceae , Enterococcaceae , Chitinophagaceae , Desulfovibrionaceae , Prevotellaceae , Xanthomonadaceae , Pseudo-monadaceae ; 31-40 — Neisseriaceae , Anaerofustaceae , Corynebacteriaceae , Sphingomonadaceae , Acti-nomycetaceae , Leptotrichiaceae , Fusobacteriaceae , Carnobacteriaceae , UCG-010, Eggerthellaceae ; 4150 — Streptococcaceae , Selenomonadaceae , Flavobacteriaceae , Micrococcaceae , Campylobacteraceae , Bacillaceae , Saccharimonadales , Defluviitaleaceae , Xanthobacteraceae , Saccharimonadaceae ; 51-60 — Izemoplasmatales , Oxalobacteraceae , Peptostreptococcales - Tissierellales , Spirochaetaceae , Propionibac-teriaceae , Tannerellaceae , Gemellaceae , Lentimicrobiaceae , Atopobiaceae , Bacteroidaceae ; 61-70 — Burkholderiaceae , Weeksellaceae , Pasteurellaceae , Porphyromonadaceae , Staphylococcaceae , Acholeplas-mataceae , Alcaligenaceae , JCI 0000069-P22, Synergistaceae , Chloroplast ; 71-80 — Sphingobacteriaceae , Cardiobacteriaceae , Caulobacteraceae , Coriobacteriaceae , Oscillospirales , Hungateiclostridiaceae , Myco-plasmataceae , Elusimicrobiaceae , Dysgonomonadaceae , Rhizobiaceae (опыт в виварии ФНЦ ВНИ-ТИП РАН, 2021 год). Описание групп см. в разделе «Методика».
Особое внимание привлекают микроорганизмы рода Akkermansia , которые были представлены единственным видом A. muciniphila . Их присутствие резко уменьшалось во всех группах при введением в рацион Т-2 токсина по сравнению с I группой (p ≤ 0,001), вплоть до полного отсутствия во II и IV группах (см. рис. 5). Снижение численности A. muciniphila в кишечнике может иметь негативные последствия для птицы. Доказано, что с присутствием A. muciniphila в пищеварительной системе связано уменьшение обилия патогенов, включая Salmonella pullorum (42). Увеличение доли A. mu-ciniphila связывают с усилением процессов регенерации слизистой оболочки кишечника у цыплят, что сопровождается возрастанием количества бокаловидных клеток и повышением синтеза муцина (43).
Интересно, что при загрязнении корма Т-2 токсином во II группе наблюдалось появление отсутствовавших в I группе патогенных микроорганизмов: Enterococcus cecorum, вызывающего гастроэнтериты и заболевания суставов птиц (44); Campylobacter concisus — возбудителя гастроэнтеритов (45); Campylobacter gracilis, вызывающего желудочно-кишечные инфекции, включая бактериемию, которая может проявиться, в первую очередь, на фоне снижения иммунитета (46); Streptococcus gordonii, связанного с развитием инфекционного эндокардита (47); Flavonifractor spp. — возбудителей инфекций кровотока (48). Это представляется закономерным, поскольку ранее Y. Li с соавт. (49) было установлено, что низкие концентрации Т-2 токсина изменяют активацию Toll-подобных рецепторов, снижая тем самым распознавание патогенов и препятствуя инициации воспалительных иммунных реакций против бактерий и вирусов (49). В III и IV группах эти патогены либо отсутствовали, либо были представлены в значительно меньшем количестве, чем во II группе (р ≤ 0,05), что указывает на позитивное влияние кормовой добавки Заслон 2+, а также ее комплекса с ферментом на количественный состав кишечной микробиоты.
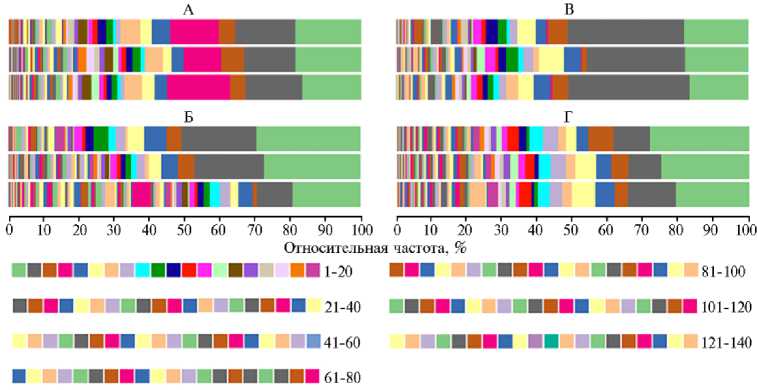
Рис. 5. Состав кишечного микробиома у цыплят-бройлеров ( Gallus gallus L.) кросса Смена 8 на уровне бактериальных родов (по данным NGS-секвенирования ампликонов гена 16S рРНК) при скармливании Т-2 токсина, кормовой добавки Заслон 2+ (ООО «БИОТРОФ», Россия) и ферментного препарата с протеолитической активностью Axtra Pro («DuPont de Nemours, Inc.», США): 1-20 — Clostridia UCG-014, Lactobacillus , Alistipes , Akkermansia , Subdoligranulum , Faecal-ibacterium , Eubacterium coprostanoligenes group, Christensenellaceae R-7 group, RF39, Ruminococcus torques group, UCG-005, Fournierella , Erysipelatoclostridium , Bifidobacterium , Clostridia vadinBB60 group, Escherichia-Shigella, Clostridium sensu stricto 1, Blautia , Ruminococcus, Veillonella ; 21-40 — Gastranaerophilales , UCG-010, Lachnoclostridium , f. Anaerovoracaceae XIII AD3011 group, Negativi-bacillus, Monoglobus , Butyricicoccus , Streptococcus , Romboutsia , Enterococcus, f. Anaerovoracaceae XIII UCG-001, Stenotrophomonas , Pseudomonas , f. Oscillospiraceae V9D2013 group, Erysipelotrichaceae , Eisenbergiella , Bilophila , Prevotella , Anaerofustis , Neisseria ; 41-60 — Corynebacterium , f. Oscillospi-raceae NK4A214 group, Sellimonas , UCG-009, Flavonifractor , Paludicola , Caproiciproducens , Actinomyces , Leptotrichia , Fusobacterium , Holdemania , UCG-008, Granulicatella , Gemella , Alloprevotella , Sphingomonas , Intestinimonas , Porphyromonas , UC5-1-2E3, Chryseobacterium ; 61-80 — Ralstonia , An-aerotruncus , Gordonibacter , Staphylococcus , Anaerofilum , Capnocytophaga , Marvinbryantia , Haemophilus , Tyzzerella , Rothia , Campylobacter , CHKCI001, Kingella , Eubacterium hallii group, Oscillibacter , Saccharimonadaceae , Enterorhabdus , Anaerostipes , Defluviitaleaceae UCG-011, Gardnerella ; 81-100 — Saccharimonadales , Selenomonas , Izemoplasmatales , Massilia , Candidatus Soleaferrea, Eubacterium nodatum group, Lautropia, Centipeda, Shuttleworthia, Treponema, Cutibacterium, GCA-900066575, Tan-nerella , WPS-2, Merdibacter , Peptococcus , Peptoniphilus , Lentimicrobium , Bergeyella , Atopobium ; 101120 — Aggregatibacter , Oscillospira , Frisingicoccus , Erysipelotrichaceae UCG-003, Catenibacillus , Vibri-onimonas , Alcaligenes , JGI 0000069-P22, Johnsonella , Rikenellaceae RC9 gut group, Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium , Megasphaera , DTU014, Papillibacter , Auricoccus-Abyssicoc-cus , Anaeroplasma , Bacteroides , Fretibacterium , Anaerococcus , Angelakisella ; 121-140 — Tuzzerella , Stomatobaculum , Solobacterium , Chloroplast , Finegoldia , Lachnospira , Nubsella , Prevotellaceae UCG-001, Prevotellaceae Ga6A1 group, WCHB1-41, Cardiobacterium , Ezakiella , Filifactor , Hydrogenoan-aerobacterium , Ureaplasma , Elusimicrobium , Dysgonomonas , Collinsella , Kocuria , f. Lachnospiraceae Incertae Sedis (опыт в виварии ФНЦ ВНИТИП РАН, 2021 год). Описание групп см. в разделе «Методика».
В то же время некоторые таксоны кишечных микроорганизмов, в основном относящиеся к филуму Firmicutes, которые присутствовали у птицы из I группы, полностью исчезали во II группе при загрязнении корма Т-2 токсином. К таким таксонам относились представители родов Marvinbryantia (сем. Lachnospiraceae), UCG-008 (сем. Butyricicoccaceae), V9D2013_group (сем. Oscillospiraceae). Это, вероятно, могло отрицательно сказаться на процессах переваривания некрахмалистых полисахаридов и синтезе бутирата, поскольку представители Lachnospiraceae и Oscillospiraceae относятся к важной группе целлюлозолитических микроорганизмов (50, 51), а бактерии семейства Butyricicoccaceae — активные продуценты ценной масляной кислоты (52). Обилие Eubacterium coprostanoligenes — представителя филума Fir-micutes также резко снижалось во II группе по сравнению с контролем (с 5,2±0,28 до 0,68±0,042 при р ≤ 0,001) и повышалось в III группе (р ≤ 0,05) на фоне кормовой добавки Заслон 2+ и в IV группе при использовании комплекса, включающего кормовую добавку и фермент, по сравнению с I группой. Eubacterium coprostanoligenes относится к представителям нормо-флоры и продуцирует ценные органические кислоты, такие как уксусная, муравьиная и янтарная (53).
По результатам реконструкции и функциональной аннотации, в микробном сообществе кишечника бройлеров мы обнаружили 756 прогнозируемых метаболических путей, по 163 из которых наблюдались различия (р ≤ 0,05) между экспериментальными группами. Эти пути относились к белковому обмену (биосинтез аминокислот, превращение азотистых соединений), липидному обмену (биосинтез липидов, олеата, пальмитолеата, пальмитата, стеарата), углеводному обмену (расщепление сложных полисахаридов, таких как хитин, деградация глюкозы), энергетическому обмену (например, цикл Кребса), к синтезу летучих жирных кислот (в частности, пропионовой и масляной), нуклеиновых кислот, нуклеотидов и нуклеозидов, кофакторов и коферментов (тетрагидрофолат, ацетил-СоА, убихинолы 7-10, гем), витаминов (биотин, тиамин дифосфат, менахинолы 6-13, диметилме-нахинолы 6, 8, 9, аденозилкобаламин), к биодеградации ксенобиотиков, к образованию клеточной стенки и спорообразованию (синтез пептидогликана, тейховых кислот), к патогенезу (синтез О-антигенов, сидерофоров), образованию биопленок. Обращает на себя особое внимание тот факт, что значительное число прогнозируемых метаболических путей, обеспечивающих деградацию различных органических веществ, прежде всего аминокислот и ароматических соединений (в частности, ксенобиотиков), различались между экспериментальными группами (р ≤ 0,05). Сходную тенденцию выявили и для метаболических путей, связанных с синтезом кофакторов и коферментов (25 путей), а также витаминов (19 путей) (р ≤ 0,05).
При воздействии Т-2 токсина на кишечный микробиом (II группа по сравнению с I группой) отмечалось усиление следующих прогнозируемых метаболических путей деградации ароматических соединений, включая ксенобиотики: PWY-5182 (деградация толуола IV) — в 6,8 раза (р ≤ 0,05), PWY-5415 (деградация катехола I) — в 5,7 раза (р ≤ 0,05), 3-HYDROXYPHE-NYLACETATE-DEGRADATION-PWY (деградация 4-гидроксифенилацетата) — в 3,0 раза (р ≤ 0,05), PWY0-321 (деградация фенилацетата I) — в 5,0 раза (р ≤ 0,05) (рис. 6). Ранее изучалось воздействие пробиотиков (54) и возраста птиц (55) на метаболический потенциал кишечного микробиома. Сообщений о влиянии ксенобиотиков на прогнозируемые метаболические пути в кишечнике птиц, животных и человека мы в доступной научной литературе не обнаружили. Тем не менее способность многих микроорганизмов к деградации различных ксенобиотиков известна давно. Так, показана
(56) возможность разложения фенилацетата, который служит основным промежуточным звеном в бактериальной деградации многих ароматических соединений. Микроорганизмы могут окислять фенилацетат как в аэробных, так и в анаэробных условиях при участии ферментов фенилацетат-КоА-ли-газы, фенилацетил-СоА 1,2-эпоксидазы и оксигеназы (57, 58). Продемонстрировано также (59), что в кишечнике идут активные процессы метаболизма ксенобиотиков при участии β -глюкуронидазы, нитроредуктазы, суль-фоксидредуктазы.
Метаболические пути
Группа
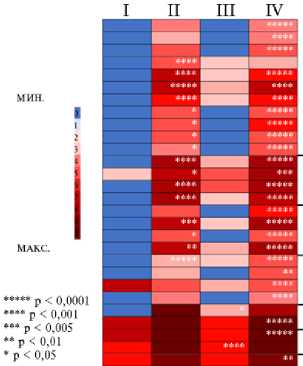
*****

*****
3-HYDROXYPHENYLACETATE-DEGRADATION-PWY
GALLATE- DEGRADATION- П- PWY
P221-FWY
P281-PWY
PROTOCATECHUATE-ORTHOCLEAVAGEPWY
PWY 5182
PWY 5415 PWY-5431 PWYO-321 PWY 6182
PWY-6185
P381-PWY
PWY-5OO5
PWY-55O7
PWY-7376
PWY-5651 LEU-DEG2-PWY CRNFORCAT-PWY TYRFUMCAT-PWY
PWY-6906
PWY-7295
PWY-7456
DHGLUCONATE-PYR-CAT- PWY
PWY6470
PWYG-321
PWY-7664
PWYO-862
PWY-5855
PWY-5920
PWY-6562
PWY-7328
PWYO-42
PWY1G-0
PWY 7198
PWY-7254
РАЗЛОЖЕНИЕ /АРОМАТИЧЕСКИХ ВЕЩЕСТВ, ВКЛЮЧАЯ КСЕНОБИОТИКИ
СИНТЕЗ ВИТАМИНОВ
ДЕГРАДАЦИЯ БЕЛКОВЫХ СОЕДИНЕНИЙ
ДЕГРАДАЦИЯ МОНОСАХАРОВ И ПОЛИСАХАРИДОВ
ФОРМИРОВАНИЕ КЛЕТОЧНЫХ СТЕНОК И СПОР
ЛИПИДНЫЙ ОБМЕН
СИНТЕЗ КОФАКТОРОВ И КОФЕРМЕНТОВ
ФОРМИРОВАНИЕ. БИОПЛЕНОК
ПАТОГЕНЕЗ
.И ГРА. LM II (Я ..П '■ Л ". .Л.ЕГТМХ КИСЛОТ
БИОСИН ГЕ'! ПРОН КТОРОВ
СИНТЕЗ НУКЛЕОТИДОВ И НУКЛЕОЗИДОВ ЭНЕРГЕТИЧЕСКИЙ ОБМЕН
Рис. 6. Результаты функциональной аннотации прогнозируемых метаболических путей в микробиоме слепых отростков кишечника у цыплят-бройлеров (Gallus gallus L.) кросса Смена 8 (по данным NGS-секвенирования ампликонов гена 16S рРНК) при скармливании Т-2 токсина, кормовой добавки Заслон 2+ (ООО «БИОТРОФ», Россия) и ферментного препарата с протеолитической активностью Axtra Pro («DuPont de Nemours, Inc.», США) (опыт в виварии ФНЦ ВНИ-ТИП РАН, 2021 год). Данные получены при помощи программного комплекса PICRUSt2 (v.2.3.0). Для анализа метаболических путей и ферментов пользовались базой данных MetaCyc . Шкала отражает интенсивность потенциальных метаболических путей микробиома: синий цвет — наименьшая (минимальная) интенсивность, красный — наибольшая (максимальная). Описание групп см. в разделе «Методика».
В то же время в нашем исследовании введение в рацион бройлеров кормовой добавки Заслон 2+ (III группа) на фоне Т-2 токсина привело к снижению потенциала метаболических путей деградации ароматических соединений, включая ксенобиотики, по сравнению со II группой (p ≤ 0,05). Так, в 2,9 раза снизилась активность пути PWY-5182, в 4,1 раза — PWY-5415, в 3,0 раза — 3-HYDROXYPHENYLACETATE-DEGRADATION-PWY, в 5,0 раза — PWY0-321 (р ≤ 0,05). Этот эффект может быть связан с уменьшением токсической нагрузки при введении в рацион кормовой добавки Заслон 2+. Интересно, что в IV группе при добавлении ферментного препарата в рацион не было отмечено различий (р > 0,05) со II группой по этим метаболическим путям. То есть введение протеазы снижало эффективность кормовой добавки Заслон 2+. При загрязнении корма Т-2 токсином наблюдалось усиление потенциала метаболических путей деградации таких важных для птиц соединений, как аминокислоты (p ≤ 0,05). В частности, во II группе по сравнению с I группой потенциал LEU-DEG2-PWY
(деградация L-лейцина I) повышался в 6,9 раза (p ≤ 0,05), PWY-5651 (деградация L-триптофана до полуальдегида 2-амино-3-карбоксимуконата) — в 4,6 раза, TYRFUMCAT-PWY (деградация L-тирозина I) — в 6,5 раза, CRNFORCAT-PWY (деградация креатинина I) — в 6,9 раза. Усиление путей деградации аминокислот может быть связано с появлением бактерий фи-лума Fusobacteriota у птицы из II и IV групп. Известно, что представители этого таксона используют аминокислоты в качестве источника энергии (60). В то же время введение в рацион бройлеров кормовой добавки Заслон 2+ на фоне Т-2 токсина (III группа) снизило (p ≤ 0,05) метаболический потенциал деградации аминокислот до уровня I группы (без загрязнения корма Т-2 токсином). Это положительный эффект, поскольку аминокислоты служат важным пластическим материалом, обеспечивающим синтез белка и ростовые показатели птицы (61).
Кроме того, загрязнение корма Т-2 токсином (II группа по сравнению с I группой) приводило к активации прогнозируемого метаболического пути PWY0-42 (2-метилцитратный цикл I), приводящего к деградации пропионовой кислоты (летучая жирная кислота) (p ≤ 0,05). Органические кислоты, в частности пропионовая, вырабатываются представителями нормо-флоры, присутствующими в кишечнике (62). Эти вещества могут повышать продуктивность домашней птицы за счет изменения рН пищеварительной системы и, следовательно, изменения состава микробиома (63). В частности, пропионат вызывает у патогенных бактерий подкисление цитозоля, рассеивание протон-движущей силы, нарушение гомеостаза CoA и в некоторых случаях — ингибирование ключевых ферментов цикла трикарбоновых кислот аконитазы и цитратсинтазы вследствие образования (2S,3S)-2-метилцитрата. Кроме того, органические кислоты способны улучшать морфологию и физиологию желудочно-кишечного тракта (64). Однако некоторые кишечные бактерии могут разлагать пропионат и даже использовать его в качестве единственного источника углерода. Из всех путей деградации пропионата наиболее широко используется цикл 2-метилцитриновой кислоты. В этом пути метиленовая группа пропионата кальция окисляется до кетогруппы с образованием пирувата — общего предшественника для биосинтеза и образования энергии. Этот путь хорошо известен у Salmonella enterica enterica серовар Typhimurium (65) и E. coli (66). У этих микроорганизмов путь начинается с активации пропаноата до пропаноил-СоА пропио-нат-СоА-лигазой, затем следует синтез (2S,3S)-2-метилцитрата из пропа-ноил-СоА и оксалоацетата, катализируемый 2-метилцитратсинтазой. Далее (2S,3S)-2-метилцитрат дегидратируется до цис-2-метилаконитата с помощью 2-метилцитратдегидратазы с последующей регидратацией до (2Р,3S)-2-метилизоцитрата и расщеплением последнего на пируват и сукцинат.
Закономерным представляется и то, что загрязнение корма Т-2 токсином приводило к активации прогнозируемых метаболических путей PWY-6562 (биосинтез норспермидина) и PWY1G-0 (биосинтез микотиола) соответственно в 4,0 и 3,8 раза (р ≤ 0,05). Известно, что полиамин норспермидин участвует в регуляции образования биопленки у микроорганизмов (67), в частности у Vibrio cholera — возбудителя холеры с симптомами диареи (68, 69). Бактерии образуют биопленки в качестве механизма выживания, поскольку такие структуры способствуют защите от экстремальных значений рН, осмотического стресса, ультрафиолетового излучения, противо-микробных препаратов (70) и, как показало наше исследование, вероятно, от Т-2 токсина. Усиление выработки микотиола на фоне загрязнения корма Т-2 токсином во II и III группах по сравнению с I группой (р ≤ 0,05) также закономерно. Микотиол — основной тиол, содержащийся в клетках акти-номицетов (71). Вероятно, активация выработки микотиола была связана с возрастанием (р ≤ 0,05) обилия бактерий суперфилума Actinobacteriota в кишечнике птиц из II и IV групп по сравнению с контролем. По функциям микотиол во многом аналогичен глутатиону — доминирующему тиолу у других бактерий, отсутствующему у актинобактерий. Это вещество участвует в детоксикации алкилирующих агентов, активных форм кислорода и азота, антибиотиков (72). Также он действует как тиоловый буфер, имеющий свойства восстановителя и защищающий от дисульфидного стресса (73).
Ранее отмечалось (74, 75), что реакция птицы на введение протеаз в рационы не всегда благоприятна. Показано (75), что, несмотря на повышение переваримости аминокислот в подвздошной кишке, показатели роста и потребления корма снижались, а конверсия корма ухудшалась. Авторы (75) объяснили это сложностями в подборе оптимальных дозировок протеаз в каждом конкретном случае. При этом введение протеазы в дозе 160 мг/кг в рацион бройлеров значительно снизило активность панкреатического трипсина. M. Mahagna с соавт. (76) сообщали, что введение препаратов амилазы и протеазы в рацион из сорго и соевого шрота значительно снижало активность собственной амилазы, химотрипсина и трипсина в кишечном содержимом бройлеров. По мнению L. Liu с соавт. (31), протеолитические системы и селективный протеолиз рассматриваются в качестве ключевых регуляторов процессов опухолевой прогрессии; процессы протеолиза имеют непосредственное отношение к реакциям воспаления и деструкции тканей.
Таким образом, при экспериментальной контаминации корма Т-2 токсином (2-кратное превышение ПДК) в кишечнике цыплят-бройлеров изменялось биоразнообразие и составе микробиома уже на уровне филумов. Обилие бактерий суперфилума Actinobacteriota и филума Proteobacteria возрастало (соответственно в 1,8 и 3,5 раза, р ≤ 0,05), суперфилума Desulfo-bacterota — напротив, снижалось (в 2,2 раза, р ≤ 0,05). При введении в рацион кормовой добавки Заслон 2+ в комплексе с протеолитическим ферментным препаратом Axtra Pro обилие суперфилума Actinobacteriota и фи-лума Proteobacteria также возрастало по сравнению с контролем (р ≤ 0,05); одна кормовая добавка Заслон 2+ такого эффекта не давала. Представители суперфилума Verrucomicrobiota полностью исчезали в группах, получавших Т-2 токсин без добавок, а также при использовании комплекса кормовой добавки и фермента, тогда как в контроле присутствовали в значительном количестве — 14,1±0,8 %. Применение только добавки Заслон 2+ увеличивало обилие бактерий рода Lactobacillus по сравнению с контролем с 15,9±1,32 до 30,7±1,84 % (p ≤ 0,01). При введении в рацион Т-2 токсина резко уменьшалась (p ≤ 0,001) численность микроорганизмов Akkermansia muciniphila, появлялись отсутствовавшие в контроле патогенные микроорганизмы (Enterococcus cecorum, Campylobacter concisus, Campylobacter gracilis, Streptococcus gordonii, Flavonifractor spp.). При использовании кормовой добавки или ее комплекса с ферментом эти патогены либо отсутствовали, либо были представлены в значительно меньшем количестве (р ≤ 0,05). Экспериментальные группы различались (р ≤ 0,05) по 163 прогнозируемым метаболическим путям. Под воздействием Т-2 токсина в 3,0-6,9 раза усиливались (р ≤ 0,05) метаболические пути деградации ароматических соединений (включая ксенобиотики), аминокислот, синтеза коферментов, кофакторов, образования биопленок, клеточных стенок, спор и протекторных веществ в клетках. Кормовая добавка Заслон 2+ в 2,9-5,0 раза снижала потенциал ме- таболической деградации ароматических соединений, включая ксенобиотики, и аминокислот. В целом кормовая добавка Заслон 2+, а также комплекс, включающий эту добавку и протеолитический фермент, позитивно влияли на состав и потенциальную функциональную активность микробиома кишечника у цыплят-бройлеров, причем кормовая добавка без фермента оказалась эффективнее.
Список литературы Состав и метаболический потенциал микробиома кишечника бройлеров Gallus gallus L. Под влиянием кормовых добавок при экспериментальном Т-2 токсикозе
- Zain M.E. Impact of mycotoxins on humans and animals. Journal of Saudi Chemical Society, 2011, 15(2): 129-144 (doi: 10.1016/j.jscs.2010.06.006).
- Cinar A., Onba§i E. Mycotoxins: the hidden danger in foods. In: Mycotoxins and food safety /S. Sabuncuoglu (ed.). United Kingdom, IntechOpen, 2019: Ch 4 (doi: 10.5772/intechopen.89001).
- Adhikari M., Negi B., Kaushik N., Adhikari A., Al-Khedhairy A.A., Kaushik N.K., Ha Choi E. T-2 mycotoxin: toxicological effects and decontamination strategies. Oncotarget, 2017, 16(8): 33933-33952 (doi: 10.18632/oncotarget.15422).
- Kalantari H., Zong M.S., Chang I.-M. Assay of T-2 toxin contamination in domestic and imported agricultural products in Korea. Proc. Jpn. Assoc. Mycotoxicol., 1989, 30: 32-34 (doi: 10.2520/myco1975.1989.30_32).
- Krska R., Malachova A., Berthiller F., van Egmond H.P. Determination of T-2 and HT-2 toxins in food and feed: An update. World Mycotoxin Journal, 2014, 7(2): 131-142 (doi: 10.3920/WMJ2013.1605).
- Кононенко Г.П., Буркин А.А., Зотова Е.В. Микотоксикологический мониторинг. Сообщение 3. Кормовая продукция от переработки зернового сырья. Ветеринария сегодня, 2020, 3(34): 213-219 (doi: 10.29326/2304-196X-2020-3-34-213-219).
- Akande K.E., Abubakar M.M., Adegbola T.A., Bogoro S.E. Nutritional and health implications of mycotoxins in animal feeds: a review. Pakistan Journal of Nutrition, 2006, 5: 398-403 (doi: 10.3923/pjn.2006.398.403).
- Devreese M., De Backer P., Croubels S. Different methods to counteract mycotoxin production and its impact on animal health. Vlaams Diergeneeskundig Tijdschrift, 2013, 82(4): 181-190 (doi: 10.21825/vdt.v82i4.16695).
- Pande V.V., Kurkure N.V., Bhandarkar A.G. Effect of T-2 toxin on growth, performance and haematobiochemical alterations in broilers. Indian Journal of Experimental Biology, 2006, 44(1): 86-88.
- Indresh H.C., Umakantha B. Effects of ochratoxin and T-2 toxin combination on performance, biochemical and immune status of commercial broilers. Veterinary World, 2013, 6(11): 945-949 (doi: 10.14202/vetworld.2013.945-949).
- Stoev S.D., Diakov L., Koynarski V., Angelov A. Special pathology and diagnostics of mycoses, mycotoxicoses, parasitoses, intoxications and avitaminoses. Publishing House CD Contrast, Stara Zagora, Bulgaria, 2010: 1-239.
- Turner J.R. Intestinal mucosal barrier function in health and disease. Nature Reviews Immunology, 2009, 9: 799-809 (doi: 10.1038/nri2653).
- Jing J., Beekmann K., Ringoe E., Rietjens I., Xing F., Fuguo X. Interaction between food-borne mycotoxins and gut microbiota: a review. Food Control, 2021, 126: 107998 (doi: 10.1016/j.food-cont.2021.107998).
- Lessard M., Savard C., Deschene K., Lauzon K., Pinilla V.A., Gagnon C.A., Lapointe J., Guay F., Chorfi Y. Impact of deoxynivalenol (DON) contaminated feed on intestinal integrity and immune response in swine. Food and Chemical Toxicology, 2015, 80: 7-16 (doi: 10.1016/j.fct.2015.02.013).
- Meinl W., Sczesny S., Brigelius-Flohe R., Blaut M., Glatt H. Impact of gut microbiota on intestinal and hepatic levels of phase 2 xenobiotic-metabolizing enzymes in the rat. Drug Metabolism and Disposition, 2009, 37(6): 1179-1186 (doi: 10.1124/dmd.108.025916).
- Guerre P. Mycotoxin and gut microbiota interactions. Toxins, 2020, 12(12): 769 (doi: 10.3390/toxins12120769).
- Wang C., Wang X., Huang Y., Bu X., Xiao S., Qin C., Qiao F., Qin J.G., Chen L. Effects of dietary T-2 toxin on gut health and gut microbiota composition of the juvenile Chinese mitten crab (Eriocheir sinensis). Fish and Shellfish Immunology, 2020, 106: 574-582 (doi: 10.1016/j.fsi.2020.08.019).
- Chang J., Wang T., Wang P., Yin Q., Liu C., Zhu Q., Lu F., Gao T. Compound probiotics alleviating aflatoxin B1 and zearalenone toxic effects on broiler production performance and gut microbiota. Ecotoxicology and Environmental Safety, 2020, 194: 110420 (doi: 10.1016/j.ecoenv.2020.110420).
- De Souza M., Baptista A.A.S., Valdiviezo M.J., Justino L., Menck-Costa M.F., Ferraz C.R., da Gloria E.M., Verri W.A., Bracarense A.P.F. Lactobacillus spp. reduces morphological changes and oxidative stress induced by deoxynivalenol on the intestine and liver of broilers. Toxicon, 2020, 185: 203-212 (doi: 10.1016/j.toxicon.2020.07.002).
- Tozaki H., Emi Y., Horisaka E., Fujita T., Yamamoto A., Muranishi S. Degradation of insulin and calcitonin and their protection by various protease inhibitors in rat caecal contents: implications in peptide delivery to the colon. Journal of Pharmacy and Pharmacology, 1997, 49(2): 164168 (doi: 10.1111/j.2042-7158.1997.tb06773.x).
- Европейская конвенция о защите позвоночных животных, используемых для экспериментов или в иных научных целях (ETS №123). 1986 Режим доступа: https://base.garant.ru/4090914/. Дата обращения: 26.01.2022.
- Методика проведения научных и производственных исследований по кормлению сельскохозяйственной птицы. Молекулярно-генетические методы определения микрофлоры кишечника /Под ред. В.И. Фисинина. Сергиев Посад, 2013.
- Douglas G.M., Maffei V.J., Zaneveld J.R., Yurgel S.N., Brown J.R., Taylor C.M., Hut-tenhower C., Langille M.G.I. PICRUSt2 for prediction of metagenome functions. Nature Biotechnology, 2020, 38: 685-688 (doi: 10.1038/s41587-020-0548-6).
- Tracey K.J., Wei H., Manogue K.R., Fong Y., Hesse D.G., Nguyen H.T., Kuo G.C., Beutler B., Cotran R.S., Cerami A. Cachectin/tumor necrosis factor induces cachexia, anemia, and inflammation. The Journal of Experimental Medicine, 1988, 167(3): 1211-1227 (doi: 10.1084/jem.167.3.1211).
- Knol J., Scholtens P., Kafka C., Steenbakkers J., Groß S., Helm K., Klarczyk M., Schöpfer H., Böckler H-M., Wells J. Colon microflora in infants fed formula with galacto- and fructo-oligo-saccharides: more like breast-fed infants. Journal of Pediatric Gastroenterology and Nutrition, 2005, 40(1): 36-42 (doi: 10.1097/00005176-200501000-00007).
- de Vrese M., Marteau P.R. Probiotics and prebiotics: effects on diarrhea. The Journal of Nutrition, 2007, 137(3): 803S-811S (doi: 10.1093/jn/137.3.803S).
- Lourenco J.M., Nunn S.C., Lee E.J., Dove C.R., Callaway T.R., Azain M.J. Effect of supplemental protease on growth performance and excreta microbiome of broiler chicks. Microorganisms, 2020, 8(4): 475 (doi: 10.3390/microorganisms8040475).
- Dibner J.J., Richards J.D. Antibiotic growth promoters in agriculture history and mode of action. Poultry Science, 2005, 84: 634-643 (doi: 10.1093/ps/84.4.634).
- Xiao Y., Xiang Y., Zhou W., Chen J., Li K., Yang H. Microbial community mapping in intestinal tract of broiler chicken. Poultry Science, 2017, 96(5): 1387-1393 (doi: 10.3382/ps/pew372).
- Macfarlane S., Macfarlane G.T. Regulation of short-chain fatty acid production. Proceedings of the Nutrition Society, 2003, 62(1): 67-72 (doi: 10.1079/PNS2002207).
- Liu L., Li Q., Yang Y., Guo A. Biological function of short-chain fatty acids and its regulation on intestinal health of poultry. Frontiers in Veterinary Science, 2021, 8: 736739 (doi: 10.3389/fvets.2021.736739).
- Simon P.C., Stovell P.L. Diseases of animals associated with Sphaerophorus necrophorus. Veterinary Bulletin, 1969, 39(5): 311-315.
- Phillips N.D., La T., Hampson D.J. Survival of intestinal spirochaete strains from chickens in the presence of disinfectants and in faeces held at different temperatures. Avian Pathology, 2003, 32(6): 639-643 (doi: 10.1080/03079450310001610677).
- Sichert A., Corzett C.H., Schechter M.S., Unfried F., Markert S., Becher D., Fernandez-Guerra A., Liebeke M., Schweder T., Polz M.F., Hehemann J.H. Verrucomicrobia use hundreds of enzymes to digest the algal polysaccharide fucoidan. Nature Microbiology, 2020, 5: 1026-1039 (doi: 10.1038/s41564-020-0720-2).
- Amit-Romach E., Sklan D., Uni Z. Microflora ecology of the chicken intestine using 16S ribo-somal DNA primers. Poultry Science, 2004, 83(7): 1093-1098 (doi: 10.1093/ps/83.7.1093).
- Dumonceaux T.J., Hill J.E., Hemmingsen S.M., Van Kessel A.G. Characterization of intestinal microbiota and response to dietary virginiamycin supplementation in the broiler chicken. Applied and Environmental Microbiology, 2006, 72(4): 2815-2823 (doi: 10.1128/AEM.72.4.2815-2823.2006).
- Ehrmann M.A., Kurzak P., Bauer J., Vogel R.F. Characterization of lactobacilli towards their use as probiotic adjuncts in poultry. Journal of Applied Microbiology, 2002, 92(5): 966-975 (doi: 10.1046/j.1365-2672.2002.01608.x).
- Botes M., Loos B., van Reenen C.A, Dicks L.M. Adhesion of the probiotic strains Enterococcus mundtii ST4SA and Lactobacillus plantarum 423 to Caco-2 cells under conditions simulating the intestinal tract, and in the presence of antibiotics and anti-inflammatory medicaments. Archives of Microbiology, 2008, 190(5): 573-584 (doi: 10.1007/s00203-008-0408-0).
- Yang C., Du Y., Ren D., Yang X., Zhao Y. Gut microbiota-dependent catabolites of tryptophan play a predominant role in the protective effects of Turmeric polysaccharides against DSS-induced ulcerative colitis. Food Function, 2021, 12(20): 9793-9807 (doi: 10.1039/D1F001468D).
- Schönherr-Hellec S., Klein G., Delannoy J., Ferraris L., Friedel I., Rozé J.C., Butel M.J., Aires J. Comparative phenotypic analysis of 'Clostridium neonatale' and Clostridium butyricum isolates from neonates. Anaerobe, 2017, 48: 76-82 (doi: 10.1016/j.anaerobe.2017.07.002).
- Kong Q., He G.-Q., Jia J.-L., Zhu Q.-L., Ruan H. Oral administration of Clostridium butyricum for modulating gastrointestinal microflora in mice. Current Microbiology, 2011, 62: 512-517 (doi: 10.1007/s00284-010-9737-8).
- Zhu L., Lu X., Liu L., Voglmeir J., Zhong X., Yu Q. Akkermansia muciniphila protects intestinal mucosa from damage caused by S. pullorum by initiating proliferation of intestinal epithelium. BMC Veterinary Research, 2020, 51(1): 34 (doi: 10.1186/s13567-020-00755-3).
- Shin N.R., Lee J.C., Lee H.Y., Kim M.S., Whon T.W., Lee M.S., Bae J.W. An increase in the Akkermansia spp. population induced by metformin treatment improves glucose homeostasis in diet-induced obese mice. Gut, 2014, 63(5): 727-735 (doi: 10.1136/gutjnl-2012-303839).
- Jung A., Chen L.R., Suyemoto M.M., Barnes H.J., Borst L.B. A review of Enterococcus cecorum infection in poultry. Avian Diseases, 2018, 62(3): 261-271 (doi: 10.1637/11825-030618-Review.1).
- Kaakoush N.O., Mitchell H.M. Campylobacter concisus — a new player in intestinal disease. Frontiers in Cellular and Infection Microbiology, 2012, 2: 4 (doi: 10.3389/fcimb.2012.00004).
- Shinha T. Fatal bacteremia caused by Campylobacter gracilis, United States. Emerging Infectious Diseases, 2015, 21(6): 1084-1085 (doi: 10.3201/eid2106.142043).
- Komorovsky R., Boyarchuk O., Synytska V. Streptococcus gordonii-associated infective endocarditis in a girl with Barlow's mitral valve disease. Cardiology in the Young, 2019, 29(8): 1-2 (doi: 10.1017/S1047951119001434).
- Berger F.K., Schwab N., Glanemann M., Bohle R.M., Gärtner B., Groesdonk H.V. Flavonifractor (Eubacterium) plautii bloodstream infection following acute cholecystitis. IDCases, 2018, 14: e00461 (doi: 10.1016/j.idcr.2018.e00461).
- Li Y., Zhang J., Wu Y., Liu G., Song L., Li Y., Yang J., You Y. High-sensitive chemiluminescent immunoassay investigation and application for the detection of T-2 toxin and major metabolite HT-2 toxin. Journal of the Science of Food and Agriculture, 2017, 97(3): 818-822 (doi: 10.1002/jsfa.7801).
- Direct microbial conversion of biomass to advanced biofuels /M.E. Himmel (ed.). Elsevier, 2015.
- Reau LA.J., Suen G. The Ruminococci: key symbionts of the gut ecosystem. Journal of Microbiology, 2018, 56(3): 199-208 (doi: 10.1007/s12275-018-8024-4).
- Eeckhaut V., Machiels K., Perrier C., Romero C., Maes S., Flahou B., Steppe M., Haesebrouck F., Sas B., Ducatelle R., Vermeire S., Van Immerseel F. Butyricicoccus pullicaeco-rum in inflammatory bowel disease. Gut, 2013, 62(12): 1745-1752 (doi: 10.1136/gutjnl-2012-303611).
- Freier T.A., Beitz D.C., Li L., Hartman P.A. Characterization of Eubacterium coprostanoligenes spp. nov., a cholesterol-reducing anaerobe. International Journal of Systematic and Evolutionary Microbiology, 1994, 44(1): 137-142 (doi: 10.1099/00207713-44-1-137).
- Rodrigues D.R., Briggs W., Duff A., Chasser K., Murugesan R., Pender C., Ramirez S., Valen-zuela L., Bielke L. Cecal microbiome composition and metabolic function in probiotic treated broilers. PLoS ONE, 2020, 15(6): e0225921 (doi: 10.1371/journal.pone.0225921).
- Segura-Wang M., Grabner N., Koestelbauer A., Klose V., Ghanbari M. Genome-resolved met-agenomics of the chicken gut microbiome. Frontiers in Microbiology, 2021, 12: 726923 (doi: 10.3389/fmicb.2021.726923).
- Luengo J.M., Garcia J.L., Olivera E.R. The phenylacetyl-CoA catabolon: a complex catabolic unit with broad biotechnological applications. Molecular Microbiology, 2001, 39(6): 1434-1442 (doi: 10.1046/j.1365-2958.2001.02344.x).
- Nogales J., Macchi R., Franchi F., Barzaghi D., Fernández C., García J.L., Bertoni G., Díaz E. Characterization of the last step of the aerobic phenylacetic acid degradation pathway. Microbiology, 2007, 153(2): 357-365 (doi: 10.1099/mic.0.2006/002444-0).
- Teufel R., Mascaraque V., Ismail W., Voss M., Perera J., Eisenreich W., Haehnel W., Fuchs G. Bacterial phenylalanine and phenylacetate catabolic pathway revealed. Proceedings of the National Academy of Sciences, 2010, 107(32): 14390-14395 (doi: 10.1073/pnas.1005399107).
- Stephanie L. Collins, Andrew D. Patterson. The gut microbiome: an orchestrator of xenobiotic metabolism. Acta Pharmaceutica Sinica B, 2020, 10(1): 19-32 (doi: 10.1016/j.apsb.2019.12.001).
- Saheer E.G., Haroun Sh. Pathways of glutamate catabolism in Fusobacterium species. Journal of General Microbiology, 137(5): 1201-1206 (doi: 10.1099/00221287-137-5-1201).
- Kamran Z., Mirza M.A., Haq A.U., Mahmood S. Effect of decreasing dietary protein levels with optimal amino acids profile on the performance of broilers. Pakistan Veterinary Journal, 2004, 24: 165-168.
- Huyghebaert G., Ducatelle R., Van Immerseel F. An update on alternative to antimicrobial growth promoter for broilers. Veterinary Journal, 2010, 187(2): 182-188 (doi: 10.1016/j.tvjl.2010.03.003).
- Dibner J.J., Buttin P. Use of organic acids as a model to study the impact of gut microflora on nutrition and metabolism. Journal of Applied Poultry Research, 2002, 11(4): 453-463 (doi: 10.1093/japr/11.4.453).
- Dittoe D.K., Ricke S.C., Kiess A.S. Organic acids and potential for modifying the avian gastrointestinal tract and reducing pathogens and disease. Frontiers in Veterinary Science, 2018, 5: 216 (doi: 10.3389/fvets.2018.00216).
- HorswiU A.R., Escalante-Semerena J.C. In vitro conversion of propionate to pyruvate by Salmonella enterica enzymes: 2-methylcitrate dehydratase (PrpD) and aconitase Enzymes catalyze the conversion of 2-methylcitrate to 2-methylisocitrate. Biochemistry, 2001, 40(15): 4703-4713 (doi: 10.1021/bi015503b).
- London R.E., Allen D.L., Gabel S.A., DeRose E.F. Carbon-13 nuclear magnetic resonance study of metabolism of propionate by Escherichia coli. Journal of Bacteriology, 1999, 181(11): 3562-3570 (doi: 10.1128/JB.181.11.3562-3570.1999).
- Stanley N.R., Lazazzera B.A. Environmental signals and regulatory pathways that influence biofilm formation. Molecular Microbiology, 2004, 52(4): 917-924 (doi: 10.1111/j.1365-2958.2004.04036.x).
- Karatan E., Duncan T.R., Watnick P.I. NspS, a predicted polyamine sensor, mediates activation of Vibrio cholerae biofilm formation by norspermidine. Journal of Bacteriology, 2005, 187(21): 7434-7443 (doi: 10.1128/JB.187.21.7434-7443.2005).
- Lee J., Sperandio V., Frantz D.E., Longgood J., Camilli A., Phillips M.A., Michael A.J. An alternative polyamine biosynthetic pathway is widespread in bacteria and essential for biofilm formation in Vibrio cholerae. Journal of Biological Chemistry, 2009, 284(15): 9899-9907 (doi: 10.1074/jbc.M900110200).
- Donlan R.M., Costerton J.W. Biofilms: survival mechanisms of clinically relevant microorganisms. Clinical Microbiology Reviews, 2002, 15(2): 167-193 (doi: 10.1128/CMR.15.2.167-193.2002).
- Lee S., Bergeron H., Lau P.C., Rosazza J.P. Thiols in nitric oxide synthase-containing Nocardia spp. strain NRRL 5646. Applied and Environmental Microbiology, 2007, 73(9): 3095-3097 (doi: 10.1128/AEM.02809-06).
- Newton G.L., Buchmeier N., Fahey R.C. Biosynthesis and functions of mycothiol, the unique protective thiol of Actinobacteria. Microbiology and Molecular Biology Reviews, 2008, 72(3): 47194 (doi: 10.1128/MMBR.00008-08).
- Newton G.L., Ta P., Bzymek K.P., Fahey R.C. Biochemistry of the initial steps of mycothiol biosynthesis. Journal of Biological Chemistry, 2006, 281(45): 33910-33920 (doi: 10.1074/jbc.M604724200).
- Yuan L., Wang M., Zhang X., Wang Z. Effects of protease and non-starch polysaccharide enzyme on performance, digestive function, activity and gene expression of endogenous enzymes of broilers. PLoS ONE, 2017, 12(3): e0173941 (doi: 10.1371/journal.pone.0173941).
- Walk C.L., Pirgozliev V., Juntunen K., Paloheimo M., Ledoux D.R. Evaluation of novel protease enzymes on growth performance and apparent ileal digestibility of amino acids in poultry: enzyme screening. Poultry Science, 2018, 97(6): 2123-2138 (doi: 10.3382/ps/pey080).
- Mahagna M., Nir I., Larbier M., Nitsan Z. Effect of age and exogenous amylase and protease on development of the digestive tract, pancreatic enzyme activities and digestibility of nutrients in young meat-type chicks. Reprod. Nutr. Dev., 1995, 35(2): 201-212 (doi: 10.1051/rnd:19950208).


