Состояние биоэлектрической активности мозга после каротидной эндартерэктомии в раннем восстановительном периоде ишемического инсульта
Автор: Стафеева Ирина Владимировна, Субботина Наталия Сергеевна, Дуданов Иван Петрович
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Медицинские науки
Статья в выпуске: 8 (145) т.1, 2014 года.
Бесплатный доступ
У 28 пациентов с ишемическим инсультом, перенесших каротидную эндартерэктомию в раннем восстановительном периоде, анализировали спектры мощности и показатели внутриполушарной когерентности характеристики ЭЭГ. Показано, что в послеоперационном периоде происходили значительное уменьшение показателей мощности спектра патологической медленноволновой активности и восстановление физиологических ритмов альфа- и бета-диапазонов в обоих полушариях с преобладанием изменений на стороне очага ишемии.
Ишемический инсульт, каротидная эндартерэктомия, электроэнцефалография, внутриполушарная когерентность
Короткий адрес: https://sciup.org/14750785
IDR: 14750785 | УДК: 616.8-005
Текст научной статьи Состояние биоэлектрической активности мозга после каротидной эндартерэктомии в раннем восстановительном периоде ишемического инсульта
Развитие ишемического инсульта (ИИ) в 60– 75 % случаев связано с патологией брахиоцефальных артерий (БЦА). Ведущим этиологическим фактором стенотических поражений БЦА является атеросклероз. Выполнение каротидной эндартерэктомии (КЭАЭ) при клинически проявляющемся стенозе внутренней сонной артерии снижает риск развития повторного инсульта в бассейне оперированного сосуда при стенозе более 70 % просвета. В ряде исследований обнаружено, что для пациентов без существенных отклонений по результатам КТ или при низкой плотности видимых на КТ изменений в условиях стабильного неврологического дефицита и нормального уровня сознания КЭАЭ безопасна и сопровождается низким риском операционных осложнений [5], [6], [11]. В работе [1] показано, что возможность оперировать больных с инфарктом мозга основана на изменениях мозговой гемодинамики. У пациентов с симптомным каротидным стенозом, визуально определяемой недостаточностью перфузии и потерей перфузионного резерва (коррелирующим с симптомным статусом) риск ИИ повышен. КЭАЭ устраняет межполушарную асимметрию и улучшает перфузию мозга. У пациентов с односторонним ка
ротидным стенозом после КЭАЭ нормализуются анатомические характеристики и коллатеральный кровоток по виллизиевому кругу. Снижение церебрального дефицита и сосудистого резерва после КЭАЭ может еще больше снизить риск ИИ благодаря вымыванию церебральных эмболов из пограничных зон, в которых коллатеральное кровоснабжение минимально [13]. Некоторые исследования подтвердили, что неврологический дефицит, сосудистый бассейн инсульта, размер инфаркта и время операции являются факторами, влияющими на риск оперативного вмешательства [11]. При тяжелом симптомном каротидном стенозе преимущества КЭАЭ весьма существенны и значительно повышаются по мере увеличения степени стеноза до 95 % [4]. Благоприятный эффект от операции при ИИ более выражен, чем при ТИА, хотя риск осложнений, вероятно, выше в первом случае [12]. Показано, что абсолютный риск КЭАЭ снижается наполовину, если операция откладывается как минимум на 2 недели, и далее снижается еще наполовину, если проводится не раньше чем через 4 недели. При отложенной КЭАЭ риск повторного ИИ и каротидной окклюзии составляет 2–2,5 % [1].
Целью исследования явилось изучение особенностей показателей спектров мощности и показателей внутриполушарной когерентности у пациентов ИИ, которым в раннем восстановительном периоде была выполнена КЭАЭ.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Обследованы 28 пациентов с односторонним стенозом высокой степени (75 % и более просвета артерии) ВСА на ипсилатеральной стороне инсульта: 16 пациентов с левополушарной локализацией очага и 12 пациентов с правополушарной локализацией. Среди них мужчин было 20 человек (71,4 %), женщин – 8 (28,6 %). Средний возраст пациентов составил 61,2 ± 7,6 года. Оценка степени тяжести неврологического дефицита (шкала Lindmark), функциональных возможностей (шкала Barthel) пациентов проводилась на 21-е, 30-е сутки инсульта, а также спустя 3 и 6 месяцев. Контрольную группу составили 37 пациентов с ишемическим инсультом в раннем восстановительном периоде, сопоставимых по возрасту и полу. Для регистрации ЭЭГ использовали 19-канальный цифровой электроэнцефалограф нейрокартограф фирмы «МБН» (Россия). Для количественной оценки спектра когерентности использовали программу «Нейрокартограф», которая позволяла методом быстрого преобразования Фурье рассчитать значения спектров мощности и показателей внутриполушарной когерентности (ВПК) для основных диапазонов частот ЭЭГ: дельта (0–4 Гц), тета (4–8 Гц), альфа-1 (8–10 Гц), альфа-2 (10–13 Гц), бета (13– 30 Гц). Анализировали монополярные отведения ЭЭГ с референтными ушными электродами. Запись ЭЭГ проводилась на 21-е сутки, спустя 3 и 6 месяцев заболевания. Статистическую обработку данных осуществляли при помощи пакета статистических программ S-Plus 2000 (Math Soft Inc) с использованием методов непараметрической статистики. Данным пациентам в течение 6 месяцев после перенесенного ИИ была выполнена КЭАЭ.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В клинической картине заболевания у всех пациентов в начале раннего восстановительного периода сохранялся умеренный гемипарез, анизорефлексия с повышением сухожильных и периостальных рефлексов на стороне пареза, у 9 (32,1 %) пациентов выявляли рефлекс Бабинского. Отмечали умеренное повышение мышечного тонуса по спастическому типу на стороне гемипареза. У 6 (21,4 %) пациентов данной группы с локализацией инфаркта в левом полушарии наблюдали симптомы умеренной моторной афазии. Чувствительные нарушения по гемитипу наблюдали у 15 (53,6 %) пациентов, симптомы аутотопогнозии отмечали у 4 (14,3 %) пациентов с правополушарной локализацией инфаркта.
Суммарный балл по шкале Lindmark на 21-е сутки – 376,7 ± 15,2, по шкале Barthel – 70,5 ± 4,5.
При динамическом наблюдении в раннем восстановительном периоде инсульта спустя 3 месяца от начала заболевания отмечали незначительный регресс очаговой неврологической симптоматики. Средний балл по шкале Lindmark составил 394,7 ± 16,2, по шкале Barthel – 75,5 ± 6,5. К 6-му месяцу наблюдали дальнейший регресс двигательных и чувствительных нарушений. Очаговая неврологическая симптоматика сохранялась у 23 (82,1 %) пациентов. В данной подгруппе к 6-му месяцу отмечали увеличение суммарного балла по шкале Lindmark до 417,4 ± 19,6, по шкале Barthel – до 80,7 ± 7,5. К концу раннего восстановительного периода у 21 (75 %) пациента сохранялся легкий гемипарез. У большинства пациентов нарушения мышечного тонуса регрессировали. Нарушения чувствительности были у 13 (46,45 %) пациентов.
На 7-е сутки после выполнения операции КЭАЭ существенной динамики в неврологическом статусе не выявили. При динамическом наблюдении спустя месяц после операции отмечали значительный регресс очаговой неврологической симптоматики. Средний балл по шкале Lindmark составил 436,5 ± 10,2, по шкале Barthel – 90,7 ± 5,5 (р < 0, 05) (таблица). Полный регресс двигательных нарушений наблюдали у 8 (28,5 %) пациентов, преимущественно с правополушарным инсультом. У остальных пациентов данной подгруппы сохранялись двигательные нарушения в виде легкого гемипареза, преимущественно в дистальных отделах, и анизорефлексии. У 7 (46,6 %) пациентов отмечали исчезновение нарушений поверхностной и глубокой чувствительности. Таким образом, в данной подгруппе у пациентов к 1-му месяцу произошло значительное восстановление двигательной функции и способности к самообслуживанию.
При динамическом наблюдении спустя 3 месяца после операции отмечали дальнейший регресс очаговой неврологической симптоматики. Средний балл по шкале Lindmark составил 441,7 ± 12,4, по шкале Barthel 95 ± 4,5 (см. табл.). У 7 пациентов данной подгруппы сохранялись двигательные нарушения в виде легкого гемипареза в дистальных отделах и анизорефлексии. У всех пациентов наблюдали исчезновение нарушений поверхностной и глубокой чувствительности.
Таким образом, в данной подгруппе пациентов после выполнения КЭАЭ наблюдали практически полное восстановление двигательных функций и способности к самообслуживанию. Наиболее выраженную динамику изменений отмечали спустя месяц после операции (p < 0,05). Выживаемость в послеоперационном периоде составила 100 %.
При исследовании показателей спектров мощности к концу раннего восстановительного
Динамика состояния больных, перенесших КЭАЭ, в течение 3 месяцев после операции по шкалам Lindmark и Barthel (в баллах, М ± m)
|
Группа больных |
Интегральная тяжесть по шкалам, M ± m |
|||||
|
7-е сутки |
1-й месяц |
3-й месяц |
||||
|
шкала Lindmark |
шкала Barthel |
шкала Lindmark |
шкала Barthel |
шкала Lindmark |
Шкала Barthel |
|
|
Инсульт средней тяжести (после КЭАЭ), n = 28 |
417,4 ± 19,6 |
84,7 ± 7,5 |
436,5 ± 10,2* |
90,7 ± 5,5* |
441,7 ± 12,4 |
95 ± 4,5 |
Примечание. * – достоверные отличия показателей по шкалам до операции и спустя 1 месяц после операции, p < 0,05.
периода у пациентов наблюдались высокие показатели медленноволновой, преимущественно тета-активности (р < 0,05), с преобладанием ее на стороне поражения и сохранением межполушарной асимметрии. Отмечалось увеличение показателей ВПК во всех областях обоих полушарий, преимущественно в альфа-, бета- и тета-диапазонах, по сравнению с контрольной группой. Выявлялось достоверное увеличение (р < 0,05) ВПК в лобно-височных, центрально-височных и лобно-центральных областях обоих полушарий.
Наиболее выраженная динамика изменений наблюдалась спустя месяц после восстановления мозгового кровотока при КЭАЭ (p < 0,05) (средний балл по шкалам Lindmark и Barthel 436,5 ± ± 10,2 и 90,7 ± 5,5 соответственно). Выживаемость в послеоперационом периоде составила 100 %. В течение 7 суток после выполнения КЭАЭ значимых изменений спектральной мощности не выявлено. Однако к концу 1-го месяца отмечалось уменьшение тета- и дельта-активности с уменьшением межполушарной асимметрии (р < 0,05). Отмечалось увеличение альфа- и бета-активности (р < 0,05) в лобно-центральном, лобно-височном, височных и затылочных отделах обоих полушарий с преобладанием изменений на стороне поражения по сравнению с доопера-ционными показателями.
Выявлялось достоверное уменьшение (p < 0,05) показателей ВПК в большинстве областей пораженного полушария, преимущественно в альфа-, бета- и тета-диапазонах. Наиболее выраженное снижение показателей регистрировали в бета-диапазоне (рисунок).
Спустя 3 месяца после операции картина биоэлектрической активности достоверно не изменялась. При этом значения показателей приближались к показателям группы здоровых лиц. В течение всего послеоперационного периода отмечали также снижение показателей ВПК в интактном полушарии, но менее выраженное, чем в пораженном полушарии. В послеопераци-
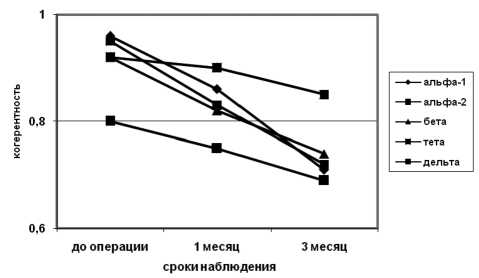
Динамика изменений внутриполушарной когерентности пораженного полушария у больных, перенесших КЭАЭ (по оси ординат – значения внутриполушарной когерентности, по оси абсцисс – сроки после операции)
онном периоде в данной подгруппе пациентов наблюдали практически полное восстановление двигательных, чувствительных функций и способности к самообслуживанию.
ЗАКЛЮЧЕНИЕ
Таким образом, в послеоперационном периоде происходит значительное уменьшение показателей мощности спектра медленноволновой активности и увеличение альфа- и бета-активности в обоих полушариях с преобладанием изменений на стороне очага. Данные изменения связаны с восстановлением процессов метаболизма нейронов головного мозга в условиях восстановления мозговой гемодинамики при КЭАЭ. У пациентов с симптомным стенозом ВСА отмечаются снижение уровня церебральной перфузии и истощение перфузионного резерва. КЭАЭ улучшает перфузию мозга и коллатеральный кровоток по виллизиевому кругу, в том числе за счет вымывания церебральных эмболов из пограничных зон, в которых коллатеральное кровоснабжение было минимально, устраняя тем самым межполушарную асимметрию, выявляемую по данным ЭЭГ.
STATE OF BRAIN ACTIVITY AFTER CAROTID ENDARTERECTOMY IN EARLY RECOVERY
PHASE OF ISCHEMIC STROKE
Список литературы Состояние биоэлектрической активности мозга после каротидной эндартерэктомии в раннем восстановительном периоде ишемического инсульта
- Баркаускас Е., Мескаскене А., Лаурикенас К. Риск, связанный с каротидной эндартерэктомией у пациентов с инфарктом головного мозга//Ангиология и сосудистая хирургия. 2005. Т. 1. № 1. С. 103-111.
- Караваев Б. И., Гавриленко А. В., Скрылев С. И., Куклин А. В. Метаболизм в головном мозге при каротидной эндартерэктомии (оксигенация, электролитный баланс, потребление глюкозы)//Ангиология и сосудистая хирургия. 2006. Т. 12. № 4. С. 43-47.
- AbuRahma A. F., Robinson P., Holt S. M. et al. Perioperative and late Stroke rates of carotid endarterectomy contralateral to carotid artery occlusion: results from a randomized trial//Stroke. 2000. Vol. 31. P. 1566-1571.
- Barnett H. J. M., Taylor D. W., Eliasziw M. et al. Benefit of carotid endarterectomy in patients with symptomatic moderate or severe stenosis//N. Engl. J. Med. 1998. Vol. 339. P. 1415-1425.
- Doerfler A., Eckstein H. H., Eichbaum M. et al. Perfusion -weighted magnetic resonance imaging in patients with carotid artery disease before and after carotid endarterectomy//J. Vasc. Surg. 2001. Vol. 34. P. 587-593.
- Kline R. A., Lazo A., Bass N. et al. Safety of early carotid endarterectomy after Stroke//Stroke. 1995. Vol. 26. P. 173. Abstract.
- Halgren E., Baudena P., Clarke J. et al. Intracerebral potentials to rare target and distractor auditory and visual stimuli. II. Medial, lateral and posterior temporal lobe//Electroencephalogr. Clin. Neurophysio. 1995. Vol. 94. P. 229-250.
- Halgren E., Marincovic K., Chauvel P. Generators of the late cognitive potentials in auditory and visual oddball tasks//Electroenceph. Clin. Neurophysiol. 1998. Vol. 106. P. 156-164.
- Maurer A. H., Siegel J. A., Comerota A. J. SPECT quantification of cerebral ischemia before and after carotid endarterectomy//J. Nucl. Med. 1990. Vol. 31. P. 1412-1420.
- Mayberg M. R., Wilson S. E., Yatsu F. Carotid endarterectomy and prevention of cerebral ischemia in symptomatic carotid stenosis//JAMA. 1991. Vol. 266. P. 3289-3294.
- Pritz M. B. Timing of carotid endarterectomy after Stroke//Stroke. 1997. Vol. 28. P. 2563-2567.
- Rothwell P. M., Gutnikov S. A., Warlow C. P. For the ECST. Re-analysis of the final results of the European Carotid Surgery Trial//Stroke. 2003. Vol. 34. P. 514-523.
- Vernieri F., Pasqualetti P., Matteis V. et al. Effect of collateral reactivity on the outcome of carotid artery jcclussion//Stroke. 2001. Vol. 32. P. 1552-1558.


