Состояние диффузной лимфоидной ткани тонкого кишечника мышей в условиях иммунодефицита и коррекции пептидным биорегулятором
Автор: Улзытуева Д.А., Лебедева С.Н.
Журнал: Вестник Восточно-Сибирского государственного университета технологий и управления @vestnik-esstu
Рубрика: Биологические науки
Статья в выпуске: 5 (50), 2014 года.
Бесплатный доступ
Изучено иммуномодулирующее действие пептидного биорегулятора на диффузную лимфоидную ткань тонкого кишечника мышей на фоне азатиоприновой иммуносупрессии. Установлено, что после введения мышам пептидного биорегулятора в собственной пластинке слизистой оболочки появляются клетки с картинами митозов, увеличивается содержание молодых форм клеток, плазматических клеток и макрофагов, снижается деструкция клеток. Эти факты свидетельствуют об усилении функциональной активности диффузной лимфоидной ткани кишки после действия пептидного биорегулятора.
Иммунная система, иммунодефицитные состояния, пептидный биорегулятор, лимфоидная ткань, тонкая кишка
Короткий адрес: https://sciup.org/142142961
IDR: 142142961 | УДК: 641.1:612.017.1
Текст научной статьи Состояние диффузной лимфоидной ткани тонкого кишечника мышей в условиях иммунодефицита и коррекции пептидным биорегулятором
На сегодня неблагоприятная экологическая ситуация, психоэмоциональные перегрузки, злоупотребление медикаментозными средствами, нарушения в питании и многие другие факторы приводят к росту числа заболеваний, сопровождающихся снижением естественной резистентности организма.
Одним из основных способов поддержания нормального функционирования иммунной системы и восстановления иммунитета при иммунодефицитных состояниях является применение иммуномодуляторов [1].
В качестве иммуномодуляторов эндогенного происхождения применяются иммуноре-гуляторные пептиды, полученные из органов иммунной системы.
В настоящее время доказана регулирующая роль пептидов в развитии большинства биологических процессов, начиная с биохимических реакций, заканчивая дифференцировкой и функциональной активностью различных клеток и систем организма. Изучение закономерностей пептидной регуляции позволяет рассматривать их как природные корректоры, направленность и сила которых зависит от исходного уровня конкретного биологического процесса.
Ранее авторами был получен пептидный биорегулятор, обладающий нейротропной, адаптогенной и иммуномодулирующей активностью [2, 3, 4]. В частности, было доказано, что пептидный биорегулятор, выделенный из тимуса свиней, восстанавливает показатели клеточного и гуморального иммунитета, функцию макрофагов при экспериментальной аза-тиоприновой иммуносупрессии. Также установлено, что биорегулятор сохраняет свой иммуномодулирующий эффект в составе фаршевого мясного продукта.
Крупнейшим отделом иммунной системы является лимфоидная ткань желудочнокишечного тракта, которая входит в состав кишечно-ассоциированной лимфоидной ткани (КАЛТ) [5].
Тонкая кишка, имея обширную пограничную поверхность, находится в постоянном контакте с многочисленными антигенами, поступающими алиментарным путем.
В связи с тесным контактом с антигенами в слизистой оболочке тонкой кишки развивается мощная лимфоидная ткань, образующая иммунокомпетентную систему, в которой происходят реакции клеточного типа, а также сенсибилизация лимфоцитов с последующей дифференцировкой в плазматические клетки, синтезирующие иммуноглобулины.
В структурной и функциональной деятельности иммунной системы слизистой оболочки тонкой кишки значительное место занимают пейеровы бляшки, одиночные лимфоидные узелки и диффузная лимфоидная ткань, которые составляют 70-80% всех иммунных клеток [6].
В связи с этим исследование механизма действия пептидного биорегулятора на периферическую лимфоидную ткань пищеварительной системы позволяет судить о реактивности иммунной системы при воздействии антигенов, поступающих извне.
Целью настоящего исследования явилось изучение функционального состояния диффузной лимфоидной ткани различных отделов тонкого кишечника мышей в условиях иммунодефицита, вызванного азатиоприном, и коррекции пептидным биорегулятором.
Материал и методы исследования
Для проведения экспериментальных исследований были использованы белые беспородные мыши-самцы весом 22-25 г. Животные были разделены на 3 группы по 10 особей в каждой. Первая группа состояла из интактных животных. Во второй группе находились животные, получавшие перорально иммунодепрессант азатиоприн в дозе 50 мг/кг веса 1 раз в сутки в течение 5 дней. Третья группа животных после введения азатиоприна получала пептидный биорегулятор, вводимый аналогичным способом в дозе 0,1 мг/кг 1 раз в сутки в течение 7 дней.
По окончании проводимых серий экспериментов животных умерщвляли методом мгновенной декапитации под легким эфирным наркозом [7].
У животных всех экспериментальных групп выделяли проксимальный, средний и дистальный отделы тонкой кишки. Материал фиксировали в 10%-ном нейтральном формалине с последующей стандартной спиртовой проводкой и заливкой в парафин по общепринятой методике [8]. Из парафиновых блоков готовили срезы толщиной 4-6 мкм на микротоме, которые окрашивали гематоксилином и эозином. Подсчет клеток проводили при помощи микроскопа Биомед 6 при увеличении объектива - 90 под масляной иммерсией по методу С.Б. Стефанова с использованием 25-узловой морфометрической сетки (с шагом 10 мкм), вмонтированной в окуляр (9х) микроскопа [9].
Полученные результаты систематизировали и подвергли статистической обработке с помощью t-критерия Стьюдента.
Результаты и их обсуждение
У животных интактной группы в проксимальном отделе тонкой кишки (табл., рис. 1) преобладали клетки лимфоидного ряда, из них 36,7% приходилось на средние лимфоциты. Количество малых лимфоцитов в 4,0 раза меньше, чем средних. Среди молодых форм клеток преобладали бластные формы, содержание которых было в 1,8 раза больше, чем больших лимфоцитов. Собственная пластинка слизистой оболочки содержала довольно большое ко- личество плазматических клеток 6,6%. Содержание нейтрофилов, макрофагов, митотиче-ски делящихся клеток составило соответственно 0,3, 1,4 и 1,6%. Содержание стромальных клеток (ретикулоцитов, фибробластов и фиброцитов) составляло в сумме 12,2%.
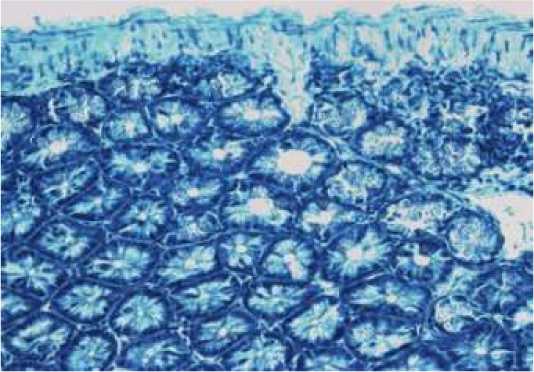
Рис. 1. Бруннеровы железы в собственной пластинке слизистой оболочки тонкой кишки интактной мыши (проксимальный отдел). Микрофотография. Фиксация – 10%-ный нейтральный формалин. Окраска гематоксилином-эозином (х 200)
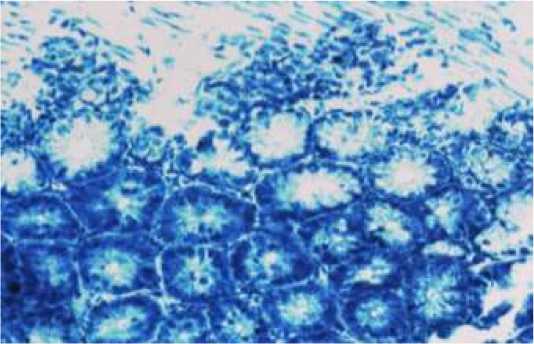
Рис. 2. Собственная пластинка слизистой оболочки тонкой кишки мыши после введения азатиоприна. Отек слизистой оболочки и массовая деструкция клеточных элементов (проксимальный отдел).
Микрофотография. Фиксация – 10%-ный нейтральный формалин. Окраска гематоксилином-эозином (х 200)
Гистологическое исследование препаратов стенки тонкой кишки мышей, подвергшихся воздействию азатиоприна, свидетельствовало о наличии воспалительно-деструктивных процессов. Наблюдались отек слизистой оболочки, подслизистой основы и массовая деструкция клеточных элементов (рис. 2). Так, содержание деструктивно измененных и разрушенных клеток в проксимальном отделе тонкой кишки увеличилось в 4,9 раза по сравнению с контролем. Клеточный анализ диффузной лимфоидной ткани в собственной пластинке слизистой оболочки данного отдела тонкой кишки показал резкое уменьшение количества клеток лимфоидного ряда: количество больших лимфоцитов уменьшилось в 8,5 раза, средних лимфоцитов – в 2,7 раза по сравнению с контролем. Содержание плазматических клеток уменьшилось в 2,4 раза. Митотически делящиеся клетки в слизистой оболочке кишки в данной группе животных не выявлены. Для данной группы животных характерно значительное увеличение содержания нейтрофилов (в 11,7 раз). Как известно, среди всех клеточных элементов нейтрофилы первыми появляются в зоне острого воспаления. Кроме того, введение аза тиоприна вызывало увеличение содержания стромальных клеток: ретикулоцитов – в 1,7 раза и клеток фибробластического ряда – в 8,0 раз.
После введения пептидного биорегулятора у опытных мышей отмечалась перестройка клеточного состава лимфоидных клеток, которая характеризовалась для проксимального отдела тонкой кишки увеличением количества больших лимфоцитов в 16,0 раза (рис. 3), средних лимфоцитов – в 2,3 раза и плазматических клеток – в 1,7 раза (по сравнению со 2-й группой).
Важным показателем действия пептидного биорегулятора на лимфоидную ткань собственной пластинки слизистой оболочки кишки являлась стимуляция репродуктивной функции лимфоидных клеток. После введения пептидного биорегулятора появлялись клетки с картинами митозов (1,0%), которые отсутствовали в интактной и азатиоприновой группах. Под воздействием пептидного биорегулятора в проксимальном отделе уменьшилось количество деструктивно измененных клеток – в 1,7 раза (по сравнению со 2-й группой), но их содержание в 2,8 раза все же превосходило данный показатель у интактных животных. Введение пептидного биорегулятора способствовало нормализации относительного числа ретикулярных клеток и уменьшению клеток фибробластического ряда, содержание которых на фоне воздействия азатиоприна уменьшилось в 1,1 раза, но все еще существенно превосходило данный показатель у интактных животных.
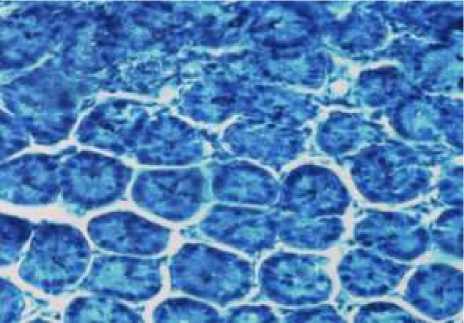
Рис. 3. Собственная пластинка слизистой оболочки мыши, получавшей пептидный биорегулятор после введения азатиоприна (проксимальный отдел). Микрофотография. Фиксация – 10%-ный нейтральный формалин. Окраска гематоксилином-эозином (х 200)
На продольных гистологических срезах лимфоидной ткани среднего отдела тонкой кишки (табл.) у интактных мышей внутренняя поверхность стенки кишки неровная, на ней видно большое количество крипт. Количество клеток лимфоидного ряда (бласты, большие, средние и малые лимфоциты и плазматические клетки) в собственной пластинке слизистой оболочки составило 65,2%.
При гистологическом исследовании препаратов среднего отдела кишки мышей после введения азатиоприна отмечались признаки иммунодепрессивного состояния. После воздействия азатиоприна клетки лимфоидного ряда встречались гораздо реже, чем в контроле (от 65,2 до 34,2%). На гистологических срезах кишки в собственной пластинке слизистой оболочки содержание деструктивно измененных и разрушенных клеток увеличилось до 18,7%, что превысило контрольные показатели почти в 3 раза.
Цитологический анализ лимфоидной ткани среднего отдела кишки мышей, получавших после введения азатиоприна пептидный биорегулятор, свидетельствовал о том, что у этих животных наблюдалось отчетливое восстановление общего числа лимфоидных клеток от 34,2 до 53,6%. Содержание деструктивно измененных и разрушенных клеток в собственной пластинке слизистой оболочки кишки данной группы экспериментальных животных снизилось по сравнению с показателями животных 2-й группы в 2,3 раза.
Таблица
Клеточный состав (в %) диффузной лимфоидной ткани собственной пластинки слизистой оболочки различных отделов тонкой кишки мышей в контроле и эксперименте (М±m)
|
Клетки/отдел |
Интактные животные (контроль) |
После введения азатиоприна |
После введения азатиоприна и пептидного биорегулятора |
||||||
|
1-я группа |
2-я группа |
3-я группа |
|||||||
|
Пр |
Ср |
Д |
Пр |
Ср |
Д |
Пр |
Ср |
Д |
|
|
Ретикулоциты |
10,4±1,3 |
8,5±0,9 |
7,3±0,8 |
17,8±0,9* |
20,2±1,3 |
23,5±2,3* |
14,3±1,2 |
10,7±0,6 |
6,2±0,7** |
|
Бласты |
12,3±0,4 |
5,4±3,1 |
0,7±0,1 |
16,7±0,3 |
12,3±2,7* |
10,3±0,4* |
11,7±2,3 |
6,1±1,8 |
3,9±0,3** |
|
Большие лимфоциты |
6,8±1,7 |
7,3±0,2 |
6,7±0,5 |
0,8±3,2* |
0,2±0,1* |
0,9±0,2* |
12,8±2,6** |
5,4±0,3** |
9,4±0,7** |
|
Средние лимфоциты |
36,7±3,6 |
35,8±3,6 |
38,1±3,5 |
13,8±2,7* |
11,5±2,2* |
8,9±1,2* |
31,5±1,4** |
19,0±3,5** |
11,6±1,3** |
|
Малые лимфоциты |
9,1±1,5 |
10,4±4,2 |
12,9±1,3 |
5,2±1,3 |
9,3±2,9* |
11,3±1,7* |
8,9±1,1 |
13,6±2,6** |
12,5±1,2** |
|
Плазмоциты |
6,6±1,2 |
6,3±1,4 |
8,7±0,9 |
2,7±0,5* |
0,9±0,1* |
- |
4,6±1,0** |
9,5±2,1** |
11,2±1,5 |
|
Нейтрофилы |
0,3±0,1 |
0,4±0,1 |
0,2±0,3 |
3,5±0,9* |
1,8±0,2 |
3,1±0,8 |
3,1±0,7 |
0,7±1,1 |
- |
|
Макрофаги |
1,4±0,2 |
1,2±0,6 |
1,1±0,2 |
1,9±0,3 |
0,3±0,1 |
- |
0,7±0,2 |
4,2±0,9 |
6,2±1,7 |
|
Митотически делящиеся |
1,6±0,3 |
1,5±0,2 |
- |
- |
- |
- |
1,0±0,1 |
0,8±1,0 |
0,9±0,1 |
|
Деструкции |
3,4±1,7 |
6,4±1,8 |
9,5±1,8 |
16,5±1,5* |
18,7±1,4* |
23,5±2,2* |
9,5±2,1** |
8,2±2,5** |
10,7±2,1** |
|
Фиброциты |
1,8±0,6 |
1,9±0,7 |
- |
14,4±2,3* |
7,3±0,8 |
6,8±1,4 |
13,0±2,0 |
7,5±1,3 |
8,3±0,3 |
Примечание. «-» в графах означает, что данные клетки не обнаружены; *, ** p<0,05 относи тельно 1-й или 2-й группы
Исследование цитоархитектоники диффузной лимфоидной ткани собственной пластинки слизистой оболочки дистального отдела тонкой кишки (см. табл.) у интактных мышей показало, что большая часть лимфоцитов из всех лимфоидных клеток относится к средним лимфоцитам – 38,1%. Малых лимфоцитов почти в 3 раза меньше (12,9%), чем средних. Среди молодых форм клеток преобладали большие лимфоциты, которые в 9,5 раза больше бластных форм клеток. В собственной пластинке слизистой оболочки тонкой кишки у интактных мышей встречались плазматические клетки (8,7%), а также были видны деструктивно измененные клетки 9,5%.
Введение мышам азатиоприна приводило к усилению деструктивных процессов в лимфоидной ткани дистального отдела. Содержание деструктивно измененных и разрушенных клеток увеличилось после действия азатиоприна в 2,5 раза по сравнению с контрольной группой. При этом общее содержание лимфоцитов снизилось от 67,1% в интактной группе до 31,4% в опыте. В собственной пластинке слизистой оболочки тонкой кишки отмечалось значительное нарушение процессов созревания молодых форм: число больших лимфоцитов уменьшилось после действия азатиоприна в 7,4 раза, средних лимфоцитов – в 4,3 раза в сравнении с интактной группой. Количество плазматических клеток незначительное. Число ретикулоцитов увеличилось в 3,2 раза, и появились фиброциты (6,8%), которые не обнаруживались в интактной группе.
После введения пептидного биорегулятора в собственной пластинке слизистой оболочки дистального отдела тонкой кишки в 2 раза уменьшилось число деструктивно измененных и разрушенных клеток (по сравнению со 2-й группой) и почти достигло показателей интактной группы мышей. В 1,5 раза увеличилось общее содержание лимфоцитов (от 31,4 до 48,6%), однако число различных популяций лимфоцитов изменялось в разной степени. Так, доля средних и больших лимфоцитов возросла по сравнению с показателями 2-й группы в 1,3 и 10,4 раза соответственно. Число бластных форм, наоборот, уменьшилось в 2,6 раза. В диффузной лимфоидной ткани собственной пластинки слизистой оболочки кишки после действия пептидного биорегулятора появлялись также плазматические клетки – 11,2%.
В ходе проведенного исследования установлено, что введение азатиоприна способствовало уменьшению содержания клеток лимфоидного ряда в проксимальном отделе тонкой кишки в 1,9 раза, в среднем – 1,9 раза и в дистальном – 2,1 раза (по сравнению с контролем). Наибольшее повреждающее действие азатиоприна проявилось в дистальном отделе тонкой кишки. При коррекции иммунодефицита, вызванного азатиоприном, пептидным биорегулятором, содержание клеток лимфоидного ряда в проксимальном отделе увеличилось в 1,8 раза, в среднем – в 1,6 раза и в дистальном – в 1,5 раза (по сравнению со 2-й группой).
Полученные экспериментальные данные согласуются с результатами исследований Д.Г. Бильдуевой (2001) [10] и Г.П. Ламажаповой (2001) [11] о том, что нарушения периферической лимфоидной ткани пищеварительной системы (в собственной пластинке слизистой оболочки подвздошной и слепой кишки), вызванные применением цитостатика азатиоприна, подвергаются коррекции природными средствами – активной фракцией, полученной из селезенки, и липосомальными структурами, содержащими жир байкальской нерпы.
Таким образом, исследование морфофункционального состояния диффузной лимфоидной ткани в собственной пластинке слизистой оболочки различных отделов (проксимальный, средний, дистальный) тонкой кишки мышей в условиях азатиоприновой иммуносупрессии и коррекции пептидным биорегулятором, позволило выявить изменения, направленные на восстановление ее структуры.
Работа выполнена при поддержке гранта «Молодые ученые и аспиранты ВСГУТУ 2014».


