Состояние микроциркуляторного русла головного мозга при жировом рационе
Автор: Шувалова М.С., Шидаков Ю.Х.М.
Журнал: Владикавказский математический журнал @vmj-ru
Статья в выпуске: 3 т.26, 2024 года.
Бесплатный доступ
Основную роль в процессе поступления и усвоения пищи организмом играет система микроциркуляции. Она обеспечивает распределение кислорода и нутриентов между нейронами с учетом их функциональной активности. Капилляры ворсин сосудистого сплетения желудочков головного мозга остаются главным местом продукции цереброспинальной жидкости, определяющей большинство физиологических функций организма. Цель исследования - выявление особенностей ремоделирования микроциркуляторного русла и сосудистого сплетения третьего желудочка головного мозга крыс, содержащихся исключительно на жировой диете.
Рацион, питание, жир, микроциркуляция, сосудистое сплетение, головной мозг
Короткий адрес: https://sciup.org/143183191
IDR: 143183191 | УДК: 612.824.2:612.397.7 | DOI: 10.34014/2227-1848-2024-3-107-116
Текст научной статьи Состояние микроциркуляторного русла головного мозга при жировом рационе
Введение. Одним из важнейших факторов, действующих на организм в течение всей жизни, является питание. Пища выступает исходным материалом для создания тканей организма, их регенерации и обновления, служит основным донатором энергии, является источником синтеза регуляторов и биохимических катализаторов: гормонов и ферментов [1].
Потребляемая пища оказывает разностороннее влияние на организм человека и животного, при этом одной из важнейших мишеней воздействия нутриентов является головной мозг. Так, жирные кислоты необходимы для поддержания структуры и функционирования клеточных мембран головного мозга и имеют решающее значение для оптимальной работы нейронов, повышают синаптическую пластичность, потенциально улучшая когнитивные функции [2].
Особо важную роль в транспорте ключевых микроэлементов и питательных веществ в структуры головного мозга играет конечное звено кровообращения – микроциркуляторное русло. Именно на уровне микроциркуляторного русла наиболее отчетливо проявляется неразрывное единство нейрогуморального регулирования кровоснабжения и метаболизма нейронов и нейроглиальных клеток. Это единство выступает центральным механизмом распределения кислорода и нутриентов между нейронами с учетом их функциональной активности. В итоге сохраняется перемежающаяся активность мик-роциркуляторного русла, нейронов и астроцитов, т.е. компонентов микрооси «нейрон-астро-цит-сосуд». Физиологические изменения гомео-кинеза и гомеоморфоза компонентов микрооси, взаимодействуя между собой на уровне гематоэнцефалического барьера, поддерживают постоянство транспорта метаболитов через биологические мембраны [1, 2].
Производным сосудистой оболочки являются сосудистые сплетения желудочков головного мозга (ССГМ). ССГМ имеют ворсинчатое строение. Основными компонентами ворсинок являются синусоидальный капилляр, соединительнотканная строма и эпенди-моциты. ССГМ крысы весом 200–250 г синтезируют за 1 сут 430–483 мл цереброспинальной жидкости без тканевой и видовой специфичности, но богатой биологически активными веществами [3, 4]. В связи с этим ремоделирование ССГМ отражается не только на структурной организации и функциональной специализации нейронов и нейроглиальных клеток, но и на поведении крыс [5].
Зачастую в экспериментальной диетологии используются продукты сложного состава. В таких случаях невозможно установить роль отдельных компонентов в возникающих изменениях. Только в единичных работах сообщается о результатах исследования состояния различных органов при кормлении животных одним из трех основных нутриентов (белков, жиров, углеводов) [2, 3]. Например, при кетогенной диете 70–80 % энергии обеспечивается за счет жиров, 15-25 % - за счет белков, 5 % - за счет углеводов [1, 3]. Надо полагать, что недостаток углеводов при использовании кетогенной диеты пополнится за счет глицерина, полученного при расщеплении жиров, гликогенных аминокислот -продукта метаболизма белков.
Цель исследования. Выявление особенностей ремоделирования микроциркулятор-ного русла и сосудистого сплетения третьего желудочка головного мозга крыс, содержащихся исключительно на жировой диете.
Материалы и методы. Работа выполнена на 20 беспородных крысах-самцах массой 200-250 г с соблюдением правил лабораторной практики, утвержденных приказом Министерства здравоохранения и социального развития Российской Федерации от 23.08.2010 № 708 Н «Об утверждении лабораторной практики», и принципов гуманности, изложенных в директивах Европейского сообщества (86/609/ЕЕС) и Хельсинкской декларации. Исследование одобрено на заседании этического комитета при научно-производственном объединении «Профилактическая медицина» Министерства здравоохранения Кыргызской Республики (протокол № 1 от 5.01.2020, номер регистрации 01-3/28).
Перед началом эксперимента животные были случайным образом распределены на контрольную и экспериментальную группы (по 10 крыс в каждой). Животных контрольной группы содержали на стандартном рационе. Опытную группу крыс кормили исключительно курдючным салом барана.
На 15-й и 30-й дни животных выводили из эксперимента путем передозировки хлороформа. Забор крови для последующего анализа содержания холестерина, глюкозы, общего белка и альбумина производился из места слияния яремной и подключичной вен (венозный угол). Определение биохимических показателей производилось энзиматическим колориметрическим методом с использованием тест-систем Vital (Россия).
После вскрытия брюшной полости осуществлялось введение в кровеносное русло (через аорту) взвеси черной туши на 10 % нейтральном формалине в разведении 1:4. Этим достигалось заполнение гемомикроцир-куляторного русла контрастной массой и фиксация органов. В последующем изготовлялись просветленные и гистологические препараты, окрашенные гематоксилин-эозином и по Ван-Гизон. Готовые срезы изучались под микро- скопом Olympus B×40 (Япония) с одновременным фотографированием с помощью цифровой камеры Levenhuk C130 NG (КНР) и протоколированием.
Морфометрию стромального компонента ССГМ проводили с помощью приложения для измерения микроскопических объектов Top View. Анализ элементов сосудистого сплетения головного мозга проводили в поле зрения светового микроскопа.
Объем эпендимоцитов (нм3) вычисляли по формуле
V эп =abc , где V эп – объем эпендимиальной клетки; а – длина эпендимоцита; b – ширина эпендимо-цита; с – высота эпендимоцита (в кубической клетке соответствует длине).
Объем ядра эпендимоцитов (нм3) вычисляли по формуле
Vяд = 4 яг2, где Vяд – объем ядра эпендимиальной клетки; r – среднее значение радиуса клетки.
Объем цитоплазмы эпендимиальной клетки (нм3) вычисляли по формуле
V цит =V эп –V яд , где V цит – объем цитоплазмы; V эп – объем эпендимиальной клетки; V яд – объем ядра.
Ядерно-цитоплазматическое отношение определяли по формуле
ЯЦО = V яд / V цит где ЯЦО – ядерно-цитоплазматическое отношение; V яд – объем ядра; V цит – объем цитоплазмы.
Полученные результаты обрабатывали в программе SPSS 16.0, достоверность различий определяли по критерию Стъюдента при p<0,05.
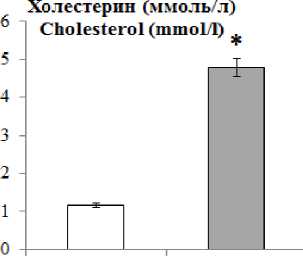
Результаты и обсуждение. У интактных животных уровень холестерина сыворотки крови составляет 1,16±0,04 ммоль/л, глюкозы – 1,67±0,01 г/л, альбумина – 24,9±0,02 г/л. В группе опыта к 30-м сут, по сравнению с группой контроля, в сыворотке крови крыс увеличивается уровень общего холестерина в 4,7 раза, на 20 % возрастает концентрация глюкозы и в 2 раза повышается содержание альбумина (p<0,05) (рис. 1).
Глюкоза (г/л)
Glucose (g/1)
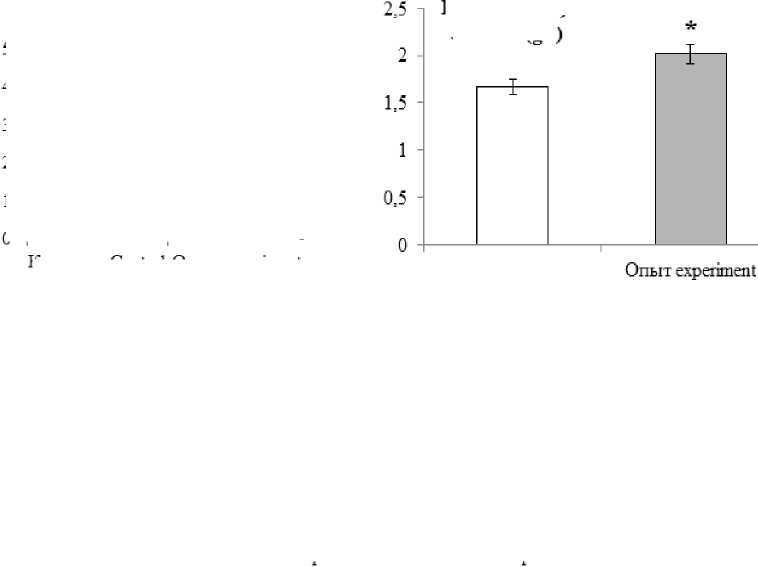
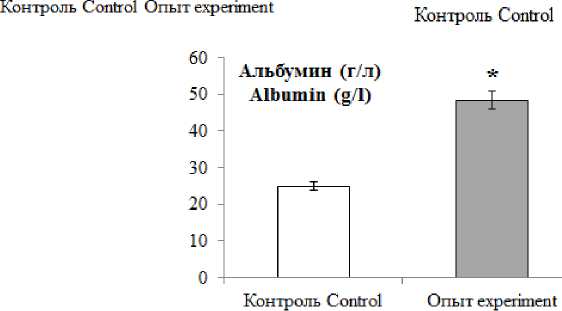
Рис. 1. Значения биохимических показателей сыворотки крови на 30-е сут (* – различие статистически значимо (р<0,05))
Fig. 1. Changes in biochemical parameters of blood serum. Fat diet, day 30 (* – the difference is statistically significant (p<0.05))
Биохимические изменения отражаются на гемореологии, что в итоге приводит к ремоделированию микроциркуляторного русла головного мозга. Так, по данным световой микроскопии, уже на 15-е сут эксперимента крупные артерии сосудистой оболочки на верхнелатеральной и медиальной поверхностях полушарий головного мозга имеют овальные очертания. Просвет их содержит незначительное количество крови. Средние артерии округлые, часто полнокровные, каких-либо структурных изменений сосудистой стенки не наблюдается. От артерий сосудистой оболочки отходят кортикальные и медуллярные ветви, проникающие в вещество головного мозга. На фронтальных срезах головного мозга видны артерии, которые с верхнелатеральной поверхности переходят на медиальную поверхность полушария головного мозга, спускаются по ней до мозолистого тела, а также поперечные срезы артерий, расположенных сагитально. Вены сосудистой оболочки выглядят атоничными. Одни из них заполнены цельной кровью, другие - кровью, расслоенной на плазму и форменные элементы. В отдельных экземплярах наблюдается студнеобразная опалесцирующая масса. Можно предположить, что она содержит значительную концентрацию хиломикронов, циркулировавших прижизненно в кровеносной системе. На уровне микроциркуляторного русла фиксируется активация артериоло-вену-лярных анастомозов. Других приспособительных (тем более патологических) изменений микроциркуляторного русла головного мозга не отмечается.
На 30-й день эксперимента наблюдаются визуальные вазальные, интравазальные и экс-травазальные изменения, касающиеся всех звеньев кровеносного русла сосудистой оболочки головного мозга. В артериях гладкая мускулатура подвергается парезу, протеолизу, вакуольной дистрофии, гипоплазии с резким расширением просвета сосуда. Эндотелиальные клетки набухают, их ядра просветляются и выпирают в просвет сосуда. В адвентиции встречаются признаки миоэластофиброза. Вены характеризуются истончением стенки, расширением просвета, наличием внутрисосудистых тромбов.
На уровне микроциркуляторного русла отмечается облитерация капилляров, что под микроскопом представляет собой нитеобразные структуры без отчетливого просвета. Образованию таких капилляров предшествует спазм артериол и формирование артериоловенулярных анастомозов.
Особое внимание привлекает взаимосвязь изменений кортикальных и медуллярных артерий, с одной стороны, и пиоглиальной мембраны и маргинальной глии - с другой. Облитерация артерий сопрягается с огрубением пиоглиальной мембраны и истончением маргинальной глии. Напротив, дилатация кортикальных и медуллярных артерий сочетается с отсутствием изменений в маргинальной глии. Из этого следует, что взаимосвязь между состоянием кровеносных сосудов нейронов и астроцитов устанавливается уже на уровне истоков интрамуральных артерий головного мозга.
Пиоглиальная мембрана, граничащая с субарахноидальным пространством, представляет собой ликвор-энцефалический барьер, через который совершается транспорт ряда веществ из цереброспинальной жидкости в вещество головного мозга. В ареале облитерированной артерии, по всей вероятности, происходит локальное изменение окружающей среды. Транспорт веществ через пиогли-альную мембрану становится нецелесообразным, она утолщается и грубеет.
Сосудистый компонент ворсинок сосудистого сплетения III желудочка состоит из синусоидальных капилляров, стенка которых построена из окончатого эндотелия, базальной мембраны и перицитов. Капилляры ворсинок получают артериальную кровь от ветвей задней мозговой и передней ворсинчатой артерий. Венозная кровь от сосудистого сплетения III желудочка оттекает во внутренние мозговые вены. Таким образом, в сосудистом сплетении III желудочка головного мозга присутствуют все звенья микрогемоциркуляторного русла [6, 7]. Следовательно, в сосудистом сплетении имеются артериолы, прекапилляры, капилляры, посткапилляры, венулы, артериоло-венуляр-ные анастомозы. В гроздьевидной части сосудистого сплетения III желудочка головного мозга среди многоярусной сети ворсинок не всегда удается обнаружить разные звенья мик-рогемоциркуляторного русла. Так, у интактных крыс нередко в сосудистом сплетении III желудочка обнаруживаются ворсинки с полнокровными и экземпляры с бескровными сосудами [8]. На наш взгляд, это является структурным субстратом вазомоции в сосудистом сплетении при жизни животного. Не исключена возможность регуляции кровотока через сосудистое сплетение путем изменения диаметра ветвей ворсинчатых артерий.
На 15-й день жировой диеты отмечается облитерация отдельных ветвей задней и передней ворсинчатых артерий, а также закупорка последних кровяными конгломератами. Но 30-й день подобные изменения встречаются чаще. Причиной может быть постоянная циркуляция в кровеносном русле возросшей концентрации альбуминов – до 48,3±13,3 г/л при норме 24,9±3,1 г/л, холестерина – до 4,78±0,028 ммоль/л против 1,16±0,04 ммоль/л в группе контроля. Отключение кровотока по отдельным ворсинчатым артериям компенсируется за счет коллатерального кровотока. В итоге плазмоток по синусоидальным капиллярам ворсинок обеспечивает выработку оптимального количества цереброспинальной жидкости эпендимоцитами до 15-го дня эксперимента. К 30-м сут наблюдается дефицит плазмотока по синусоидальным капиллярам сосудистого сплетения III желудочка, что вызывает компенсаторную гиперфункцию эпен-димоцитов.
Эпендимоциты имеют кубическую форму, базолатеральную и апикальную поверхности. Базолатеральная поверхность отделена от прилежащей соединительнотканной стороны базальной мембраной. Апикальная поверхность обращена в полость желудочка. Основная функция эпендимоцитов – продукция цереброспинальной жидкости. Особый интерес составляет расположение Na+-K+-АТФазы на апикальной поверхности эпенди-моцитов, в то время как в других секреторных клетках эта субстанция расположена на базолатеральной части [9–11].
В условиях исключительно жирового кормления у крыс увеличиваются размеры эпендимоцитов (табл. 1). Так, объем эпендими-альной клетки увеличивается в 2,8 раза (p<0,001), объем ядра – в 1,1 раза (p<0,05), объем цитоплазмы – в 2,9 раза, при этом отмечается уменьшение ЯЦО в 2,3 раза (p<0,001). В данном случае увеличение объемов эпендими-альных клеток можно связать с происходящей гипертрофией органелл, а именно с субклеточной пролиферацией митохондрий и эндоплазматического ретикулума. При микроскопии эпендимоциты ССГМ животных опытной группы приобретают более округлую форму.
Таблица 1
Table 1
Характеристика эпендимоцитов сосудистых сплетений головного мозга животных (нм3)
Comparative data of ependymocytes of vascular plexuses of the brain of animals on an exclusively fatty diet (nm3)
|
Показатель Parameter Группа Group |
Объем клетки, нм3 Cell volume, nm3 |
Объем ядра, нм3 Core volume, nm3 |
Объем цитоплазмы, нм3 Cytoplasm volume, nm3 |
ЯЦО, усл. ед. Nucleoplasmic ratio, RU |
|
Контроль Control |
7583,2±379,8 |
520,5±25,5 |
7062,7±373,7 |
0,07±0,004 |
|
Опыт Experiment |
21342,2±1141,2** |
598,4±29,5* |
20743,11±1517,1** |
0,03±0,002** |
Примечание. Различия между опытной и контрольной группами достоверны при: **– p<0,001;
*– p<0,05.
Note. The differences are significant compared with the control (* – p<0.05; ** – p<0.01).
Гипертрофические явления в эпендими-альных клетках сопряжены со снижением кровотока по синусоидальным капиллярам. Между синусоидальными капиллярами и базальной мембраной эпендимоцитов располагается соединительная ткань, которая имеет лептоменингеальное происхождение [12–15] и состоит из коллагеновых и ретикулярных волокон. Судя по происхождению она богата коллагеном III типа, не ограничивающим просвет сосудов. Поэтому ремоделирование кровеносных сосудов и эпендимоцитов не сопровождается изменением внешнего очертания сосудистого сплетения III желудочка головного мозга.
Ремоделирование молекулярного и наружного зернистого слоев (ассоциативной зоны) коры головного мозга при жировой диете характеризуется гетерогенностью в зависимости от топографии расположения. Так, в структуре мелких ассоциативных клеток молекулярного слоя под влиянием жировой диеты отмечается мутное набухание ядер с одновременным просветлением цитоплазмы, концентрация клеток зернистого слоя снижается, их высота уменьшается. Кровеносное русло этих зон также характеризуется неоднородностью. Базальная мембрана сосудов приобретает извилистый контур, истончается, порозность сосудистой стенки возрастает, приводя к возникновению локальных кровоизлияний. Эти изменения более выражены в нижних отделах пре- и постцентральных извилин, чем в средних и верхних, а также на верхнелатеральной поверхности полушарий по сравнению с нижней и медиальной.
Имеются общие черты приспособительных, компенсаторных и патологических реакций независимо от места локализации кровеносных сосудов. В качестве приспособительных реакций выступает чередование спазма и дилатации просвета без альтерации сосудистой стенки. Такая реакция артериального звена кровеносного русла служит структурной основой перемежающейся активности сосудистой стенки и паравазального тканевого окружения. Выраженная вазомоция в условиях снижения транспорта кислорода более предпочтительна, чем равномерный кровоток по соседним сосудам. Приспособительная ва- зомоция коррелирует с изменениями парава-зального окружения. Особый интерес представляет природа оптически пустых пространств, которые в литературе трактуются как паравазальный отек [16]. На наш взгляд, это вопрос дискуссионный. Дело в том, что размеры этих оптических пустот не зависят от диаметра кровеносных сосудов. От диаметра сосуда зависит толщина оптически пустого кольца, окружающего кровеносный сосуд. При вазомоции площадь пустого пространства меняется без модуляции его диаметра. Кроме того, оптически пустые пространства часто представляют артефакты, возникшие в результате растворения миелина в процессе проведения кусочков мозга по спиртам возрастающей концентрации. Следовательно, появляющиеся в процессе изготовления гистологических препаратов паравазальные оптически путые пространства не являются следствием отека вокруг сосудов. Таким образом, в случае прижизненного приспособительного ремоделирования кровеносных сосудов механизм образования вокруг них оптически пустого окружения зависит от активности вазомоции, а на гистологических препаратах – от обработки биоматериала. При облитерации сосудов паравазальные оптически пустые окружения сохраняются длительное время, пока не заполнятся разросшейся нейроглией.
Спазм кровеносных сосудов повышает активность астроцитов, которые своими длинными отростками плотно окружают сосуды, обеспечивая нейроны кислородом и нутриентами, а также транспортируя в обратном направлении отработанные продукты метаболизма.
Ремоделирование кровеносного русла в пирамидальном и внутреннем зернистом слоях коры головного мозга менее выражено, чем в молекулярном и наружном зернистом слоях. Здесь большую роль играют изменения биохимического профиля крови. Имеет значение и то, что в нижних отделах передней и задней центральных извилин локализовано ядро анализатора импульсов, идущих от внутренних органов и кровеносных сосудов. В условиях исключительно жировой диеты воз- можно снижение глюкоцентрического и повышение липоцентрического пути метаболизма. В результате микроось «нейрон-астро-цит-сосуд» приобретает особое значение.
Заключение. Исключительно жировой рацион приводит к ремоделированию микро- циркуляторного русла головного мозга, в т.ч. капилляров ворсин сосудистого сплетения III желудочка. Все изменения носят компенсаторноприспособительный характер, однако к 30-м сут эксперимента часть из них приобретает характер необратимых патологических модуляций.
Список литературы Состояние микроциркуляторного русла головного мозга при жировом рационе
- Федотова А.А., Тяглик А.Б., Семьянов А.В. Влияние диеты как фактора экспозома на работу головного мозга. Российский физиологический журнал им. И.М. Сеченова. 2021; 107 (4-5): 533-567.
- Пулатов М.Д. Гистотопографические сдвиги клеток фундальных желез желудка при однообразном белковом питании. Молодой ученый. 2018; 44 (230): 220-222.
- Байрашева В.К., Пчелин И.Ю., Егорова А.Э., Василькова О.Н., Корнюшин О.В. Экспериментальные модели алиментарного ожирения у крыс. Juvenis Scientia. 2019; 9-10: 8-13.
- Brown P.D., Davies S.L., Speake T., Millar I.D. Molecular mechanisms of cerebrospinal fluid production. Neuroscience. 2004; 129 (4): 957-970.
- Zappaterra M.W., Lehtinen M.K. The cerebrospinal fluid: regulator of neurogenesis, behavior, and beyond. Cell Mol Life Sci. 2012; 69 (17): 2863-2878.
- Dohrmann G.J. The choroid plexus: a historical review. Brain Res. 1970; 18 (2): 197-218.
- Chodobski A, Szmydynger-Chodobska J. Choroid plexus: target for polypeptides and site of their synthesis. Microsc Res Tech. 2001; 52 (1): 65-82.
- ШуваловаМ.С., ШидаковЮ.Х.М., Шаназаров А.С. Сосудистое сплетение желудочков головного мозга (Обзор литературы). Вестник Кыргызско-Российского Славянского университета. 2022; 22 (5): 159-166.
- Кирик О.В. Белок клеточных контактов бета-катенин в клетках эпендимы и эпителия сосудистого сплетения боковых желудочков головного мозга. Морфология. 2016; 148; 1: 33-37.
- MastorakosP., McGavern D. The anatomy and immunology of vasculature in the central nervous system. Science Immunology. 2019; 4 (37).
- Шерышева Ю.В. Филогенез сосудистых сплетений головного мозга позвоночных. Научное обозрение. Биологические науки. 2019; 1: 67-71.
- Коржевский Д.Э. Сосудистое сплетение головного мозга и структурная организация гематолик-ворного барьера у человека. Регионарное кровообращение и микроциркуляция. 2003; 2: 5-14.
- Гасанова И.Х. Морфологические преобразования эпендимоцитов сосудистых сплетений желудочков головного мозга половозрелых крыс при введении ксеногенного ликвора. Таврический медико-биологический вестник. 2013; 1-1: 59-61.
- Гурин В.Н. Организация микроциркуляторного русла сосудистого сплетения боковых желудочков мозга кроликов. Физиол. журн. им. И.М. Сеченова. 1991; 77 (9): 150-157.
- BetzA.L., Goldstein G.W., KatzmanR. Bloodbrain-cerebrospinal fluid barriers. In: Seigel G.J., ed. Basic Neurochemistry: Molecular, Cellular and Medical Aspects. New York: Raven Press; 1994: 681-702.
- Задворнов А.А., Голомидов А.В., Григорьев Е.В. Клиническая патофизиология отека головного мозга (часть 1). Вестник анестезиологии и реаниматологии. 2017; 14 (3): 44-50.


