Состояние митохондрий и гипертрофия сердца при развитии стрептозотоцин-индуцированного диабета на фоне экспериментального инфаркта миокарда
Автор: Егорова М.В., Афанасьев С.А., Попов С.В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 3-1 т.26, 2011 года.
Бесплатный доступ
Рассмотрено изменение морфометрических параметров крыс с экспериментальным инфарктом миокарда и са харным диабетом на разных сроках вызванных патологий. Показано, что при сочетании инфаркта миокарда и диабета наблюдается снижение степени гипертрофии сердца (в сравнении с инфарктными крысами). Во всех группах при сочетании патологий наблюдалось менее выраженное снижение массы тела относительно живот ных с диабетом. На клеточном уровне показано увеличение свободного дыхания митохондрий сердца при всех патологиях. При этом разобщение процессов окисления и фосфорилирования было менее выражено при сочета нии инфаркт+диабет. Сохранение рассматриваемых параметров не сопровождалось сохранением структуры кар диомиоцитов.
Дыхание митохондрий, инфаркт миокарда, диабет, гипертрофия, сочетанная патология
Короткий адрес: https://sciup.org/14919503
IDR: 14919503 | УДК: 616.127-005.8/616-092.9
Текст научной статьи Состояние митохондрий и гипертрофия сердца при развитии стрептозотоцин-индуцированного диабета на фоне экспериментального инфаркта миокарда
Известно, что постинфарктное ремоделирование сопровождается гипертрофией миокарда и нарушением сократительной способности кардиомиоцитов [3]. Диабет также вызывает серьезное поражение сердечной мышцы диабетическую кардиомиопатию, что приводит к нарушению функции левого желудочка и развитию сердечной недостаточности [12]. Более того, при одинаковой выраженности ИБС риск летального исхода в ближайшем периоде после острого инфаркта миокарда в 2–4 раза выше у больных с диабетом [4, 15, 16].
Многочисленные исследования убедительно продемонстрировали, что гипертрофия миокарда левого желудочка является своеобразным маркером повышенной летальности. С другой стороны, гипертрофия миокарда является компенсаторно-приспособительной реакцией при хронической ишемии и увеличении общего периферического сосудистого сопротивления [3, 10].
Ранее нами было показано, что сочетание постинфарктного ремоделирования и стрептозотоцин-индуциро-ванного сахарного диабета в эксперименте уменьшает патологические проявления в функциях миокарда срав- нительно с отдельными патологиями [2, 6, 18]. В частности, при сочетании патологий наблюдались менее выраженные гипертрофия сердца [2, 6] и нарушения инотропной функции миокарда [2]. Также менее выражена степень разобщения окисления и фосфорилирования в митохондриях сердца [6, 18]. Помимо этого имеются свидетельства того, что при сочетании патологий наблюдается снижение нарушений сократительной активности миокарда, уровня гликированного гемоглобина в крови и некоторых других показателей у экспериментальных животных [5, 17, 19]. Все это свидетельствует о проявлении адаптивно-приспособительных реакций миокарда на сочетание данных патологий, механизм которых неизвестен.
Цель исследования: провести сравнительный анализ морфометрических изменений сердца крыс в динамике развития постинфарктного ремоделирования и сахарного диабета от острого периода до хронического состояния, а также дыхания и структуры митохондрий сердца в эксперименте.
Таблица 1
Экспериментальные группы животных
|
Обозначение экспериментальных групп и подгрупп |
Срок после моделирования первой патологии, до моделирования второй патологии, недели |
Срок от моделирования второй патологии до забоя животного, недели |
Общая длительность патологии, от начала эксперимента до забоя, недели |
Число животных в группе (n) |
|
I группа – интактные животные: контроль |
- |
- |
- |
10 |
|
II группа – инфаркт (И2-И6): И2 |
2 |
- |
2 |
9 |
|
И4 |
4 |
- |
4 |
5 |
|
И6 |
6 |
- |
6 |
6 |
|
III группа – диабет (Д2-Д6): Д2 |
2 |
- |
2 |
5 |
|
Д4 |
4 |
- |
4 |
5 |
|
Д6 |
6 |
- |
6 |
12 |
|
IV группа – инфаркт+диабет (И+Д): И2Д2 |
2 |
2 |
4 |
6 |
|
И2Д4 |
2 |
4 |
6 |
5 |
|
И2Д6 |
2 |
6 |
8 |
5 |
|
И4Д2 |
4 |
2 |
6 |
7 |
|
И4Д4 |
4 |
4 |
8 |
5 |
|
И4Д6 |
4 |
6 |
10 |
5 |
|
И6Д2 |
6 |
2 |
8 |
5 |
|
И6Д4 |
6 |
4 |
10 |
5 |
|
И6Д6 |
6 |
6 |
12 |
14 |
|
V группа – диабет+инфаркт (Д+И): Д2И2 |
2 |
2 |
4 |
5 |
|
Д2И4 |
2 |
4 |
6 |
5 |
Материал и методы
Исследования проведены на половозрелых крысах-самцах одного возраста линии Вистар. Были сформированы следующие группы: I группа – контроль – интактные животные; II группа – животные после моделирования инфаркта миокарда (И); III группа – животные с индуцированным сахарным диабетом (Д); IV группа – постинфарктные животные со стрептозотоцин-индуциро-ванным сахарным диабетом (И+Д); V группа – животные, у которых после индукции сахарного диабета вызывали инфаркт миокарда (Д+И), таблица 1. Дополнительные пояснения по группам в тексте.
Для моделирования инфаркта миокарда животным под эфирным наркозом осуществляли перевязку левой передней нисходящей коронарной артерии [2, 6, 8]. Рану послойно ушивали, предварительно удалив воздух из грудной полости.
Развитие постинфарктных изменений верифицировали морфологически, гипертрофию миокарда определяли по соотношению массы сердца к массе тела (Мс/ Мт) и массы левого желудочка к массе сердца (Млж/Мс) [1, 8].
Сахарный диабет индуцировали однократным введением стрептозотоцина в дозе 60 мг/кг внутрибрюшинно, разведенного 0,01 моль/л цитратным буфером (рН 4,5) [5]. Верификацию осуществляли по увеличению концентрации глюкозы в крови крыс в 3–4,5 раза, снижению массы тела, развитию полиурии и полидипсии [2, 6].
Митохондрии из клеток сердечной мышцы животных получали стандартным методом дифференциального центрифугирования в сахарозной среде, содержащей
250 мМ сахарозы, 10 мМ ЭДТА, 10 мМ HEPES, рН 7,4 [7]. Для исследования митохондрии суспендировали и хранили в 250 мМ растворе сахарозы, 10 мМ HEPES, рН 7,4.
Скорость поглощения кислорода митохондриями определяли полярографически, с помощью электрода Кларка. Измерение проводили в среде (рН 7,4), содержащей: 300 мМ сахарозу, 10 мМ КСl, 5 мМ КН2РО4, 1,2 мМ MgCl2, 1 мМ ЭГТА, 5 мМ сукцинат, 2 мкМ ротенон, 5 мМ HEPES. В качестве добавки использовали 200 мкМ АДФ.
Дыхательный контроль (ДК) определяли как отношение скорости дыхания при максимальном синтезе АТФ к скорости дыхания в отсутствие синтеза АТФ [7]. Скорость потребления кислорода приведена в нМ О2 в мин на 1 мг белка.
Для исследования морфологии клеток при помощи электронного микроскопа кусочки сердца фиксировали 2,5% глютаровым альдегидом в 0,1 М растворе какодилата натрия (рН 7,4) при 4 °C. После фиксации кусочки дважды отмывали какодилатным буфером, затем фиксировали в 1%-м растворе четырехокиси осмия с последующим двукратным отмыванием какодилатным буфером. Полученный материал дегидратировали в этиловых спиртах восходящей концентрации. Препараты заливали в ара-дилат. Ультратонкие срезы толщиной 30–60 нм готовили на ультратоме “Ultrotom 111”. Полученные срезы наносили на сетки с формваровым покрытием и контрастировали 2%-м уранилацетатом и цитратом свинца. Полученные препараты просматривали в электронном микроскопе “JEM-100CX11” с апертурной диафрагмой 25– 30 мкм при ускоряющем напряжении 80 кВ.
В работе использовали реактивы фирмы Sigma и ICN.
Статистическую обработку полученных данных проводили с помощью пакета прикладных программ STATISTICA 6.0. Закон распределения исследуемых параметров не согласуется с нормальным законом распределения (критерий Шапиро–Вилка, р>0,05). Значения исследуемых показателей представлены в виде медианы и интерквартильного размаха в виде Q2 (Q1; Q3). Ввиду малого объема групп и их независимости статистическую значимость различий величин исследуемых параметров между сравниваемыми группами оценивали с помощью непараметрического рангового U-критерия Манна–Уитни, внутри групп – критерия Вилкоксона для зависимых переменных.
Результаты и обсуждение
Первоначальной задачей, помимо исследования в группах контроля и отдельных патологий, являлось исследование экспериментальной модели сочетанной патологии в двух модификациях:
Таблица 2
Уровень глюкозы в крови, масса тела и показатели гипертрофии миокарда у животных в экспериментальных группах
|
Группы |
Глюкоза, мМ/л |
Мт, г |
Мс/Мт, мг/г |
Млж/Мс, мг/мг |
|
I группа Контроль |
7,4 (7,3; 7,75) |
272 (251; 345) |
3,3 (3,1; 3,4) |
0,60 (0,58; 0,61) |
|
II группа И2 |
7,7 (6,93; 8,49) |
287 (275;298)& |
4,5 (4,3; 4,9)*#& |
0,54 (0,52; 0,59) |
|
И4 |
7,9 (7,9; 7,9) |
300 (298; 318)& |
5,3 (4,4; 5,5)*& |
0,62 (0,61; 0,63) |
|
И6 |
8,9 (8,4; 10,7) |
314 (310; 315)*& |
5,7 (4,9; 6,4)*& |
0,67 (0,63; 0,69)* |
|
III группа Д2 |
23,1 (23,0; 25,1)* |
172 (171; 180)*# |
2,9 (2,7; 2,9)#& |
0,60 (0,57; 0,63) |
|
Д4 |
30,0 (27,4; 31,7)* |
187 (179; 236)*# |
3,2 (2,7; 3,1)# |
0,60 (0,59; 0,63) |
|
Д6 |
29,4 (29,0; 32,5)* |
222 (206; 252)*# |
3,1 (3,3; 3,6)# |
0,57 (0,56; 0,60)# |
|
IV группа И2Д2 |
33,3 (28,4; 33,3)* |
234 (184; 296)# |
3,2 (3,0; 3,3)#^ |
0,60 (0,57; 0,63) |
|
И2Д4 |
30,1 (19,2; 31,2)* |
294 (274; 300)&^ |
3,6 (3,5; 3,8)# |
0,60 (0,57; 0,62) |
|
И2Д6 |
27,4 (24,1; 31,2)* |
283 (258; 296)*#& |
4,2 (3,8; 4,4)#& |
0,57 (0,56; 0,58)# |
|
И4Д2 |
27,4 (26,3; 29,4)* |
207 (184; 209)*#^ |
3,2 (3,1; 3,2)^ |
0,57 (0,55; 0,58)#^ |
|
И4Д4 |
31,5 (30,5; 33,3)* |
206 (179; 218)*# |
4,3 (3,7; 4,9)*#& |
0,57 (0,56; 0,59)# |
|
И4Д6 |
33,3 (33,3; 33,3)* |
215 (207; 222)# |
4,3 (3,8; 4,7)*#& |
0,63 (0,57; 0,67) |
|
И6Д2 |
32,5 (29,2; 33,3)* |
224 (218; 228)*# |
3,2 (3,1; 3,4) |
0,57 (0,56; 0,60)# |
|
И6Д4 |
26,9 (26,2; 29,4)* |
257 (223; 272)#& |
3,3 (3,0; 3,3) |
0,57 (0,55; 0,61)# |
|
И6Д6 |
33,1 (30,3; 33,2)* |
184 (183; 206)#* |
4,7 (4,0; 5,4)*#& |
0,59 (0,56; 0,60)# |
|
V группа Д2И2 |
33,1 (30,3; 33,2)* |
215 (200; 226)*# |
3,7 (3,5; 3,8)*#^ |
0,63 (0,61; 0,66)* |
|
Д2И4 |
28,0 (27,3; 28,5)* |
215 (189; 220)*# |
3,7 (3,5; 3,9)*# |
0,62 (0,59; 0,64)*^ |
Примечание: Мт – масса тела; Мс/Мт соотношение массы сердца к массе тела; Млж/Мс – сооотношение массы левого желудочка к массе сердца; * – различия статистически значимы (p<0,05) по отношению к контролю; # – различия статистически значимы (p<0,05) при сравнении в экспериментальных группах с патологиями по отношению к соответствующему показателю в подгруппе И6; & – различия статистически значимы (p<0,05) в экспериментальных группах с патологиями по отношению к соответствующему показателю в подгруппе Д6; ^ – различия статистически значимы (p<0,05) при сравнении соответствующих показателей в группах сочетанной патологии с общим сроком, но разным порядком, по отношению друг к другу (И2Д2 к Д2И2; И2Д4 к Д2И4; И2Д4 к И4Д2; И4Д2 к Д2И4).
-
1) предшествование инфаркта миокарда диабету;
-
2) предшествование диабета инфаркту миокарда. Изучение материала предполагало исследование в следующих точках: а) через 2, 4 и 6 недель после экспериментального инфаркта моделировали сахарный диабет введением стрепто-зотоцина и исследовали материал через 2, 4 и 6 недель после моделирования диабета. Таким образом, сформировали 9 подгрупп IV экспериментальной группы (табл. 1);
-
б) аналогичным образом была сделана попытка сформировать еще 9 подгрупп V экспериментальной группы, в которых диабет предшествует инфаркту (табл. 1). Однако по причине высокой смертности животных в этой экспериментальной модели удалось получить только две подгруппы животных. Выживаемость отдельных
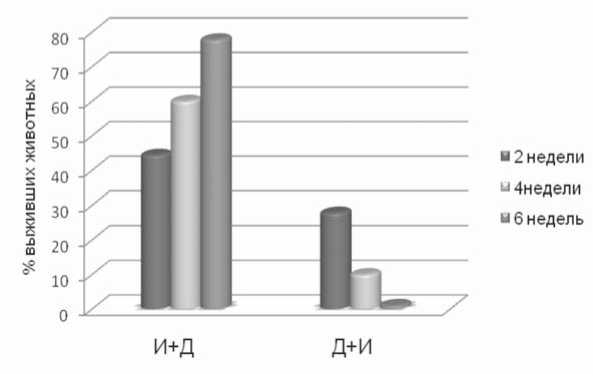
Рис. 1. Выживаемость животных в эксперименте при сочетании инфаркт+-диабет и диабет+инфаркт. 2, 4, 6 недель – срок первой патологии, на котором моделировалось второе заболевание; И+Д – диабет на фоне развивающегося постинфарктного кардиосклероза (IVгруппа); Д+И – развитие постинфарктного кардиосклероз на фоне диабета (V группа)
животных в других подгруппах была статистически не значима.
Вариант диабет+инфаркт характеризовался более агрессивным течением: как видно из диаграммы, максимальная выживаемость животных с исходным диабетом была ниже минимальной у животных с обратной после- довательностью формирования сочетанной патологии (рис. 1).
С увеличением срока диабета, на фоне которого производилась коронароокклюзия, выживаемость резко падала. У животных с исходным инфарктом, с увеличением срока перед моделированием диабета, выживаемость при
Таблица 3
Скорость поглощения кислорода и дыхательный контроль митохондрий cердца
|
Группы |
ЯК |
ДК |
|
I группа контроль |
26,5 (25,5; 27,5) |
3,4 (2,9; 3,5) |
|
II группа И2 |
87,3 (55,8; 91,3)* |
1,8 (1,71; 2,06) * |
|
И4 |
77,2 (71,9; 79,5)* |
2,0 (1,9; 2,3)* |
|
И6 |
123,7 (119,1; 133,6)* |
1,9 (1,78; 2,03)* |
|
III группа Д2 |
92,3 (86,6; 98,1)* |
1,8 (1,6; 1,79)* |
|
Д4 |
136,5 (131,3; 141,7)* |
1,8 (1,65; 1,83)* |
|
Д6 |
137,6 (130,9; 138,6)* |
1,7 (1,7; 1,82)* |
|
IV группа И2Д2 |
65,5 (64,3; 66,6)*&^ |
1,7 (1,6; 1,73)* |
|
И2Д4 |
138,2 (134,9; 141,5)*#^ |
1,7 (1,6; 1,78)* ^ |
|
И2Д6 |
139,7 (135,7; 141,5)*# |
1,7 (1,6; 1,84)* |
|
И4Д2 |
84,0 (64,2; 87,4)* #^ |
2,2 (2,25; 2,3)*&^ |
|
И4Д4 |
88,8 (84,4; 98,6)*& |
1,9 (1,8; 2,0)* |
|
И4Д6 |
87,8 (87,0; 93,7)*& |
1,9 (1,81; 1,94)* |
|
И6Д2 |
87,8 (79,2; 95,2)*# |
1,8 (1,6; 1,9)* |
|
И6Д4 |
131,3 (114,6; 152,2)* |
1,8 (1,73; 2,09)* |
|
И6Д6 |
150,5 (144,9; 166,2)*#& |
1,7 (1,6; 1,84)* |
|
V группа Д2И2 |
78,5 (77,5; 78,6)*&^ |
1,7 (1,7; 1,8)* |
|
Д2И4 |
150,0 (148,4; 151,4)*#&^ |
1,7 (1,6; 1,84)*^ |
Примечание: ЯК – янтарная кислота, субстрат окисления; ДК – дыхательный контроль; * – различия статистически значимы (p<0,05) по отношению к контролю; # – различия статистически значимы (p<0,05) при сравнении в группах сочетанной патологии (IV и V группы) по отношению к соответствующему показателю в II группе, на том же сроке моделируемого инфаркта (например, И2Д2, И2Д4, И2Д6 и Д2И2 в сравнении с И2, аналогично в других подгруппах); & – различия статистически значимы (p<0,05) в группах сочетанной патологии (IV и V группы) по отношению к соответствующему показателю в III группе, на том же сроке моделируемого диабета (например, И2Д2, И4Д2, И6Д2, Д2И2 и Д2И4 в сравнении с Д2, аналогично в других подгруппах); ^ – различия статистически значимы (p<0,05) при сравнении соответствующих показателей в группах сочетанной патологии с общим сроком, но разным порядком, по отношению друг к другу (И2Д2 к Д2И2; И2Д4 к Д2И4; И2Д4 к И4Д2; И4Д2 к Д2И4).
сочетании патологии выросла с 44 до 78%.
Нужно отметить, что уровень глюкозы в крови сохранялся примерно на одинаково высоком уровне во всех экспериментальных группах с диабетом (табл. 2). Таким образом, очевидно, что разная выживаемость в обеих сериях обусловлена не столько гипергликемией, сколько способностью организма противостоять патологическому состоянию.
Хроническая гипергликемия сопровождалась истощением животных. В среднем, крысы с диабетом (Д2–Д6) теряли в весе от 30 до 50% по отношению к контрольным животным, в то время как у животных с инфарктом потеря веса была незначительной в сравнении с контролем. При сочетании инфаркта и диабета истощение животных также наблюдалось, однако снижение массы тела было менее выражено.
Гипертрофию миокарда определяли по соотношению Мс/Мт. Как видно из таблицы 2, наблюдается выраженная гипертрофия миокарда на сроке И6, на стадии морфологически выраженного постинфарктного кардиосклероза [8]. При сочетании инфаркта и диабета на всех сроках наблюдается снижение степени гипертрофии, в том числе и при сочетании диабет+инфаркт. Индекс Млж/ Мс демонстрирует, что гипертрофия левого желудочка менее выражена при сочетании инфаркт+диабет, однако при сочетании диабет+инфаркт левый желудочек увеличен относительно сочетания инфаркт+диабет, хотя и менее, чем при инфаркте без диабета.
Развивающаяся в органе гипертрофия, несомненно, имеет положительное значение, поскольку позволяет сохранить функцию органа, несмотря на заболевание – хорошо известная в клинике стадия компенсации. В дальнейшем в органе возникают дистрофические изменения, происходит ослабление функции и, в конечном счете, когда адаптационные механизмы исчерпаны, наступает стадия декомпенсация и гибели организма.
Известно, что недостаток кислорода приводит к запуску компенсаторных процессов на уровне митохондрий, с переходом энергосинтеза на альтернативные, более быстрые и мощные процессы [9]. Увеличение синтеза АТФ, с одной стороны, помогает обеспечивать возрастающие потребности сердца. С другой стороны, АДФ выступает в роли естественного ингибитора процесса разобщения окисления и фосфорилирования [20], неизбежно сопутствующего рассматриваемым патологиям [9].
Наше исследование показало, что скорость потребления кислорода митохондриями сердца крыс при всех патологиях, как по отдельности, так и при их сочетании, сопровождается увеличением свободного, не связанного с фосфорилированием дыхания (табл. 3).
Однако степень разобщения окисления и фосфорилирования была менее выражена при сочетании инфар-кт+диабет, как по отношению к таковому показателю при инфаркте, так и по отношению к сочетанию диабет+ин-фаркт. Наибольшая устойчивость наблюдалась в подгруппе животных И4Д2-6, т.е. в условиях уже имеющегося ремоделирования [8], на фоне которого пагубное воздействие диабета на любых сроках было менее выражено. В тех случаях, когда после инфаркта проходило 6 недель (животные подгруппы И6Д2-6), сочетание с диабетом уже не усиливало компенсаторных реакций и состояние энергетики, в целом, не отличалось от такового в подгруппах И6 и Д6.
Логично было бы ожидать, что сохранение морфометрических и метаболических показателей при сочетании патологии в нашем эксперименте по отношению к отдельным патологиям будет сопровождаться и относительно меньшим проявлением структурных изменений миокарда. К сожалению, это предположение не подтвердилось. На рисунке 2 приведены электронномикроскопические фотографии кардиомиоцитов интактных животных (рис. 2.1), животных при сформированном постинфарктном кардиосклерозе (рис. 2.2), диабете (рис. 2.3) и их сочетании (рис. 2.4).
При обеих патологиях наблюдались типичные изменения митохондрий [13], характеризующие процесс их разрушения: набухание органелл с деградацией их наружных мембран, просветление, вымывание и гомогенизация митохондриального матрикса, деструкция крист (рис. 2.2 и 2.3). Эти изменения свидетельствуют как о деградации, так и о гиперфункции митохондриального аппарата [14]. Сочетание патологий приводило к значительно-

Рис. 2. Типичные изменения кардиомиоцитов (1–4) и митохондрий (А–Г) миокарда левого желудочка сердца крысы при моделируемых патологиях. Примечание: 1 – миоцит из сердца интактного животного, х1050; 2 – миоцит из сердца животного с постинфарктным кардиосклерозом (И6), х1200; 3 – миоцит из сердца крысы с диабетом (Д6), х1000; Г – структурные изменения в кардиомиоците животного с сочетанной патологией (И4Д4), х1000. А – интактная митохондрия, х5200; Б – митохондрия постинфарктного сердца х5000; В – митохондрия диабетического миокарда, х5000; Г –митохондрии при сочетанной патологии, х5000; МХ – митохондрии; МФ – миофибриллы; Я – ядро
му усилению деструктивных процессов в митохондриях сердца (рис. 2.4).
Помимо нарушений в структуре митохондрий нами отмечены также нарушения в ядерном и сократительном аппарате кардиомиоцитов: деформация и сморщивание ядра, фрагментация ядрышек, смещение, “расплетание” и неправильная ориентация миофибрил и др. (рис. 2.2– 2.4), характерные для миокарда при повышенной функциональной нагрузке [11, 13, 14].
Эти наблюдения позволяют объяснить “срыв” адаптации на поздних сроках рассматриваемых патологий: генерализация нарушений структуры кардиомиоцита приводит в конечном счете к его анатомической, а следовательно, и функциональной гибели. На этом фоне клетку не могут спасти “всплески” метаболической активности, связанные с активацией внутренних альтернативно-ком- пенсационных биохимических процессов.
Однако полученные нами данные не позволяют ответить на вопрос, почему при сочетании инфаркт+диабет есть проявления адаптивной компенсации, пусть и не на всех стадиях развития патологий (табл. 2, 3; рис. 1), а при обратном сочетании диабет+инфаркт такой реакции не наблюдается. Очевидно, что ответ нужно искать не в структурных изменениях, а в разветвленной системе функционально-биохимических механизмов регуляции жизнедеятельности клетки.
В литературе можно найти многочисленные доказательства того, что именно гипоксия запускает сложный комплекс адаптивно-компенсаторных процессов. Примером тому служит и открытый относительно недавно феномен “прекондиционирования” миокарда, в котором на сегодняшний день описано уже две стадии адаптации:
немедленной и отсроченной [21]. Возможно, нам следует искать аналогии в адаптивных реакциях на примере этого феномена?
Заключение
Проведенное исследование в динамике развития моделируемых патологий позволяет отметить несколько важных моментов:
– развитие патологий, как каждой в отдельности, так и при их сочетании, сопровождается нарастанием структурно-метаболических нарушений;
– эти изменения достаточно быстро проявляются на ранних стадиях монопатологий;
– при сочетанной патологии структурно-метаболические изменения развиваются более медленно по сравнению с монопатологиями;
– предшествование диабета инфаркту приводит к ухудшению функционального состояния кардиомиоцитов и резко снижает выживаемость экспериментальных животных по сравнению с моделью, в которой инфаркт предшествует диабету.
Полученные результаты не позволяют сделать однозначных выводов о резистентности миокарда к сочетанию патологий, однако собственные данные, полученные ранее, и литературные данные открывают новые горизонты для исследований в этом направлении.
Работа выполнена при финансовой поддержке Федерального агентства по науке и инновациям в рамках Федеральной целевой научно-технической программы “Исследования и разработки по приоритетным направлениям развития научно-технического комплекса России на 2007–2012 гг.” (Государственный контракт № 02.527.11.0007 от 30 апреля 2009 г.).
Список литературы Состояние митохондрий и гипертрофия сердца при развитии стрептозотоцин-индуцированного диабета на фоне экспериментального инфаркта миокарда
- Автандилов Г.Г. Медицинская морфометрия. -М.: Медицина, 1990. -384 с.
- Афанасьев С.А., Кондратьева Д.С., Цапко Л.П. и др. Особенности инотропных реакций миокарда крыс на экстрасистолические воздействия при сочетанном развитии постинфарктного кардиосклероза и сахарного диабета//Вестник аритмологии. -2009. -№ 55. -С. 56-59.
- Булгак А.Г., Островский Ю.П., Рачок Л.В. и др. Современный взгляд на проблему хронической сердечной недостаточности//Кардиология в Беларуси. -2009. -№ 3. -С. 114-127.
- Дедов И.И. Сахарный диабет в Российской Федерации: проблемы и пути решения//Сахарный диабет. -1998. -№ 1. -С. 7-18.
- Дубилей Т.А., Бадова Т.А., Мигован С.А. и др. Влияние ишемии/реперфузии на функцию изолированного сердца у крыс разного возраста со стрептозотоциновым сахарным диабетом//Проблемы старения и долголетия. -2007. -Т. 16, № 1. -С. 11-21.
- Егорова М.В., Афанасьев С.А., Попов С.В. и др. Проявление адаптивноприспособительных изменений при сочетанном развитии постинфарктного ремоделирования сердца и сахарного диабета//Бюллетень экспериментальной биоло гии и медицины. -2010. -Т. 150, № 8. -С. 132-135.
- Егорова М.В., Афанасьев С.А. Выделение митохондрий из клеток и тканей животных и человека: современные методические приемы//Сибирский медицинский журнал (Томск). -2011. -Т. 26. -№ 1. -С. 22-28.
- Кондратьева Д.С., Афанасьев С.А., Фалалеева Л.П. и др. Инотропная реакция миокарда крыс с постинфарктным кардиосклерозом на экстрасистолические воздействия//Бюл летень экспериментальной биологии и медицины. -2005. -№ 6. -С. 613-616.
- Лукьянова Л.Д. Гипоксия при патологиях. Молекулярные механизмы и принципы коррекции//Перфторорганические соединения в биологии и медицине. -Пущино, 2001. -С. 56-69.
- Меерсон Ф.З., Пшенникова М.Г. Адаптация к стрессорным ситуациям и физическим нагрузкам. -М.: Медицина, 1988. -256 с.
- Непомнящих Л.М., Лушникова Е.Л., Непомнящих Г.И. Морфометрия и стереология гипертрофии сердца. -Новосибирск: Наука, 1986. -304 с.
- Обрезан А.Г., Бицадзе Р.М. Структура сердечно-сосудистых заболеваний у больных сахарным диабетом 2 типа, диабетическая кардиомиопатия как особое состояние миокарда//Вестник Санкт-Петербургского университета. -2008. -Сер. 11. -Вып. 2. -С. 47-52.
- Пауков В.С., Фролов В.А. Элементы теории патологии сердца. -М.: Медицина, 1982. -272 с.
- Фролов В.А., Пухлянко В.П. Морфология митохондрий в норме и патологии. -М.: Издво УДН, 1989. -142 с.
- American Diabetes Association, National Heart, Lung and Blood Institute, Juvenile Diabetes Foundation International, National Institute of Diabetes and Kidney Disease, American Heart Association. Diabetes mellitus: a major risk factor for cardiovascular disease//Circulation. -1999. -Vol. 100. -P. 1132-1133.
- Betteridge D.J. Epidemiology of the cardiac complications of type 2 diabetes mellitus//Medicographia. -2001. -Vol. 23. -P. 95-99.
- Chen H., Shen W.L., Wang X.H. Paradoxically enhanced heart tolerance to ischaemia in type 1 diabetes and role of increased osmolarity//Clinical and Experimental Pharmacology and Physiology. -2006. -Vol. 10. -P. 910-916.
- Egorova M.V., Afanasiev S.A., Kondratyeva D.S. et al. Possible mechanism of increasing resistance of the myocardium during combination of post infarction remodeling and diabetes mellitus//Natural Science. -2011. -Vol. 3, No. 4. -P.295-300.
- Nawata T., Takahashi N., Opie T. Cardioprotection by streptozotocininduced diabetes and insulin against ischemia/reperfusion injury in rats//J. Cardiovasc. Pharmacol. -2002. -Vol. 40, No. 4. -P. 491-500.
- Saito A., Castilho R.F. Inhibitory effects of adenine nucleotides on brain mitochondrial permeability transition//Neurochem. Res. -2010. -Vol. 35, No. 11. -P. 1667-1674.
- Yellon D.M., Baxter G.F. A "second window of protection" or delayed preconditioning phenomenon: future horizons for myocardial protection?//J. Mol. Cell. Cardiol. -1995. -Vol. 27. -P. 1023-1034.


