Состояние тонкой кишки в процессе химиолучевого лечения у больных лимфомой Ходжкина
Автор: Хомов Д.А., Синев Ю.В., Сотников В.М., Иванова О.В., Грунин И.Б., Волоцков В.И.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Гастроэнтерология
Статья в выпуске: 1 т.8, 2008 года.
Бесплатный доступ
В статье описывается опыт применения капсульной эндоскопии у больных с диагнозом «Лимфома Ходжкина» с целью выявления поражений тонкой кишки в процессе химиолучевой терапии. До настоящего времени тонкая кишка была малоизученным органом, в особенности, тощий и подвздошный ее отделы. Полученные нами данные по использованию капсульной эндоскопии в диагностике поражений тонкой кишки в процессе химиолучевого лечения свидетельствуют о том, что в перспективе, при широком внедрении данного метода в клиническую практику, возможно, придется пересматривать статистические данные о частоте, структуре, процентном соотношении осложнений со стороны данного органа.
Лимфома ходжкина, химиолучевое лечение, лучевые реакции организма, капсульная эндоскопия
Короткий адрес: https://sciup.org/14955134
IDR: 14955134
Текст научной статьи Состояние тонкой кишки в процессе химиолучевого лечения у больных лимфомой Ходжкина
До настоящего времени тонкая кишка была малодоступным для визуализации органом, в особенности тощий и подвздошный ее отделы. В значительной степени это обусловлено большой протяженностью тонкой кишки, наличием ее многочисленных изгибов и отсутствием технологии эндоскопического исследования тощей и подвздошной кишки [1]. Благодаря внедрению современных программ химиолучевого лечения Лимфома Ходжкина превратилась в заболевание с благоприятным прогнозом [2]. Однако, осложнения, возникающие в результате лечения, не только влияют на качество жизни пациентов, но и негативно сказываются на прогнозе заболевания.
Органы желудочно-кишечного тракта, являясь одними из наиболее химио- и радиочувствительных, страдают при применении любой схемы лечения, и если оценка состояния их в процессе лечения и проводится, то только при наличии жалоб пациента, и ограничивается эзофагогастроскопией и реже - колоноскопией.
Широко известно, что с побочным действием препаратов, используемых в химиотерапии, на гемопоэз конкурирует по частоте диспепсический синдром, который возникает обычно как одна из форм непосредственных или ближайших, связанных больше со свойствами, чем с полученной суммарной дозой цитостатика, токсических реакций. Передозировка (абсолютная или относительная) цитостатика, обычно не вызывающая проявлений диспепсии, несомненно, способна привести к ряду подобных расстройств. Однако, если учесть терапевтические пределы разовых и суммарных доз препаратов, то их качественная характеристика в отношении способности обуславливать диспепсический синдром преобладает над количественными факторами [3].
Часть перечисленных осложнений может наблюдаться сразу или через несколько часов после первых введений препарата и закономерно повторяться при последующих введениях. Такой рефлекторный побочный эффект обычно заключается в появлении тошноты и рвоты.
В зависимости от скорости метаболизма и выведения цитостатика из организма тошнота и рвота бывают кратковременными или длящимися до 1-2 сут.
Чувствительность к эметическому действию цитостатиков весьма индивидуальна. При лечении одним и тем же препаратом в стандартном режиме и дозах у одних больных возникает неукротимая рвота, а у других не наблюдается даже тошноты.
Причиной поражения слизистых оболочек желудочно-кишечного тракта от мукозита до язвенных изменений является прямое цитотоксическое действие химиотерапевтических препаратов на быстро пролиферирующий эпителий [3]. Язвенные поражения кишечника являются самым тяжелым осложнением из группы диспепсических расстройств, череватым кровотечениями и перфорациями[3].
Диспепсический синдром представляет собой существенную часть наиболее общих для различных химиопрепаратов и относительно неспецифических побочных действий, требующих специальных мер профилактики и лечения, если они превышают допустимые пределы манифестации, согласно рекомендациям ВОЗ по градации побочных эффектов химиотерапии. Таким пределом является симптоматика с оценкой 2 балла (табл. 1). Диспепсические нарушения 3-й и 4-й степени ведут к необходимости временного или окончательного прекращения цитостатической терапии в любом ее варианте и проведения неотложной терапии [3].
Таблица 1. Оценка интенсивности (в баллах) диспепсического синдрома
|
Осложнение |
0 |
1 |
2 |
3 |
4 |
|
Стоматит |
Нет |
Раздражение, гиперемия |
Гиперемия, изъязвления, возможность принимать твердую пищу |
Язвы, возможность принимать только жидкую пищу |
Питание не представляется возможным |
|
Тошнота и рвота |
Нет |
Тошнота |
Кратковременная рвота |
Рвота, требующая коррекции |
Неукротимая рвота |
|
диарея |
нет |
Переходящая, меньше 2 дней |
Переносимая, но больше 2 дней |
непереносимая, требующая лечения |
Профузный понос с наличием крови в кале, обезвоживание |
Лучевое лечение онкологических больных может сочетаться с острым и отсроченным повреждением нормальных тканей, которое наблюдается в пределах от нескольких дней до недель или месяцев и даже лет после облучения. Исследования в области лучевых реакций организма продолжаются и сегодня, в основном это исследования in vitro.
По последним данным повреждения нормальных тканей, индуцированных ионизирующим излучением, различаются в зависимости от органа мишени и типов клеток. Острые или ранние реакции изначально характеризуются быстро возникающими изменениями в течение нескольких часов, такими как нарастающий отек эндотелия, повышение проницаемости сосудов и отек тканей за счет инфильтрации лимфоцитами. Апоптоз эндотелиальных клеток – важная составляющая в картине острого радиационного повреждения сосудистой системы облученного органа. Ответ сосудистой системы на облучение есть количественное отношение погибших клеток и процессов регенерации с помощью выживших стволовых клеток [4].
Поздние реакции, встречающиеся через месяцы или даже года после облучения являются изначально результатом ремодулирования стромы, приводящее к фиброзу, дисфункции органа и некрозу. Хотя, раннее возбуждение молекулярных связей, результируя манифестацию поздних реакций обычно встречаются сразу после облучения, гибель клеток и процессы перестройки тканей, начинающиеся с этих механизмов, развертываются долгое время [4].
Лучевое повреждение сосудов протекает двумя путями. Острые сосудистые изменения (до 24 часов) представлены, в основном, индуцированной радиацией гибелью клеток эндотелия [5]. Поздние (до нескольких месяцев) включают расширение капилляров, истончение базальной мембраны, телеангиоэктазии и потерей коллагена [6]. Капилляры – самый чувствительный компонент сосудистого русла [7,8]. Эндотелий капилляров отвечает на излучение адгезией лейкоцитов, разбуханием клеток эндотелия и снижением проницаемости капилляров [9].
Клеточные и молекулярные реакции эндотелиальных клеток на ионизирующее излучение хорошо изучены только in vitro [10].
Увеличение концентрации токсинов в тканях после облучения может быть следствием ранней фазы воспаления поздних стромальных повреждений. В легких, например, лучевые пневмониты прогрессируют в фиброз [8].
Индуцированная излучением соединительнотканная перестройка тканей, есть многокомпонентный процесс, происходящий по межклеточным связям через цитокины и факторы роста, которые индуцируются в процессе ответа на облучение каждым типом клеток в отдельности. Специфические фиброзные изменения, такие как накопление коллагена и других белков экстрацеллюлярного матрикса, в основном основываются на реактивации системы фибробластов [11-13]. Это показывает, что ионизирующее излучение индуцирует конечную дифференцировку потенциальных митотических фибробластов в постмитотические фиброциты [14-20]. Окончательно дифференцированные фиброциты функционируют и активируют клетки системы фибробластов для продукции ткане-специфичных коллагена и молекул матрикса, обычно факторов роста и цитокинов [12 ,15 ,20 -22].
Основываясь на этих функциональных свойствах фибробласт-фиброцит системы, можно предположить, что индуцированная излучением аккумуляция постмитотических фиброцитов приведет к увеличению синтеза и экстрацеллюлярному отложению коллагена [4].
Другой интересный аспект в контексте постлучевой перестройки ткани был опубликован Strup-Perrot и соавторами [24] в 2006. Исследуя воздействие ММР белков у крыс в процессах перестройки экстрацеллюлярного матрикса эпителия толстой кишки при облучении, они определили две фазы ответа ткани на лучевую агрессию – эпителиальное оголение и последующее заживление. Исследование показало, что в фазе обнажения, повреждения слизистой оболочки сочетались с локальным подъемом ММР подтипов, включающихся в процессы деградации базальной мембраны, это ММР-2, -3 и -9.
Учитывая многообразие реакций организма на проводимую терапию, и не до конца изученные механизмы возникновения этих реакций, следовало бы предположить, что во время проведения противоопухолевого лечения всем пациентам назначается исследование желудочно-кишечного тракта с целью своевременного выявления нежелательных эффектов лечения. Но как уже говорилось выше, при отсутствии жалоб пациента на органы желудочно-кишечного тракта, пациентам избегают назначать эндоскопические исследования.
В нашем центре была проведена капсульная эндоскопия 26 пациентам разного пола и возраста, в различные сроки лечения и после лечения с диагнозом «Лимфома Ходжкина» . Данная группа пациентов была выбрана в связи с тем, что противоопухолевое лечение включает в себя химотерапию и лучевую терапию, зачастую на парааортальные лимфоузлы, в тсвязи с чем тонкая кишка неизбежно попадает облучаемую область. Подготовка к исследованию проводилась по стандарту, рекомендованному фирмой производителем данного эндоскопического оборудования и заключалась в следующем: После 10 часов вечера накануне проведения капсульной эндоскопии воздержаться от приема пищи и жидкости, за исключением приема необходимых лекарств, запиваемых небольшим количеством воды.
Не принимать никакие лекарства в течение двух часов перед началом капсульной эндоскопии.
Воздержание от курения в течение 24 часов перед прохождением процедуры.
Пациентам мужского пола необходимо побрить в день проведения обследования живот в пределах 15 см выше и ниже пупка
Поражения желудочно-кишечного тракта были выявлены во всех случаях наблюдения. В 15 случаях (57,69 % )жалоб диспепсического характера пациенты не предъявляли, при этом у всех из них определялись выраженные воспалительные изменения тонкой кишки, в большинстве наблюдений определялись эрозии с незначительным капиллярным кровотечением, у двоих из них, по мимо вышеперечисленных изменений были обнаружены стриктуры тощей и подвздошной кишки(рис.1,2) (что составило 3,85% от всех случаев наблюдения). Стриктуры были обнаружены по истечении трех лет после окончания лечения. Здесь же определялась резко выраженная лимфангиоэктазия (рис.3) Эрозии двенадцатиперстной кишки определились у 12 пациентов, из них в 10 случаев наблюдения определялось кровотечение из эрозий, степень которого варьировала от незначительного до умеренного капиллярного. По частоте эрозии тощей и подвздошной кишки оказались практически на одном уровне 14 и 16 случаев наблюдения (53,85% и 61,54% соответственно), при этом в подавляющем числе наблюдений у тощей кишки была поражена проксимальная треть, а у подвздошной дистальная, причем капиллярное кровотечение чаще всего определялось из эрозий тощей кишки — двенадцать случаев из четырнадцати наблюдений (46,15% и 53,85% соответственно).
У всех больных при проведении капсульной эндоскопии было так же выявлено поражение ворсин кишки, что выражалось отеком или фиброзом, имелись также и сочетания отека и фиброза, что по данным исследований последних лет является различными стадиями одного и того же процесса. Фиброзные изменения ворсин чаще всего наблюдались в двенадцатиперстной и тощей кишке, в 38,46% случаев. Отек ворсин был выражен больше всего в двенадцатиперстной кишке — 76,92% случаев наблюдения. В подвздошной кишке эти изменения были относительно редким явлением (таб. 2).
Мальабсорбция определялась в 46,15% случаев.
Язвенные поражения тонкой кишки в процессе химилучевой терапии оказались не столь частым явлением, как мы предполагали. Данный тип поражений составил всего 6 случаев наблюдения: четыре в тощей кишке и две в подвздошной, 15,38% и 7,69% соответственно. Из новообразований тонкой кишки в 2 случаях наблюдения были обнаружены полипы подвздошной кишки, что составило 7,69% от общего числа наблюдений, и у 4 пациентов в тощей кишке, одно из которых оказалось злокачественной лимфомой (рис.4), поражавшее проксимальную треть тощей кишки циркулярно. Также у пацента со злокачественной лимфомой были обнаружены афтозные язвы тощей и подвздошной кишки, что было расценено нами как очаги отсева злокачественного процесса(рис. 5).
Лимфофолликуллярная гиперплазия была выявлна только в подвздошной кишке, в основном в дистальной ее трети (рис.6).
Дуоденогастральный рефлюкс обнаружен у 14 пациентов (53,85% случаев), у половины из них капсула из двенадцатиперстной кишки была заброшена обратно в желудок.
Два исследования оказались неинформативными из-за спавшегося просвета кишки на всем ее протяжении. В последствии было выяснено, что пациенты при подготовке к исследованию не принимали пищу и жидкость более суток, что и явилось на наш взгляд причиной подобного явления.
Все обнаруженные нами изменения тонкой кишки, у пациентов проходящих химиолучевое лечение, так и после него, укладываются в современные теории реакции нормальных тканей на ионизирующее излучение и воздействия на них препаратов, использующихся в химиотерапии. Желудочно-кишечный тракт, являясь одним из наиболее чувствительных органов к такому воздействию, до последнего времени оценивался не в полном объеме, что было связано с техническими трудностями в диагностике его патологии, но благодаря методике капсульной эндоскопии появилась возможность восполнить этот недостаток. Система позволяет при достаточно простой подготовке визуализировать патологию тонкой кишки, не принося серьезных неудобств пациенту.
В последние годы в онкологии одной из приоритетных задач становится не только повышение процента безрецидивной выживаемости, но и повышение качества жизни онкологических больных. В связи с чем своевременная диагностика и соответственно коррекция возникающих осложнений становится одной из главных проблем современной онкологии.
Учитывая тот факт, что более 50% обследованных нами пациентов не предъявляли жалоб на органы желудочно-кишечного тракта, при этом имея выраженные изменения в нем, следует рекомендовать полное эндоскопическое обследование, включающее не только традиционные фиброгастроскопию и фиброколоноскопию, но еще и капсульную эндоскопию, перед курсом противоопухолевого лечения для оценки возможных осложнений. Также следует проводить данные эндоскопические исследования во время и после проведения химиолучевой терапии с целью своевременного выявления и по возможности быстрейшей коррекции побочных действий проведенной терапии на органы желудочно-кишечного тракта, что благоприятным образом скажется на качестве жизни онкологических больных.
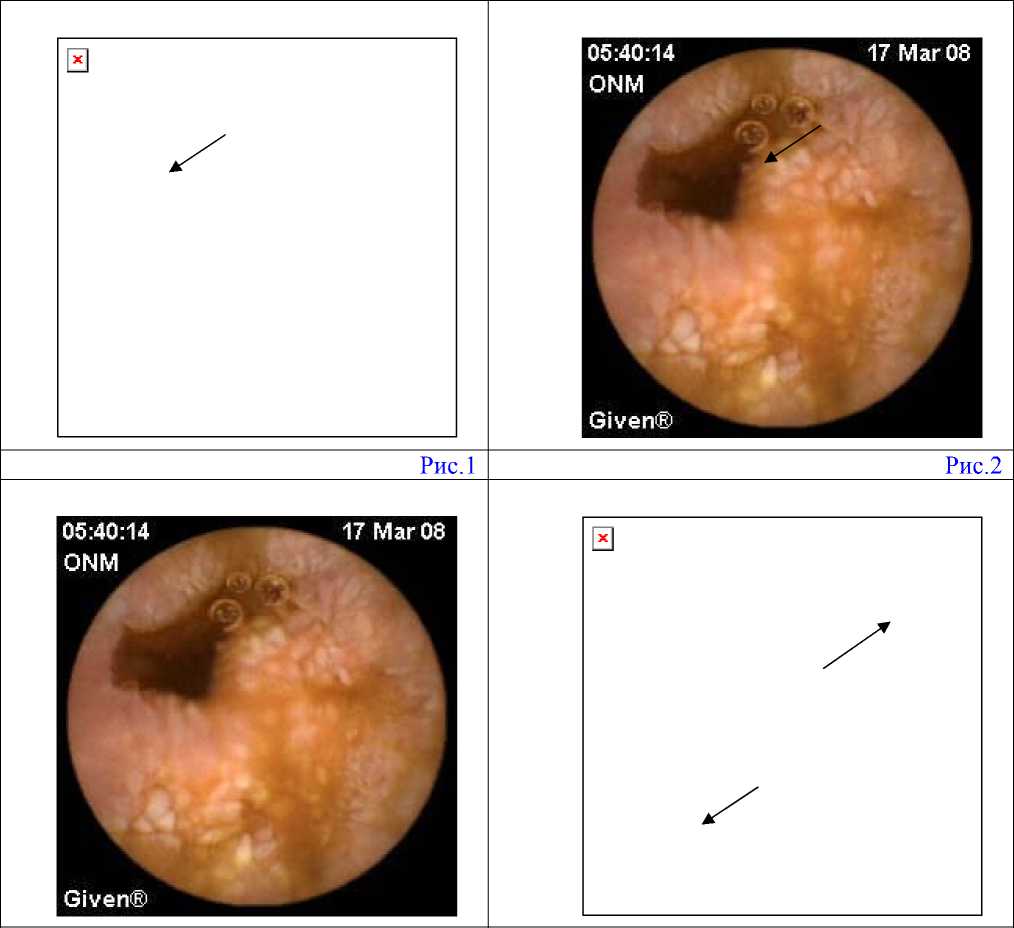
Рис.3
Рис. 4
Таблица 2
Рис.5
Рис.6
-
2. Mauch P.V., Armitage J.D., Diehl V., et all. Hodgkin’ s disease // Philadelphia.-1999
-
3. Гершанович М.Л. Осложнения при химио- и гормонотерапии злокачественных опухолей. -М.: Медицина, 1982, 224 с
-
4. H. Peter Rodemann, Marcel A. Blaese Responses of Normal Cells to Ionizing Radiation //Radiation oncology. -2007.- P81
-
5. Pena LA, Fuks Z, Kolesnick R: Stress-induced apoptosis and the sphingomyelinpathway. Biochem Pharmacol 53:615-621, 1997
-
6. Pena LA, Fuks Z, Kolesnick RN: Radiation-induced apoptosis of endothelialcells in the murine central nervous system: Protection by fibroblastgrowth factor and sphingomyelinase deficiency. Cancer Res 60:321327, 2000
-
7. Morris GM, Coderre JA, Bywaters A, et al: Boron neutron capture irradiation of the rat spinal cord: Histopathological evidence of a vascularmediated pathogenesis. Radiat Res 146:313-320, 1996
-
8. Fajardo LF, Bathrong M, Anderson RE: Radiation Pathology. New York, Oxford University Press, 2001
-
9. Jaenke RS, Robbins ME, Bywaters T, et al: Capillary endothelium: Target site of renal radiation injury. Lab Invest 68:396-405, 1993
-
10. Dimitrievich GS, Fischer-Dzoga K, Griem ML: Radiosensitivity of vascular tissue: I-Differential radiosensitivity of capillaries: A quantitative in vivo study. Radiat Res 99:511-535, 1984
-
11. Tada H, Ogushi F, Tani K, et al: Increased binding of chemotactic capacities of PDGF-BB on fibroblasts in radiation pneumonitis. Radiat Res 159:805-811, 2003
-
12. Rodemann HP, Bamberg M: Cellular basis of radiation-induced fibrosis. Radiother Oncol 35:83-90, 1995
-
13. Rubin P, Finkelstein J, Schapiro D: Molecular biology mechanisms in the radiation induction of pulmonary injury syndromes: Interrelationship between the alveolar macrophage and the septal fibroblast. Int J Radiat Oncol Biol Phys 24:93-101, 1992
-
14. Rodemann HP, Peterson HP, Schwenke K, et al: Terminal differentiation of human fibroblasts is induced by radiation. Scanning Microsc 5:1135-1143, 1992
-
15. Rodemann HP, Binder A, Burger A, et al: The underlying cellular mechanism of fibrosis. Kidney Int 49:32-36, 1996
-
16. Lara PC, Russell NS, Smolders IJ, et al: Radiation-induced differentiation of human skin fibroblasts: Relationship with cell survival and collagen production. Int J Radiat Biol 70:683-692, 1996
-
17. Burger A, Loeffler H, Bamberg M, et al: Molecular and cellular basis of radiation fibrosis. Int J Radiat Biol 73:401-408, 1998
-
18. Herskind C, Bentzen SM, Overgaard J, et al: Differentiation state of skin fibroblast cultures versus risk of subcutaneous fibrosis after radiotherapy.
-
19. Hakenjos L, Bamberg M, Rodemann HP: TGF-_1-mediated alterations of rat lung fibroblast differentiation resulting in the radiation-induced fibrotic response. Int J Radiat Biol 76:503-509, 2000
-
20. Fournier C, Scholz M, Kraft-Weyrather W, et al: Changes of fibrosisrelated parameters after high and low LET irradiation of fibroblasts. Int
-
21. J Radiat Biol 77:713-722, 2001
-
22. Rodemann HP, Bayreuther K, Francz PI, et al: Selective enrichment and biochemical characterisation of seven fibroblast cell types of human skin fibroblast populations in vitro. Exp Cell Res 180:84-93, 1989
-
23. Herskind C, Johansen J, Bentzen SM, et al: Fibroblast differentiation in subcutaneous fibrosis after postmastectomy radiotherapy. Acta Oncol 39:383-388, 2000
-
24. Strup-Perrot C, Vozenin-Brotons MC, Vandamme M, et al: Expression and activation of MMP-2, -3, -9, -14 are induced in rat colon after abdominal X-irradiation.
Radiother Oncol 47:263-269, 1998
Scand J Gastroenterol. 41:60-70, 2006
Список литературы Состояние тонкой кишки в процессе химиолучевого лечения у больных лимфомой Ходжкина
- А.С.Логинов, Ю.В.Васильев, Д.А.,Парфенов. Особенности эндоскопичкского исследования при поражениях тощей и подвздошной кишки.
- Mauch P.V., Armitage J.D., Diehl V., et all. Hodgkin's disease//Philadelphia.-1999
- Гершанович М.Л. Осложнения при химио-и гормонотерапии злокачественных опухолей.-М.: Медицина, 1982, 224 с
- H. Peter Rodemann, Marcel A. Blaese Responses of Normal Cells to Ionizing Radiation//Radiation oncology. -2007.-P81
- Pena LA, Fuks Z, Kolesnick R: Stress-induced apoptosis and the sphingomyelinpathway. Biochem Pharmacol 53:615-621, 1997
- Pena LA, Fuks Z, Kolesnick RN: Radiation-induced apoptosis of endothelialcells in the murine central nervous system: Protection by fibroblastgrowth factor and sphingomyelinase deficiency. Cancer Res 60:321-327, 2000
- Morris GM, Coderre JA, Bywaters A, et al: Boron neutron capture irradiation of the rat spinal cord: Histopathological evidence of a vascularmediated pathogenesis. Radiat Res 146:313-320, 1996
- Fajardo LF, Bathrong M, Anderson RE: Radiation Pathology. New York, Oxford University Press, 2001
- Jaenke RS, Robbins ME, Bywaters T, et al: Capillary endothelium: Target site of renal radiation injury. Lab Invest 68:396-405, 1993
- Dimitrievich GS, Fischer-Dzoga K, Griem ML: Radiosensitivity of vascular tissue: I-Differential radiosensitivity of capillaries: A quantitative in vivo study. Radiat Res 99:511-535, 1984
- Tada H, Ogushi F, Tani K, et al: Increased binding of chemotactic capacities of PDGF-BB on fibroblasts in radiation pneumonitis. Radiat Res 159:805-811, 2003
- Rodemann HP, Bamberg M: Cellular basis of radiation-induced fibrosis. Radiother Oncol 35:83-90, 1995
- Rubin P, Finkelstein J, Schapiro D: Molecular biology mechanisms in the radiation induction of pulmonary injury syndromes: Interrelationship between the alveolar macrophage and the septal fibroblast. Int J Radiat Oncol Biol Phys 24:93-101, 1992
- Rodemann HP, Peterson HP, Schwenke K, et al: Terminal differentiation of human fibroblasts is induced by radiation. Scanning Microsc 5:1135-1143, 1992
- Rodemann HP, Binder A, Burger A, et al: The underlying cellular mechanism of fibrosis. Kidney Int 49:32-36, 1996
- Lara PC, Russell NS, Smolders IJ, et al: Radiation-induced differentiation of human skin fibroblasts: Relationship with cell survival and collagen production. Int J Radiat Biol 70:683-692, 1996
- Burger A, Loeffler H, Bamberg M, et al: Molecular and cellular basis of radiation fibrosis. Int J Radiat Biol 73:401-408, 1998
- Herskind C, Bentzen SM, Overgaard J, et al: Differentiation state of skin fibroblast cultures versus risk of subcutaneous fibrosis after radiotherapy. Radiother Oncol 47:263-269, 1998
- Hakenjos L, Bamberg M, Rodemann HP: TGF-_1-mediated alterations of rat lung fibroblast differentiation resulting in the radiation-induced fibrotic response. Int J Radiat Biol 76:503-509, 2000
- Fournier C, Scholz M, Kraft-Weyrather W, et al: Changes of fibrosisrelated parameters after high and low LET irradiation of fibroblasts. Int
- J Radiat Biol 77:713-722, 2001
- Rodemann HP, Bayreuther K, Francz PI, et al: Selective enrichment and biochemical characterisation of seven fibroblast cell types of human skin fibroblast populations in vitro. Exp Cell Res 180:84-93, 1989
- Herskind C, Johansen J, Bentzen SM, et al: Fibroblast differentiation in subcutaneous fibrosis after postmastectomy radiotherapy. Acta Oncol 39:383-388, 2000
- Strup-Perrot C, Vozenin-Brotons MC, Vandamme M, et al: Expression and activation of MMP-2, -3, -9, -14 are induced in rat colon after abdominal X-irradiation. Scand J Gastroenterol. 41:60-70, 2006


