Сосудистое сплетение и микроциркуляция головного мозга при черепно-мозговой травме, возникшей в условиях высокогорья
Автор: Шувалова М.С., Шаназаров А.С., Шидаков Ю.Х.-М.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Физиология
Статья в выпуске: 4, 2020 года.
Бесплатный доступ
Горы занимают около 24 % территории суши. Здесь располагаются значительные природные ресурсы, освоение которых сопряжено с повышенным риском травматизма. Черепно-мозговая травма на горных высотах - частое явление, а микрососудистая дисфункция, как и в обычных условиях обитания человека, является ключевым звеном в цепи событий, развертывающихся в центральной нервной системе. Однако данных о состоянии сосудистых сплетений и микроциркуляции головного мозга при черепно-мозговой травме, возникшей в высокогорье, крайне мало. Цель исследования - выявить закономерности ремоделирования сосудистых сплетений и основных звеньев микроциркуляции головного мозга при черепно-мозговой травме, возникшей в условиях высокогорья. Материалы и методы. Объектом исследования послужили 46 белых беспородных лабораторных крыс-самцов весом 210-270 г, которым моделировалась черепно-мозговая травма в условиях низко-горья (высота 760 м над уровнем моря, г. Бишкек) и высокогорья (перевал Туя-Ашу, 3200 м над уровнем моря). Для воспроизведения черепно-мозговой травмы использовалась ударная модель weight drop method по Y. Tang. После воспроизведения травмы в условиях высокогорья животных транспортировали в условия низкогорья и на 3-и сут выводили из эксперимента путем передозировки хлороформа. Микроциркуляция изучалась микроскопическим методом с применением внутрисосудистого инъецирования раствором черной туши. Препараты изучались под микроскопом Olympus Bx40 (Япония). Параллельно проводилось серийное микрофотографирование с помощью цифрового фотоаппарата, подключенного к компьютеру, с одновременным протоколированием результатов. Морфометрия компонентов сосудистых сплетений головного мозга осуществлялась с помощью приложения для измерения микроскопических объектов Top View. Статистическая обработка данных проводилась в программе SPSS 16.0. Результаты. Черепно-мозговая травма, возникшая в условиях высокогорья, приводит к сужению просвета капилляров на 52 % (p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Микроциркуляция, сосудистые сплетения, головной мозг, черепно-мозговая травма, высокогорье
Короткий адрес: https://sciup.org/14117592
IDR: 14117592 | УДК: 616.83-005.4-092.9(23.03):612.014 | DOI: 10.34014/2227-1848-2020-4-153-166
Текст научной статьи Сосудистое сплетение и микроциркуляция головного мозга при черепно-мозговой травме, возникшей в условиях высокогорья
Введение. Ежегодно в мире от черепномозговой травмы (ЧМТ) погибает более 5 млн чел. [1, 2]. По степени летальности ЧМТ конкурирует с ишемической болезнью сердца и цереброваскулярными заболеваниями [3, 4]. ЧМТ характеризуется не только тем, что она зани- мает третье место по летальности, уступая в этом сердечно-сосудистым и онкологическим заболеваниям [3], но и потерей дееспособности оставшихся в живых пациентов [5–7]. Инвалидизация, утрата трудоспособности, когнитивные нарушения снижают качество жизни [8].
В генезе повреждения мозга после ЧМТ существенная роль отводится ишемическому каскаду [9], который приводит к снижению утилизации глюкозы, накоплению лактата, уменьшению количества АТФ и снижению активности АТФ-зависимых ионных насосов, Ca2+-индуцированной деполяризации, эксай-тотоксичности и клеточной смерти [9, 10]. Для оценки развития ишемического повреждения головного мозга Brain trauma Foundation рекомендует использование мониторинга внутричерепного давления (ВЧД) и церебрального перфузионного давления (ЦПД) у всех пациентов с тяжелой ЧМТ [9, 11]. Отсюда становится очевидной актуальность исследования гемоциркуляторного русла – пути перфузии мозга и сосудистого сплетения головного мозга (ССГМ) – органа, вырабатывающего спинномозговую жидкость (СМЖ), от состояния которой зависит ВЧД.
Сведений о состоянии сосудистого сплетения и гемоциркуляции головного мозга при черепно-мозговой травме в высокогорье в литературе крайне мало. Между тем ЧМТ на горных высотах – нередкое явление, а микрососу-дистая дисфункция, как и в обычных условиях обитания человека, может быть ключевым звеном в цепи событий, развертывающихся в центральной нервной системе.
Цель исследования. Оценить состояние микроциркуляторного русла и степень ремоделирования сосудистых сплетений желудочков головного мозга при черепно-мозговой травме в высокогорье.
Материалы и методы. Работа выполнена на базе лаборатории экспериментального моделирования патологических процессов Кыргызско-Российского Славянского университета (КРСУ) (760 м над уровнем моря) и высокогорной базе Института горной физиологии и медицины НАН КР (перевал Туя-Ашу, 3200 м над уровнем моря, атмосферное давление – 520–523 мм рт. ст., парциальное давление О2 – 105 мм рт. ст.). Объектом исследования послужили 46 белых беспородных лабораторных крыс-самцов весом 210–270 г. Предварительно животных разделили на 4 группы: в первую вошли здоровые, интактные животные, во вторую – крысы с моделированной ЧМТ в условиях низкогорья, третью группу составили интактные крысы, которые подвергались транспортировке в высокогорье, в четвертую группу вошли крысы, у которых ЧМТ была вызвана в условиях высокогорья. Для воспроизведения черепно-мозговой травмы использовалась ударная модель weight drop method по Y. Tang. Прибор для нанесения ЧМТ представляет собой горизонтальную станину с закрепленным на ней столиком для фиксации животного. У данного аппарата присутствует вертикальная металлическая труба высотой 1 м, внутри которой свободно перемещается груз массой 68 г. При воспроизведении ЧМТ груз, находящийся в трубе на высоте 90 см, приводили в действие, убирая механический регулятор высоты. Он, падая, наносил удар по стержню, через который энергия удара (0,6 Дж) передавалась на теменную область черепа животного [12, 13].
Все экспериментальные вмешательства осуществлялись в соответствии с соблюдением «Правил лабораторной практики в Российской Федерации» (приказ МЗ РФ № 267 от 19 июня 2003 г.). Протокол исследований одобрен локальным этическим комитетом при НПО «Профилактическая медицина» МЗ КР.
После экспериментального вмешательства в высокогорье животных транспортировали в Бишкек (760 м над уровнем моря) и в течение 3 сут содержали в стандартных условиях вивария. На 3-и сут после моделирования ЧМТ животных выводили из эксперимента путем передозировки хлороформа.
Для детального изучения системы микроциркуляции головного мозга был выбран микроскопический метод [14, 15], который в сочетании с инъекцией сосудов позволяет изучить ангиоархитектонику сосудистого русла, геометрию его сосудов, выявить количество сосудов, их диаметры, углы отхождения малых от более крупных, что в совокупности дает основания судить о состоянии гемореологии [16].
Двенадцати животным (по 3 крысы из каждой группы) проводили инъецирование сосудистого русла раствором черной туши на 10 % формалине (1:4) [17]. Перфузию кровеносных сосудов проводили посмертно, вводя взвесь туши через брюшную аорту.
Мозг, взятый для исследования, дополнительно фиксировался в 10 % растворе нейт- рального формалина, обезвоживался в спиртах возрастающей концентрации и заливался в парафин. Из парафиновых блоков готовились срезы толщиной 5–7 мкм, которые окрашивались гематоксилином-эозином, пикрофукси-ном по Ван Гизону. Готовые просветленные и гистологические препараты изучались под микроскопом Olympus Bx40 (Япония). Одновременно проводилось серийное микрофотографирование с помощью цифрового фотоаппарата, подключенного к компьютеру, и параллельное протоколирование результатов. Морфометрия компонентов ССГМ осуществлялась с помощью приложения для измерения микроскопических объектов Top View.
Статистическая обработка полученных данных проводилась в программе SPSS 16.0. Нормальность распределения оценивалась согласно критерию Колмогорова–Смирнова. В случае нормального распределения данных использовался параметрический t-критерий Стьюдента, в случае ненормального распределения – U-критерий Манна–Уитни. Достоверными считались отличия с уровнем значимости более 95 % (p<0,05).
Результаты и обсуждение. ЧМТ приводит крыс в состояние стресса и травматического шока. Они становятся гиподинамич-ными, у них нарушаются соматосенсорная ре- акция, неврологический статус и поведение [18, 19].
В сосудистой системе головного мозга выделяют две взаимосвязанные подсистемы: систему макроциркуляции, расположенную практически на поверхности мозга и образующую русло для общего суммарного мозгового кровотока, и систему микроциркуляции, обеспечивающую кровоснабжение вещества мозга и формирующую сосудистое ложе для локального мозгового кровотока [20]. В наших исследованиях обе эти подсистемы подвергаются существенному ремоделированию.
У низкогорной серии крыс с ЧМТ на мик-роциркуляторном уровне в зоне травмы обнаруживается расширение артерий, всех звеньев микроциркуляторного русла (МЦР) и вен, субарахноидальные кровоизлияния, набухание и отторжение мягкой мозговой оболочки, признаки воспаления на поверхности головного мозга (рис. 1). На гистологических препаратах в просвете артерий и вен встречается сепарация крови на форменные элементы и плазму, находящуюся в свернутом состоянии, от которой отходят фибриллярные структуры, прикрепляющиеся к сосудистой стенке. Эндотелий и медия сосудистой стенки отечные, в медии отмечаются щели и вакуоли, заполненные отечной жидкостью.
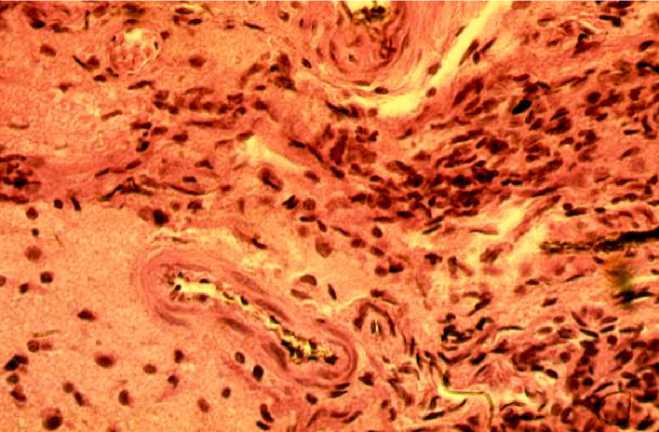
Рис. 1. Инфильтрация и отек вещества мозга; артериолы деформированы, застой крови в венах (окраска гематоксилин-эозином, ×400)
Fig. 1. Infiltration and brain swelling; arterioles are deformed, venous hyperemia (hematoxylin-eosin staining, ×400)
По периферии места приложения удара отмечаются внутрисосудистые, околососуди-стые компенсаторно-приспособительные, патологические, обратимые и необратимые явления. К внутрисосудистым обратимым изменениям относятся стаз крови, закупорка микрососудов крупными лейкоцитами. Эти явления имеют временный характер и служат фактором регуляции кровотока в пределах структурно-функциональной единицы головного мозга, т.е. относятся к компенсаторно-приспособительным. К патологическим, необрати- мым изменениям относится образование тромбов в венулярном отделе МЦР.
На уровне сосудистой стенки отмечается усиление извитости, что предохраняет от развития избыточного кровотока и перепадов давления крови в МЦР, т.е. имеет приспособительное значение. Наряду с этим наблюдаются повышение проницаемости, порозности и даже разрывы капилляров, приводящие к па-равазальному отеку и микрокровоизлияниям в мягкой мозговой оболочке головного мозга, что носит патологический характер (рис. 2).
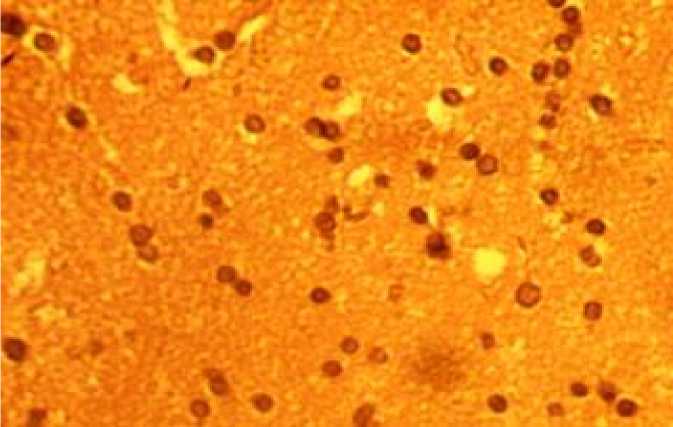
Рис. 2. Явления паравазального отека головного мозга (окраска гематоксилин-эозином, ×400)
Fig. 2. Paravasal cerebral edema (hematoxylin-eosin staining, ×400)
К общим проявлениям ответа на уровне подсистемы микроциркуляции при ЧМТ относится спазм артериолярного звена МЦР. Интерпретировать его однозначно невозможно, так как в одних случаях спазм имеет защитное, а в других – патологическое значение. Например, спазм артериолярного звена МЦР направлен на снижение риска развития отека на уровне гематоэнцефалического барьера. В то же время он опасен развитием ишемического каскада и переходом компенсаторноприспособительных реакций в патологические. В том и другом случаях наблюдается результат ауторегуляции локального мозгового кровотока.
Известно, что ауторегуляторные реакции артериальных сосудов мозга имеют место не только при сдвигах системной гемодинамики, но и при изменении давления спинномозговой жидкости [20]. В нашем исследовании особенности ремоделирования ССГМ, располагающихся в разных желудочках мозга, имеют как общие черты, так и определенные отличия. Одним из общих проявлений является гиперемия сосудистого компонента ССГМ. В результате дилатации и гиперемии сосудов ворсинки компактно прилегают одна к другой и границы между ними под микроскопом не выявляются. Во всех ССГМ отмечается застой крови в венозном сегменте, что сочетается с явлениями разделения крови на форменные элементы и плазму. Стенки вен деформируются и подвергаются плазморрагии. Стенки артерий спазмируются, что вызывает актива- цию артериоло-венулярных анастомозов. В результате этого взвесь туши, инъецированной через брюшную аорту, проникает в венозные звенья ССГМ, что, несомненно, облегчает отток крови из ССГМ.
В ССГМ IV желудочка (рис. 3) наблюдаются паравазальные кровоизлияния, которые отсутствуют в сосудистых сплетениях III и боковых желудочков. Это сочетается с расширением полости желудочка и нарушением целостности эпендимального покрова стенки. В боковых желудочках отмечаются очаги кровоизлияния под эпендимальным покровом с признаками воспалительной реакции.
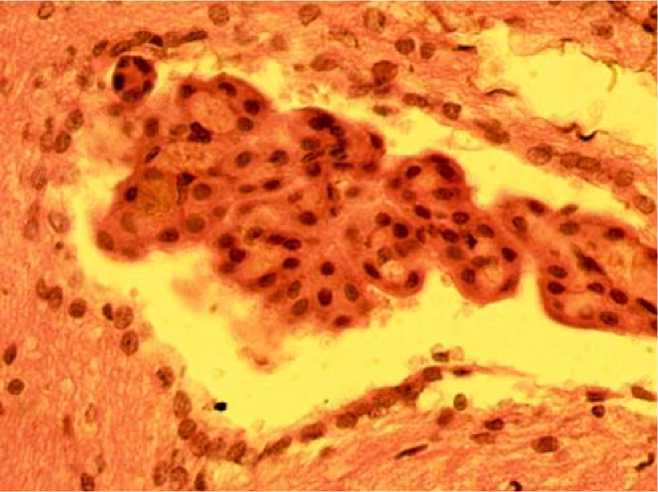
Рис. 3. Гиперемия сосудистого сплетения IV желудочка головного мозга крыс при ЧМТ в низкогорье (окраска гематоксилин-эозином, ×400)
Fig. 3. Hyperemia of the choroid plexus of the 4th ventricle of the rat brain in craniocerebral injury in low mountains (hematoxylin-eosin staining, ×400)
Общая картина гемоциркуляции головного мозга при ЧМТ, возникшей в высокогорье, существенно отличается от низкогорной.
Так, в подсистеме макроциркуляции на месте нанесения травмы появляются внутрисосудистые, сосудистые, вокругсосудистые обратимые и необратимые изменения. К внутрисосудистым гемореологическим изменениям относятся конгломераты форменных элементов крови, образование «монетных столбиков» из эритроцитов, краевое стояние и прилипание лейкоцитов к эндотелию, маятникообразное течение крови. К обратимым изменениям сосудистой стенки относятся их спазм или дилатация, формирование извилин разной формы и величины, рекомбинация расположения ядер гладкомышечных и эндотелиальных клеток. К необратимым относятся щели и вакуоли в медии, отторжение эндотелия и адвентиции, нарушение целостности всех трех оболочек сосудов. К обратимым паравазальным изменениям относятся отек, расширение околососуди-стых пространств, а к необратимым – массивные кровоизлияния и микроизлияния (рис. 4).
По периферии места нанесения травмы отмечаются генерализованный спазм мелких артериальных ветвей и артериол, чрезвычайная мозаичность ремоделирования подсистемы макроциркуляции в зависимости от топографии на поверхности головного мозга. На первый взгляд, представляется парадоксальным спазм мелких артериальных ветвей и артериол, когда системы и органы страдают от недостатка кислорода в условиях высокогорной гипоксической гипоксии. Казалось бы, в данной ситуации рациональнее иметь дело с дилатацией артериального звена макроцирку-ляторной подсистемы сосудистой системы головного мозга с соответствующим увеличением церебрального кровотока. Однако этого не происходит. Напротив, в первые дни пребывания животных в условиях высокогорья наблюдается снижение объемной скорости кровотока в головном мозге [21]. Мозг располагается в ригидном вместилище черепа. Поэтому дополнительный приток крови привел бы к избыточному внутричерепному давлению. В данном случае проблема разрешается путем перераспределения кровотока в подсистеме микроциркуляции [22, 23]: часть крови из белого вещества перебрасывается в кору головного мозга. Так, по некоторым данным [21, 22], на 7-е сут пребывания собак на перевале Туя-Ашу объемная скорость кровотока в головном мозге составила 54,4 мл/мин/100 г, которая до подъема на высоту равнялась 59,5 мл/мин/100 г. При этом объемная скорость кровотока в белом веществе снизилась с 53,5±7,8 до 45,3±3,2 мл/мин/100 г, тогда как в сером веществе – всего лишь с 65,6±6,3 до 63,6±5,7 мл/мин/100 г [22].
Другой особенностью является активация артериоло-венулярных анастомозов. Об этом свидетельствует тот факт, что взвесь туши, инъецированной через брюшную аорту, оказывается в венулярном звене МЦР. Целесообразность усиления артериоло-венулярных анастомозов можно связать с тем, что это способствует передаче высокоэнергетического артериального потока энергоемкому венозному. А это в свою очередь облегчает венозный отток из полости черепа.
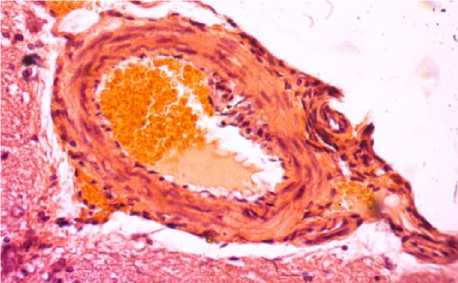
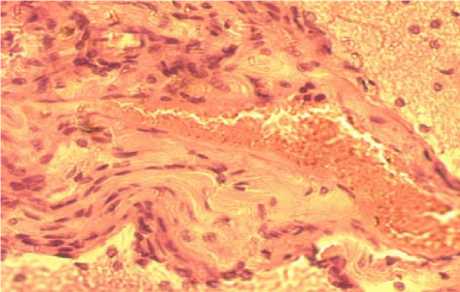
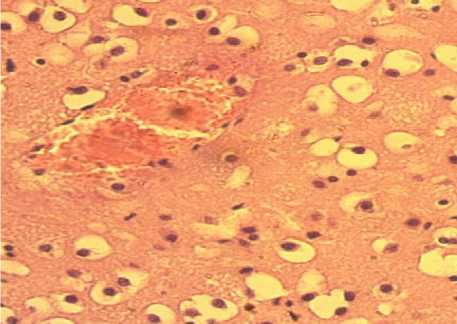
Рис. 4. Внутрисосудистые и внесосудистые изменения микроциркуляции головного мозга (окраска гематоксилин-эозином, ×400)
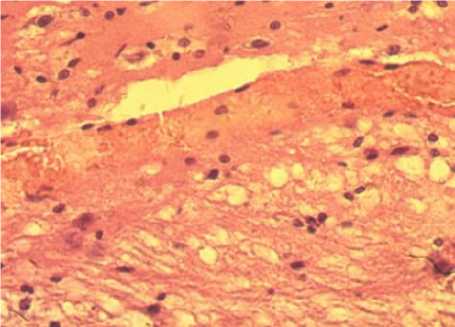
Fig. 4. Intravascular and extravascular changes in brain microcirculation (hematoxylin-eosin staining, ×400)
В микроциркуляторной подсистеме церебрального кровообращения ремоделирование характеризуется выраженной гетерогенностью. Поэтому далее обсуждаются наиболее общие его черты. В одних отделах головного мозга отмечается резкий спазм, вплоть до полного перекрытия просвета мелких артерий и артериол. В этих сосудах расположенные поперечно к сосудистой стенке ядра гладкомышечных и эндотелиальных клеток противоположных стенок сосудов соприкасаются между собой, манифестируя необратимую облитерацию артерий и артериол. Венозное звено при этом полнокровное с признаками застоя. Вокруг венулярного и капиллярного звеньев отмечается отечность с элементами плазморра-гии. Паравазальная отечная жидкость сдавливает прилежащее вещество мозга, в котором обнаруживается имбибиция форменных элементов крови, продукты распада которых вызывают нейровоспалительный эффект, цитотоксический отек и некротическую гибель клеток. В других участках мозга, напротив, отмечается гиперкапилляризация, сочетающаяся с паравазальным отеком, нарушением гематоэнцефалического барьера, мелкоклеточными кровоизлияниями, реактивным аст-роцитозом, индукцией апоптоза. Также имеются участки без каких-либо нарушений на уровне световой микроскопии. Отмеченная мозаичность ремоделирования микроцирку-ляторной подсистемы кровеносного русла мозга, по-видимому, связана с ауторегуляцией локального кровотока, а также с состоянием спинномозговой жидкости. Так, при повышении давления спинномозговой жидкости наблюдается снижение трансмурального давления и уменьшение растягивающей сосуды силы, что вызывает ауторегуляторную дилатацию мозговых артерий, а также усиление оттока венозной крови за счет повышения тонуса венозных сосудов мозга [20].
В свою очередь количество, давление и другие свойства спинномозговой жидкости, как показали результаты экспериментальных исследований, сопряжены с морфофункциональным состоянием ССГМ, которое после нанесения ЧМТ в высокогорье отличается от данных, полученных в низкогорье. Так, средний диаметр сосудов меньше показателей не только нормы, но и значений после нанесения ЧМТ в низкогорье. На препаратах видно, что одни сосуды дилатированы, заполнены кровью либо инъекционной массой, а другие -спазмированы и пусты. Даже в пределах сосудистого сплетения одного желудочка головного мозга встречаются участки гипер- и гиповаскуляризации. В отдельных случаях в соединительной строме выявляются очаги геморрагий, отеки, клеточная инфильтрация.
В отличие от данных, полученных в низ-когорье, часто встречается нарушение ликвороэнцефалического барьера. Например, отмечается отслоение эпендимальной выстилки желудочков головного мозга. По всей вероятности, при этом происходит разрыв иммуно-позитивных отростков эпендимоцитов в области субвентрикулярной зоны. В этих случаях наблюдаются очаги нейровоспаления, мелкоточечных кровоизлияний, клеточной инфильтрации в паравентрикулярной зоне головного мозга.
Размеры эпендимоцитов при ЧМТ в высокогорье значительно превышают данные, полученные в низкогорье, что указывает на отек клетки. Характерна эктопия эпендимоцитов в сторону полости желудочков и прилежащей соединительной ткани, которая не наблюдалась в опытах в низкогорье.
Морфометрия сосудистых сплетений желудочков головного мозга показала, что ЧМТ существенно отражается на показателях стромально-клеточного баланса (табл. 1): у животных, перенесших ЧМТ, на 3-и сут отмечается увеличение объема клетки в 3,8 раза (p<0,001), в 3,4 раза (p<0,001) увеличивается объем ядра, объем цитоплазмы возрастает в 3,8 раза (p<0,001), при этом ядерно-цитоплазматиче-ское отношение (ЯЦО) в группе крыс с ЧМТ в низкогорье достоверно не отличается от показателей контрольной группы.
Аналогичные изменения отмечаются и при ЧМТ, возникшей в высокогорье (табл. 1). Здесь объем эпендимальной клетки, объем ядра, объем цитоплазмы и ЯЦО увеличиваются на 35, 256, 30 и 133 % соответственно (p<0,001).
При анализе влияния высокогорья на эпендимоциты сосудистого сплетения (табл. 1) можно отметить, что у животных, подверг- шихся транспортировке на высоту 3200 м над уровнем моря, отмечается тенденция к набуханию клетки и ее главных компонентов. Так, объем эпендимальной клетки у крыс, побывавших в высокогорье, увеличивается в 3,4 ра- за (p<0,001), объем ядра возрастает на 26 %, объем цитоплазмы – в 3,6 раза, а ЯЦО у транспортированных в горы животных снижается на 58 % (p<0,001) по сравнению с низкогорной серией.
Таблица 1
Table 1
Сравнительный анализ элементов стромального компонента (эндотелиоцитов) сосудистых сплетений головного мозга в низко- и высокогорье, нм3
Comparative analysis of elements of the stromal component (endotheliocytes) of the cerebral vascular plexus in low and high altitudes, nm3
|
Группа Group |
Объем клетки, нм3 Cell volume, nm3 |
Объем ядра, нм3 Nucleus volume, nm3 |
Объем цитоплазмы, нм3 Cytoplasm volume, nm3 |
ЯЦО Nuclear-cytoplasmic correlation |
|
|
Контроль Control |
7583,2±379,8 |
520,5±25,5 |
7062,7±373,7 |
0,070±0,004 |
|
|
ЧМТ Craniocerebral injury |
28724,05±2084,80 *** |
1796,2±84,7 *** |
26927,8±2110,2 *** |
0,070±0,005 |
|
|
m к |
Контроль Control |
26114,2±1633,4 ^^^ |
658,1±35,5 ^^ |
25456,07±1627,7 ^^^ |
0,300±0,002 ^^^ |
|
ЧМТ Craniocerebral injury |
35464,3±1413,6 ***^ |
2344,9±104,7 ***^^^ |
33119,4±1369,9 ***^ |
0,070±0,003 *** |
|
Примечания: 1. Различия достоверны в группах с ЧМТ по сравнению с контролем в низкогорье/вы-сокогорье: * – p<0,05; ** – p<0,01; *** – p<0,001. 2. Различия достоверны в группах высокогорья в сравнении с группами низкогорной серии опытов: ^ – p<0,05; ^^ – p<0,01; ^^^ – p<0,001. Далее обозначения те же.
Notes: 1. Differences are significant in the groups with craniocerebral injuries in comparison with the control in the low/high altitudes: * – p<0.05; ** – p<0.01; *** – p<0.001. 2. Differences are significant in the high-altitude groups in comparison with low-altitude groups: ^ – p<0.05; ^^ – p<0.01; ^^^ – p<0.001. Hereafter, designations are the same.
Значимые отличия отмечаются в показателях клеточных компонентов и у животных с ЧМТ, воспроизведенной в горах. Так, на 3-и сут эксперимента объем эпендимоцитов возрастает на 23 % (p<0,05), объем ядра – на 30 % (p<0,001), объем цитоплазмы – на 22 % (p<0,05). При этом ЯЦО остается без до- стоверно значимых изменений с сравнении с соответствующей низкогорной серией опытов.
Колебания числовых параметров наблюдаются и при морфометрии сосудистого компонента ССГМ в различных сериях эксперимента.
Таблица 2
Table 2
Сравнительный анализ элементов сосудистого компонента сосудистых сплетений головного мозга в низко- и высокогорье, нм
Comparative analysis of elements of the vascular component of the cerebral vascular plexus in low-and high-altitudes, nm
|
Группы Groups |
Диаметр капилляров Capillary diameter |
Диффузионное расстояние Diffusion distance |
|
|
Низкогорье Low altitudes |
Контроль Control |
23,84±0,30 |
28,5±0,5 |
|
ЧМТ Craniocerebral injury |
20,75±0,90** |
30,91±0,40*** |
|
|
Высокогорье High altitudes |
Контроль Control |
25,30±1,06 |
29,6±0,5 |
|
ЧМТ Craniocerebral injury |
12,18±0,80***^^^ |
29,5±0,4^ |
|
При ЧМТ, возникшей в условиях низкого-рья (табл. 2), отмечается уменьшение просвета функционирующих капилляров на 23 % от исходных данных (p<0,01). Диффузионное расстояние при этом имеет тенденцию к увеличению.
Под влиянием высокогорья ЧМТ приводит к значительному сужению просвета капилляров (табл. 2): диаметр капилляров уменьшается на 52 % (p<0,001), а диффузионное расстояние не имеет достоверных отличий от контрольной группы.
Анализ сосудистого компонента (табл. 2) показал, что при транспортировке крыс в высокогорье диаметр капилляров достоверно не изменяется.
При ЧМТ, возникшей на горных высотах, напротив, отмечается сужение капиллярного диаметра на 42 % (p<0,001) по сравнению с величинами, полученными в низкогорье.
Вышеприведенные результаты собственных исследований вполне согласуются с литературными данными. Так, Zhang Ch. еt al. [24] отмечают, что уже через 1 ч после травмы наблюдаются точечные кровоизлияния вокруг кровеносных сосудов в поврежденном участке головного мозга, что сопровождается расширением интерстициального пространства и признаками вазогенного отека с нарушением гематоэнцефалического барьера. Че- рез 6 ч после ЧМТ отмечается набухание глиальных клеток, цитоплазма просветляется вследствие нарастания внутриклеточного отека. Помимо увеличения объема цитоплазмы отмечается увеличение объема ядер и других органелл глиальных клеток. Через 24 ч внутриклеточный отек усиливается и сопровождается воспалительной инфильтрацией и пролиферацией микроглии.
Исходя из данных [24] повреждение гематоэнцефалического барьера наблюдается через 1 ч после черепно-мозговой травмы, что позволяет предположить, что оно происходит раньше, чем отек мозга. Механические стрессы, связанные с ЧМТ, повреждают кровеносные сосуды в головном мозге, вызывая более мелкие кортикальные кровоизлияния и ушибы, а также более крупные кровоизлияния, такие как субдуральные и эпидуральные гематомы, которые могут привести к ишемии головного мозга на более поздних стадиях травмы. Образование посттравматического отека мозга может повысить внутричерепное давление внутри неподатливой черепной полости, а это в свою очередь может снизить церебральное перфузионное давление и вызвать ишемию [25].
Выводы:
-
1. ЧМТ вызывает выраженное ремоделирование макро- и микроподсистем кровенос-
- ного русла головного мозга независимо от места проведения опытов.
-
2. В условиях высокогорья изменения стромального компонента сосудистых сплетений и запустение артериол с явлениями венозного полнокровия выражены в большей степени, чем в низкогорье.
-
3. Преобразование сосудистой системы головного мозга сопряжено со структурно-
- функциональными изменениями ССГМ, а также количеством и составом спинномозговой жидкости.
-
4. Морфометрическая реорганизация ССГМ, направленная на стимуляцию образования спинномозговой жидкости, имеет компенсаторно-приспособительное значение в условиях формирования ишемического каскада, особенно в высокогорье.
Список литературы Сосудистое сплетение и микроциркуляция головного мозга при черепно-мозговой травме, возникшей в условиях высокогорья
- Peden M. World report in road traffic injury prevention. Summary. Geneva: World health Organization; 2004. 120.
- Белошицкий В.В. Принципы моделирования черепно-мозговой травмы в эксперименте. Украинский нейрохирургический журнал. 2008; 4: 9-15.
- McGraw C.P., Pashayan A.G., Wendel O. T. Cerebral infarction in the Mongolian gerbil exacerbated by phenoxybenzamine treatment. Stroke. 1976; 7 (5): 485-488.
- Мартынова О.В., Анциферов О.В., Мартынов М.А., Череватенко Р. Ф., Нестерова Н.И., Нестеров А.В. Исследование нейродинамических нарушений у крыс при черепно-мозговой травме. Научные результаты биомедицинских исследований. 2019; 5 (3): 1/9-7/9.
- Коновалов А.Н., Лихтерман Л.Б., Потапов А.А. Клиническое руководство по черепно-мозговой травме. В 3 т. Т. 1. М.: Антидор; 1998. 550.
- Marklund N., Hillered L. Animal modelling of traumatic brain injury in preclinical drug development: where do we go from here? Br. J. Pharmacol. 2011; 164 (4): 1207-1229.
- McAllister T.W. Neurobiological consequences of traumatic brain injury. Dialogues Clin. Neurosci. 2011; 13 (3): 287-300.
- Дмитриенко Е.В., Филатенкова Т.А., Рыбакина Е.Г., Кориева Е.А. Поведенческие реакции животных после экспериментальной черепно-мозговой травмы: влияние препарата нуклеотидной природы. Вестник Санкт-Петербургского университета. 2014; 11 (3): 180-191.
- Дзяк Л.А., Кобеляцкий Ю.Ю., Йовенко И.А., Царев А.В. Интенсивная терапия повреждений мозга и ранняя нейрореабилитация при политравме с превалированием тяжелой черепно-мозговой травмы. Опыт применения оригинального амантадина сульфата (ПК-МЕРЦ, "Мерц форма ГМБХ и К°"). Медицина неотложных состояний. 2015; 8 (71): 57-65.
- Дафин Ф. Мурешану. Нейропротекция и нейропластичность при черепно-мозговой и спинальной травме. Международный медицинский журнал. 2007; 6 (16). URL: http://www.mif-ua.сот/archive/ar-ticle/3820 (дата обращения: 22.09.2020).
- Bratton S.J., Chestnut R., Ghajar J. Guidelines for the Management of Severe Traumatic Brain Injury IX. Cerebral perfusion thresholds. J. Neurotrauma. 2007; 24: 59-64.
- Tang Y.P., Noda Y., Hasegawa T., Nabeshima T. A concussive-like brain injury model in mice (I): impairment in learning and memory. J. Neurotrauma. 1997; 14: 851-862.
- Tang Y.P., Noda Y., Hasegawa T., Nabeshima T. A concussive-like brain injury model in mice (II): selective neuronal loss in the cortex and hippocampus. J. Neurotrauma. 1997; 14: 863-873.
- Савчук Р.Н. Состояние гемомикроциркуляторного русла легких в условиях промышленного загрязнения атмосферы. Свгг медицини та бюлоги. 2014; 2 (44): 160.
- Свинцицкая Л.Н. Исследование кровеносного русла интактного желудка человека с помощью инъекционно-коррозионного метода. Свгг медицини та бюлоги. 2014; 2 (44): 160-163.
- Крылова Н.В., Соболева Т.М. Микроциркуляторное русло человека. М.; 1986. 62.
- Свинцицкая Н.Л., Шерстюк О.А., Гринь В.Г., Пилюгин А.В., Каценко А.Л. Особенности ангиоархитектоники кровеносного русла желудка человека. М.; 2019. 152.
- Волкович О.В., Захаров Г.А., Горохова Г.И. Влияние глибенкламида на неврологический статус крыс с черепно-мозговой травмой. Вестник ТГУ. 2017; 22 (2): 271-273.
- Захаров Г.А., Волкович О.В., Горохова Г.И. Влияние глибенкламида на время соматосенсорной реакции у крыс с черепно-мозговой травмой. Вестник КРСУ. 2015; 15 (4): 36-37.
- Бабиянц А.Я., Хананашвили Я.А. Мозговое кровообращение, физиологические аспекты и современные методы исследования. Журнал фундаментальной медицины и биологии. 2018; 3: 46-54.
- Нарбеков О.Н., Шидаков Ю.М. Высокогорное легочное сердце. М.; 1991. 244.
- Балыкин М.В. Механизмы регуляции микроциркуляторного гемостаза в условиях гор. В кн.: Абдумаликова И.А., Балыкин М.В., Горохова Г.И., Гринько Л.Г., Шидаков Ю.Х.-М., ред. Горная микроангиология. М.: КРСУ; 2019: 50-64
- Шидаков Ю.Х.-М., Каркобатов Х.Д., Текеева Ф.А. Высокогорная кардиоангиология. М.; 2001. 228.
- Zhang C., Chen J., Lu H. Expression of aquaporin-4 and pathological characteristics of brain injury in a rat model of traumatic brain injury. Mol. Med. Rep. 2015; 12: 7351-7357.
- Chodobski A., Zink B.J., Szmydynger-Chodobska J. Blood-brain barrier pathophysiology in traumatic brain injury. Transl. Stroke Res. 2011; 2 (4): 492-516.


